ANALYSIS OF LDF-GRAMS IN WISTAR RUNOFF RATS UNDER HYPOXIA MODELING CONDITIONS
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 6 (72), №3, 2020
Publication text (PDF):Download
UDK: 57.084.1
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Alistratova F. I., Saint-Petersburg State University of Veterinary Medicine, Saint-Petersburg, Russia
Toropova Ya. G., Almazov national medical Research Centre, Saint-Petersburg, Russia
Osipova S. A., Almazov national medical Research Centre, Saint-Petersburg, Russia
Vasyutina M. L., Almazov national medical Research Centre, Saint-Petersburg, Russia
TYPE:Article
DOI:https://doi.org/10.37279/2413-1725-2020-6-3-18-32
PAGES:from 18 to 32
STATUS:Published
LANGUAGE:Russian
KEYWORDS: LDF-grams, microcirculatory bed of the skin, hypoxia.
ABSTRACT (ENGLISH):
The aim of the study was to assess the dynamics of the change in peripheral blood flow parameters of the blood vessels of the microcirculatory bed of the skin, with an additional analysis of the change in the amplitude of the frequency ranges of cutaneous blood flow, in the conditions of daily interval hypobaric training by laser Doppler flowmetry.
The effect of interval hypobaric training course (seven days duration, exposure duration was 60 minutes) on the state of the microcirculatory bed of the skin was investigated to study the peculiarities of the formation and course of adaptive reactions in the vessels of the microcircuit.
An analysis of microcirculation indicators using LDF diagnostics was carried out. Hardware – laser analyzer of capillary circulation «LACC-02» manufactured by LLC NPP «Lasma,» Moscow. The main basal blood flow indicators and microcirculation indicators were revealed when exposed to a 7-day course of interval hypobaric training. The statistical values of PM (constant perfusion parameter, units), σ (mean square deviation of amplitude of perfusion fluctuation, units) and Kv (coefficient of variation, %) provided an opportunity to analyze the general state of blood microcirculation. The amplitude-frequency spectrum of perfusion oscillations was also evaluated. With the help of a wavelet analysis (program 2.2.0.507, NPP Lasma, Russia), normalized amplitudes of blood flow fluctuations in frequency ranges were determined (endothelial due to nitric oxide activity (0.0095–0.02 Hz); neurogenic (0.02–0.06 Hz); myogenic (vasomosis) (0.06–0.2 Hz) and passive frequency range (cardiac (0.6–1.6 Hz), respiratory (0.2–0.6 Hz). Measurement of microcirculation parameters was carried out 3 times at the following stages of the experiment: before hypoxic exposure – point 0 (8 minutes), on the 1st day immediately after hypoxia exposure (8 minutes), and on the 7th day immediately after hypoxia session (8 minutes). The measurement area was the inner surface of the lower pelvic limb, the LDF sensor was located on the surface of the skin. The recording duration was 360 seconds.
The hypoxic effect used in the study was implemented using hardware – an experimental hypobarocamera, in which the necessary conditions were created (negative pressure (–0.306kg/cm2)). The pressure in the chamber was reduced in stages: the first stage – a height of 1000 m with air dilution (–0.1 kg/cm2), duration 180 seconds; second stage – 2000 m rarefaction was (–0.21 kg/cm2) with the same duration; and the last stage is 3000 m high, which corresponds to a vacuum (–0.306 kg/cm2).
A seven-day course of hypoxia did not cause significant changes in cutaneous blood flow in animals in group C (control), and in animals in group P (pseudo-hypoxic rats). However, it was found that in rats in group H (hypoxia) there was an increase in the coefficient of variation by 62.5 % (p≤ 0.05) on the 7th day of exposure, this may be due to the launch of adaptation mechanisms, which are necessary to adequately supply blood to cells, tissues and organs. When analyzing LDF-grams in rats of group C (control) and P (pseudo-hypoxed), there was no change in the perfusion parameter in the microcirculatory channel, but in group G (hypoxia) – PM (microcirculation index) significantly decreased by 47 % (p<0.05). In animals of groups C (control) and P (psvedo-hypoxed), there were no significant changes, according to the data of the wavelet analysis. However, in group H rats (hypoxia) on the 1st day of exposure, there was an increase in the frequency of the amplitude of oscillations in the myogenic range (0.06–0.2 Hz) on 18.72 % (p < 0.05) and passive frequency ranges (cardiac modulating factor (0.6–1.6 Hz) in the LDF-gram of the subjects on 14.97 % (p<0.05).
Summing up the above, the results of the analysis of LDF-grams and the microcirculation index (PM) made it possible to establish a significant role in the possible use of the LDF-diagnostic method to evaluate the quality of methods for increasing the adaptive capabilities of the vessels of the skin microcirculatory bed and also central vessels. The dynamics of the frequency ranges of the vessels of nutritive blood flow in rats after a weekly course of interval hypobaric changed as follows: the role of passive factors, mainly the pulse wave from the arterial link, was increased by 24 % (p<0.05). The observed changes can be related to the enhancement of muscle cells in the vascular wall of the arterial vessels of the skin microcirculatory system, and as a result, the enhancement of the functioning of the circulatory system.
By laser Doppler flowmetry, the dynamics of changes in peripheral circulatory indices were investigated with the assessment of changes in rats, with the study of the frequency ranges of cutaneous blood.
ВВЕДЕНИЕ
Выполнение физических нагрузок или иных энергозатратных задач, зачастую, приводит к возникновению или может послужить причиной развития продолжительной хронической гипоксии [1, 2]. Однако, применение кратных дозированных экспозиций умеренной гипоксии может запустить процесс активации различных систем организма, а проведение курсового моделируемого гипоксического воздействия соответственно может упрочить данный эффект и способствовать расширению его компенсаторных возможностей [3].
Широко известно применение тренировок гипоксией или гипоксического прекондиционирования в клинической и адаптационной медицине [4].
В значительной степени признание получили методы естественного приспособления организма к условиям гипоксии: пребывание в горах в течение продолжительного времени, курсовое применение газовых смесей со снижением доли кислорода, а также моделирование гипоксии в барокамере. Перечисленные способы адаптации к дефициту кислорода объединяет, тот факт, что запуск компенсаторных реакций в организме происходит благодаря снижению парциального давления кислорода во вдыхаемом воздухе [5].
Обнаружено, что в условиях воздействия гипоксии в организме происходит ряд важных компенсаторных изменений, в том числе инициализация дыхательной и кардиальной систем, а также перестройка сосудистой системы, выраженная в снижении шунтирования крови в легких, расширение альвеолярной поверхности, увеличение числа регионарных сосудов, что стимулирует повышенное кровоснабжение сердца и печени, за счет уменьшении кровоснабжения скелетных мышц [6].
Изучены и экспериментально подтверждены молекулярно- генетические аспекты функциональных гемодинамических изменений. Например, применяется моделирование гипоксии для запуска гена HIF-1 (фактор, индуцируемый гипоксией 1), который способствует развитию компенсаторно-приспособительных процессов в организме в горах, в ходе восстановления организма после повреждений, малокровии, и в ходе онтогенеза [5].
Ранее была выяснена роль фактора, индуцируемого гипоксией в становлении адаптационного ответа. Главным образом, в экспрессии генов эритропоэтина, что способствует созданию и дифференцировке клеток-предшественников эритроидного ряда в центральном органе кроветворения; увеличении доли миоглобина, что приводит к стабилизации мембран клеток; активации образования VEGF (эндотелиального сосудистого фактора), который приводит неоваскуляризации, а также процессам ангиогенеза [7].
Указанные выше результаты мобилизации сердечно-сосудистой системы были изучены в различных органах, в том числе в отделах головного мозга, также отмечено усиление системы коронарных артерий и увеличение объема кровенаполнения сердца [3, 8].
В процессе формирования адаптивной реакции организма на воздействие гипоксии различного типа и режима значительное место отводится микроциркуляторному руслу [7].
Известно, что реакции сосудов микроциркуляторного русла на воздействие экзо– и эндогенных факторов имеют системный характер. Так перестройки в функционировании отдельных сосудов отражают сдвиг в функционировании нутритивных сосудов БКК (большого круга кровообращения) [9].
В ходе исследования применения гипоксических тренировок на организм человека и животных внимание ученых, в большей степени, было сосредоточено на изучении респираторной системы, роли гуморальной регуляции, перестройках в системе крови, а также особенностях адаптации центральной гемодинамики [4]. Однако, исследование особенностей функционирования и механизмов регуляции тонуса сосудов микроциркуляторного русла кожи, с использованием компьютерного спектрального анализа ЛДФ-грамм в доступной литературе не были обнаружены [4].
Существует значительное количество, прямых (инвазивных) и непрямых (не инвазивных) путей изучения работы сосудов нутритивного тока. В большинстве своем данные методы технически трудно осуществимы и имеют ограничения, поскольку адаптированы для интерпретации функционирования строго конкретного параметра [10].
Среди диагностических методов изучения тканевого кровотока наиболее перспективным и широко используемым считается лазерная допплеровская флоуметрия (ЛДФ). Данная методика дает возможность изучить как индивидуальную адаптацию сосудов микроциркуляторного русла, так и раскрыть механизмы их регуляции. Описанная методика проста в своем исполнении и широко используется в исследованиях как у людей, так и у животных [11].
В связи с этим, в нашем исследовании было проведен анализ показателей микроциркуляции с использованием метода лазерной допплеровской флоуметрии (ЛДФ), поскольку его применение позволяет наиболее полно и точно изучить состояние микрогемодинамики, с выяснением ведущих механизмов регуляции, на примере тканей кожи исследуемых крыс, при воздействии гипоксии.
Цель: Методом лазерной допплеровской флоуметрии исследовать показатели периферического кровообращения и оценить динамику их изменений у крыс, с изучением частотных диапазонов кожного кровотока, в условиях ежедневных интервальных гипобарических тренировок.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось на базе ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России. Работа была выполнена на взрослых крысах-самцах стока Wistar массой тела 210–235 гр. Животные случайным образом были распределены по группам в соответствии с применяемым к ним воздействием гипоксического фактора (табл. 1). Описание экспериментальных групп: животные группы Г (гипоксия) были подвержены ежедневному часовому воздействия гипобарической гипоксии. В группе П (псведо-гипоксированные крысы) животные ежедневно помещались в гипобарокамеру, с включенным насосом, но изменение степени разрежения воздуха не происходило, так как герметизации камеры не было. Крысы группы К (контроль) не подвергались никакому экзогенному воздействию, и на всем протяжении исследования находились в виварии.
Таблица 1
Основные группы животных согласно применяемому к ним воздействию гипоксическим фактором
|
Группа, n=10 |
Воздействие гипоксии |
|
Контроль (К) |
— |
|
Псевдо-гипоксированные крысы (ПГК) |
— |
|
Гипоксия (Г) |
+ |
Животные находились при стандартных условиях содержания в виварии для кормления применялся полнорационный комбикорм, питьевая вода, ad libitum, в условиях стандартного двенадцатичасового суточного свето-темнового цикла.
В ходе организации экспериментов следовали требованиям Всемирного общества защиты животных (WSPA) и Европейской конвенции по защите экспериментальных животных [12].
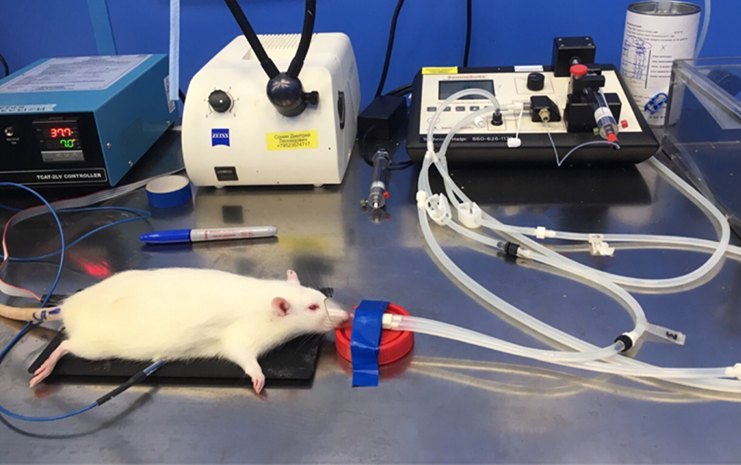
Исследования выполнялись в манипуляционной комнате непосредственно после проведения сеанса гипоксии при температуре 22–24 °С. Анализ воздействия интервальных гипобарических тренировок на микроциркуляцию кожного покрова проводился методом неинвазивного лазерного допплер-флоуметрического зондирования. Аппаратное обеспечение – лазерный анализатор капиллярного кровообращения «ЛАКК–02» производства ООО НПП «Лазма», г. Москва. Установка представлена блоком анализатора и многожильным световодным зондом, благодаря которому осуществляется взаимодействие между областью зондирования и каналами прибора. Перед началом осуществляли калибровку лазерного анализатора капиллярного кровотока. Эксперименты проводили на наркотизированных животных (анестетик изофлуран (Форан) и система анестезии SomoSuite. Наркотизированные крысы фиксировались в положении лежа на животе с отведенными в стороны конечностями (рис. 1).
Рис. 1. Крыса под действием анестетика-изофлурана, зафиксированная в положении лежа на животе с отведенными в стороны конечностями.
Областью измерений являлась внутренняя поверхность нижней тазовой конечности, датчик ЛДФ располагался на поверхности кожи. Продолжительность записи составляла 360 секунд. После достижения достаточной глубины наркоза, о чем свидетельство отсутствие или значительное подавление «роговичного рефлекса», рефлекса на болевой раздражитель – щипок кожи на конечности животного. Животное размещали на нагревательной платформе TCAT–2LV (PHY SITEMP I nstruments Inc., США) для поддержания постоянной температуры тела на физиологическом уровне. Регистрацию параметров функционирования сосудов микроциркуляторного русла проводили с помощью поверхностного датчика (диаметр 10 мм) лазерного допплеровского флоуметра (ЛДФ) BSL 3.7 (Transonik Systems Inc., США). Запись и обработка данных производилась на ПК по средствам программы LDF 3.1.LAZMA 3.2.0.439. Были определены основные параметры базального кровотока и показатели микроциркуляции при воздействии 7-ми дневного курса интервальных гипобарических тренировок. Статистические показатели ПМ (постоянный параметр перфузии, п. ед.), σ (среднеквадратическое отклонение амплитуды колебания перфузии, п. ед.) и Kv (коэффициент вариации, %) предоставили возможность провести анализ общего состояния микроциркуляции крови. Также была проведена оценка амплитудно-частотного спектра колебаний перфузии. Значения амплитуд колебаний микрососудистого кровотока осуществляли по среднему квадратичному отклонению колебаний кровотока, а с помощью вейвлет-анализа (программа 2.2.0.507, НПП «Лазма», Россия) определяли нормированные амплитуды колебаний кровотока в диапазонах частот (эндотелиальный, обусловленный активностью оксида азота (0,0095–0,02 Гц); нейрогенный (0,02–0,06 Гц); миогенный (вазомоции) (0,06–0,2 Гц) и диапазон пассивных частот (сердечный (0,6–1,6 Гц), дыхательный (0,2–0,6 Гц) [13]. Измерение параметров микроциркуляции осуществляли 3 раза на следующих этапах эксперимента: до гипоксического воздействия – точка 0 (8 минут), на 1-ые сутки сразу после воздействия гипоксии (8 минут), и на 7-е сутки непосредственно после сеанса гипоксии (8 минут).
При зондировании ткани лазерным излучением, создаваемая амплитуда отраженного излучения устанавливается путем отражения сигнала от эритроцитов. Эритроциты двигаются с различной скоростью, их количественное размещение в капиллярах, артериолах, венулах и АВА (артериоловенулярных анастомозах) численно значительно различается. Поэтому, в методе лазерной допплеровской флоуметрии используется алгоритм усреднения, что дает возможность вычислить средний допплеровский сдвиг частоты по всему численному составу эритроцитов, которые непосредственно попадают в исследуемую область. Применение описанного алгоритма усреднения, позволяет, применяя ЛДФ – метод исследовать динамику тока эритроцитов. Сила отражённого сигнала является совокупностью одиночных отраженных сигналов, на каждом эритроците и потому тесно коррелирует с их численным содержанием. Полученная в результате ЛДФ – диагностики амплитуда, отраженного излучения является наилучшим отражением количественного и качественного состава эритроцитов [14].
Функциональная оценка тканевого кровотока может быть описана в следующей формуле:
ПМ = K×Nэр×Vср, (1)
где: ПМ – показатель микроциркуляции (амплитуда отраженного излучения в вольтах), K – коэффициент пропорциональности (К = 1), Nэр – число эритроцитов, Vср – средняя скорость эритроцитов в исследуемом поле.
Подведя итог вышесказанному, метод флоуметрии, используемый для оценки микроциркуляторного русла крови способен показать динамику изменения кровотока за единицу времени в заданном объеме [9].
У животных исследовали изменения уровня и спектра колебаний кожного микрокровотока после воздействия курса интервальных гипобарических тренировок.
Характеристика гипобарокамеры, используемой в эксперименте. Отрицательное давление в камере создавалось с помощью вакуумного насоса и составляло –0,306 кг/см2, что соответствует 3000 м над ур. моря. Корпус гипобарокамеры закрывали герметичной крышкой, после чего запускали вакуумный насос для создания условий пониженного барометрического давления. Давление в камере понижали ступенчато: первая ступень – высота 1000 м с разрежением воздуха (–0,1 кг/см2), продолжительность 180 секунд; вторая ступень – 2000 м разрежение составляло (–0,21 кг/см2) с той же продолжительностью; и последняя ступень – высота 3000 м, что соответствует разрежению (–0,306 кг/см2). На вакуумметре регистрировали уровень разрежения. По завершении сеанса гипобарии отрицательное давление в камере сбрасывали, также ступенчато, но в обратном порядке, посредством запорного крана, установленного на герметичной крышке короба.
Статистическая обработка данных осуществлялась с помощью стандартного пакета программ Microsoft Office 2013. Для оценки достоверности различий выборок с ненормальным распределением данных применяли знаковый ранговый критерий Уилкоксона, используемый для сравнения двух связанных (парных) выборок. Метод основан на рангах, поэтому не требовалась проверка распределения на нормальность. Для оценки значимых различий значений выборок при нормальном распределении использовали t-критерий Стьюдента. На нормальность распределения количественных значений в выборках проверяли с помощью критерия Лиллиефорса. Применяемые критерии позволили установить направленность изменений и их выраженность. Данные, приведенные в таблице, в виде медианы и интерквартильного размаха (25-й и 75-й процентили): Me (25 %; 75 %), достоверное брали различие при уровне вероятности 95 % и более (p <0,05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
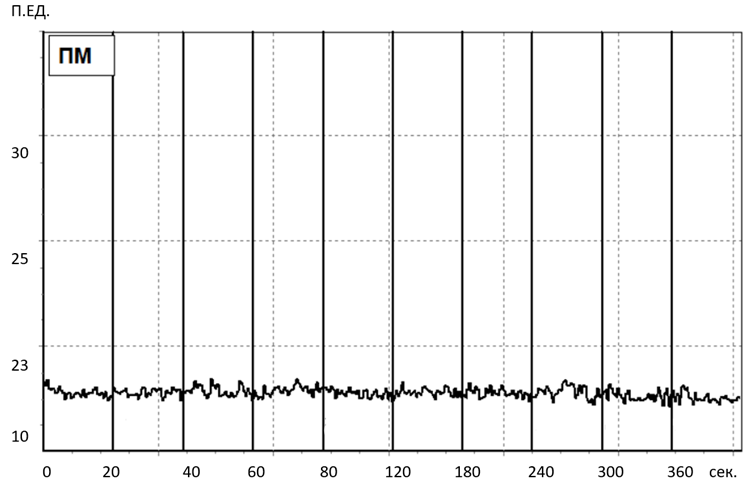
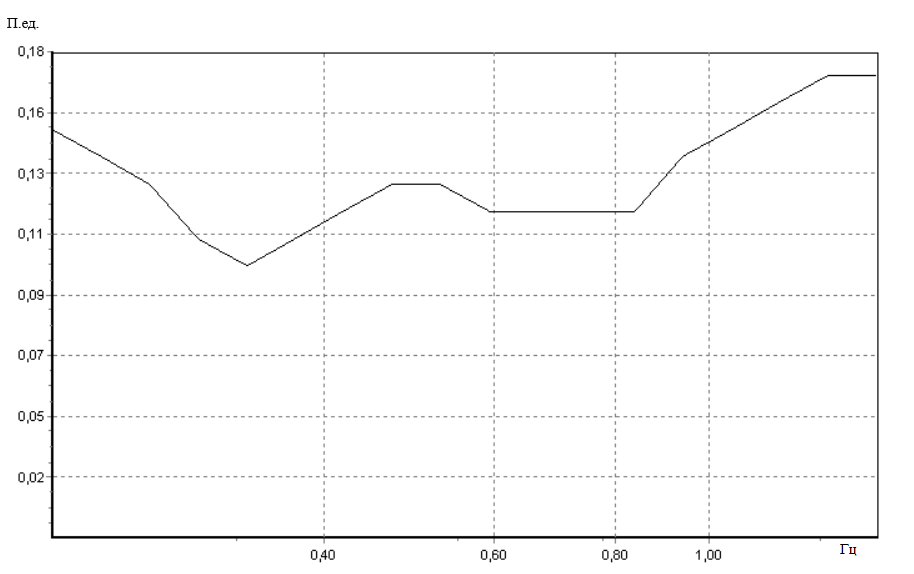
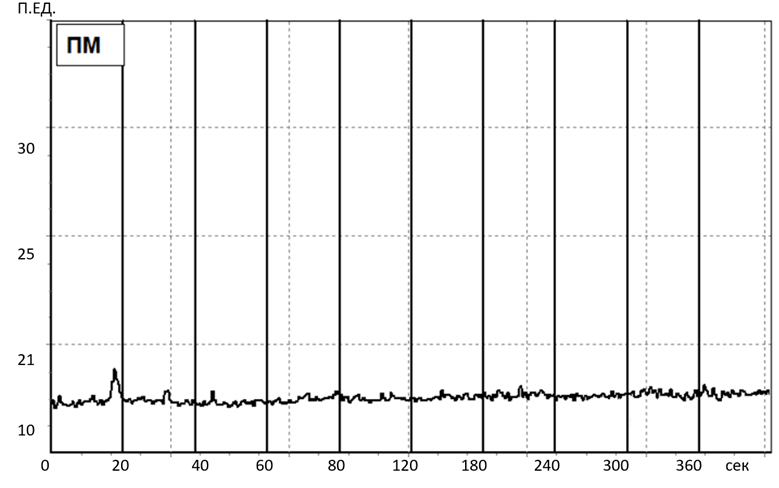
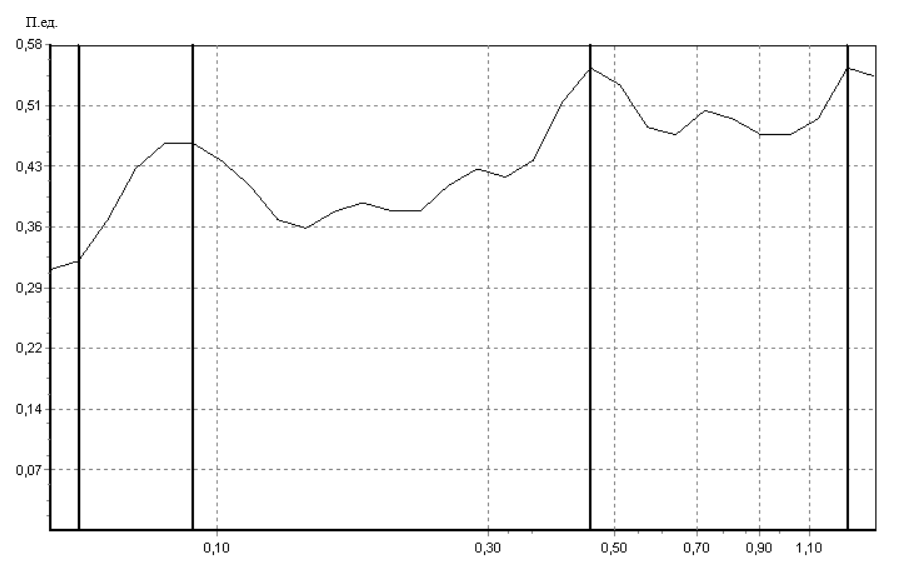
Исходно значения показателя микроциркуляции и вейвлет-спектры у крыс во всех исследуемых группах не имели достоверных различий. Пример записи ЛДФ-грамм и вейвлет-спектра колебаний кровотока представлены на рисунке 2, рисунке 3.
Рис. 2. Пример записи ЛДФ-граммы у крыс в исходном состоянии.
Рис. 3. Пример вейвлет-спектра колебаний кровотока сосудов кожи в исходном состоянии.
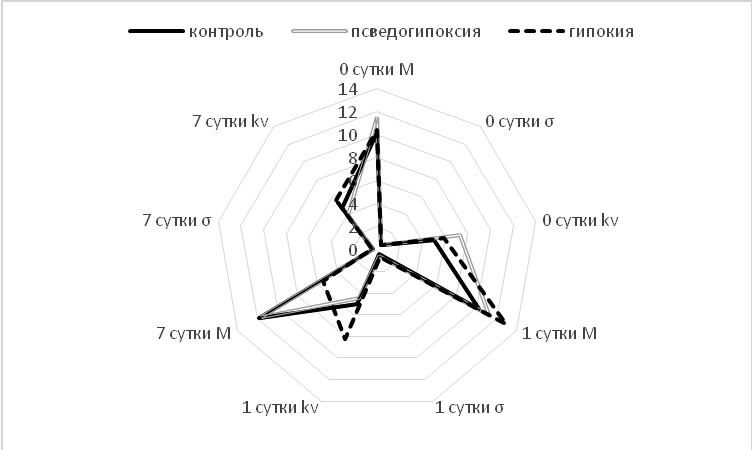
Проведение семидневного курса гипоксии не вызывало достоверных изменений показателя кожного кровотока у животных в группе К (контроль), и у животных в группе П (псевдо-гипоксированные крысы) (рис. 4).
Тем не менее, было установлено, что у крыс в группе Г (гипоксия) происходило повышение показателя коэффициента вариации на 62,5 % (p≤ 0,05) на 7 сутки воздействия, которое может быть обусловлено запуском адаптационных механизмов, необходимых для адекватного снабжения кровью клеток, тканей и органов. Выявленная динамика согласуется с известными данными, исходя их которых воздействие гипоксического фактора на организм лабораторных животных [15], приводит к снижению числа функционирующих кровеносных капилляров поперечнополосатой мускулатуры в условиях дефицита содержания кислорода во вдыхаемом воздухе. Так же в условиях моделирования гипоксической газовой среды (16 %) на добровольцах была установлена динамика периферического кровообращения, наблюдали понижение линейных скоростных показателей микроциркуляции при воздействии гипоксии [16].
Рис. 4. Динамика изменения основных параметров микроциркуляции.
Факторы, регулирующие диаметр просвета сосудов подразделяются на две группы – это активные и пассивные факторы. К активным факторам микроциркуляции относятся: нейрогенный, эндотелиальный и миогенный. Эти факторы, напрямую оказывают генерализованное влияние на микроциркуляторное русло, тем самым модулируют ток крови со стороны сосудистой стенки и осуществляются с помощью мышечной составляющей. К пассивным факторам регуляции относят кардиальный или сердечный, представленный пульсовой волной со стороны артерий; второй фактор – дыхательный или респираторный, создаваемый присасывающим действием со стороны вен. Эти факторы регуляции кровотока оказывают регулировку вне системы микроциркуляции, но оказываются в кровотоке и могут быть обнаружены при проведении зондирования, поскольку сама система микроциркуляторного русла тесно связана со всем аппаратом кровообращения и локализована между артерий и вен [17].
Наблюдаемая динамика изменения работы регулирующих механизмов тонуса сосудов микрокровотка у исследуемых крыс реализовалась в преобразовании параметров активных и пассивных факторов, регулирующих нутритивный ток крови. После однократного сеанса гипоксии, с изменением уровня разрежения воздуха (–0,306 кг/см2) было отмечено усиление частоты пассивных ритмов регуляции микрокровотка (сердечный) и активных (миогенный) [18].
При проведении анализа ЛДФ-грамм у крыс группы К (контроль) и П (псевдо-гипоксированные) не было установлено изменения параметра перфузии в микроциркуляторном русле испытуемых, в тот момент, когда в группе Г (гипоксия) (табл. 2) – ПМ (показатель микроциркуляции) достоверно снизился на 47 % (р<0,05) (табл. 2). Снижение (ПМ) параметра микроциркуляции у крыс в группе Г (гипоксия) говорит о том, происходит усиление мышечного тонуса прекапиллярных артериол, осуществляющих контроль притока крови в нутритивное русло. Данное обстоятельство является подтверждением того, что происходит снижение количества крови, которое поступает в капилляры и возможной централизации крови в сосуды центрального кровообращения (компенсаторная реакция) [19, 20].
Таблица 2
Основные параметры микроциркуляции, Me [25 %, 75 %]
|
Модель |
Контроль(К) |
Псевдогипокси-рованные (П) |
Гипоксия (Г) |
|
|
ПM(п.ед.) Ме[25 %;75 %] |
До воздействия |
10,23[9,5; 10,91] |
11,57[8,79; 12,1] |
10,41 [6,1; 16,92] |
|
На 1 сутки |
10,25 [ 8,61; 10,63] |
11,28 [10,48; 11,35] |
12,9 [10,38; 15,16]]* |
|
|
На 7 сутки |
11,84 [10,07; 12,12] |
11,67[10,31; 11,99] |
5,42 [5,04; 6,9]* |
|
|
Kv (%) |
До воздействия |
5,07[4,59; 5,76] |
7,35 [7,0; 7,5] |
5,08[4,11; 7,69] |
|
На 1 сутки |
5,0 [4,15; 5,68] |
4,45 [3,75; 5,67] |
4,86[3,71; 5,88] |
|
|
На 7 сутки |
4,7 [3,8; 4,33] |
3,98 [3,74; 4,07] |
8,25 [4,27; 8,32] |
|
|
σ (п.ед.) |
До воздействия |
0,51 [0,5; 0,53] |
0,51 [0,47; 0,54] |
0,51 [0,47; 0,54] |
|
На 1 сутки |
0,41 [0,23; 0,58] |
0,59 [0,54; 0,63] |
0,64 [0,34; 0,89] |
|
|
На 7 сутки |
0,35 [0,27; 0,42] |
0,34 [0,27; 0,4] |
0,46 [0,29; 0,64] |
|
* – по сравнению с исходным значением (p≤0,05)
ПМ (п.ед.) – средний арифметический показатель микроциркуляции; Kv (%) – коэффициент вариации, σ (п.ед.) – среднеквадратичное отклонение амплитуды колебания кровотока
Согласно данным вейвлет-анализа у животных контрольных групп К (контроль) и П (псведо-гипоксированных) значимых изменений не обнаружено. Однако, у крыс группы Г (гипоксия) на 1-е сутки воздействия было отмечено усиление частоты амплитуды колебаний в миогенном диапазоне (0,06–0,2 Гц) на 18,72 % (р<0,05) и пассивных частотных диапазонов (сердечного, кардиального модулирующего фактора (0,6–1,6 Гц) в ЛДФ-грамме испытуемых на 14,97 % (р<0,05) (рис. 5), (табл. 2).
Рис. 5. Запись ЛДФ-граммы у крыс на 7-сутки воздействия гипоксии.
Подводя итог вышесказанному, результаты анализа ЛДФ-грамм (результаты вейвлет-анализа) и показателя микроциркуляции (ПМ) позволили установить значительную роль в возможном использовании метода ЛДФ-диагностики для оценки качества методов повышения адаптивных возможностей сосудов микроциркуляторного русла кожи и центральных сосудов.
Динамика частотных диапазонов сосудов нутритивного кровотока у крыс по истечении недельного курса интервальных гипобарических изменялась следующим образом: отмечено усиление роли пассивных факторов, главным образом пульсовой волны со стороны артериального звена, на 24 % (р<0,05) (рис. 6). Наблюдаемые изменения можно связать с усилением работы мышечных клеток в сосудистой стенке артериальных сосудов микроциркуляторной системы кожи, и как следствие усиление функционирования системы кровообращения.
Данные полученные в представленной работе согласуются с результатами исследований при моделировании кратковременной гипоксической тренировки с регистрацией (ПМ) показателя микроциркуляции (снижение, затем компенсаторное увеличение уровня перфузии) [16].
Рис. 6. Вейвлет-спектр колебаний кровотока сосудов кожи у крыс на 7-сутки воздействия гипоксии.
ЗАКЛЮЧЕНИЕ
Методом лазерной допплеровской флоуметрии было исследована динамика показателей периферического кровообращения с проведением оценки изменений у крыс, с изучением частотных диапазонов кожного кровотока, в условиях ежедневных интервальных гипобарических тренировок. Таким образом, проведенный анализ состояния микроциркуляции и механизмов ее регуляции, на модели крыс, продемонстрировал положительное влияние интервальных гипобарических тренировок на функционирование системы микроциркуляторного русла кожи и расширение компенсаторного резерва, а также запуск адаптационных механизмов микроциркуляции в условиях моделирования разрежения воздуха. Полученные данные о реакциях артериального, обменного и венулярного звеньев периферической микрогемоциркуляции сосудов кожи открывают возможности избирательного воздействия на микрососуды с использованием прерывистой гипобарической гипоксии.
В результате проведенных исследований было установлено:
-
Применение интервального гипоксического воздействия способствует усилению микроциркуляции, показателя микроциркуляции (ПМ) на 1 сутки на 24,3 %(р <0,05).
-
В условиях воздействия гипоксии в развитии адаптивного ответа в части регуляции сосудистого тонуса задействованы как пассивные (пульсовая волна) увеличивались на 14,97 % (р<0,05), так и активные (миогенный фактор) увеличивались на 18,72 % (р<0,05), механизмы вклад которых равнозначен.
REFERENCES
-
Sokolov A. V., Rakita D. R., Kochetkova N. G., Garmash V. Ya. Intermittent normobaric hypoxytherapy in clinical practice, Rus. med. — Biol. Vestn. im. Akad. I. P. Pavlov, 3(4), 166 (2001).
-
Weissman N., Mantsy D., Buchspies D., et al. Congenital overexpression of erythropoietin causes «anti-pulmonary hypertension» of structural and functional changes in mice, both in normoxia and hypoxia, J Thrombinemost, 94(10), 630 (2005).
-
Meerson F. Z. Adaptive medicine: mechanisms and protective effects of adaptation, 334 p. (M.: Hypoxia medical LTD., 1993).
-
Goranchuk V. V. Hypoxytherapy, 536 (SPb: 000 «ALBI-SPB», 2003).
-
Masunaga S., Uto Yu., Nagasawa H., et al. Evaluation of hypoxic cell radiosensitizers from the point of view of radiosensitizing and repairinhibiting potential: dependence on the p53 status of tumor cells and influence on intratumoral resting cells, Antitumor RES, 26, 9, 1261 (2006).
-
Glazachev O. S., Kryzhanovskaya Yu. Adaptive medicine: strategy of psychophysiological adaptation of a person to a critically changed environment, Bulletin of the International Academy of Sciences (Russian section) 1, 48 (2019).
-
Aleshin A. I., Volovich V. B., Zabirov M. R., Burdakov V. V., Kots Ya. I., Meerson F. Z. Influence of adaptation to periodic hypoxia on the course of idiopathic arrhythmias, microcirculation and blood clotting, Cardiology, 32 (4), 35 (1992).
-
Ravaeva M. Yu., Chuyan E. N., Mironyuk I. S., Cheretaev I. V., Kolesnik V. V., Pivovarchuk A.V., Grishina T. V., Ibragimova E. I. Indicators of the rat cardiorespiratory system under the action of acetylsalicylic acid in different concentrations, Scientific notes of the V. I. Vernadsky Crimean Federal University. Biology. Chemistry, 6 (1), 150 (2020).
-
Krupatkin A. I., Sidorov V. V., Functional diagnostics of the state of microcirculatory and tissue systems. Fluctuations, information, non-linearity, 496. (M.: Librikom, 2013).
-
Flammer A. J., Anderson T., Celermajer D. S., Creager M. A., Deanfield J., et al. The assessment of endothelial function: from research into clinical practice, Circulation, 126, 753 (2012).
-
Alistratova F., Toropova Ya., Bulavinova N., Smirnova E. Dynamics of skin vessels microcirculation parameters in rats at the hypoxia, International Scientific and Practical Conference «AgroSMART – Smart Solutions for Agriculture». ser. «KnE Life Sciences», 578 (2019).
-
Toropova Ya. G., Bogushevskaya V. D., Mishanin V. I., Korolev D. V., & Gareev K. G. Studying the effectiveness and safety of magnetically controlled delivery of magnetic nanoparticles on the model of an isolated rat heart, I. M. Sechenov Russian journal of physiology, 105(3), 386 (2016).
-
Tankanag A. V., Chemeris N. K. Application of wavelet transform for analysis of laser Doppler fluorograms, «Аpplication of laser Doppler flowmetry in medical practice», 28 (Pushchino, 2002)
-
Li Z. et. al. Effect of prolonged surface pressure on skin blood flows in analgesic rats-evaluation by spectral analysis of laser Doppler flowmetry signals, Physiol. Medical. Biol., 51, 2681 (2006).
-
Saldivar E. microcirculatory changes in chronic adaptation to hypoxia, Circ. Physiology, 5, 2064 (2003).
-
Shakhnovich P. G., Ivanov A. O., Cherkashin D. V., Belyaev V. F., Svistov A. S., Andrianov V. P., Zagarov E. S. The Possibility of correction of microcirculation indicators in hypoxia, Bulletin of the Russian Military medical Academy, 3 (51), 28 (2015).
-
Alexandrin V. V. Wavelet analysis of cerebral blood flow in rats, Regional blood circulation and microcirculation, 4 (36), 63 (2010).
-
Winslow R. M., Monge C. C., Statham N. J., Gibson C. G., Charache S. et al. Variability of oxygen affinity of blood: human subjects native to high altitude, N. Engl. J. Med., 284, 1298 (1971).
-
Chuyan E. N., Mironyuk I. S., Ravaeva M. Yu., Cheretaev I. V., Grishina T. V., Indicators of the rat cardiorespiratory system under the action of acetylsalicylic acid and its complex compounds with metals, Scientific notes of the V. I. Vernadsky Crimean Federal University. Biology. Chemistry, 6 (72), 2, 267 (2020).
-
Yang T. Xenon and sevoflurane provide analgesia during labor and fetal brain protection in a perinatal rat model of hypoxia-ischemia, PLoS one., 7, 544 (2012).