PECULIARITIES OF THE DEVELOPMENT OF DROSOPHILA MELANOGASTER UNDER CONDITIONS OF MODERATE FERROMAGNETIC SHIELDING AND X-RAY RADIATION ACTION
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 6 (72), №3, 2020
Publication text (PDF):Download
UDK: 595.773.4:537.531:544.163.3
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Tumanyants K. N., Federal V. I. Vernadsky Crimean University, Simferopol, Russia
Yarmolyuk N. S., Federal V. I. Vernadsky Crimean University, Simferopol, Russia
Stelmakh I. S. Federal V. I. Vernadsky Crimean University, Simferopol, Russia
TYPE:Article
DOI:https://doi.org/10.37279/2413-1725-2020-6-3-246-255
PAGES:from 246 to 255
STATUS:Published
LANGUAGE:Russian
KEYWORDS: ferromagnetic shielding, X-ray radiation, Drosophila melanogaster, pupated larvae, imago.
ABSTRACT (ENGLISH):
The question of the biological role of weakened electromagnetic fields (EMF) is relevant due to the fact that in modern life, organisms of varying degrees of complexity often face conditions in which the natural EMF can be shielded or distorted. And the study of the influence of ionizing radiation on life expectancy has been conducted for several decades in various laboratories around the world. The main component in determining the effects of radiation exposure is induced genetic instability, against the background of which it is possible to implement a variety of radiobiological reactions that lead to both stimulation and significant suppression of vital functions of the cell or body. In this regard, the aim of the study was to investigate the effect of moderate ferromagnetic shielding and 40 Gy X-ray radiation on the development of Drosophila melanogaster.
Two series of experiments were carried out to achieve the goal. Initially, the nutrient medium prepared from yeast, sugar, semolina, propionic acid, water, and agar-agar was placed in the test tube. In groups there were 10 test tubes each, in which adult flies in number of 1 female and 1 male were placed. In the experiment, tubes with daily egg-laying were used (after the daily content of parent flies were removed from the tubes). Clutches were observed: from the appearance of the first pupae to the end of adults’ release. All groups of insects were kept in special thermoboxes (without light access). In the first series of the experiment the air temperature was 22 °C, in the second series of the experiment – 18 °C.
The development of Drosophila melanogaster depends on t° air, with its decrease from 22 ° C to 18 ° C, the intensity of pupation of larvae and the yield of adults decreases by 45 % (p<0,05) and 50 % (p<0,05), respectively, and slows down by two days. In conditions of moderate ferromagnetic shielding in the first series of the experiment no reliable changes were found, while in the second series at t = 18 °C EME stimulates the process of pupation of larvae on the 8th day by 21 % (p<0,05), and the yield of adults on the 16th day by 30 % (p<0,05) in contrast to the development of Drosophila melanogaster in the control group. However, in both series EMEs do not affect the total number of pupated larvae and the yield of adults. In the first series of the experiment, X-ray irradiation with 40 Gy absorbed dose and 5-minute exposure leads to 28 % (p<0,05) and 55 % (p<0,05) decrease in the number of pupated larvae on the 6th and 7th days of development, respectively, and to 86 % (p<0,05) and 30 % (p<0,05) decrease in adults appearance on the 12th and 13th days, respectively, in comparison with the control group data. Whereas, in the second series of the experiment the number of pupated larvae decreased by 85 % (p<0,05) and 50 % (p<0,05) respectively on the 7th and 9th days, and the number of adults decreased by 85 % (p<0,05) relatively to the control data. Also X-ray irradiation causes delay in time of pupation of larvae and formation of adults.
ВВЕДЕНИЕ
Вопрос о биологической роли ослабленных электромагнитных полей (ЭМП) является актуальным в связи с тем, что в современной жизни организмы различной степени сложности часто сталкиваются с условиями, в которых естественное ЭМП может экранироваться или искажаться. А исследование влияния ионизирующей радиации на продолжительность жизни ведется уже несколько десятилетий в различных лабораториях мира. Основным компонентом в определении эффектов облучения является индуцированная генетическая нестабильность, на фоне которой возможна реализация разнообразных радиобиологических реакций, приводящих как к стимуляции, так и значимому угнетению жизненно важных функций клетки или организма.
В связи с этим, целью исследования явилось изучение влияния умеренного ферромагнитного экранирования и рентгеновского излучения в дозе 40 Гр на развитие Drosophila melanogaster.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование изменений плодовитости в условиях экранирования и рентгеновского облучения выполнено на плодовых мушках Drosophila melanogaster. В экспериментах использовались мухи чистой линии D18, полученные от кафедры генетики Киевского национального университета имени Т. Шевченко.
Для реализации поставленной цели были проведены две серии эксперимента.
Изначально в пробирку помещалась питательная среда, приготовленная из дрожжей, сахара, манной крупы, пропионовой кислоты, воды и агар-агара. В группах было по 10 пробирок, в которые помещались взрослые особи мух в количестве 1 самки и 1 самца. В эксперименте использовались пробирки с суточной кладкой яиц (после суточного содержания мухи-родители из пробирок удалялись). Кладки наблюдались: от появления первых куколок до прекращения выхода имаго. Все группы насекомых содержались в специальных термобоксах (без доступа света). В первой серии эксперимента температура воздуха составляла 22 °С, во второй серии эксперимента – 18°С.
Во всех сериях эксперимента закладки в группах делались параллельно друг к другу. Мухи интактной группы (Контроль) находились в стандартных лабораторных условиях. Насекомые второй группы (ЭМЭ) находились 24 часа в сутки в экранируемой камере. Насекомые третьей группы (Х-гау 5′) находились после 5 минут облучения в стандартных лабораторных условиях. Облучение проводилось на 2-е сутки от начала закладки родителей – стадия личинки первых суток.
Ослабление фонового ЭМП достигалось применением экранирующей камеры размером 2x3x2 м, изготовленной из двухслойного железа «Динамо». Измерения шумов и постоянной составляющей гипомагнитного поля проводились в лаборатории и внутри экрана. Коэффициент экранирования постоянной составляющей МП, измеренный с помощью феррозондового магнитометра, составлял по вертикальной составляющей 4,375, по горизонтальной составляющей – 20. Кроме того, в помещении лаборатории и в экранирующей камере были произведены измерения естественного радиационного фона с помощью радиометра бета-гамма излучения РКС-20.03 «Припять». Величина фона составила 10-15 мкР/ч, что соответствует норме. Различий естественного радиационного фона в лаборатории и в экранирующей камере не выявлено [1].
Для облучения насекомых был сконструирован дополнительный модуль к дифрактометру ДРОН-3 для облучения биологических объектов. Рабочим элементом модуля служила трубка рентгеновская 2,1БСВ29-Мо. Модуль позволяет проводить рентгеновское облучение биологических объектов помещенных в пробирки 14×100-120 (диаметр луча ~10 мм), доза полученная мухами составила 40 Гр.
Для проверки достоверности отличий использовался непараметрический метод: критерий Манна-Уитни. Значение асимметрии и эксцесса полученных данных в группах подтверждают не нормальное распределение в них переменных. Сравнение в разных вариантах эксперимента проводили при помощи дисперсионного анализа количественных признаков. Показатель усредняли в каждом варианте опыта. И для каждого среднего рассчитывали статистическую ошибку. Для вычислений использовали программное обеспечение Microsoft Excel и STАTISTICА 10 [2].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для оценки воспроизводимости результатов исследования было проведено 2 серии эксперимента в разные сезоны года, когда t° воздуха существенно различалась. Первая серия была проведена при t = 22 °C. Вторая серия эксперимента была проведена при температуре воздуха 18 °C.
При более низкой температуре воздуха 18 °C развитие личинок происходит медленнее – с 7 по 9 день, при t° воздуха 22 °C – с 5 по 7 сутки (рис. 1А). Таким образом, развитие Drosophila melanogaster зависит от t° воздуха, при ее снижении интенсивность окукливания личинок снижается.
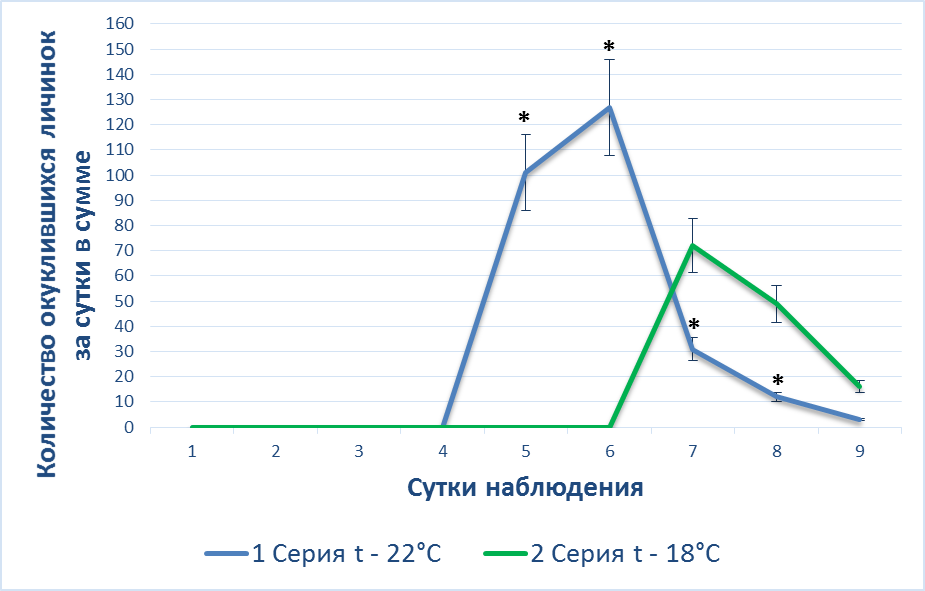 |
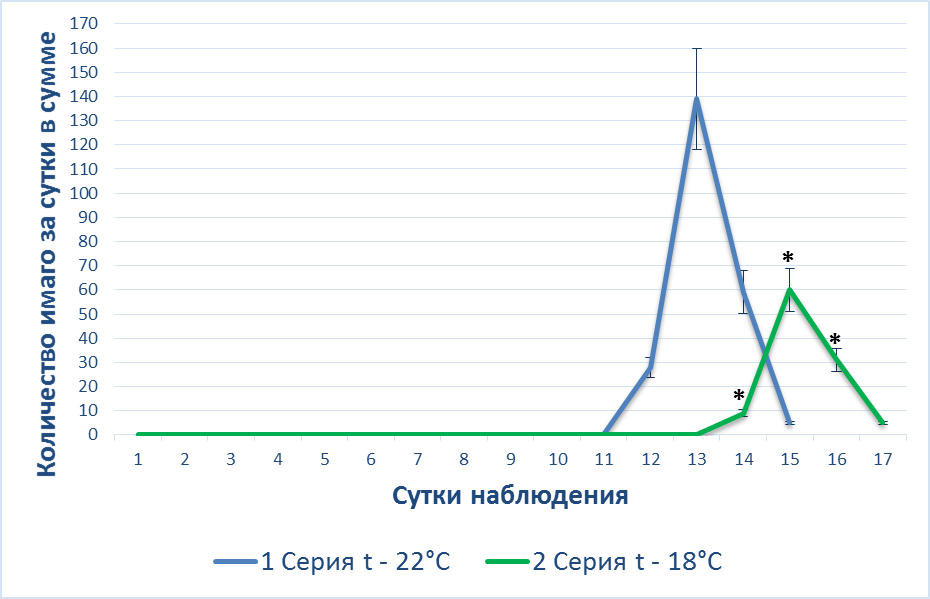 |
| А | Б |
Рис 1. А – Динамика () окукливания личинок у интактных животных при различной температуре воздуха; Б – динамика () выхода имаго у интактных животных при различной температуре воздуха.
Примечание: * – различия достоверны между данными, полученными у животных сравниваемых групп (*– p<0,05).
Выход взрослых особей при более низкой температуре воздуха 18 °C, как и развитие личинок, происходит медленнее (с 14 по 16 день), тогда как при t° воздуха 22 °C – с 12 по 14 сутки (рис. 1Б). Таким образом, выход имаго Drosophila melanogaster, как и период окукливания, также зависит от t° воздуха. При ее снижении интенсивность выхода взрослых особей снижается.
Из проведенных двух серий экспериментов можно утверждать, что развитие Drosophila melanogaster зависит от t° воздуха, при ее снижении с 22 °С до 18 °С интенсивность окукливания личинок и выход имаго снижается на 45 % (p<0,05) и 50 % (p<0,05) соответственно, и замедляется на двое суток.
Изменение динамики развития Drosophila Melanogaster в условиях электромагнитного экранирования
Анализируя влияние ЭМЭ на развитие Drosophila Melanogaster отмечено, что в первой серии эксперимента в динамике окукливания личинок и появления имаго достоверных отличий не обнаружено.
Тогда как во второй серии эксперимента в условиях ЭМЭ установлено: пик окукливания пришелся на седьмые сутки в обеих группах, различий при уровне достоверности между группами (p<0,05) не обнаружено. На 8-е сутки пришелся спад окукливания, в среднем окуклившихся личинок было 6±1,5 на пробирку, тогда как в группе ЭМЭ было на 21 % (p<0,05) больше куколок в отличие от контрольной группы (рис. 2А).
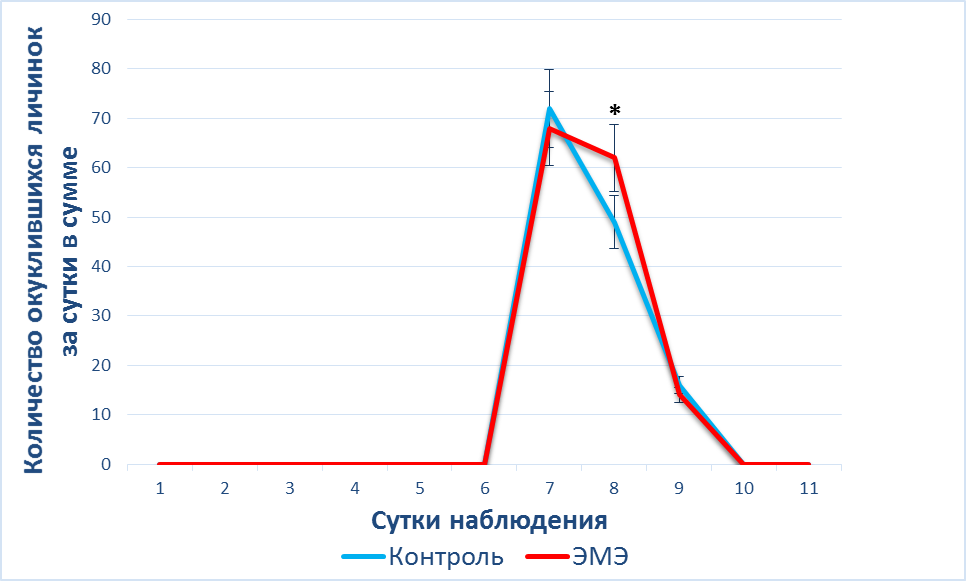 |
 |
| А | Б |
Рис. 2. А – динамика () окукливания личинок в условиях ЭМЭ при
t = 18°C; Б – динамика () появления имаго в условиях ЭМЭ при t – 18 °C
Примечание: * – различия достоверны между данными, полученными у животных контрольной группы, и при воздействии ЭМЭ (*– p<0,05).
Во второй серии эксперимента первые имаго в исследуемых группах появились на 14-е сутки наблюдения, а на 15-е сутки пришелся пик их появления, когда количество имаго составляло 5±0,6 на пробирку, однако различия в эти сутки исследования были статистически не достоверны. На 16-й день произошел спад во всех группах, где в группе ЭМЭ на 30 % (p<0,05) имаго было больше, чем в контрольной группе.
Таким образом умеренное ферромагнитное экранирование во второй серии эксперимента при t – 18 °C стимулирует процесс окукливания личинок на 8-е сутки на 21 % (p<0,05) и выход взрослых особей на 16-е сутки на 30 % в отличие от первой серии при t = 22°C, когда достоверных изменений не было обнаружено (рис. 2). Но в обеих сериях эксперимента ЭМЭ не влияет на суммарное количество окуклившихся личинок и выход имаго.
Изменение динамики развития Drosophila Melanogaster в условиях рентгеновского излучения
В первой серии эксперимента окуклившиеся личинки после облучения начинали появляться на 5-е сутки наблюдения, но стоит отметить, что в группе X-ray 5′ было на 13 % меньше окуклившихся личинок, чем в контроле, однако эти данные статистически не достоверны. На шестые сутки пришелся пик окукливания в контрольной группе – 9±1,5 на пробирку, где количество окуклившихся личинок в группе X-ray 5′ было уже на 28 % (p<0,05) меньше по сравнению с контролем. После чего в группах произошел спад окукливания, когда в группе X-ray 5′ было куколок меньше на 55 % (p<0,05), чем в контрольной группе (рис. 3).
Следует отметить, что в общей сумме по количеству окуклившихся личинок выявлено, что в группе X-ray 5′ в первой серии эксперимента на 26 % меньше окуклилось личинок, чем в контроле.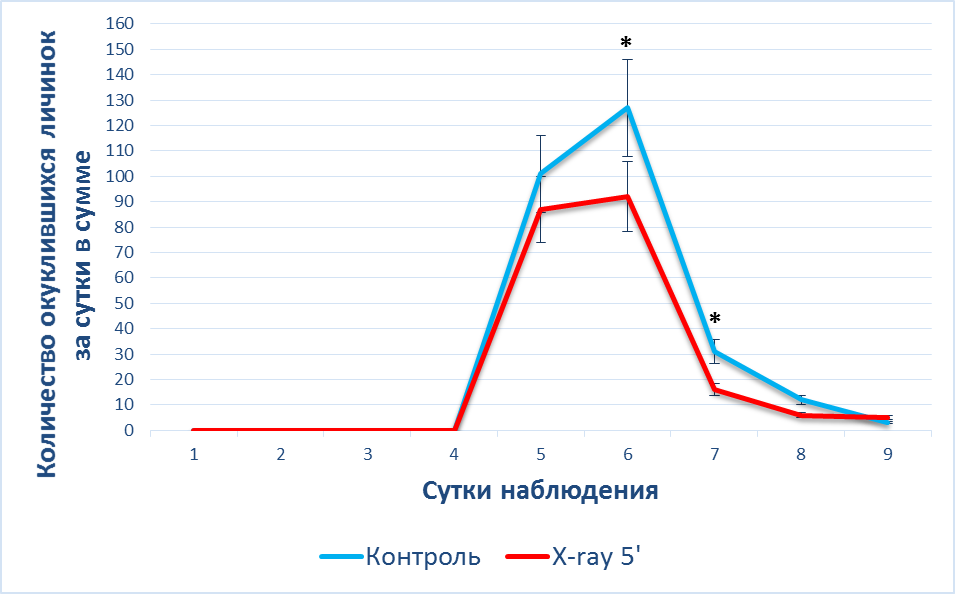
Рис. 3. Динамика () окукливания личинок после рентгеновского облучения при t – 22°C
Примечание: * – различия достоверны между данными, полученными у животных контрольной группы, и после воздействии X-ray 5′ (*– p<0,05).
Анализируя вторую серию эксперимента в группе X-ray 5′ наблюдалось отставание на 1 сутки от контроля в окукливании личинок на протяжении всего наблюдения. Так, пик окукливания личинок в облученной группе пришелся на 8-е сутки исследования (6±1 на пробирку) с отставанием в развитии и количестве куколок.
Рис. 4. Динамика () окукливания личинок после рентгеновского облучения при t = 18°C
Примечание: * – различия достоверны между данными, полученными у животных контрольной группы, и после воздействия X-ray 5′ (*– p<0,05).
Достоверные различия наблюдались в окукливании личинок на 7-е и 9-е сутки эксперимента, когда в группе X-ray 5′ было на 85 % (p<0,05) и 50 % (p<0,05) соответсвенно меньше личинок, чем в контроле (рис. 4).
Кроме того, в общей сумме по количеству окуклившихся личинок выявлено, что в группе X-ray 5′ во второй серии эксперимента на 40 % меньше окуклилось личинок, чем в контроле.
Анализируя динамику появления взрослых особей после воздействия рентгеновским облучением можно отметить, что в первой серии эксперимента первые имаго появились в группе X-ray 5′ на двенадцатые сутки наблюдения. В первый день в выходе имаго в группе X-ray 5′ наблюдалось отставание от контроля на 86 % (p<0,05). Пик появления имаго пришелся на 13 сутки наблюдения – 10±1 на пробирку, где куколок было на 30 % (p<0,05) меньше, чем в контрольной группе (рис. 5).
Следуем отметить, что в общей сумме в первой серии эксперимента в группе
X-ray 5′ вышло на 28 % меньше имаго, чем в контроле.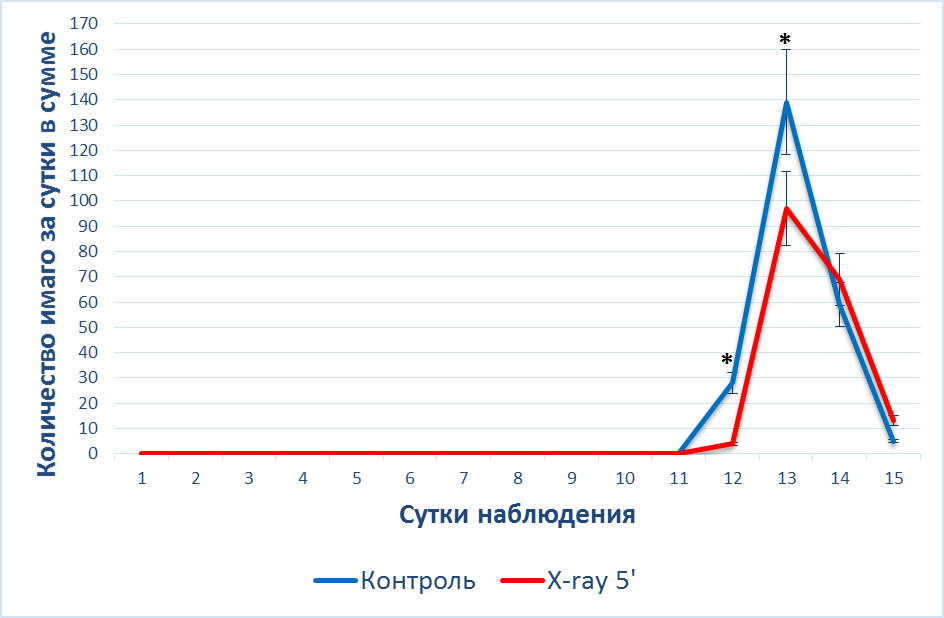
Рис. 5. Динамика () появления имаго после рентгеновского облучения при t – 22°C
Примечание: * – различия достоверны между данными, полученными у животных контрольной группы, и после воздействия X-ray 5′ (*– p<0,05).
Во второй серии эксперимента в группе X-ray 5′ наблюдалось отставание на 1 сутки от контроля в появлении имаго на протяжении всего наблюдения. На 15 сутки наблюдения в группе X-ray 5′ было на 85 % (p<0,05) меньше личинок, чем в контроле, где в эти сутки отмечен пик в развитии особей. Тогда как в облученной группе пик пришелся на 16 сутки, когда количестве имаго превышало таковые на 48 % (p<0,05) относительно данных контрольной группы, однако в это время в контроле уже отмечен спад в динамике появения имаго (рис. 6).
Кроме того выявлено, что в общей сумме в группе X-ray 5′ во второй серии эксперимента вышло на 43 % меньше имаго, чем в контроле.
Из проведенных двух серий экспериментов можно утверждать, что рентгеновское облучение приводило к снижению числа окуклившихся личинок и появления имаго. Кроме того наблюдалась задержка во времени окукливания личинок и образовании взрослых особей.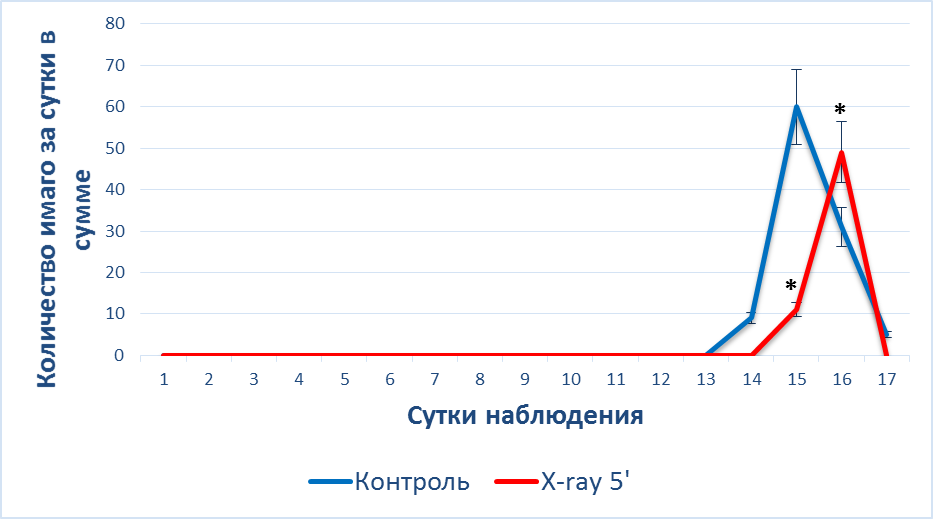
Рис. 6. Динамика () появления имаго после рентгеновского облучения при t = 18°C
Примечание: * – различия достоверны между данными, полученными у животных контрольной группы, и после воздействии X-ray 5′ (*– p<0,05).
Таким образом, развитие Drosophila melanogaster в условиях умеренного ферромагнитного экранирования и действия рентгеновского излучения характеризуется изменением процессов окукливания и появления имаго.
Согласно литературным данным благодаря Drosophila melanogaster были проведены исследования в области влияния электромагнитных полей на живые организмы. Однако полученные результаты очень часто приводили к неоднозначным выводам. В 1985 году руководитель группы Хэмнериусом не наблюдал изменений в глазной пигментации при влиянии высокочастотных электромагнитных полей, ни генетических изменений, влияющих на смертность у Drosophila melanogaster [3]. С другой стороны, в 1988 году Сима и Томура наблюдала определенные генные изменения, которые затронули форму крыла [4]. В 1995 году Коан и др. описал эффект влияния магнитных полей на росте митотических перекомбинаций [5]. Однако исследование, проводимое в 1993 году Кикути и др., не сообщило ни о каких изменениях, о воздействиях электромагнитных полей чрезвычайно низких частот [6], тогда как в 1995 году команда Нгуена сообщила, что воздействие магнитных полей на эмбрионы приводит к неправильному развитию Drosophila melanogaster [7].
Коллектив авторов (Варенцова Е. Р. и др.) в 1985 г. исследовали у радиочувствительной линии дрозофилы 201 G1 плодовитость после облучения самок и частоту доминантных летальных мутаций γ-лучами. Выяснено, что дозы γ-лучей, превышающие 10 Гц, оказывают сильное стерилизующее действие на мутантных самок и повышение смертности мух после облучения [8]. Далее в 1986 г. Моссэ И. Б. и Савченко В. К. изучали плодовитость и жизнеспособность экспериментальных популяций дрозофилы при рентгеновском облучении и воздействии пигмента меланина на протяжении 55 поколений. Результаты исследований показали, что жизнеспособность особей в облученных популяциях в среднем ниже, чем в контрольных. Плодовитость при облучении вначале снижается, затем повышается, превосходя уровень в контроле. Добавление меланина в питательную среду оказывает благоприятное воздействие на оба показателя как в облученных, так и в контрольных популяциях [9]. В период с 1993 по 1995 гг. коллективом авторов (Ратнер В.А. и др.) в изогенной линии Drosophila melanogaster были изучены дозы γ-облучения, которые вызывают ряд мутаций. Получены результаты о зависимости уровня дозы к количеству возникших мутаций в двух поколениях [10]. В 1962 г. ученые показали возможность использования Drosophila melanogaster в изучении генетических эффектов облучения в малых дозах [11]. Полученная при облучении в дозе 0.2 Гр частота рецессивных сцепленных с полом летальных мутаций (РСПЛМ) превышала контрольный уровень в 2–4 раза. Сегодня большинство исследований свидетельствуют о высокой генетической эффективности облучения в малых дозах.
ЗАКЛЮЧЕНИЕ
- Развитие Drosophila melanogaster зависит от t° воздуха, при ее снижении с 22 °С до 18 °С интенсивность окукливания личинок и выход имаго снижается на 45 % (p<0,05) и 50 % (p<0,05) соответственно, и замедляется на двое суток.
- В условиях умеренного ферромагнитного экранирования в первой серии эксперимента достоверных изменений не обнаружено, тогда как во второй серии при t = 18°C ЭМЭ стимулирует процесс окукливания личинок на 8-е сутки на 21 % (p<0,05), а выход взрослых особей на 16-е сутки на 30 % (p<0,05) в отличие от развития Drosophila melanogaster в контрольной группе. Однако в обеих сериях ЭМЭ не влияет на суммарное количество окуклившихся личинок и выхода имаго.
- В первой серии эксперимента рентгеновское облучение с поглощенной дозой в 40 Гр и экспозицией времени 5 минут приводит к снижению числа окуклившихся личинок на 6 и 7-е сутки развития на 28 % (p<0,05) и 55 % (p<0,05) соответственно, и к снижению появления имаго на 12 и 13-е сутки на 86 % (p<0,05) и 30 % (p<0,05) соответственно относительно данных контрольной группы. Тогда как во второй серии эксперимента снижение числа окуклившихся личинок отмечено на 7 и 9-е сутки на 85 % (p<0,05) и 50 % (p<0,05) соответственно, а снижение появления имаго на 15-е сутки – на 85 %(p<0,05) относительно контроля. Также рентгеновское облучение вызывает задержку во времени окукливания личинок и образования взрослых особей.
Работа выполнена на базе ЦКП «Экспериментальная физиология и биофизика» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского»
REFERENCES
- Bogatina N. I. The method of obtaining extremely weak permanent magnetic and electric fields and a well reproducible combined magnetic field for biological research, Scientists of the V.I. Vernadsky Tauride National University, 23(62), 2, 54 (2010).
- Lapach S. N., Chubenko A. V., Babich P. N. Statistical methods in medical and biological research using Excel, 319 р. (K.: Modmon, 2000).
- Muller H. J. Further studies on the nature and of gene mutations, Proc. of the 6th Int. Congr. of Genetics., 1, 213 (1932).
- Servomaa K., Rytomaa T. UV light and ionizing radiations cause programmed death of rat chlorleukemia cells by inducing retropositions of a mobile DNI ‘ element (LIRn), Intm. J. Radiat. Biol., 57, 2, 331 (1990).
- Malpel S., Klarsfeld A., Rouyer F. Circadian synchronization and rhythmicity in larval photoperception-defective mutants of Drosophila, Journal of Biological Rhythms., 19, 10 (2004).
- Kikuchi T. [et al.] Multigeneration exposure test of Drosophila melanogaster to ELF alternating magnetic fields, Bioelectromagnetics, 19, 6, 335 (1998).
- Zhang B. Exposure to hypomagnetic field space for multiple generations of amnesia in Drosophila melanogaster, Neuroscience Letters., 371, 190 (2004).
- Weisman N. Ya. Signal cell pathways in animal ontogenesis on the example of Notch cascade in Drosophila melanogaster, Journal of Biology., 65(4), 322 (2004).
- Mglinets V. A., Ivanov V.I. Time of action of genes in ontogenesis of drosophila (in Russian), Ontogenesis, 8, 2, 183 (1977).
- Romanovsky Yu. M., Stepanova N. V., Chernavskii D. S. Mathematical Biophysics (in Russian), 304 р. (Moscow: Nauka, 1984).
- Golubovsky M. D. Dobzhansky in Two Worlds, VOGIS Newsletter., 12, 9 (2006).



