AGE FEATURES OF BETA RHYTHMS EEG IN CHILDREN AGED 4-15 IN A STATE OF STABLE VISUAL ATTENTION
JOURNAL:«SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 7 (73), №2, 2021
Publication text (PDF): Download
UDK:612.821
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Mikhailova A. A., V.I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia
Kaida A. I., V.I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia
Eismont E. V., V.I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia
Pavlenko V. B. V.I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia
TYPE: Article
DOI: https://doi.org/10.37279/2413-1725-2021-7-2-95-103
PAGES: from 95 to 103
STATUS: Published
LANGUAGE: Russian
KEYWORDS:Thymus L., morphology, anatomy, RAPD-PCR, genetic electroencephalogram, relative power, beta rhythm, children, adolescents.
ABSTRACT (ENGLISH):
One of the reliable parameters for assessing the bioelectrical activity of the brain in children is the relative power (RP) of the EEG. Previous results have shown that EEG RP systematically changes not only depending on age, but also with various developmental disorders. The beta rhythm RP is of particular interest when performing tasks requiring the involvement of cognitive functions. In connection with the above, the purpose of the present study was to identify and analyze the RP of beta1 and beta2 EEG rhythms in a state of stable visual attention (SVА) in children 4–15 years old. The study involved 159 children (82 girls and 77 boys) aged 4–15 years with a normal level of physical and mental development. In the present study, children were required to observe and reproduce the movements of a computer mouse. At the same time, at certain moments, an image of a stationary computer mouse was presented, which was accompanied by a request to look at the computer screen, in connection with which both voluntary and involuntary attention of the subjects was activated. The use of the SVА situation makes it possible to analyze the nature of differences in the EEG pattern of children, taking into account the data on the neurophysiological mechanisms of attention. The greatest increase in the RP of the EEG beta1 rhythm found in the age range of 7–12. For the beta2 rhythm, the greatest increase discovered in the period of 10–15 years. The obtained values of the RP of the beta1 and beta2 rhythms of the EEG, recorded in the state of stable visual attention, in children of different ages can be used as reference data in the relevant research areas, as well as in the development of correction protocols for the cognitive functions and psychoemotional state using EEG biofeedback. The age-related dynamics of the beta rhythm RP can serve as an indicator of the maturation of cortical inhibition processes in children, which underlie the formation of voluntary cognitive functions and conscious purposeful behavior.
ВВЕДЕНИЕ
Биоэлектрическая активность головного мозга, регистрируемая с поверхности кожи головы, характеризуется ритмическими колебаниями, генерируемыми синхронизированной синаптической активностью больших популяций нейронов в таламокортикальных и кортико-корковых сетях. Такая активность представлена в виде электроэнцефалограммы (ЭЭГ). В процессе онтогенеза важной особенностью ЭЭГ является постепенное снижение мощности ее ритмов на протяжении детского и подросткового возраста. Причиной этих изменений являются синаптический прунинг (сокращение числа синапсов или нейронов для повышения эффективности нейросетей, удаления избыточных связей), увеличение толщины костей черепа и мягких тканей головы. При этом, однако, в наибольшей степени падает мощность низкочастотных компонентов ЭЭГ (дельта- и тета-ритмов), в то время как мощность высокочастотных составляющих (альфа-, бета- и гамма-ритмов) снижается в меньшей степени [1].
Одним из надежных параметров оценки биоэлектрической активности головного мозга у детей является относительная мощность (ОМ) ЭЭГ. Указанный показатель отражает вклад конкретного ритма по отношению к общей электрической активности в определенном отведении ЭЭГ. Использование показателей ОМ минимизирует индивидуальные различия абсолютной мощности, связанные с толщиной костей черепа и другими анатомическими факторами.
Было показано, что ОМ высокочастотных колебаний значимо увеличивается в возрастных периодах 8–12 [2], 10–13 лет [3]. При этом увеличение ОМ альфа-ритма происходило в затылочных областях, а ОМ бета-ритма – в центральных и передних областях неокортекса. Изменения спектрального состава ЭЭГ могут отражать снижение количества активных синапсов по мере взросления детей [4], увеличение миелинизации или размера аксонов [5].
Также были обнаружены различия в ОМ ЭЭГ у детей с синдромом дефицита внимания и гиперактивности (СДВГ) и нормально развивающихся сверстников. Так, у детей 8–12 лет с СДВГ, в сравнении с контрольной группой, обнаружены более высокие показатели ОМ дельта- и тета-ритмов, низкие значения ОМ альфа- и бета-ритмов [6]. Аналогичные особенности были обнаружены и в группах детей с СДВГ 8–13 лет [7] и 6–14 лет [8]. В другой работе было показано, что ОМ бета-ритма в центральных областях была выше у нормально развивающихся детей по сравнению с детьми с СДВГ [9]. У взрослых с СДВГ также зарегистрирована более низкая ОМ альфа-ритма, чем у здоровых испытуемых [10].
Особенности показателей ОМ ритмов ЭЭГ выявлены и у детей 8–11 лет с плохой успеваемостью в школе. Такие дети имели более высокую ОМ тета-ритма и низкую ОМ альфа2-ритма по сравнению с детьми контрольной группы [11].
Таким образом, результаты исследований показали, что ОМ ЭЭГ систематически изменяется не только в зависимости от возраста, но и при различных нарушениях развития. Однако не было проведено комплексного исследования изменений ОМ ритмов ЭЭГ у детей в широком возрастном диапазоне, что позволило бы выявить критические периоды в развитии биоэлектрической активности головного мозга. Такие данные могли бы быть использованы при проведении коррекционных тренингов биологической обратной связи по ЭЭГ с детьми и подростками. Особый интерес представляет исследование бета-ритма ЭЭГ, поскольку данный ритм отражает активность тормозящих ГАМК-эргических нейронных сетей неокортекса [12, 13]. Баланс возбуждения и торможения критически важен для оптимального протекания процессов произвольного и непроизвольного внимания, обучения, мышления, а также для поддержания эмоционального статуса ребенка. Исходя из этого важно выявить в каком возрасте является нормой определённая степень выраженности показателей бета-ритма и его поддиапазонов.
Предыдущие исследования анализировали возрастную динамику ОМ ритмов ЭЭГ детей в покое и, как правило, при закрытых глазах [2, 3]. В то же время, особый интерес представляет ОМ бета-ритма при выполнении заданий, требующих вовлечения когнитивных функций. В связи с вышеизложенным, целью настоящего исследования явилось выявление и анализ ОМ бета1- и бета2-ритмов ЭЭГ в состоянии устойчивого зрительного внимания (УЗВ) у детей 4–15 лет.
В настоящем исследовании дети должны были наблюдать за движениями компьютерной мыши и воспроизводить их. При этом в определенные моменты предъявлялось изображение неподвижной компьютерной мыши, что сопровождалось просьбой смотреть на экран компьютера, в связи с чем активировалось как произвольное, так и непроизвольное внимание испытуемых. Использование ситуации УЗВ позволяет анализировать природу различий в паттерне ЭЭГ детей разного возраста, учитывая данные о нейрофизиологических механизмах внимания.
МАТЕРИАЛ И МЕТОДЫ
В исследовании приняли участие 159 детей (82 девочки и 77 мальчиков) в возрасте от 4 до 15 лет с нормальным уровнем физического и умственного развития. Выборка была разделена на 4 возрастные группы: 4–6 лет (43 человека), 7–9 лет (51 человек), 10–12 лет (33 человека) и 13–15 лет (32 человека).
Регистрацию ЭЭГ осуществляли с помощью электроэнцефалографа «Нейрон-Спектр – 3», данные обрабатывали с использованием компьютерной программы «WinEEG». Для коррекции артефактов применяли метод независимых компонент. ЭЭГ-потенциалы отводили монополярно в 19 отведениях по системе 10–20. Областью интересов в данном исследовании являлись переднелобные, лобные, височные, центральные, теменные и затылочные регионы неокортекса (локусы Fp1, Fp2, F3, F4, F7, F8, T3, T4, T5, T6, С3, С4, P3, P4, O1, O2). Референтным электродом служили объединенные контакты, закрепленные на мочках ушей. Частоты среза фильтров высоких и низких частот составляли, соответственно, 1,5 и 35 Гц, частота оцифровки ЭЭГ-сигналов – 250 Гц.
Запись ЭЭГ производилась в ситуации УЗВ в течение 30 секунд. Отрезки ЭЭГ подвергались быстрому преобразованию Фурье с эпохой анализа 4 с и взаимным перекрытием эпох 50 %.
Определяли значения мощности ЭЭГ в следующих частотных диапазонах: тета- (4–7 Гц), альфа- (8–13 Гц), бета1- (14–20 Гц) и бета2- (14–20 Гц) ритмы. Для дальнейшего анализа рассчитывались показатели ОМ бета1- и бета2-ритмов. ОМ для данных ритмов ЭЭГ рассчитывалась как отношение мощности отдельного ритма к сумме мощностей всех исследованных ритмов в каждом отведении.
Статистический анализ данных проводился с использованием пакета STATISTICA 10.0 (StatSoft Inc., США). Различия в ОМ бета1- и бета2-ритмов ЭЭГ у детей четырех возрастных групп оценивались с помощью дисперсионного анализа с повторными измерениями (repeated measures ANOVA). Оценивали влияние факторов «Возраст» (дети в возрасте 4–6, 7–9, 10–12 и 13–15 лет) и «Локус» (16 отведений ЭЭГ). Далее, для расчета статистической значимости различий в ОМ бета1- и бета2-ритмов ЭЭГ у детей в привязке отдельно к каждому из шестнадцати отведений ЭЭГ, в рамках каждой возрастной группы использовался метод априорных контрастов (оценка F-распределения). Для описания данных использовали среднее и стандартную ошибку среднего.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты дисперсионного анализа различий в ОМ бета1-ритма в УЗВ у детей 4–6, 7–9, 10–12 и 13–15 лет представлены в таблице 1.
Обнаружено значимое влияние факторов ГРУППА и ЛОКУС, а также их взаимодействия. Для оценки значимости различий в ОМ бета1-ритма в каждом из 16 локусов ЭЭГ рассчитывались априорные контрасты на основе F-статистики. Гистограммы величин ОМ бета1-ритма в сравнении между различными возрастными группами представлены на рис. 1.
Таблица 1
Результаты дисперсионного анализа различий в относительной мощности бета 1- и бета 2-ритмов ЭЭГ при открытых глазах (в ситуации зрительного внимания) у детей разных возрастных групп (фактор ГРУППА)
| Ритм ЭЭГ | ГРУППА | ЛОКУС | ЛОКУС×ГРУППА |
| F3, 155;
p |
F15, 2325;
p |
F45, 2325;
p |
|
| Бета 1 | 17,08;
< 0,001 |
69,73;
< 0,001 |
1,40
0,04 |
| Бета 2 | 1,53;
0,20 |
78,6
< 0,001 |
1,61
0,006 |
Примечание: ЛОКУС – 16 отведений
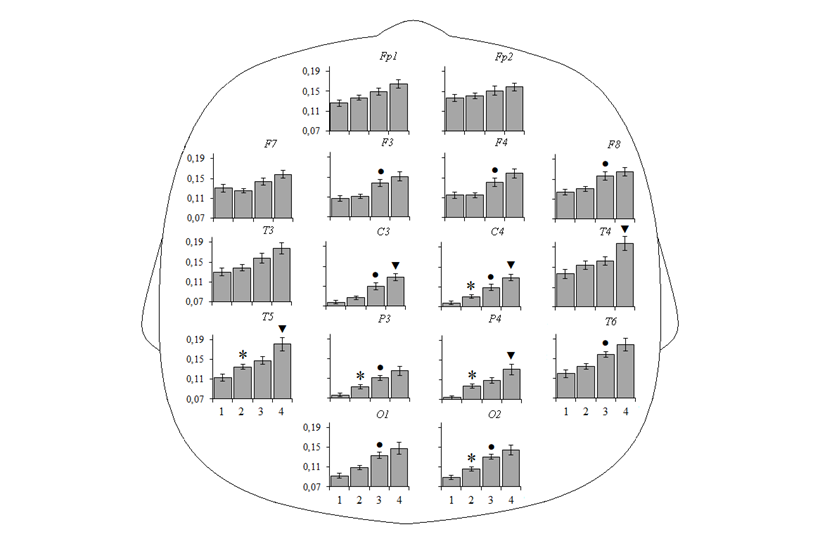
Рис. 1. Относительная мощность бета1-ритма ЭЭГ у детей в возрасте 4–6 (1), 7–9 (2), 10–12 (3) и 13–15 (4) лет. Случаи достоверных различий (при р<0,05), выявленные методом априорных контрастов: * – между группами детей 1 и 2, ● – между группами детей 2 и 3, ▼ – между группами детей 3 и 4.
В группе детей 7–9 лет по сравнению с детьми 4–6 лет были выявлены значимо более высокие показатели ОМ бета1-ритма ЭЭГ, зарегистрированной в ситуации УЗВ, в центральном локусе правого полушария (С4: p = 0,04), задневисочном отведении левого полушария (T5: p = 0,04), теменных локусах (Р3: p = 0,02;
Р4: p = 0,002) и затылочном отведении правого полушария (О2: p = 0,03). У детей 10-12 лет, в сравнении с детьми 7–9 лет, величина ОМ бета1-ритма была значимо выше в лобных областях (F3: p = 0,002; F4: p = 0,005), заднем нижне-лобном локусе правого полушария (F8: p = 0,005), центральных отведениях (С3: p = 0,002;
С4: p = 0,007) и задневисочном локусе правого полушария (T6: p = 0,04), а также в теменном локусе левого полушария (Р3: p = 0,02) и затылочных областях
(О1: p = 0,01; О2: p = 0,003). В группе детей 13–15 лет, в сравнении с группой 10–12 лет, значимо более высокие показатели ОМ бета1-ритма ЭЭГ были зарегистрированы в центральных областях (С3: p = 0,02; С4: p = 0,01), средне-височном локусе правого полушария (T4: p = 0,02), задневисочном отведении левого полушария (T5: p = 0,009) и теменном локусе правого полушария (Р4: p = 0,01).
Таким образом, обнаружено увеличение представленности бета1-ритма у детей 4–15 лет по мере взросления, а наиболее критичным в этом отношении является период 7–12 лет.
Дисперсионный анализ различий в ОМ бета2-ритма в ситуации УЗВ у детей четырех возрастных групп продемонстрировал значимое влияние фактора ЛОКУС и взаимодействия факторов ГРУППА× ЛОКУС (табл. 1). Гистограммы величин ОМ бета2-ритма в сравнении между различными возрастными группами представлены на рис. 2.
Значимо более низкие показатели ОМ бета2-ритма ЭЭГ, зарегистрированной в ситуации УЗВ, были выявлены в группе детей 7–9 лет относительно детей 4–6 лет во фронтальном локусе правого полушария (F4: p = 0,02). Значимых различий в ОМ бета2-ритма ЭЭГ у детей 7–9 и 10–12 обнаружено не было. В группе подростков
13–15 лет, в сравнении с детьми 10–12 лет, зарегистрированы значимо более высокие показатели ОМ бета2-ритма ЭЭГ в средне-височном (T3: p = 0,04) и задневисочном отведениях левого полушария (T5: p = 0,04) и теменном локусе левого полушария (Р3: p = 0,03).
Таким образом, значимое нарастание представленности бета2-ритма выявлено в период 10–15 лет.
Обнаруженное возрастание ОМ бета1- и бета2-ритмов ЭЭГ согласуется с результатами других исследований. Так, известно, что по мере взросления наблюдается уменьшение доли медленных волн в диапазоне дельта- и тета-ритмов и увеличение более быстрой альфа- и бета-активности, а также увеличение доминирующей частоты ритмов [2]. Принято считать, что данные изменения начинаются в затылочных областях мозга, затем следуют изменения в центральных и фронтальных областях [3].
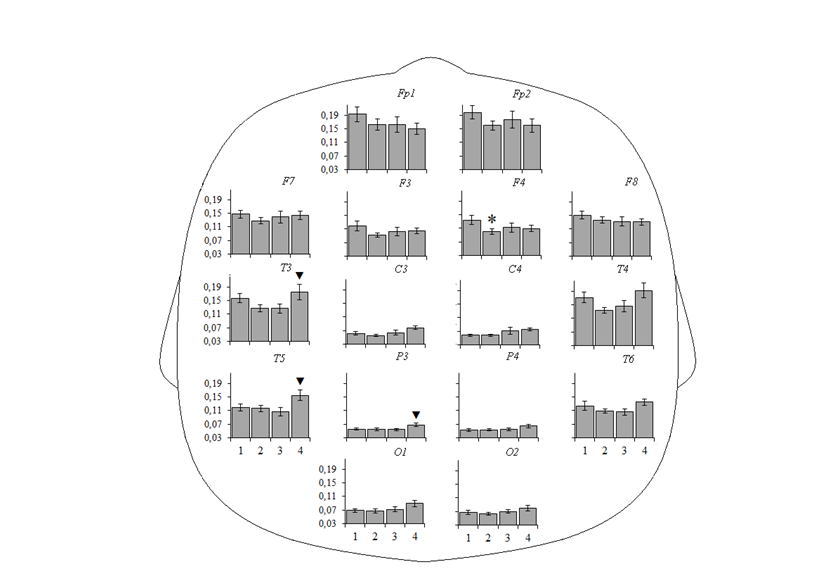
Рис. 2. Относительная мощность бета2-ритма ЭЭГ у детей в возрасте 4–6 (1),
7–9 (2), 10–12 (3) и 13–15 (4) лет. Случаи достоверных различий, выявленные методом априорных контрастов, при р<0,05: * – между группами детей 1 и 2,
▼ – между группами детей 3 и 4.
Как уже отмечалось, бета-ритм отражает активность сети ГАМК-эргических тормозящих нейронов неокортекса. В недавнем исследовании, в котором участвовали взрослые молодые люди (больные эпилепсией с субдуральными электродами) [14], изучали процессc принятия решения о получении небольшого вознаграждения немедленно или крупного вознаграждения в будущем. Испытуемые, выбиравшие немедленное вознаграждение (импульсивный выбор) отличались меньшей мощностью бета- и большей тета-ритмов ЭЭГ. Участники, выбиравшие крупное вознаграждение с некоторой задержкой (взвешенный, обдуманный выбор) демонстрировали хорошо выраженный бета-ритм ЭЭГ. Очевидно, их система тормозящих нейронов работала более эффективно. Меньшая ОМ бета-ритма у младших детей, выявленная в нашем исследовании, свидетельствует о невысокой эффективности процессов ГАМК-эргического торможения в их коре мозга. Их тормозящие нейроны и рецепторы ГАМК являются недостаточно зрелыми [13]. Очевидно, данный фактор является одной из причин несдержанного, импульсивного поведения дошкольников и младших школьников. В то же время меньшая выраженность процессов торможения благоприятствует пластичности поведения у детей данного возраста, что необходимо, в частности, для освоения широкого круга социальных навыков. Увеличение ОМ бета-ритма у старших детей свидетельствует о созревании процессов коркового торможения и становлении нейрофизиологических механизмов, лежащих в основе произвольного внимания, принятия обоснованных решений, большей поведенческой сдержанности.
ЗАКЛЮЧЕНИЕ
Полученные значения показателей ОМ бета1- и бета2-ритмов ЭЭГ, зарегистрированной в состоянии УЗВ у детей разного возраста, могут быть использованы как референтные данные в соответствующих областях исследований. Предлагается использовать показатели возрастной динамика ОМ бета-ритма в качестве индикатора созревания процессов коркового торможения, лежащих в основе становления произвольных когнитивных функций и осознанного целенаправленного поведения. Выявленные особенности становления бета1- и бета2-ритмов ЭЭГ у детей разных возрастных групп могут быть важны при разработке эффективных протоколов коррекции когнитивных функций и психоэмоционального состояния с применением биологической обратной связи по ЭЭГ.
Исследование выполнено при финансовой поддержке РФФИ и Министерства образования, науки и молодежи Республики Крым в рамках научного проекта № 20-413-910001 р_а.
Работа выполнена на оборудовании ЦКП научным оборудованием «Экспериментальная физиология и биофизика» ФГАОУ ВО «КФУ им. В. И. Вернадского».
REFERENCES
- Rodríguez-Martínez E. I., Barriga-Paulino C. I., Rojas-Benjumea M. A. and Gоmez C. M., Co-maturation of theta and low-beta rhythms during child development, Brain Topogr., 28, 250 (2015).
- Clarke A. R., Barry R. J., McCarthy R. and Selikowitz M., Age and sex effects in the EEG: development of the normal child, Clinical Neurophysiology, 112, 806 (2001).
- Cragg L., Kovacevic N., McIntosh A. R., Poulsen C., Martinu K., Leonard G. and Paus T., Maturation of EEG power spectra in early adolescence: a longitudinal study, Dev Sci., 14(5), 935 (2011).
- Whitford T. J., Rennie C. J., Grieve S. M., Clark C. R., Gordon E. and Williams L. M., Brain maturation in adolescence: concurrent changes in neuroanatomy and neurophysiology, Human Brain Mapping, 28(3), 228 (2007).
- Segalowitz S. J., Santesso D. L. and Jetha M. K., Electrophysiological changes during adolescence: a review, Brain and Cognition, 72(1), 86 (2010).
- Barry R. J., Clarke A. R., Hajos M., McCarthy R., Selikowitz M. and Dupuy F. E., Resting-state EEG gamma activity in children with attention-deficit/hyperactivity disorder, Clin Neurophysiol., 121(11), 1871 (2010).
- Clarke A. R., Barry R. J., McCarthy R., Selikowitz M., Magee C. A., Johnstone S. J. and Croft R. J., Quantitative EEG in low-IQ children with attention-deficit/hyperactivity disorder, Clin Neurophysiol., 117(8), 1708 (2006).
- Shi T., Li X., Song J., Zhao N., Sun C., Xia W., Wu L. and Tomoda A., EEG characteristics and visual cognitive function of children with attention deficit hyperactivity disorder (ADHD), Brain Dev., 34(10), 806 (2012).
- Markovska-Simoska S. and Pop-Jordanova N., Quantitative EEG in children and adults with attention deficit hyperactivity disorder: comparison of absolute and relative power spectra and theta/beta ratio, Clin EEG Neurosci., 48(1), 20 (2017).
- Deiber M. P., Hasler R., Colin J., Dayer A., Aubry J. M., Baggio S., Perroud N. and Ros T., Linking alpha oscillations, attention and inhibitory control in adult ADHD with EEG neurofeedback, Neuroimage Clin., 25, 102145 (2020).
- Fonseca L. C., Tedrus G. M. A. S., Chiodi M. G, Cerqueira J. N and Tonelotto J. M. F., Quantitative EEG in children with learning disabilities: analysis of band power, Arq Neuropsiquiatr., 64(2B), 376 (2006).
- Jensen O., Goel P., Kopell N., Pohja M., Hari R. and Ermentrout B., On the human sensorimotor-cortex beta rhythm: sources and modeling, Neuroimage., 26(2), 347 (2005).
- Walther M., Berweck S., Schessl J., Linder-Lucht M., Fietzek U.M., Glocker F.X., Heinen F. and Mall V., Maturation of inhibitory and excitatory motor cortex pathways in children, Brain and Development, 31(7), 562 (2009).
- Gui D. Y., Yu T., Hu Z. Yan J. and Li X., Dissociable functional activities of cortical theta and beta oscillations in the lateral prefrontal cortex during intertemporal choice, Rep., 9, 1 (2019).



