DYNAMICS OF THE IMPULSE ACTIVITY OF NEURONS IN THE VENTRAL POSTEROLATERAL NUCLEUS (VPL) OF THE RAT’S THALAMUS IN RESPONSE TO SOMATOSENSOR CORE STIMULATION IN A PARKINSON’S DISEASE MODEL
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 7 (73), №1, 2021
Publication text (PDF):Download
UDK: 616.858-008.6
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Musheghyan G. Kh., Armenian State Pedagogical University after K. H. Abovyan, Yerevan, Armenia
Arajyan G. M., Armenian State Pedagogical University after K. H. Abovyan, Yerevan, Armenia
Poghosyan М. V., Institute of Physiology L. A. Orbeli NAS RA, Yerevan, Armenia
Sarkissian J. S., Institute of Physiology L. A. Orbeli NAS RA, Yerevan, Armenia
TYPE:Article
DOI:https://doi.org/10.37279/2413-1725-2021-7-1-111-123
PAGES:from 111 to 123
STATUS:Published
LANGUAGE:Russian
KEYWORDS: rotenone model of Parkinson’s disease, unilateral damage of substantia nigra compacta (SNc), impulse activity of nVPL single neurons, high frequency stimulation of SII cortex.
ABSTRACT (ENGLISH):
Neurodegenerative diseases are going to increase as the life expectancy is getting longer. Most patients with neurodegenerative diseases (ND) complain of pain, the origin of which remains largely unknown and requires further research. One of the reasons why the topic of pain and PD is difficult to address is that it is sometimes tough to discern whether a particular pain is due to PD or not. Chronic pain is such a common symptom among the general population, and people with PD are not immune to common problems as well. However, there are aspects of PD that may exacerbate the pain experienced from a common problem. In addition, there are particular types of pain that may be unique to people with PD. There is a frequent and more intense onset of pain in Parkinson’s disease, as the most important non-motor symptom, with a violation of both the emotional measurement of pain and the subjective perception of its intensity. In addition, various types of pain have been described in PD, mainly neuropathic or nociceptive. The presence of pain symptoms is often not taken into account in the recommendations for treatment, leaving their management at the discretion of only doctors. Studies focusing on pain frequency in such disorders suggest a high prevalence of pain in selected populations from 40% to 86% in Parkinson’s disease (PD). The methods of pain assessment vary between studies so the type of pain has been rarely reported. However, a prevalent nonneuropathic origin of pain emerged for PD.
The electrophysiological investigations on 8 rats Albino lines (230±30g.) has been conducted: intacts (5 animals) and on the rotenone model of Parkinson’s disease (PD) (3 animals) has been conducted. The extracellular recording of impulse activity 229 single neurons of ventral-posterolateral nucleus (nVPL) of thalamus on high frequency stimulation of second somatosensory cortex of the brain has been produced. Analyses of relative degree frequency intensity of depressor and excitatory effects, on the bases of diagrams of average frequency of impulses, presented as disk graphs in mentioned conditions following changes of tetanic depressor and excitatory reactions, accompanied by posttetanic depressor and potentiation has been revealed. On the model of PD in both sequences, in comparison with norm, reduction in the number of neurons, responded by inhibitory poststimulus reactions has been revealed. The prestimulus frequency of nVPL neurons impulse activity, preceding to both inhibitory and excitatory sequences, in comparison with, dramatically increased turned out to be. The poststimulus frequency of impulse activity on the model of PD, accompanied by inhibitory and excitatory sequences also significantly increased turned out to be. A significant shift of frequency of pre- and poststimulus activity in pathology is a consequence of the development of excitotoxicity, that is fraught with apoptosis and dead. In conclusion, on the model of PD the excitotoxicity revealed in neurons of nVPL, leading to neurodegenerative defeat of these important antinociceptive structures of thalamus, with origin of resistant chronic pain. Marked indicates the need of protective conservation of inhibitory effects and reduced of excessive excitatory.
ВВЕДЕНИЕ
Большинство пациентов с нейродегенеративными болезнями (НБ) жалуются на боль, происхождение которой во многом остается неизвестным и нуждается в дальнейших исследованиях [1]. Отмечается частое и более интенсивное возникновение боли при болезни Паркинсона (БП), в качестве важнейшего немоторного симптома [2], с нарушением как эмоционального измерения боли, так и субъективного восприятия ее интенсивности [3]. К тому же, при БП описаны различные типы боли, преимущественно нейропатические или ноцицептивные [4]. Однако, в развернутых стадиях БП проявляются все 4 типа боли, связанных с БП (опорно-двигательного аппарата, дистоническая, корешковая и нейропатическая) [5]. В частности, возникновение нейропатической боли при БП связано с нейродегенерацией антиноцицептивных структур, задействованных в модуляцию боли [6]. Среди них представляют интерес околоводопроводное серое вещество (Periaqueductal gray matter – PAG) и голубое пятно (Locus coeruleus – LC). Причем LC с большим ядром шва продолговатого мозга (Raphe magnus – RMg), в котором оканчивается медиальная система, вовлекаются в аффективное и когнитивно-оценочное измерение боли, болевую память, и автономные ответы [4]. Они активно участвуют в модуляции спинальной ноцицептивной передачи, в частности, торможением ноцицептивных стимулов от нейронов дорзального рога спинного мозга, нарушение чего чревато повышением ощущения боли [7]. Далее, представляет особый интерес реципрокное взаимодействие таламуса и коры мозга на уровне вентрального заднелатерального ядра таламуса (Ventral postero-lateral nucleus – nVPL) и первичной и вторичной cоматосенсорной коры мозга – S1 и SII. Так, например, cтимуляция последней ослабляет боль у людей и воспалительную ноцицепцию у животных. Латеральный таламус, будучи одним из высших центров, важных для болевых механизмов, играет также большую роль в центральной боли. Латеральный таламус – ключевая инстанция передачи ноцицептивной информации к мозговой коре. Таламические ядра воспринимающие ноцицептивные входы от cоматосенсорной коры мозга через медиолемнисковый путь [8], нуждаются в специальном исследовании. Это, в частности, относится к проекции от SII к nVPL на модели БП. В настоящее время известны несколько экспериментальных моделей БП для ее воспроизведения. С этой целью используются резерпин, метамфетамин, 6-гидроксидофамин (6-OHDA), 1-метил-4-фенил-1,2,3,6-тетрагидропиридин – вещества, которые селективно разрушают катехоламинергические системы или нарушают их нормальное функционирование [9,10]. Также обнаружено, что некоторые сельскохозяйственные химикаты, такие как ротенон и паракват, при системном введении могут воспроизводить у грызунов ряд ключевых особенностей БП [9]. Несмотря на диффузное воздействие, ротенон вызывает селективную дегенерацию нигростриатного дофаминергического пути, избирательное окислительное повреждение полосатого тела и образование убиквитин- и α-синуклеинпозитивных включений в нигральных клетках, которые сходны с тельцами Леви при БП [11]. К достоинствам ротеноном индуцированной модели следует отнести то, что она воспроизводит большинство механизмов патогенеза БП. Например, у таких животных можно зарегистрировать формирование нейрональных включений и окислительный стресс, наблюдаемые при БП [12, 13]. Более того, отмечается, что только на ротеноновой модели получены данные, которые свидетельствуют о развитии тревожного расстройства, а нарушения в аффективной сфере, как известно, служат важнейшими немоторными проявлениями БП [13]. Основным недостатком этой модели считается ее вариабельность, но в отношении лишь поведенческих нарушений у части животных. Наконец, представляет интерес эксайтотоксичность, выявленная на моделях НБ, компенсирующая недостаток возбуждения из-за гибели нейронов. Она возникает в результате нарушения кальциевой буферизации, генерации свободных радикалов, активации митохондриальной проницаемости и вторичной эксайтотоксичности [14]. Что является результатом чрезмерной активации глутаматных NMDA и AMPA рецепторов, причиняющих серъезное повреждение нейронов [15], с их гибелью [16, 17] и содействующая развитию хронической боли.
Недавние исследования на клеточном и сетевом уровнях показывают, что функция синаптического торможения у млекопитающих сложная и не может оцениваться лишь в качестве противовеса синаптическому возбуждению [18]. Представляет интерес тот факт, что в некоторых структурах мозга, в течение эволюции, ГАМК выступает в качестве трофического фактора, влияющего на пролиферацию, миграцию, дифференциацию, созревание синапсов, клеточную гибель и экспрессию рецептора ГАМК(А) [19].
В настоящем исследовании предпринято изучение соотношения возбудительных и тормозных постстимульных проявлений активности одиночных нейронов nVPL таламуса при стимуляции SII коры мозга на модели БП, с целью выявления эксайтотоксичности, свидетельствующей о поражении одиночных нейронов nVPL таламуса и содействующей формированию стойкой боли.
МАТЕРИАЛЫ И МЕТОДЫ
Проведены электрофизиологические исследования на 8 белых беспородных крысах (230±30 г.): интактных (5 животных) и на модели БП (3 животных), индуцированной унилатеральным введением ротенона спустя 4 нед их выдерживания. Введение ротенона осуществляли в условиях уретанового наркоза (1.2 г/кг, в/б) из расчета 12 мкг в 0.5 мкл димексида (со скоростью 0.1 мкл/мин) в медиальном пучке переднего мозга ՛՛medial forebrain bundle՛՛ по координатам стереотаксического атласа [20] (AP+0.2; L±1.8; DV+8 мм). Исследование проводилось в соответствии с принципами Базельской декларации и рекомендациями руководства. ARRIVE [21].
Операции производили в следующей очередной последовательности: фиксация черепа в стереотаксическом аппарате, краниотомия с удалением костей от брегмы до лямбды и отсепаровкой твердой мозговой оболочки. Предварительно животные с БП обездвиживались 1 % дитилином (25 мг/кг в/б) и переводились на исскуственное дыхание. Стеклянные микроэлектроды с диаметром кончика 1-2 мкM, заполненные 2M NaCl, вводили в nVPL согласно стереотаксическим координатам (AP-2.28; L±3.0; DV+5.8 мм) для экстраклеточной регистрации импульсной активности одиночных нейронов (рис. 1).
Осуществляли высокочастотную стимуляцию (ВЧС) SII (прямоугольными толчками тока длительностью – 0.05 мс, амплитудой 0.12–0.18 мВ, силой тока 0.32 мА и частотой 100 Гц в течение 1 сек) электродами вживленными в SII согласно стереотаксическим координатам (АР–1.8, L±6.1, DV+5.5 мм).
Активность нейронов проявлялась в виде тетанической депрессии и потенциации (ТД и ТП), сопровождаемых посттетанической депрессией и потенциацией (ПТД и ПТП). Проводили анализ одиночной импульсной активности 229 нейронов nVPL. Далее проводили многоуровневую статистическую обработку для пре– и постстимульного отрезков времени. Для избираемых сравниваемых групп импульсной активности строили суммированные и усредненные перистимульные (РЕТН Average) гистограммы и гистограммы частоты (Frequency Average). Анализ полученных данных производили по специально разработанному алгоритму, обеспечивающему достоверность перистимульных изменений межимпульсных интервалов [22]. Однородность двух независимых выборок проверяли t–критерием Стьюдента. Различия считали достоверными при P<0.05. Физиологическая установка представлена в качестве математической программной, с систематическим статистическим анализом в процессе регистрации, разработанной в лаборатории Каменецким В. и на основе данных указанных в книге Орлова [24]. Параметры отведения импульсной активности в следующих пределах: частотная полоса усиления от 100 Гц до 5 кГц, амплитуда потенциалов действия (ПД) – в пределах разрешения 10-битного АЦП.
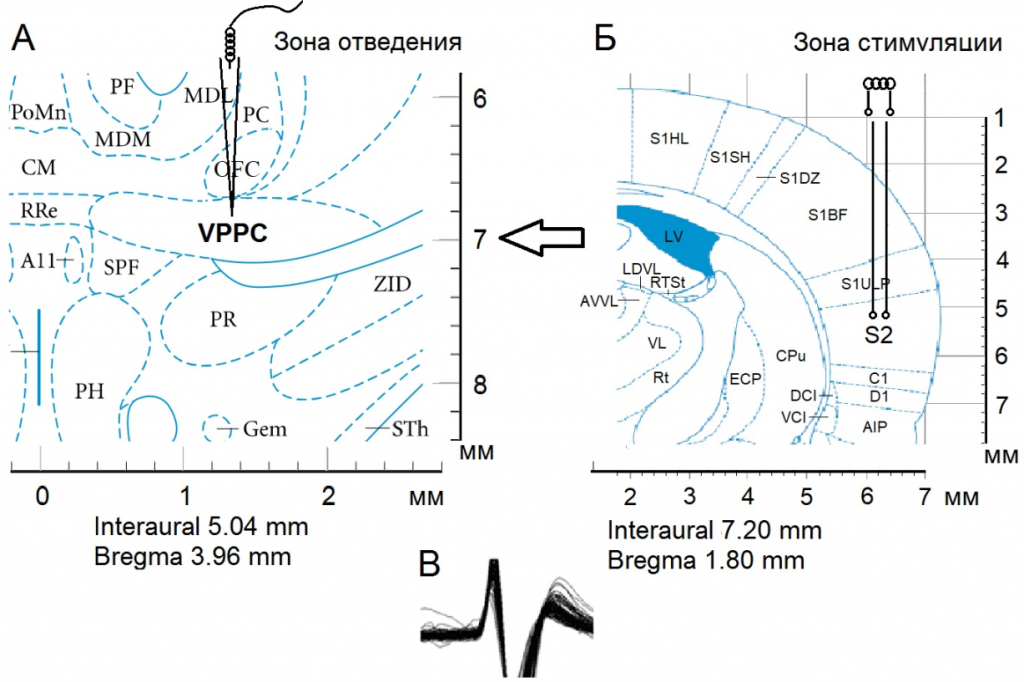
Рис. 1. Схема эксперимента по раздражению SII и отведению из VPPC (nVPL). Стереотаксическое изображение пункта регистрации нейронной активности – Б, зоны стимуляции – А и характерного потенциала действия – В.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Импульсная активность одиночных нейронов nVPL на ВЧС SII: интактных (125 нейронов, 5 животных) и на модели БП (104 нейрона, 3 животных) регистрировали внеклеточно.
По сравнению с престимульным уровнем, были обнаружены cледующие изменения тормозных и возбудительных тетанических и посттетанических реакций.
В нейронах nVPL на ВЧС SII ТД в депрессорных и возбудительных посттетанических реакциях в норме достигала 3.0-и 2.0-кратного снижения престимульной активности, а на модели БП – оказалась в пределах 1.14- и 1.17-кратного снижения в обеих постстимульных последовательностях, соответственно (рис. 2 А, В, Группы А, Б).
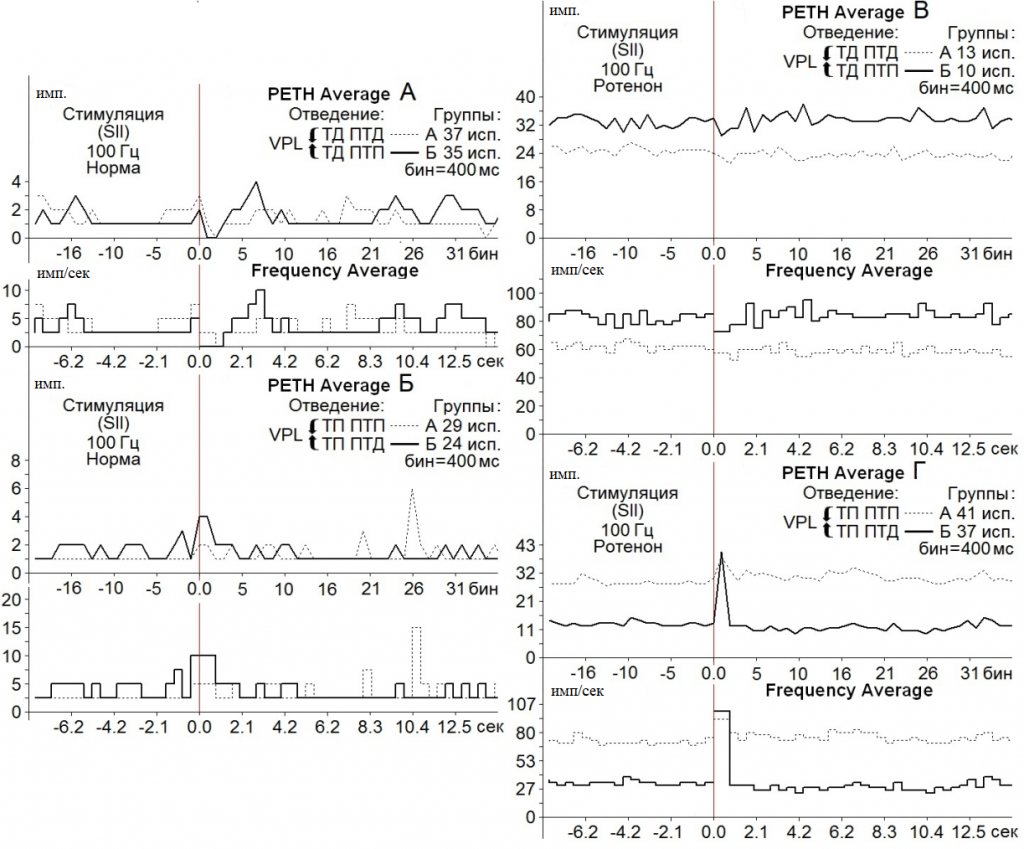
Рис. 2. Усредненные перистимульные (РЕТН Average) и гистограммы частоты (Frequency Average) тормозных (А, В) и возбудительных (Б, Г) постстимульных проявлений активности нейронов nVPL в норме (А, Б) и на модели БП (В, Г) при ВЧС (100 Гц, 1 сек) SII. Для групп А, Б указано количество испытаний (исп.).
ТП в ПТП и ПТД в контроле определялись в пределах 2.0- и 4.0-кратного превышения престимульной активности (рис. 2 Б, Группы А, Б), на модели БП определялись в пределах 1.26- и 3.02–кратного превышения (рис. 2 Г, Группы А, Б).
Очевидно, что помимо значительного превышения ТП в возбудительно-тормозной последовательности (рис. 2 Г), имело место снижение количества нейронов, отвечающих депрессорными постстимульными реакциями на модели БП в обеих последовательностях, в сравнении с нормой (порядка 13 и 10 против 37 и 35) (рис. 2 А, В).
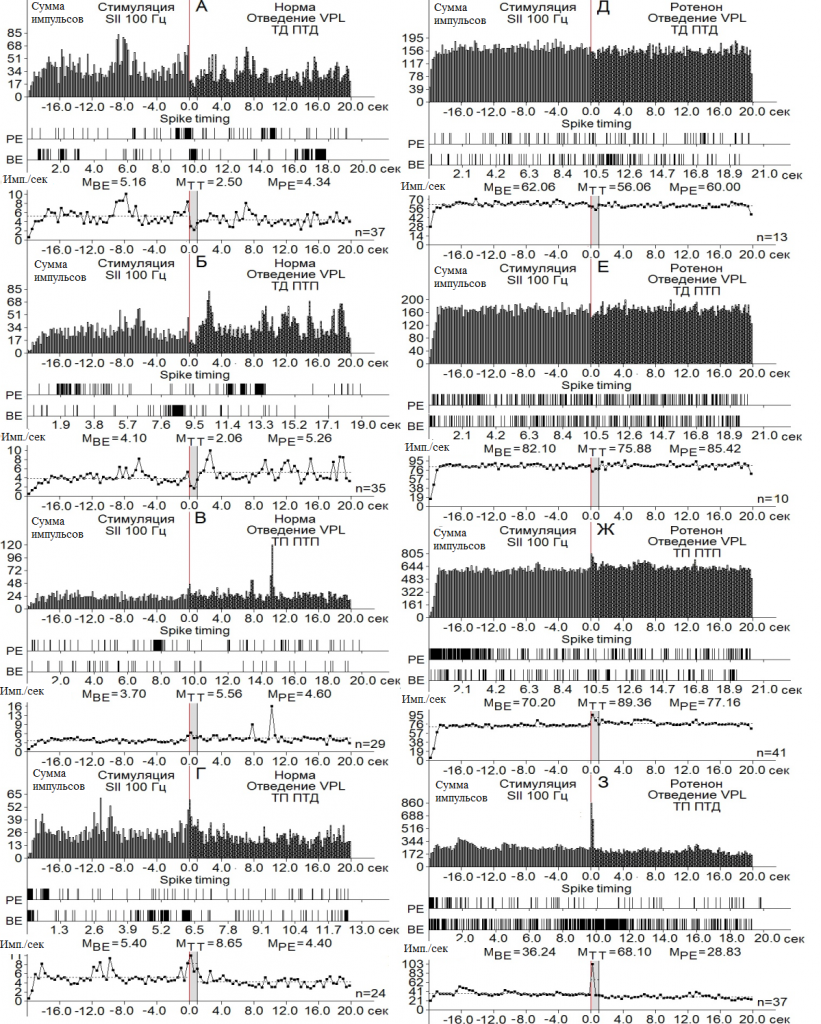
Рис. 3. Перистимульные гистограммы суммы импульсов с диаграммой частоты импульсов, с усредненными значениями, сконструированные на основе пре- и постстимульных тетанических и посттетанических тормозных (А), в сочетании с возбудительными (Б), возбудительных (В), сопровождаемых депрессорными (Г), проявлений импульсной активности одиночных нейронов nVPL при ВЧС 100 Гц SII на модели БП.
При оценке относительной степени выраженности вышеотмеченных тормозных и возбудительных эффектов, на примере диаграмм усредненной частоты импульсов, получены значения, представленные в виде дисковых диаграмм для более наглядного представления степени выраженности и в частотном отображении (в %) экспериментальных данных в Рис. 4 (на основе рис. 3). Они привели к следующему выводу.
В двух депрессорных последовательностях значения ТД в нейронах nVPL в контроле достигали уровня снижения престимульной активности 2.06– и 2.10-кратного (рис. 3 А, Б; 4 А), а на модели БП – лишь 1.10- и 1.02-кратного (рис. 3 Д, Е, 4 Б). В возбудительных последовательностях уровень ТП нейронов nVPL в контроле исчислялся в пределах 1.5- и 1.6-кратного превышения (рис. 3 В, Г; 4 А), на модели БП – 1.27- и 1.88-кратного.
Таким образом, тормозные постстимульные прояления активности на модели БП оказались вдвое ниже контроля, а возбудительные – близкими к контролю, но без учета резкого изменения частоты пре- и постстимульных потенциалов действия (рис. 3; 4 А-Е). Престимульная частота активности нейронов nVPL, предшествующая депрессорным последовательностям в норме, оказалась порядка 5.16 и 4.10 имп./сек, а на модели БП –62.06 и 82.10 имп./сек, что в 12.02 и 20.02 раза выше (рис. 3 А, Б, Д, Е; 4 Ж, З). Престимульная частота активности, предшествующая постстимульным возбудительным последовательностям, оказалась в пределах 3.7 и 5.4 в норме и 70.20 и 36.24 на модели БП, что 19.07 и 6.71 раз выше, соответственно (рис. 3 В, Г, Ж, З; 4И, К).
Иными словами, на модели БП, престимульная частота импульсной активности нейронов nVPL, предшествующая как тормозным, так и возбудительным постстимульным реакциям, значительно превысила таковые в контроле. Наконец, постстимульная частота импульсов нейронов nVPL, сопровождаемая постстимульными депрессорными последовательностями в контроле, достигала 2.50 и 2.06 имп./сек, а постстимульная частота импульсов нейронов nVPL, сопровождаемая постстимульными возбудительными последовательностями – 5.56 и 8.65, (рис. 3 А-Г; 4 Ж, З). Постстимульная частота импульсной активности на модели БП, сопровождаемая депрессорными последовательностями, достигала 56.06 и 75.88, а сопровождаемая таковыми возбудительными – 89.36 и 68.10, что 22.42 и 36.83 раз превысила контроль в тормозной последовательности и 16.07 и 7.87 раз – в возбудительной. Иными словами, явно наблюдается резкое превышение частоты импульсной активности на модели БП, в отношении как пре-, так и постстимульной активности (рис. 3; 4 Ж-К).
Таким образом, как и следовало ожидать, на модели БП в нейронах nVPL произошел значительный сдвиг в отношении частоты пре- и постстимульных потенциалов действия, которые предшествовали и сопровождали тормозные и возбудительные проявлениями постстимульной активности, в сравнении с контролем.
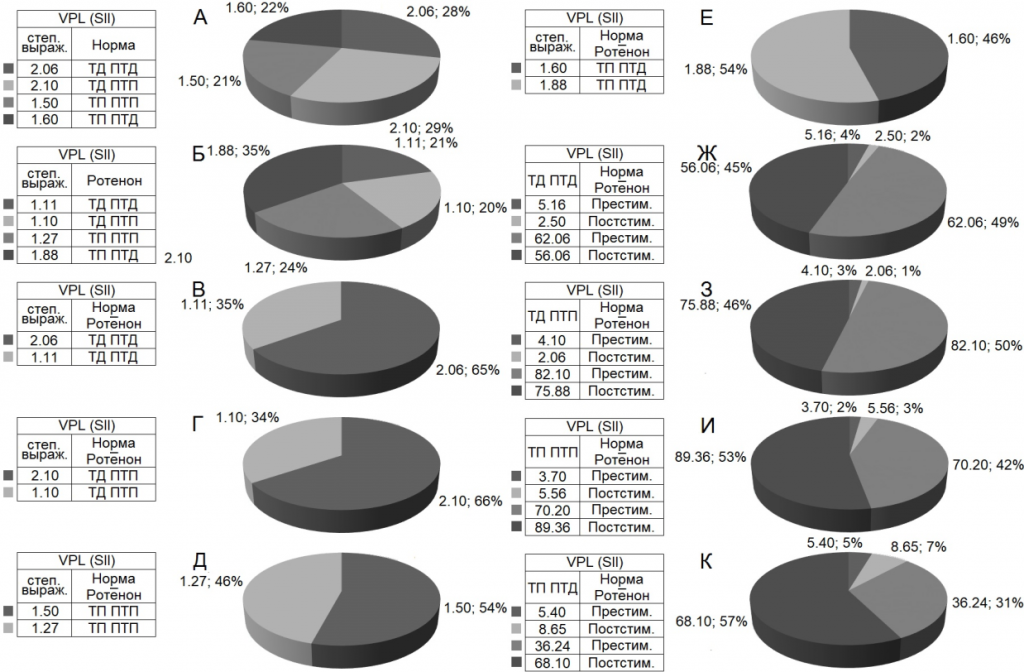
Рис. 4. Процентное соотношение степени выраженности (по усредненной частоте) депрессорных (ТД ПТД), депрессорно-возбудительных (ТД ПТП), возбудительных (ТП ПТП) и возбудительно-депрессорных (ТП ПТД) постстимульных эффектов в одиночных нейронах nVPL при ВЧС SII в норме и на ротеноновой модели БП. Обозначения: степ. выраж. – степень выраженности, престим. и постстим. – престимульный и постстимульный.
Литературные данные о изменении импульсной активности одиночных нейронов при нейродегенерации [23], как и в других аналогичных работах, преимущественно относились к выявлению более высокого ритма нейронального разряда и увеличения количества пачек импульсов в минуту. В работе Galvan A. и соавт. [24] у пациентов с БП и у животных моделей этого заболевания, нейроны в базальных ганглиях (БГ) и связанных с ними областях в таламусе и коре мозга, техникой электрофизиологической регистрации одиночной клетки, показали перестроенные (деформированные) ритмы и образцы разряда, патологическую ритмическую активность и повышенную межнейрональную синхронизацию. При этом модификации в ритмах разряда сопровождались изменениями в паттернах разряда. Такими как повышенная тенденция нейронов к залпу барстами потенциалов действия, усиленная ритмичная активность в пределах каждого ядра и среди структур, и повышенная синхронность активации ближайших нейронов. Более того, обзор литературы указанными авторами показывает, что сходные изменения в нейрональной активности (изменения в ритмах разряда, повышение в пачках импульсов, синхронность и активность в бета-ритме ЭЭГ видны почти во всех ядрах БГ, как у БП пациентов, так и в животных моделях болезни [24]. Использование в настоящей работе разработанного нами программного математического анализа импульсной активности в многочисленных наших публикациях, посвященных как специфической, так и неспецифической нейродегенерации, позволило выдвинуть следующее представление. Заключается оно в актуальности привлечения протекторного назначения тормозных постстимульных эффектов, сниженных в патологии, но способных успешно противодействовать неизбежной эксайтотоксичности, что надо учитывать при подборе соответствующей терапевтической стратегии [25]. В настоящей работе на модели БП в нейронах nVPL выявлена эксайтотокcичность, ведущая к нейродегенеративному поражению этой важной антиноцицептивной структуры таламуса, c возникновением стойкой хронической боли.
ЗАКЛЮЧЕНИЕ
Отмеченное свидетельствует о необходимости протекторного углубления депрессорных эффектов и снижения чрезмерных возбудительных, что согласуется с многочислнными вышеотмеченными нашими исследованиями, позволившими выдвинуть такое представление.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены. Настоящая статья не содержит результатов каких-либо исследований с участием людей в качестве объектов исследований.
REFERENCES
- 1. De Tommaso M. L., Defrin R. et al. Pain in Neurodegenerative Disease: Current Knowledge and Future Perspectives. Behavioural Neurology, (1), 1 (2016).
- Beiske A. G., Loge J. H., Rønningen A., Svensson E. Pain in Parkinson’s disease: prevalence and characteristics, Pain, 141, 173 (2009).
- Juri C., Rodriguez-Oroz M., Obeso J.A. The pathophysiological basis of sensory disturbances in Parkinson’s disease, J. Neurol. Sci., 289, 60 (2010).
- Ramiro-González M., Fernández-de-las-Peñas C. Pain in Parkinson disease: A review of the literature. Parkinsonism & Related Disorders, 19(3), 285 (2013).
- Valkovic P., Minar M., Singliarova H., Harsany J., Hanakova M., Martinkova J., Benetin J. Pain in Parkinson’s Disease: A Cross-Sectional Study of Its Prevalence, Types, and Relationship to Depression and Quality of Life. PLoS One., 10(8), e0136541 (2015).
- Jensen T. S., Baron R, Haanpää M., Kalso E., Loeser J. D., Rice A. S., Treede R. D. A new definition of neuropathic pain. Pain., 152(10), 2204 (2011).
- Scherder E., Wolters E., Polman C.,Sergeant J., Swaab D. Pain in Parkinson’s disease and multiple sclerosis: its relation to the medial and lateral pain systems. Neurosci. Biobehav. Rev., 29, 1047 (2005).
- Sagalajev B., Viisanen H., Wei H., Pertovaara A. Descending antinociception induced by secondary somatosensory cortex stimulation in experimental neuropathy: role of the medullospinal serotonergic pathway. Journal of Neurophysiology, 117(3), 1200 (2017).
- Stavrovskaja A.V., Konorova I.L., Illarioshkin S.N., Fedorova T.N., Stelmashuk E.V., Jamshchikova N.G., Stvolinsky S.L., Genrikhs E.E, Konovalova E.E. Technology of modeling of the nervous system diseases/ In: Neurology of XXI century: diagnostic, medical and research technologies. A guide for doctors. In 3 v. Under Ed. Piradova M.A., Illarioshkina S.N., Nanashian M.M. III. Modern research technologies in experimental neurology, 73 (М.: ATMO., 2015).
- Blesa J., Przedborski S. Parkinson’s disease: animal models and dopaminergic cell vulnerability. Frontiersin Neuroanatomy, 8, 155 (2014).
- Schmidt W., Alam M. J. Controversies on new animal models of Parkinson’s disease pro and con: the rotenone model of Parkinson’s disease (PD). Journal of Neural Transmission. Supplementum., 70, 273 (2006).
- Voronkov D. N., Khudojorkov R. M., Dovedova E. L. The changes of neuroglial interaction in nigrostriate structures of the brain under modeling disfunction of dofaminergic system. Korsakov Journal of Neurology and Psychiatry (Zhurnal nevrologii i psikhiatrii imeni S.S. Korsakova), 113(7), 47 (2013).
- Hoglinger G. U., Oertel W. H., Hirsch E. C. The rotenone model of parkinsonism – the five years inspection. Journal of Neural Transmission. Supplementum., 70, 269 (2006).
- Dong Xiao-xia, Wang Yan, Qin Zheng-hong. Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases. Acta Pharmacologica Sinica, 30, 379 (2009).
- Matthew R.H. Glutamate-mediated excitotoxicity and neurodegeneration in Alzheimer’s disease. NCI., 45(5), 583 (2004).
- Lucas D. R., Newhouse J. P. The toxic effect of sodium L-glutamate on the inner layers of theretina. AMA Archives of ophthalmology, 58(2), 193 (1957).
- Olney J. W. Brain lesions, obesity, and other disturbances in mice treated with monosodium glutamate. Science, 164(3880), 719 (1969).
- Birke G., Draguhn A. No simple brake–the complex functions of inhibitory synapses. Pharmacopsychiatry., 43(1), 21 (2010).
- Owens D., Kriegstein A. Is there more to GABA than synaptic inhibition? Nat Rev Neurosci., 3(9), 715 (2002).
- Paxinos G., Watson C. The rat brain in stereotaxic coordinates. (Elsevier, Academic Press, 5th ed., 2005).
- Kilkenny C., Browne W. J., Cuthill I. C., Emerson M., Altman D. G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. PLoS Biol., 8(6), e1000412 (2010).
- Von Wrangel C., Schwabe K., John N., Krauss J. K., Alam M. The rotenone-induced rat model of Parkinson’s disease: behavioral and electrophysiological findings. Behav Brain Res., 279, 52 (2015).
- Galvan A., Devergnas A., Wichmann T. Alterations in neuronal activity in basal ganglia-thalamocortical circuits in the parkinsonian state. Front Neuroanat., 9, 5 (2015).
- Orlov A.I. Applied statistics, p. 483. (Publisher: Exam ISBN: 5-472-01122-1, 2004).
- Sarkissian J. S., Poghosyan M. V., Danielyan M. A., Stepanyan H. Y, Vardanyan A. V. The assign of depressor synaptic processes in condition of specific neurodegenerative pathology and protection. (LAP LAMBERT Academic Publishing RU, 2018).



