POSSIBLE ANTI-DEPRESSANT EFFECT OF THE SELECTIVE COX-2 INHIBITOR MELOXICAM, ITS RELATIONSHIP WITH THE DOPAMINERGIC BRAIN SYSTEM
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 7 (73), №1, 2021
Publication text (PDF):Download
UDK: 57.024; 57.034; 611.81
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Chajka A. V., Krasnolesie Crimean College of Olympic Reserve, Simferopol district, Russian Federation
Khusainov D. R., Krasnolesie Crimean College of Olympic Reserve, Simferopol district, Russian Federation V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation; V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Tumanyants K. N., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
TYPE:Article
DOI:https://doi.org/10.37279/2413-1725-2021-7-1-229-242
PAGES:from 229 to 242
STATUS:Published
LANGUAGE:Russian
KEYWORDS: meloxicam, depression, haloperidol, COX-2, dopamine.
ABSTRACT (ENGLISH):
Inflammation is now believed to play an important role in the development of depression, and it is suggested that inflammation may be a promising target for the treatment and prevention of mood disorders. It is not surprising that various non-steroidal anti-inflammatory drugs (NSAIDs), including selective inhibitors of cyclooxygenase-2 (COX-2), are being tested for their antidepressant properties. At the same time, it is known that inhibition of COX-2 has a certain effect on the dopaminergic (DA) system. However, in the literature, there are also opposite opinions on this matter, for example, that the neuroprotective effect of NSAIDs is associated not with COX-2, but with the PI3K/Akt signaling pathway, and inhibition of COX-2 does not have a neuroprotective effect, and even negatively affects the central nervous system up to until the pathophysiology of depression aggravates. Therefore, the question of the antidepressant properties of COX-2 inhibitors remains open for further research. In addition, because of the dynamic nature of depression, it is important to ascertain whether NSAIDs may be prophylactic in the early stages of depression.
Accordingly, the aim of this study was to determine the presence or absence of antidepressant potential in the selective COX-2 inhibitor meloxicam (21 days, 1 mg/kg), its possible relationship with the DA system, by tracing these effects over time.
The combined use of meloxicam and haloperidol (24 days, 2.5 mg kg) in the first 7 days of the experiment did not significantly affect the level of immobility of rats in the «Forced swim test», but on days 8, 12–19, and 21 of the experiment, the level of immobility in this the group was significantly higher than in the haloperidol group. The administration of meloxicam also failed to reverse the negative effects of stress: on days 1–5, 7–12 and 15–19, there were no differences between the groups in the level of immobility, and on days 6, 13–14 and 20-21, meloxicam even increased immobility by compared with the stress group.
Another evidence in favor of the depressant effect of meloxicam is the fact that it increases the level of immobility in intact rats, while the MAO inhibitor selegiline (24 days, 3 mg/kg), on the contrary, does not affect the level of immobility – the data are indistinguishable from control.
Meloxicam also failed to increase locomotor activity in rats in the «Actimeter», suppressed by the combined use of haloperidol and stress. The positive effect of meloxicam was manifested only in the improvement of the task performance on the Rotarod against the background of D2-receptor blockade.
Inhibition of COX-2 by meloxicam did not have the expected antidepressant effect in the «Forced swim test» and «Actimeter», but, on the contrary, led to a worsens emotional state of the animals. At the behavioral level, we were unable to obtain convincing evidence of a direct connection between the effects of meloxicam and the functioning of the DA system, although its activating effect on animal locomotion in the Rotarod test after blockade of D2-receptors with haloperidol was established.
ВВЕДЕНИЕ
На сегодняшний день считается, что воспалительные процессы играют важную роль в развитии депрессии, и предполагается, что воспаление может быть многообещающей мишенью для лечения и профилактики аффективных расстройств [1–3]. Неудивительно, что различные нестероидные противовоспалительные препараты (НПВП), в том числе и селективные ингибиторы циклооксигеназы-2 (ЦОГ-2), тестируются на предмет наличия у них антидепрессантных свойств [4–6].
В ходе ряда исследований было установлено, что дофаминергическая (ДА) система мозга принимает важное участие в процессах формирования и течения депрессивных эпизодов [7–9], которые могут сопровождаться морфологической деградацией нейронов [10], угнетением нейрогенеза [11] и повышение уровня ЦОГ-2 в гиппокампе [12, 13].
В тоже время, известно, что ингибирование ЦОГ-2 оказывает определённое воздействие на ДА-систему: влияет на файринг ДА-нейронов в среднем мозге [14], приводит к нейропротективному эффекту в чёрной субстанции [15, 16] и стриатуме [15]; а сам по себе ЦОГ-2 способен окислять дофамин и увеличивать окислительный стресс, вызывая дегенерацию ДА-нейронов [17]. Таким образом, антидепрессантный эффект, возникающий в результате ингибирования ЦОГ-2 [18–21], вероятно, опосредован как снижением нейровоспаления в целом, так и влиянием на ДА-систему в частности. Однако, в литературных данных встречаются и противоположные мнения на этот счёт, например, что нейропротективный эффект НПВП связан не с ЦОГ-2, но PI3K/Akt сигнальным путём [22], а ингибирование ЦОГ-2 не оказывает нейропротективного эффекта [23], и даже негативно влияет на ЦНС – подавляет нейрогенез в гиппокампе [24], приводит к нейровоспалению, снижению уровня антиоксидантов, повреждению митохондрий, и собственно усугублению патофизиологии депрессии [25, 26]. Поэтому, вопрос об антидепрессантных свойствах ингибиторов ЦОГ-2 остаётся открытым для дальнейших исследований. К тому же, из-за динамического характера депрессии важно выяснить, могут ли НПВП иметь профилактическое значение на ранних стадиях депрессии [27].
Соответственно, целью данного исследования было определить наличие или отсутствие антидепрессантного потенциала у селективного ингибитора ЦОГ-2 мелоксикама, его возможную связь с ДА-системой, проследив эти эффекты в динамике.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты проведены на 80 крысах-самцах (Wistar, 200-250 г), разделённых на 8 равных групп (n=10):
1) контроль
2) стресс
3) галоперидол
4) юмекс
5) мелоксикам
6) стресс+мелоксикам
7) галоперидол+мелоксикам
8) стресс+галоперидол+мелоксикам.
Группа «стресс» на протяжении 21 дня подвергалась хроническому непредсказуемому умеренному стрессу, по описанной ранее методике [28].
Селективный блокатор D2-рецепторов галоперидол («Галоперидол», Мосхимфармпрепараты им. Н. А. Семашко, Россия) вводился в течение 24 дней (3 дня предварительного введения для достижения высокого % заблокированных рецепторов) в дозе 2,5 мг/кг.
Ингибитор МАО селегилин («Юмекс», Хиноин, Венгрия) вводился в течение 24 дней (3 дня предварительного введения для достижения высокого % ингибирования ферментов) в дозе 3 мг/кг.
Селективный ингибитор ЦОГ-2 мелоксикам («Мелоксикам», ООО Славянская Аптека, Россия) вводился в течение 21 дня в дозе 1 мг/кг.
Все вещества разводились в физрастворе и вводились внутрибрюшинно в объёме 0,2 мл/животное за 30 мин до начала тестирования. Контрольная группа получала физраствор в аналогичном объёме. При сочетанном введении нескольких веществ между инъекциями производился перерыв в 30 мин.
Начиная с 4-го дня эксперимента, поведение животных ежедневно исследовали в тесте Порсолта, через 30 мин после инъекций. Установка данного теста представляет собой прозрачный цилиндр из оргстекла высотой 45 см и диаметром 20 см (НПК «Открытая Наука», Россия). Цилиндр заполняли на 2/3 водой температурой +22±1°С. Длительность тестирования – 3 минуты (укороченная процедура) [29, 30]. Регистрировались следующие показатели: иммобильность (сек.), плавание (сек.), климбинг (сек.), а также груминг и отряхивания (шт.).
Дополнительно, каждые 7 дней, была проведена регистрация двигательной активности в тестах «Актиметр» и «Ротарод».
«Актиметр» (IR Actimeter, Harvard Apparatus) – это аналог «Открытого поля» квадратной формы (45×45 см), где регистрация поведения проводится автоматизировано, с помощью двух инфракрасных рамок. Длительность тестирования 3 мин.
«Ротарод» (ООО «Нейроботикс») представляет собой вращающийся стержень с лопастями (радиус барабан 185 мм), на который помещаются животные для определения длительности удержания равновесия. Установка оснащена инфракрасными сенсорами для регистрации падения животных. Опираясь на наш опыт предыдущих исследований, была определена оптимальной скорость в 25 оборотов/мин. Регистрировалось время до падения животного с барабана, в противном случае записывалось максимальное время тестирования в 300 сек.
Достоверность различий между группами определялась с помощью критерия Манна-Уитни или теста Стьюдента, согласно характеру распределения данных. Расчёты и визуализация результатов проведена в программе GraphPad Prism 8.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рассмотрим влияние мелоксикама на поведение животных в различных тестовых ситуациях. Сочетанное введение мелоксикама и галоперидола оказало негативный эффект на эмоциональное состояние животных, и мелоксикам не смог отменить действие галоперидола, более того, в некоторых случаях комбинация этих двух веществ оказывала больший отрицательный эффект, чем каждое из них по отдельности.
Сочетанное применение мелоксикама и галоперидола в первые 7 дней эксперимента значимо не влияло на уровень иммобильности крыс в «Тесте Порсолта», однако на 8, 12–19 и 21 дни эксперимента уровень иммобильности в этой группе был достоверно выше, чем в группе «галоперидол» (рис. 1).
Введение мелоксикама также не смогло отменить негативное воздействие стресса: на 1–5, 7–12 и 15–19 дни различий между группами в уровне иммобильности не наблюдалось, а на 6, 13–14 и 20–21 дни, мелоксикам даже увеличивал иммобильность по сравнению с группой «стресс» (рис. 2).
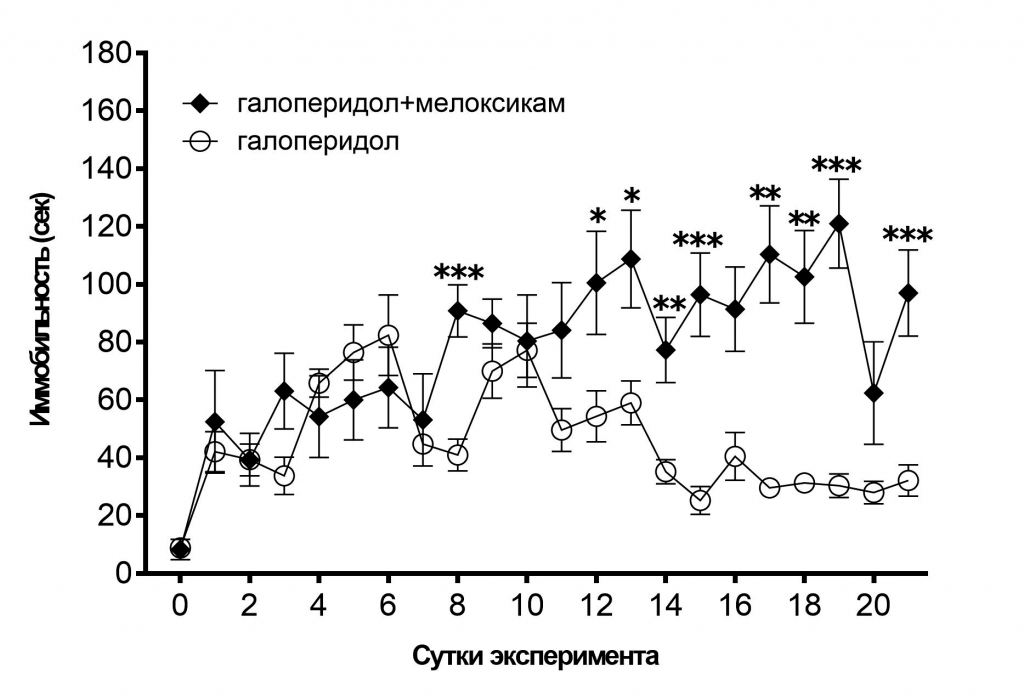
Рис. 1. Влияние галоперидола и мелоксикама на уровень иммобильности крыс в «Тесте Порсолта».
Примечание: звёздочками отмечены достоверные отличия при *p<0,05, **р<0,01, ***р<0,001 (критерий Манна-Уитни).
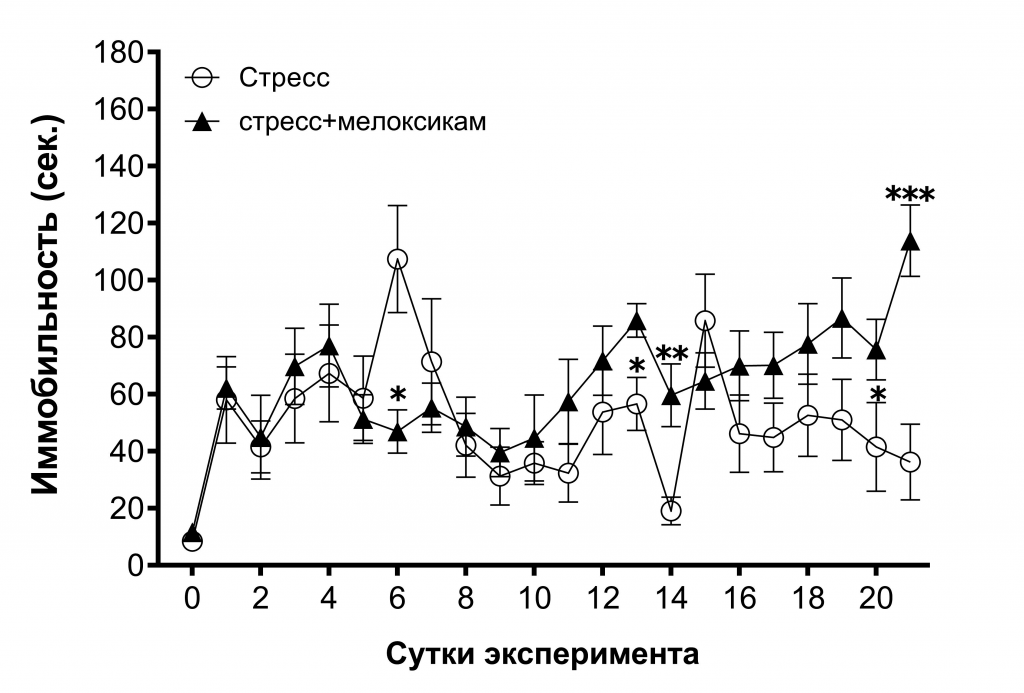
Рис. 2. Влияние стресса и мелоксикама на уровень иммобильности крыс в «Тесте Порсолта».
Примечание: звёздочками отмечены достоверные отличия при *p<0,05, **р<0,01, ***р<0,001 (критерий Манна-Уитни).
Существенных различий между двумя этими группами также не наблюдалось и по показателям «плавание» и «климбинг». Однако, значимые отличия между группами «стресс» и «стресс+мелоксикам» были выявлены по показателю «отряхивание+груминг» на 1–6 и 10 сутки эксперимента (р<0,05, р<0,01) (рис. 3). Отряхивания и груминг рассматриваются некоторыми авторами как проявление дискомфорта у животных, маркер тревоги и депрессии [31, 32].
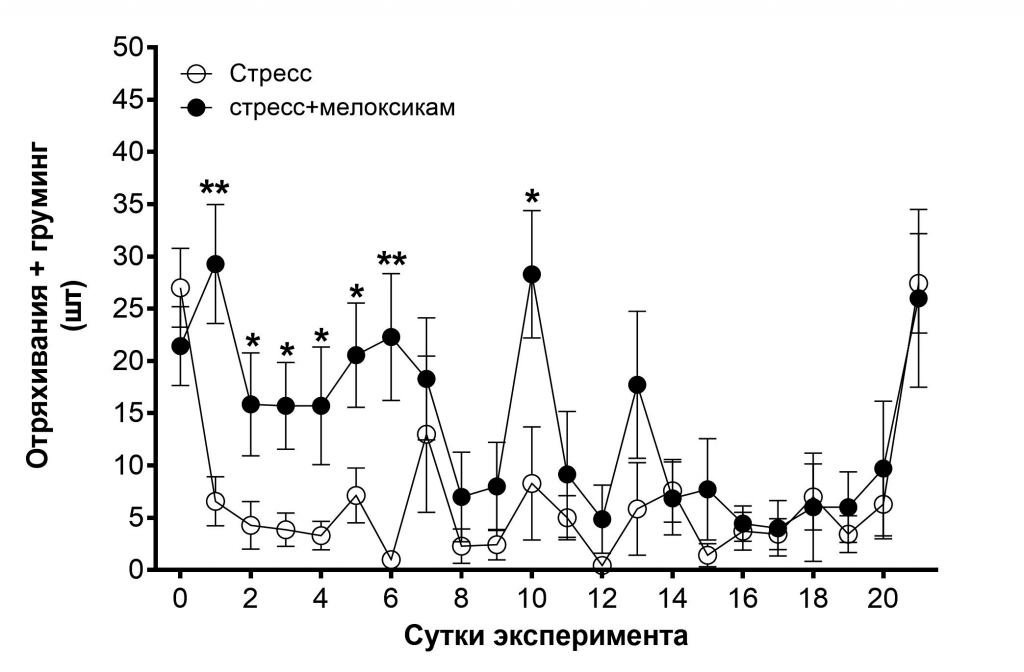
Рис. 3. Влияние стресса и мелоксикама на отряхивание и груминг у крыс в «Тесте Порсолта».
Примечание: звёздочками отмечены достоверные отличия при *р<0,05, **р<0,01 (критерий Манна-Уитни).
Несколько неожиданные результаты были получены в группе «стресс+галоперидол+мелоксикам» (рис. 4). Предыдущие результаты по мелоксикаму чётко указывали на его скорее, анксиогенное и продепрессантное действие, а совместное использование стресса и блокады D2-рецепторов галоперидолом показывало увеличение иммобильности и эффект суммации негативного воздействия каждого из компонентов, поэтому ожидаемым эффектом применения сразу 3 факторов был наибольший продепрессантный эффект среди всех групп. Однако, по факту оказалось, что в группе «стресс+галоперидол+мелоксикам» уровень иммобильности на 1, 5, 7–13, 15–17, и 20–21 дни не отличим от уровня контрольного, а на 3, 4 и 6 сутки даже достоверно ниже контрольных значений. Тем не менее, эти данные ещё не означают того, что эмоциональное состояние животных в данной группе было сравнимым с контрольными особями. Во-первых, стоит отметить, что несмотря на общую положительную динамику, на 2, 14, 18–19 сутки эксперимента уровень иммобильности в этой группе был достоверно выше контрольного, а на 2 день и вовсе наблюдался пик иммобильности в 83,9±14,36 сек., что сопоставимо с результатами групп «стресс» и «галоперидол».
Во-вторых, высокие показатели климбинга в данной группе, на уровне данных контроля, ещё не гарантируют положительного психоэмоционального состояния у животных, несмотря на то, что активное плавание считается таковым маркером. Некоторые авторы уместно отмечают, что климбинг может служить показателем высокого уровня тревожности, что не противоречит общепринятым взглядам, т.к. известно, что многие антидепрессанты активирующего типа способны повышать тревожность [33].

Рис. 4. Влияние совместного применения стресса мелоксикама и галоперидола на иммобильность у крыс в «Тесте Порсолта».
Примечание: звёздочками отмечены достоверные отличия при *р<0,05, **р<0,01, ***р<0,001 (критерий Манна-Уитни).
В-третьих, показатели группы «стресс+галоперидол+мелоксикам» в тесте «Актиметр» (рис. 5–6) говорят о том, что животные пребывают в тревожно-депрессивном состоянии: снижается пройденная дистанция вообще и в центре установки.
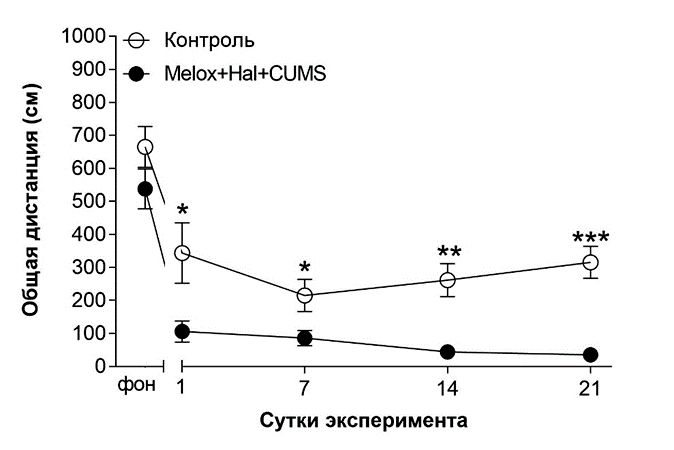
Рис. 5. Влияние совместного применения стресса, мелоксикама и галоперидола на двигательную активность в «Актиметре».
Примечание: звёздочками отмечены достоверные отличия при *р<0,05, **р<0,01, ***р<0,001 (критерий Стьюдента).
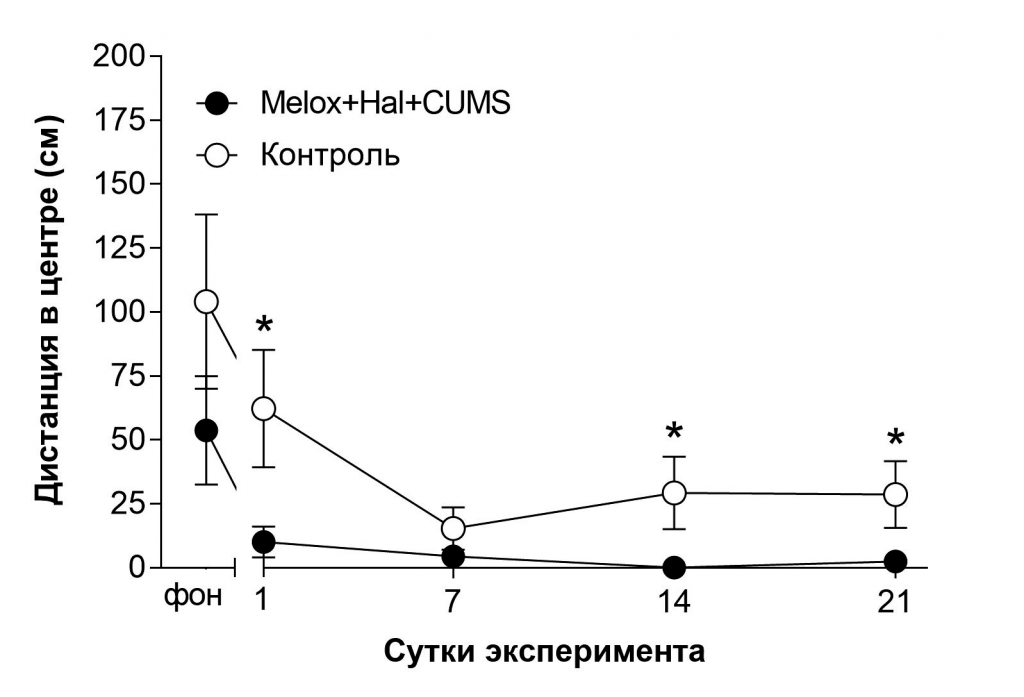
Рис. 6. Влияние совместного применения стресса, мелоксикама и галоперидола на двигательную активность в центре установки «Актиметр».
Примечание: звёздочками отмечены достоверные отличия при *р<0,05, (критерий Манна-Уитни).
Ещё одним доказательством в пользу продепрессантного эффекта мелоксикама является тот факт, что он увеличивает уровень иммобильности у интактных крыс, в то время как группа «юмекс», напротив, демонстрирует уровень иммобильности не отличимый от показателей контроля (рис. 7). Высокая вариабельность данных в группе «мелоксикам» может объясняться индивидуальной чувствительностью к веществу у животных.
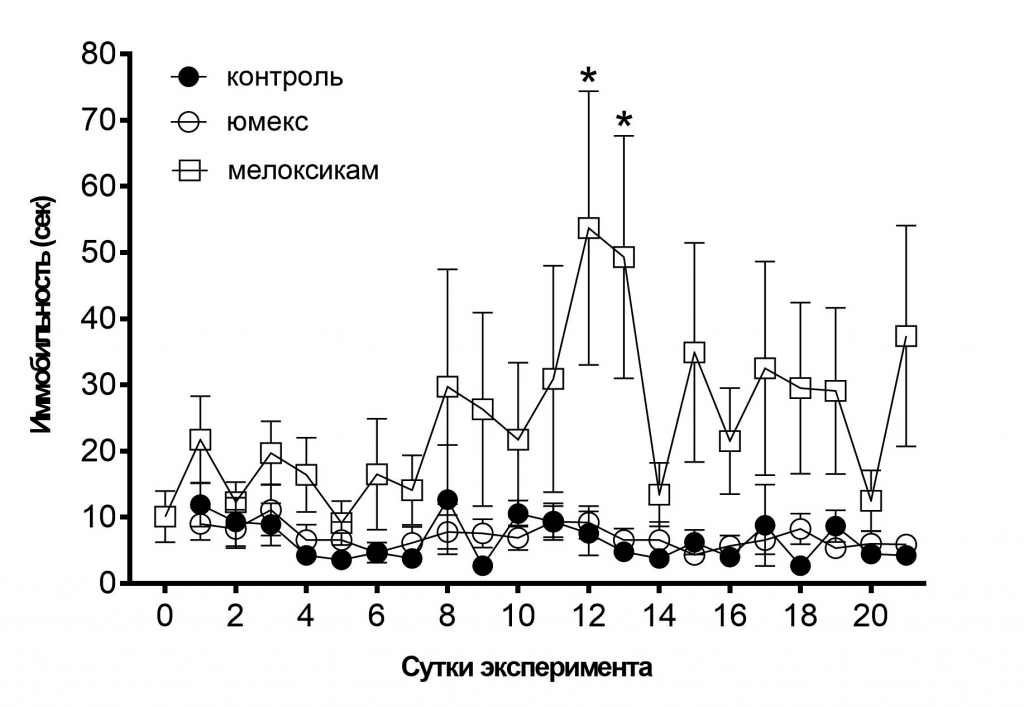
Рис. 7. Уровень иммобильности в группах «контроль», «юмекс» и «мелоксикам».
Примечание: звёздочками отмечены достоверные отличия при *р<0,05, (критерий Манна-Уитни).
Опираясь на вышеуказанные результаты, полученные в ходе данного исследования, становится очевидным анксиогенный и продепрессантный эффекта мелоксикама. Разумеется, совсем не обязательно, что все тревожно-депрессивные расстройства имеют в своей основе нейровоспаление, что, возможно, объясняет почему противовоспалительные препараты в таких случаях не проявляют антидепрессантных свойств, и даже могут усугубить ситуацию, понизив способность организма к нормальному воспалительному процессу. Верно и то, что связь воспаления с депрессией и ДА-системой сложная и многогранная, и не сводится к простой дихотомии «снижение воспаления – снижение депрессии», «усиление воспаления – усиление депрессии».
В тоже время, большинство учёных склоняется к тому, что галоперидол является провоспалительным агентом [34–36], поэтому несколько неожиданно, что мелоксикам не смог снизить, вызванную им иммобильность в «Тесте Порсолта». Возможно, иммобильность как таковая не обязательно напрямую связана с протеканием воспалительных процессов в организме, о чём говорят результаты и других экспериментов [37].
Так или иначе, в литературе присутствуют данные, пускай и немногочисленные, о негативном влиянии мелоксикама на эмоциональное состояние животных и людей [25, 26], и результаты данного исследования подтверждают эти выводы. Однако, стоит отметить, что мелоксикам смог улучшить двигательную активности крыс в тесте «Ротарод» на фоне блокады D2-рецепторов галоперидолом (рис. 8). Тем не менее, эти результаты, как и ранее в случае с климбингом, скорее, подтверждают, что мелоксикам способен вызывать ажитацию и повышенную раздражительность, без значимых улучшений депрессивных симптомов. К подобному заключение пришла и C. L. Nemeth с соавт. [38], установив, что мелоксикам снижает нейровоспаление в гиппокампе крыс-самок, однако депрессивные симптомы при этом не устраняет.
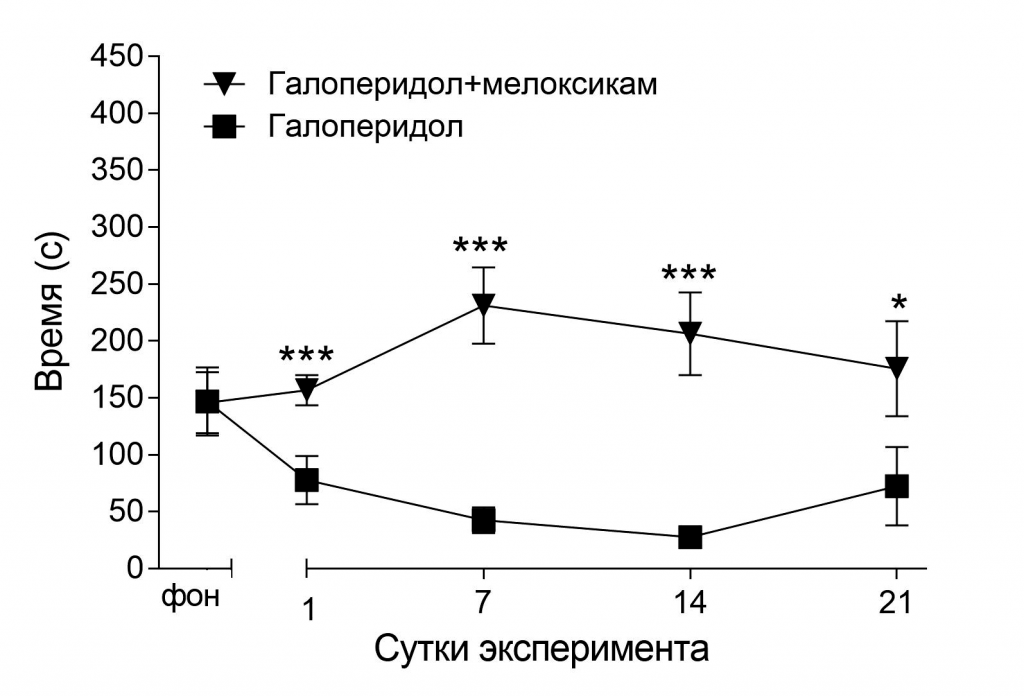
Рис. 8. Влияние галоперидола и мелоксикама на двигательную активность крыс в тесте «Ротарод».
Примечание: звёздочками отмечены достоверные отличия при *р<0,05, ***р<0,001 (критерий Стьюдента).
ЗАКЛЮЧЕНИЕ
Ингибирование ЦОГ-2 мелоксикамом не оказало ожидаемого антидепрессантного эффекта в «тесте Порсолта» и «Актиметре», а напротив, привело к ухудшению психоэмоционального состояния животных. На поведенческом уровне нам не удалось получить убедительных доказательств прямой связи эффектов мелоксикама с функционированием ДА-системы, хотя и было установлено его активирующее действие на локомоцию животных в тесте «Ротарод» после блокады D2-рецепторов галоперидолом.
Работа выполнена на оборудовании ЦКП ФГАОУ ВО «КФУ им. В. И. Вернадского» «Экспериментальная физиология и биофизика».
REFERENCES
- 1. Eyre H. A., & Baune B. T. Anti-inflammatory intervention in depression, JAMA psychiatry, 72(5), 511 (2015).
- 2. Beydoun M. A., Obhi H. K., Weiss J., Canas J. A., Beydoun H. A., Evans M. K., & Zonderman A. B. Systemic inflammation is associated with depressive symptoms differentially by sex and race: a longitudinal study of urban adults, Molecular psychiatry, 25(6), 1286 (2020).
- Beurel E., Toups M., & Nemeroff C. B. The bidirectional relationship of depression and inflammation: double trouble, Neuron, 107(2), 234 (2020).
- Mueller N. COX-2 inhibitors as antidepressants and antipsychotics: clinical evidence. Current opinion in investigational drugs (London, England: 2000), 11(1), 31 (2010).
- Păunescu H. (Anti) Depressant Effects of Non-Steroidal Antiinflammatory Drugs in Mice, International Journal of Pharmacological and Pharmaceutical Sciences, 9(5), 427 (2015).
- Allison D. J., Sharma B., & Timmons B. W. The efficacy of anti-inflammatory treatment interventions on depression in individuals with major depressive disorder and high levels of inflammation: a systematic review of randomized clinical trials, Physiology & behavior, 207, 104 (2019).
- Dunlop B. W., & Nemeroff C. B. The role of dopamine in the pathophysiology of depression, Archives of general psychiatry, 64(3), 327 (2007).
- Tye K. M., Mirzabekov J. J., Warden M. R., Ferenczi E. A., Tsai H. C., Finkelstein J., Kim S. Y., Adhikari A., Thompson K. R., Andalman A. S., Gunaydin L. A., Witten I. B. & Deisseroth K. Dopamine neurons modulate neural encoding and expression of depression-related behaviour, Nature, 493(7433), 537 (2013).
- 9. Schneier F. R., Slifstein M., Whitton A. E., Pizzagalli D. A., Reinen J., McGrath P. J., Iosifescu D. V. & Abi-Dargham A. Dopamine release in antidepressant-naive major depressive disorder: A multimodal [11C]-(+)-PHNO positron emission tomography and functional magnetic resonance imaging study, Biological psychiatry, 84(8), 563 (2018).
- Vyas A., Mitra R., Rao B. S., & Chattarji S. Chronic stress induces contrasting patterns of dendritic remodeling in hippocampal and amygdaloid neurons, Journal of Neuroscience, 22(15), 6810 (2002).
- Choi M., & Son H. Effects of serotonin on erythropoietin expression in mouse hippocampus, Experimental neurobiology, 22(1), 45 (2013).
- Wang Y., Yang F., Liu Y. F., Gao F., & Jiang W. Acetylsalicylic acid as an augmentation agent in fluoxetine treatment resistant depressive rats, Neuroscience letters, 499(2), 74 (2011).
- Wang J. M., Yang L. H., Zhang Y. Y., Niu C. L., Cui Y., Feng W. S., & Wang G. F. BDNF and COX-2 participate in anti-depressive mechanisms of catalpol in rats undergoing chronic unpredictable mild stress, Physiology & behavior, 151, 360 (2015).
- 14. Schwieler, L., Erhardt, S., Nilsson, L., Linderholm, K., & Engberg, G. Effects of COX‐1 and COX‐2 inhibitors on the firing of rat midbrain dopaminergic neurons—Possible involvement of endogenous kynurenic acid, Synapse, 59(5), 290 (2006).
- Teismann P., & Ferger B. Inhibition of the cyclooxygenase isoenzymes COX‐1 and COX‐2 provide neuroprotection in the MPTP‐mouse model of Parkinson’s disease, Synapse, 39(2), 167 (2001).
- Sui Y. I., Stanić D., Tomas D., Jarrott B., & Horne M. K. Meloxicam reduces lipopolysaccharide-induced degeneration of dopaminergic neurons in the rat substantia nigra pars compacta, Neuroscience letters, 460(2), 121 (2009).
- Chae S. W., Bang Y. J., Kim K. M., Lee K. Y., Kang B. Y., Kim E. M., Inoue H., Hwang O. & Choi H. J. Role of cyclooxygenase-2 in tetrahydrobiopterin-induced dopamine oxidation, Biochemical and biophysical research communications, 359(3), 735 (2007).
- Kumar A., Kumari B., & Kumar P. Protective effects of selective and non-selective cyclooxygenase inhibitors in an animal model of chronic stress, Neuroscience bulletin, 26(1), 17 (2010).
- Haile M., Boutajangout A., Chung K., Chan J., Stolper T., Vincent N., Batchan M., D’Urso J., Lin Y., Kline R., Yaghmoor F., Jahfal S., Kamal R., Aljohani W., Blanck T., Bekker A. & Wisniewski T. The COX-2 inhibitor meloxicam ameliorates neuroinflammation and depressive behavior in adult mice after splenectomy, Journal of neurophysiology and neurological disorders, 3, 1 (2016).
- Luo W., Ma Q. Y., Wei L. J., Wang J. F., Guo Y. X., Luo Y., Yu H. R., & Yang J. Q. Protective effect of meloxicam on CUMS-induced behavioral alterations in rats, Chinese pharmacological bulletin, 28(1), 123 (2012).
- Luo Y., Kuang S., Li H., Ran D., & Yang J. cAMP/PKA-CREB-BDNF signaling pathway in hippocampus mediates cyclooxygenase 2-induced learning/memory deficits of rats subjected to chronic unpredictable mild stress, Oncotarget, 8(22), 35558 (2017).
- Tasaki Y., Omura T., Yamada T., Ohkubo T., Suno M., Iida S., Sakaguchi T., Asari M., Shimizu K., & Matsubara K. Meloxicam protects cell damage from 1-methyl-4-phenyl pyridinium toxicity via the phosphatidylinositol 3-kinase/Akt pathway in human dopaminergic neuroblastoma SH-SY5Y cells, Brain research, 1344, 25 (2010).
- Di Matteo V., Pierucci M., Di Giovanni G., Di Santo A., Poggi A., Benigno A., & Esposito E. Aspirin protects striatal dopaminergic neurons from neurotoxin-induced degeneration: an in vivo microdialysis study, Brain research, 1095(1), 167 (2006).
- Goncalves M. B., Williams E. J., Yip P., Yáñez‐Muñoz R. J., Williams G., & Doherty P. The COX‐2 inhibitors, meloxicam and nimesulide, suppress neurogenesis in the adult mouse brain, British journal of pharmacology, 159(5), 1118 (2010).
- White D., & McCauley M. Depressive psychosis associated with a cyclo oxygenase 2 inhibitor (meloxicam), Irish journal of psychological medicine, 27(3), 157 (2010).
- Maes M. Targeting cyclooxygenase-2 in depression is not a viable therapeutic approach and may even aggravate the pathophysiology underpinning depression, Metabolic brain disease, 27(4), 405 (2012).
- Baune B. T. Are non-steroidal anti-inflammatory drugs clinically suitable for the treatment of symptoms in depression-associated inflammation? Inflammation-Associated Depression: Evidence, Mechanisms and Implications, 303 (2016).
- Chajka A. V., Konoshenko E. V, Khusainov D. R., Shakhmatova V. I., Mozharovskaya I. A., Cheretaev I. V. Forced swim test as a longitude method of assessment the dynamics of the emotional state of rats in the model of chronic unpredictable mild stress, Scientific Notes of V. I. Vernadsky Crimean Federal University. Biology. Chemistry, 4(2), 133 (2018).
- Kalueff A. V. Stress, anxiety and behavior, 95 p. (Kyiv: Enigma, 1998).
- Frolova G. A. Comparative ethological characteristics of males and females of white rats in Porsolt test in blocking receptors of sex hormone, Vestnik VGU, Seriya: Khimiya. Biologiya. Farmatsiya, 4, 110 (2016).
- Naitoh H., Nomura S., Kunimi Y., & Yamaoka K. “Swimming-induced head twitching” in rats in the forced swimming test induced by overcrowding stress: a new marker in the animal model of depression? The Keio journal of medicine, 41(4), 221 (1992).
- Belozertseva I. V. The problem of repeatability and reproducibility of data in the light of the evolution of the experimental method. Seminar FarmBioLine: Preclinical research. Modern trends and problems. GLP in the vivarium. Moscow, March 30, 2016. 31 slides. URL: http://docplayer.ru/29223082-Problema-povtoryaemosti-i-vosproizvodimosti-dannyh-v-svete-evolyucii-eksperimentalnogo-metoda.html
- Anyan J., & Amir S. Too depressed to swim or too afraid to stop? A reinterpretation of the forced swim test as a measure of anxiety-like behavior, Neuropsychopharmacology, 43(5), 931 (2018).
- Bishnoi M., Chopra K., Rongzhu L., & Kulkarni S. K. Protective effect of curcumin and its combination with piperine (bioavailability enhancer) against haloperidol-associated neurotoxicity: cellular and neurochemical evidence, Neurotoxicity research, 20(3), 215 (2011).
- Sárvári A. K., Veréb Z., Uray I. P., Fésüs L., & Balajthy Z. Atypical antipsychotics induce both proinflammatory and adipogenic gene expression in human adipocytes in vitro, Biochemical and biophysical research communications, 450(4), 1383 (2014).
- Khaziakhmetova V., Baiysbekov K., Torobekov S., Cong H., & Ziganshina L. The Effects of Haloperidol on Acute Carrageenan-Induced Inflammation, BioNanoScience, 7(2), 442 (2017).
- Deak, T., Bellamy, C., D’Agostino, L. G., Rosanoff, M., McElderry, N. K., & Bordner, K. A. Behavioral responses during the forced swim test are not affected by anti-inflammatory agents or acute illness induced by lipopolysaccharide, Behavioural brain research, 160(1), 125 (2005).
- Nemeth C. L., Glasper E. R., Harrell C. S., Malviya S. A., Otis J. S., & Neigh G. N. Meloxicam blocks neuroinflammation, but not depressive-like behaviors, in HIV-1 transgenic female rats, PloS one, 9(10), e108399 (2014).



