Ученые записки Крымского федерального университета имени В. И. Вернадского
Биология. Химия. Том 11 (77). 2025. № 1. С. 151–161.
УДК 581.1:579.64
DOI 10.29039/2413-1725-2025-11-1-151-161
АКТИВНОСТЬ КАТАЛАЗЫ И ПЕРОКСИДАЗЫ ПШЕНИЦЫ И ТОМАТОВ ПРИ ИНОКУЛЯЦИИ TRIHODERMA SP. НА РАННИХ ЭТАПАХ ОНТОГЕНЕЗА
Сидякин А. И., Чмелёва С. И., Белоусов В. В., Джелдубаева Э. Р., Туманянц К. Н.
ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», Симферополь,
Республика Крым, Россия
E-mail: acid2302@mail.ru
В статье приведены результаты исследования влияния различных штаммов микроорганизмов Trichoderma sp, полученных из ризопланы дикорастущих злаков флоры Республики Крым на активность каталазы и пероксидазы в проростках пшеницы и томатов. Показано, что предпосевная инокуляция штаммами Trichoderma sp. № 2, № 4 и № 5 стимулирует прорастание семян томатов и не оказывает влияние на прорастание семян пшеницы. Получены экспериментальные данные, свидетельствующие, что штаммы не оказывают отрицательного действия на ферментативную активность. Данный эффект не зависит от штамма и сохраняется на протяжении всего эксперимента.
Ключевые слова: Trichoderma sp., энергия прорастания семян, всхожесть, Lycopersicon esculentum Mill., Triticum durum L., каталаза, пероксидаза.
ВВЕДЕНИЕ
В процессе онтогенеза культурные растения подвергаются воздействию различных биотических факторов, в том числе, почвенных микроорганизмов [1]. Видовой состав микрофлоры, способной заселить ризосферу, во многом определяет развитие растительного организма и, в конечном счете, влияет на его урожайность. Одним из распространенных компонентов микрофлоры в ризосфере растений являются грибы рода Trichoderma. Они обладают развитой системой ферментативного аппарата, благодаря которому обеспечивается их высокая приживаемость и конкурентоспособность [1]. Воздействие микроорганизмов может сказываться как отрицательно, так и положительно на ростовые процессы растений и, их восприимчивость к различного рода болезням [2].
Создание и применение биопрепаратов на основе микроскопических грибов рода Trichoderma – современный и наиболее действенный способ повышения продуктивности растений, качества урожая, а также сохранение естественного плодородия почв.
Колонизация корней видами Trichoderma вызывает изменение в метаболизме растений, которые в будущем могут приводить к усилению развития корневой системы, увеличению урожая и повышения общего сопротивления к абиотическим и биотическим факторам. Но данный признак является штаммоспецифичным, и поэтому, исследование новых штаммов рода Trichoderma на предмет типа его воздействия на растительные организмы является актуальным и важным вопросом при разработке биопрепаратов.
Грибы рода Trichoderma являются полиантагонистами, способными в естественных условиях подавлять развитие многих патогенных микроорганизмов, обитающих в корневой зоне растений, кроме того, они обладают способностью влиять на вредные организмы через стимулирование защитных свойств растений [3, 4]. Они также могут оказывать положительное действие на ростовые процессы растений и влиять на их продуктивность [5, 6]; способны синтезировать физиологически активные вещества, которые влияют на биохимические процессы, протекающие в растениях. Так, внесение грибов этого рода в ризосферу значительно активизируют многие ферменты растений – инвертазу, каталазу, амилазу, уреазу, что, в свою очередь, увеличивает интенсивность окислительновосстановительных процессов, фотосинтез и поглощение питательных элементов корневой системой [7]. Все это влияет не только на уровень урожайности сельскохозяйственных культур, но и на качественные характеристики продукции, увеличивая содержание белков, незаменимых аминокислот и витаминов [8].
В связи с вышеизложенным целью работы явилось оценка влияния новых штаммов Trichoderma sp. на активность каталазы и пероксидазы пшеницы и томатов при инокуляции Trihoderma sp. на ранних этапах онтогенеза в условиях вегетационного лабораторного опыта.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальная часть работы проводилась на базе кафедры ботаники и физиологии растений и биотехнологий Института биохимических технологий, экологии и фармации Крымского федерального университета имени В. И. Вернадского в период 2023–2024 гг.
Для определения влияния различных штаммов Trichoderma sp. на ферментативную активность проростков Lycopersicon esculentum Mill. (сорт Ранний низкий 83) и Triticum durum L. (сорт Одари), семена по 100 штук в трехкратной повторности промывали теплым мыльным раствором, а затем протравливали для дезинфекции 1 %-ным раствором формалина в течение 5 минут. После дезинфекции семена промывали в трех сменах водопроводной воды по 10–15 минут, и переносили в чашки Петри на фильтровальную бумагу. Затем в чашки Петри наливали по 10 мл отстоянную водопроводную воду (контроль) или растворы препаратов. В соответствии со схемой опыта семена инокулировали штаммами микроорганизмов Trichoderma sp, полученными из ризопланы дикорастущих злаков флоры Республики Крым сотрудниками НПО Биотехсоюз и предоставленные нам из их коллекции:
1 – Контроль, отстоянная водопроводная вода;
2 – Штамм 1, 1,0%-ный раствор спор штамма Trichoderma sp. Б7 NO3 поли 105 100 мкл 2;
3 – Штамм 3, 1,0%-ный раствор спор штамма Trichoderma sp. СС 3 Б10 моно 107 1,0 мл 1;
4 – Штамм 4, 1,0%-ный раствор спор штамма Trichoderma sp. СС 3 Б10 моно 107 1,0 мл 2;
5 – Штамм 5, 1,0%-ный раствор спор штамма Trichoderma sp. N2 Na Cl 7,5 107 1мл;
6 – Штамм 6, 1,0%-ный раствор спор штамма Trichoderma sp.СС 3 Na Cl 7,5 103 1 мл.
Семена помещали в термостат типа ТС–80–М–2, согласно требованиям государственного стандарта для сельскохозяйственных культур 12038–84 [9]. Проростки на третьи-пятые сутки выращивания (с нормально развитым корнем) переносили в стеклянные материальные сосуды, содержащие 500 см3 минерального питательного раствора Цинцадзе, для выращивания растений в водной культуре в условиях лабораторного вегетационного опыта [8]. Проростки, а затем и растения выращивали в лаборатории, при освещенности не менее 2500 лк, температуре
+20–25 оС и естественном освещении и фотопериоде [9].
Активность ферментов определяли у 3- и 7-суточных проростков пшеницы и 5-, 10-суточных проростков томатов, активность каталазы – газометрическим способом [10], для определения активности пероксидазы 7-суточных проростков пшеницы и 10-суточных проростков томатов использовали фотометрический метод [10].
Исследования проводили в трехкратной повторности, статистическую обработку полученных данных осуществляли, рассчитывая среднюю арифметическую и стандартную ошибку средней арифметической, стандартное отклонение, критерий достоверности Стьюдента для сравнения двух выборок. Все измерения и исследования осуществляли на оборудовании, прошедшим метрологическую проверку и экспертизу [11].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При прорастании семян в них генерируются активные формы кислорода, защита от которых осуществляется за счет использования высокоактивной антиоксидантной системы, состоящей из низко- и высокомолекулярных соединений [12]. В комплекс высокомолекулярной системы антиоксидантной защиты входят ферменты: каталаза, супероксиддисмутаза, пероксидаза и др. [13]. Действие компонентов системы антиоксидантной защиты в основном сводится к подавлению образования свободных радикалов, поддержанию нормального уровня свободнорадикальных процессов и перекисного окисления липидов в тканях [14, 15]. Однако роль антиоксидантов в механизмах покоя и прорастания семян пшеницы мало изучена. Хотя известно, что многие из низкомолекулярных антиоксидантов могут быть субстратами пероксидазы [13, 16]. Первичная активизация метаболических процессов в прорастающих семенах обусловлена интенсификацией дыхания, сопряженного с окислительно-восстановительными реакциями растительного организма. Согласно современным представлениям, каталаза играет ведущую роль, регулируя окислительный режим в организме и её активность может рассматриваться в качестве меры интенсивности и продуктивности общего метаболизма.
В результате наших исследований установлено, что инокуляция семян Triticum durum L. новыми штаммами Trichoderma sp. в целом не оказала стимулирующего влияния на активность каталазы в проростках пшеницы, что согласовывалось с влиянием исследуемых штаммов на процессы прорастания семян. Под влиянием новых штаммов Trichoderma sp. такие параметры прорастания семян пшеницы твердой сорта Одари, как: энергия прорастания и всхожесть семян не изменяются (рис. 1).
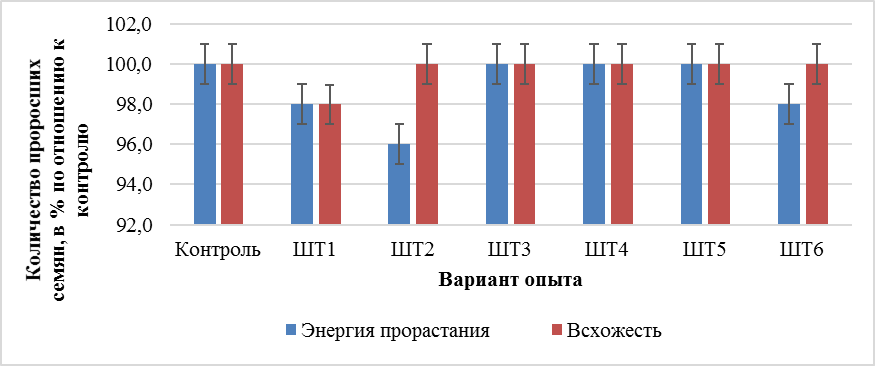
Рис. 1. Влияние новых штаммов Trichoderma sp. на энергию прорастания и всхожесть семян пшеницы; Б-томаты. Контроль-отстоянная водопроводная вода; ШТ1,2…6-штаммы триходермы.
В опытных вариантах, при инокуляции семян штаммом № 1 каталазная активность проростков пшеницы увеличилась в среднем на 31,19 %, что составляет 131,19 % по отношению к контролю. Под действием штамма № 2, № 4 и № 6 каталазная активность проростков пшеницы увеличивалась недостоверно (табл. 1).
При использовании штаммов № 3 и № 5 наблюдалась положительная динамика. Штамм № 3 увеличил показатель каталазной активности проростков пшеницы в среднем на 27,72 % (127,72 % по отношению к контролю). В опыте со штаммом № 5 показатель каталазной активности составил 141,87 % по отношению к контролю (табл. 1).
Как следует из представленных в таблице данных, каталазная активность проростков пшеницы твердой сорта Одари в контрольном варианте опыта на 7 сутки составила 1,03 мкМ О2/г сыр. массы тк*мин. В варианте с использованием штамма № 1 каталазная активность проростков пшеницы твердой сорта Одари на 7 сутки составила 100,56 %, что является недостоверным увеличением показателя.
Штамм № 2 уменьшил данный показатель на 6,46 %, что составляет 93,54 % по отношению к контролю. В варианте с использованием штамма № 3 каталазная активность проростков пшеницы твердой уменьшилась 12,02 % (87,98 % по отношению к контролю). Штамм № 4 снизил данный показатель на 8,61 % (91,33 % по отношению к контролю). Под действием штамма № 5 показатель каталазной активности проростков составил 84,31 % по отношению к контролю. Незначительно ниже показатель каталазной активности при использовании штамма № 6 84,54 % по отношению к контролю.
Таблица 1
Влияние новых штаммов Trichoderma sp. на каталазную активность проростков пшеницы
| Вариант опыта | Исследуемый показатель | |||
| 3-суточные проростки | 7-суточные проростки | |||
| мкМ О2/г сыр. массы ткани×мин | в % к контролю | мкМ О2/г сыр. массы ткани×мин | в % к контролю | |
| Контроль | 0,44±0,01 | 100,00 | 1,03±0,02 | 100,00 |
| Штамм 1 | 0,58±0,02 | 131,19 | 1,04±0,03 | 100,56 |
| Штамм 2 | 0,45±0,01 | 103,59 | 0,97±0,02 | 93,54 |
| Штамм 3 | 0,56±0,02 | 127,72 | 0,91±0,01 | 87,98 |
| Штамм 4 | 0,46±0,03 | 104,25 | 0,94±0,04 | 91,33 |
| Штамм 5 | 0,62±0,05 | 141,87 | 0,87±0,02 | 84,31 |
| Штамм 6 | 0,45±0,03 | 103,63 | 0,87±0,04 | 84,54 |
Примечание к таблице: разница средних значений контроля и опыта достоверна при Р < 0,05 для всех вариантов.
Таким образом, проведенные исследования влияния новых штаммов Trichoderma sp. на показатель каталазной активности проростков пшеницы твердой сорта Одари показали, что на 7 сутки новые штаммы Trichoderma sp. снижали данный показатель.
Проведенные лабораторные исследования по изучению влияния новых штаммов Trichoderma sp. на каталазную активность проростков томатов сорта Ранний низкий 83 на 5 и 10 сутки, представленные в таблице 2 показали, что каталазная активность проростков томатов в вариантах, с инокуляцией штаммом № 1 достоверно уменьшилась на 47,61 %, что составляет 52,39 % по отношению к контролю. Обработка семян штаммами № 2 и № 6 также достоверно снижает показатель каталазной активности проростков томатов, что согласуется с показателями прорастания семян. Штаммы Trichoderma sp. № 2, № 4, № 5 повышают по сравнению с контролем энергию прорастания и всхожесть семян томата сорта Ранний низкий 86 (рис. 2).
Штамм № 2 на 25,52 % (74,48 % по отношению к контролю), штамм № 6 на 17,98 % (82,02 % по отношению к контролю). Штамм № 3 недостоверно снижает каталазную активность проростков томатов сорта Ранний низкий 83 на 0,04 % (99,96 % по отношению к контролю). В вариантах с использованием штаммов № 4 и № 5 каталазная активность проростков томатов достоверно увеличивается. Штамм № 4 увеличил данный показатель на 15,27 %, что составляет 115,27 % по отношению к контролю. Обработка семян штаммом № 5 увеличило каталазную активность на 8 % (108 % по отношению к контролю).
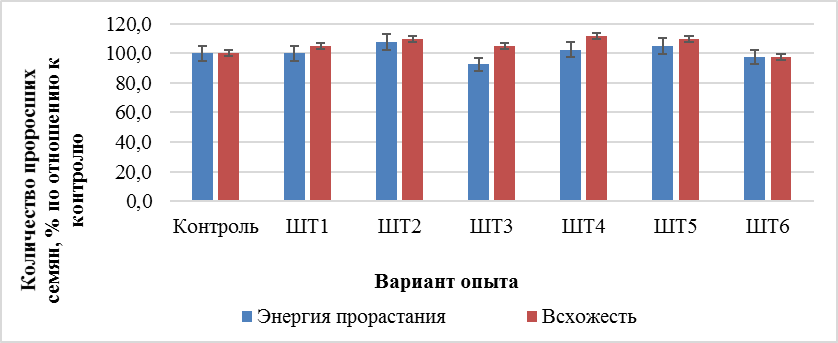
Рис. 2. Влияние новых штаммов Trichoderma sp. на энергию прорастания и всхожесть семян томатов. Контроль-отстоянная водопроводная вода; ШТ1,2…6-штаммы триходермы.
Таблица 2
Влияние новых штаммов Trichoderma sp. на каталазную активность проростков томатов
| Вариант опыта | Исследуемый показатель | |||
| 5-суточные проростки | 10-суточные проростки | |||
| мкМ О2/г сыр. массы тк*мин | в % к контролю | мкМ О2/г сыр. массы тк*мин | в % к контролю | |
| Контроль | 0,44±0,01 | 100,00 | 1,34±0,03 | 100,00 |
| Штамм 1 | 0,23±0,02 | 52,39 | 0,94±0,03 | 70,04 |
| Штамм 2 | 0,32±0,02 | 74,48 | 0,87±0,02 | 64,95 |
| Штамм 3 | 0,44±0,03 | 99,96 | 1,33±0,03 | 99,10 |
| Штамм 4 | 0,50±0,04 | 115,27 | 1,26±0,01 | 94,05 |
| Штамм 5 | 0,47±0,03 | 108,00 | 1,61±0,03 | 120,39 |
| Штамм 6 | 0,36±0,02 | 82,02 | 1,42±0,04 | 105,93 |
Примечание к таблице: разница средних значений контроля и опыта достоверна при Р < 0,05 для всех вариантов.
Проведенные лабораторные исследования влияние новых штаммов Trichoderma sp. на показатель каталазной активности проростков томатов на 5 сутки показали, что максимальный эффект оказали штаммы № 4 и № 5 достоверно увеличив этот показатель. На 10 сутки каталазная активность проростков томатов увеличилась под действием штаммов № 5 и № 6, остальные штаммы достоверно снижали каталазную активность.
Повышение активности пероксидазы при прорастании семян свидетельствует о том, что фермент может участвовать в пусковых механизмах прорастания семян, инициируя реакции свободно-радикального окисления. Наилучшие результаты по влиянию штаммов Trichoderma sp. активность пероксидазы были получены нами в вариантах, в которых использовалось предпосевное инокулирование семян пшеницы штаммом № 6. Как следует их представленных в таблице 3 данных, пероксидазная активность проростков пшеницы твердой сорта Одари в контрольном варианте опыта на 7 сутки составила 23,45 ед. опт. плотн. /
(г сыр.массы)*(сек).
Повышение активности пероксидазы при прорастании семян свидетельствует о том, что фермент может участвовать в пусковых механизмах прорастания семян, инициируя реакции свободно-радикального окисления. Наилучшие результаты по влиянию штаммов Trichoderma sp. активность пероксидазы были получены нами в вариантах, в которых использовалось предпосевное инокулирование семян пшеницы штаммом № 6. Как следует их представленных в таблице 3 данных, пероксидазная активность проростков пшеницы твердой сорта Одари в контрольном варианте опыта на 7 сутки составила 23,45 ед.опт.плотн. /
(г сыр.массы)*(сек).
Таблица 3
Влияние новых штаммов Trichoderma sp. на пероксидазную активность проростков пшеницы твердой сорта Одари на 7 сутки
| Вариант опыта | Активность пероксидазы | |
| ед.опт.плотн./(г сыр.массы)*(сек) | % к контролю | |
| Контроль | 23,45 ± 1,07 | 100,00 |
| Штамм 1 | 26,61 ± 1,02 | 113,48 |
| Штамм 2 | 23,05 ± 1,02 | 98,29 |
| Штамм 3 | 31,60 ± 1,04 | 134,77 |
| Штамм 4 | 33,43 ± 1,05 | 142,58 |
| Штамм 5 | 28,41 ± 1,01 | 121,18 |
| Штамм 6 | 40,25 ± 1,08 | 171,69 |
Примечание к таблице: разница средних значений контроля и опыта достоверна при Р < 0,05 для всех вариантов.
Повышение активности пероксидазы при прорастании семян свидетельствует о том, что фермент может участвовать в пусковых механизмах прорастания семян, инициируя реакции свободно-радикального окисления. Наилучшие результаты по влиянию штаммов Trichoderma sp. активность пероксидазы были получены нами в вариантах, в которых использовалось предпосевное инокулирование семян пшеницы штаммом № 6. Как следует их представленных в таблице 3 данных, пероксидазная активность проростков пшеницы твердой сорта Одари в контрольном варианте опыта на 7 сутки составила 23,45 ед.опт.плотн. /
(г сыр.массы)*(сек).
При использовании штамма № 1 пероксидазная активность проростков пшеницы твердой увеличилась на 13,48 %, что составляет 113,48 % по отношению к контролю. Использование штамма № 2 уменьшает значение показателя. Штаммы № 3, № 4, № 5 и № 6 достоверно увеличивают данный показатель. Использование штамма № 3 на 34,77 % (134,77 % по отношению к контролю). В варианте с использованием штамма № 4, пероксидазная активность проростков пшеницы твердой сорта Одари увеличилось на 42,58 %. Штамм № 5 увеличил показатель на 21,18 %, что составило 121,18 % по отношению к контролю. Использование штамма № 6 увеличило пероксидазную активность проростков пшеницы твердой сорта Одари на 71,69 % (171,69 % по отношению к контролю).
Таблица 4
Влияние новых штаммов Trichoderma sp. на пероксидазную активность проростков томатов сорта Ранний низкий 83 на 10 сутки
| Вариант опыта | Активность пероксидаза | |
| ед.опт.плотн./(г сыр.массы)*(сек) | % к контролю | |
| Контроль | 39,67 ± 1,11 | 100,00 |
| Штамм 1 | 18,81 ± 0,93 | 47,41 |
| Штамм 2 | 19,28 ± 0,85 | 48,60 |
| Штамм 3 | 19,71 ± 0,23 | 49,69 |
| Штамм 4 | 14,98 ± 0,08 | 37,77 |
| Штамм 5 | 17,20 ± 0,74 | 43,36 |
| Штамм 6 | 18,63 ± 0,56 | 46,95 |
Примечание к таблице: разница средних значений контроля и опыта достоверна при Р < 0,05 для всех вариантов.
Максимальный эффект на показатель пероксидазной активности проростков пшеницы твердой сорта Одари на 7 сутки оказал штамм № 6. Все остальные штаммы за исключением штамма № 2, также увеличивали данный показатель.
Как следует из представленных в таблице 4 данных, пероксидазная активность проростков томатов сорта Ранний низкий 83 на 10 сутки в контрольном варианте опыта составила 39,67 ед.опт.плотн. / (г сыр.массы)*(сек). В варианте с использованием штамма №1 пероксидазная активность проростков томатов уменьшилась на 52,59 %, что составило 47,41 % по отношению к контролю. Штамм № 2 также снижал пероксидазную активность проростков томатов и составил 48,60 % по отношению к контролю. Использование штамма № 3 снизило данный показатель на 50,31 % (49,69 % по отношению к контролю). Штаммы № 4, № 5 и № 6 аналогично снижают пероксидазную активность проростков томатов сорта Ранний низкий 83.
Таким образом, проведенные лабораторные исследования перксидазной активности на 10 сутки проростков томатов сорта Ранний низкий 83 показали, что все новые штаммы Trichoderma sp. снижают данный показатель.
ЗАКЛЮЧЕНИЕ
Проведенные исследования по влиянию новых штаммов Trichoderma sp., выделенных из ризопланы дикорастущих злаков флоры Республики Крым на активность каталазы и пероксидазы проростков Lycopersicon esculentum Mill. (сорт Ранний низкий 83) и Triticum durum L. (сорт Одари) показали, что инокуляция семян не оказывает отрицательного влияния на ферментативную активность. Данные штаммы могут быть рекомендованы для создания биопрепаратов на основе микроскопических грибов рода Trichoderma.
Список литературы
- Голованова Т. И. Роль грибов рода Trichoderma в повышении урожайности пшеницы и ячменя / Т. И. Голованова, Е. В. Долинская, Е. А. Сичкарук // Вестник КрасГАУ. – 2009. – Т. 6. – С. 53–58.
- Голованова Т. И. Взаимоотношения пшеницы с микроорганизмами прикорневой зоны растений // Голованова Т. И, Литовка Ю. А., Долинская Е. В., Сичкарук Е. А., Валиулина А. Ф., Савицкая А. Г., Схиладзе О. Л. // Вестник КрасГАУ. – 2010. – № 9. – С. 10.
- Голованова Т. И. Физиолого-морфологические параметры растений при действии спор гриба рода Trichoderma / Т. И. Голованова, А. А. Аксентьева // Вестник КрасГУ. Серия Естественные науки. – 2003. – С. 134–139.
- Громовых Т. И. Эффективность действия Trichoderma asperellum G. Samuels штамм МГ – 97 на развитие фузариоза на сеянцах Larix sibirica L. / Т. И. Громовых, Ю. А. Литовка, В. С. Громовых, Е. Г. Махова // Микология и фитопатология. – 2002. – Т. 36, Вып. 4. – С. 70–75.
- Великанов Л. Л. Сравнение гиперпаразитической и антибиотической активности изолятов рода Trichoderma Pers.: Fr. и Gliocladium virens Miller, Giddens et Foster по отношению к патогенам, вызывающим корневые гнили гороха / Л. Л. Великанов, Е. Ю. Сухоносенко, С. И. Николаева, И. Л. Завелишко // Микология и фитопатология. – 1994. – Т. 28, Вып. 6. – С. 52–56.
- Громовых Т. И. Фитопатогенные микромицеты сеянцев хвойных в Средней Сибири: видовой состав, экология, биологический контроль : Автореф. диссертации… доктора биологических наук. / Громовых Т. И. – Москва, 2002. – 37 с.
- Гринько Е. К. Экологически безопасная система защиты овощных культур закрытого грунта от фитопатогенов / Гринько Е. К. // Рекомендации. – Краснодар: Агропромполиграфист, 2000. – 44 с.
- Алимова Ф. К. Промышленное применение грибов рода Trichoderma: учебное пособие / Ф. К. Алимова. – Казань: Казанский государственный университет им. В. И. Ульянова-Ленина, 2006. – 209 с.
- ГОСТ 12038. Семена сельскохозяйственных культур, Методы определения всхожести. – Введ. 1986-07-01. – М.: Госстандарт России: Изд-во стандартов, 2011. – 64 с.
- Емельянов В. В. Активность каталазы и пероксидазы в растениях пшеницы и риса в условиях аноксии и постаноксической аэрации / В. В. Ласточкин, Е. Г. Приказюк, Т. В. Чиркова // Физиология растений – 2022. – T. 69, № 6. – С. 675–690.
- Лакин Г. Ф. Биометрия / Г. Ф. Лакин. – М., Высшая школа. – 1980. –146 с.
- Верхотуров В. В. Взаимное влияние пероксидазы и низкомолекулярных антиоксидантов при прорастании семян пшеницы: автореферат дис. … кандидата биологических наук: 03.00.12, 03.00.04 / Верхотуров В. В. – Сиб. ин-т физиологии и биохимии растений СО РАН. – Иркутск, 1999. – 23 с.
- Андреева В. А. Фермент пероксидаза / В. А. Андреева. – М.: Наука, 1988. – 128 с.
- Бурлакова Е. Б. Перекисное окисление липидов мембран и природные антиоксиданты / Е. Б. Бурлакова, Н. Г. Храпова // Успехи химии. – 1985. – Т. 54, № 9. – С. 1540–1558.
- Кения М. В. Роль низкомолекулярных антиоксидантов при окислительном стрессе / М. В. Кения, А. И. Лукаш, Е. П. Гуськов // Успехи современной биологии. – 1993. – Т.113, № 4. – С.456–470.
- Запрометов М. Н. Фенольные соединения растений и их биогенез / М. Н. Запрометов // Итоги науки и техники. Серия биологическая химия. ВИНИТИ, 1993. – Т. 27. – 188 с.
CATALASE AND PEROXIDASE ACTIVITY IN WHEAT AND TOMATO PLANTS INOCULATED WITH TRICHODERMA SP. AT EARLY STAGES OF ONTOGENESIS
Sidyakin A. I., Chmelyova S. I., Belousov V. V., Dzheldubaeva E. R., Tumanyants K. N.
V. I. Vernadsky Crimean Federal University, Simferopol, Russian Federation
E-mail: acid2302@mail.ru
This article presents the results of a study on the effects of novel strains of microscopic fungi of the genus Trichoderma, isolated from the rhizoplane of wild cereals native to the flora of the Republic of Crimea, on the enzymatic activity of seedlings of durum wheat (Triticum durum L., cultivar “Odari”) and tomato (Lycopersicon esculentum Mill., cultivar “Ranniy nizkiy 83”) during the early stages of ontogenesis. At the current stage of biotechnology development, one of the pressing challenges is the creation of effective and environmentally safe biopreparations based on antagonistic microorganisms that can not only suppress the development of pathogenic microflora in the rhizosphere but also positively influence the physiological and biochemical processes in plants.
The aim of this study was to assess the influence of seed inoculation with different Trichoderma sp. strains on the activity of key antioxidant enzymes—catalase and peroxidase—as markers of the metabolic activity of seedlings. Under laboratory vegetation conditions, the activity levels of these enzymes were studied in wheat seedlings (on days 3 and 7) and tomato seedlings (on days 5 and 10) after seed germination in spore suspension solutions of six fungal strains.
The results showed that the effects of Trichoderma sp. strains are strain-specific. Some strains (e.g., strains No. 4 and No. 5) caused statistically significant increases in catalase activity in tomato seedlings, while strain No. 6 exhibited the most pronounced stimulating effect on peroxidase activity in wheat seedlings. At the same time, other strains either reduced enzymatic activity or had no significant effect. It was found that seed inoculation with Trichoderma sp. strains did not suppress enzymatic activity, which indicates the absence of stress effects and supports the potential of these strains as components of biopreparations.
The findings contribute to the understanding of the interactions between microscopic fungi and plants at early developmental stages and may be used in the selection of promising Trichoderma strains for enhancing crop resistance to biotic and abiotic stresses, as well as for the development of new microbial products aimed at stimulating plant growth and development in agriculture.
Keywords: Trichoderma sp., seed germination energy, germination rate, Lycopersicon esculentum Mill., Triticum durum L., catalase, peroxidase.
References
- Gоlоvаnоvа T. I., Dоlinskаyа Е. V., Sichkаruk Е. А. The role of fungi of the genus Trichoderma in increasing the yield of wheat and barley, Vеstnik KrаsGАU, 6, 53 (2009).
- Gоlоvаnоvа T. I., Litоvkа Yu. А., Dоlinskаyа Е. V., Sichkаruk Е. А., Vаliulinа А. F., Sаvitskаyа А. G., Skhilаdzе О. L. Wheat relations with microorganisms of the root zone of plants, Vеstnik KrаsGАU, 9, 10 (2010).
- Gоlоvаnоvа T. I., Аksеnt’еvа А. А. Physiological and morphological parameters of plants under the action of spores of the fungus Trichoderma, Vеstnik KrаsGАU. Sеriya Еstеstvеnnyе nаuki, 134 (2003).
- Grоmоvykh T. I., Litоvkа Yu. А., Grоmоvykh V. S., Mаkhоvа Е. G. The effectiveness of the action of Trichoderma asperellum G. Samuels strain MG – 97 on the development of fusarium on seedlings of Larix sibirica L., Mikоlоgiya i fitоpаtоlоgiya, 36 (4), 70 (2002).
- Vеlikаnоv L. L., Sukhоnоsеnkо Е. Yu., Nikоlаеvа S. I., Zаvеlishkо I. L. Comparison of hyperparasitic and antibiotic activity of isolates of the genus Trichoderma Pers.: Fr. and Gliocladium virens Miller, Giddens et Foster against pathogens causing pea root rot, Mikоlоgiya i fitоpаtоlоgiya, 28 (6), 52 (1994).
- Grоmоvykh T.I. Phytopathogenic micromycetes of coniferous seedlings in Central Siberia: species composition, ecology, biological control, Abstract of dissertation… doctor of biological sciences (Mоscоw, 2002).
- Grin’kо Е. K. Environmentally safe system for protecting greenhouse vegetable crops from phytopathogens, (Аgrоprоmpоligrаfist, Krаsnоdаr, 2000).
- Аlimоvа F.K. Industrial application of fungi of the genus Trichoderma (Kаzаnski Gоsudаrstvеnny Univеrsitеt im. V. I. Ul’yаnоvа-Lеninа, Kаzаn’, 2006).
- GОST 12038. Seeds of agricultural crops, Methods for determining germination (Gоsstаndаrt Rоssii, Izd-vо stаndаrtоv, Mоscоw, 2011).
- Еmеl’yаnоv V. V., Lаstоchkin V. V., Prikаzyuk Е. G., Chirkоvа T. V. Catalase and peroxidase activity in wheat and rice plants under conditions of anoxia and post-anoxic aeration, Fiziоlоgiya Rаstеnii, 69 (6), 675 (2022).
- Lаkin G. F. Biometry (Vysshаya shkоlа, Mоscоw, 1980).
- Vеrkhоturоv V. V. The mutual influence of peroxidase and low-molecular antioxidants during the germination of wheat seeds, Abstract of dissertation… candidate of biological sciences. (Sib. In-t fiziоlоgii i biоkhimii rаstеnii SО RАN, Irkutsk, 1999).
- Аndrееvа V. А. The enzyme peroxidase (Nаukа, Mоscоw, 1988).
- Burlаkоvа Е. B., Khrаpоvа N. G. Lipid peroxidation of membranes and natural antioxidants, Uspеkhi khimii, 54 (9), 1540 (1985).
- Kеniya M. V., Lukаsh А. I., Gus’kоv Е. P. The role of low-molecular antioxidants in oxidative stress, Uspеkhi sоvrеmеnnоi biоlоgii, 113 (4), 456 (1993).
- Zаprоmеtоv M. N. Phenolic compounds of plants and their biogenesis, Itоgi nаuki i tеkhniki. Sеriya biоlоgichеskаya khimiya (VINITI, Mоscоw, 1993).



