Ученые записки Крымского федерального университета имени В. И. Вернадского
Биология. Химия. Том 11 (77). 2025. № 2. С. 37–47.
УДК 616.631:612.465 – 57.089
DOI 10.29039/2413-1725-2025-11-2-37-47
ВЛИЯНИЕ ПРОБИОТИЧЕСКОГО МИКРОБНОГО КОНСОРЦИУМА НА ПОЧЕЧНУЮ ТКАНЬ КРЫС ПРИ АЛЛОКСАН-ИНДУЦИРОВАННОМ ДИАБЕТЕ
Джелдубаева Э. Р., Ярмолюк Н. С., Ржевская В. С., Туманянц К. Н., Назырова Л. Э.
ФГАОУ ВО «Крымский федеральный университет им. В. И. Вернадского», Симферополь,
Республика Крым, Российская Федерация
Е-mail: delviza@mail.ru
В работе представлено экспериментальное исследование влияния пробиотического микробного консорциума (ПМК) на морфологическое состояние почек у крыс с аллоксан-индуцированным сахарным диабетом. Проведён морфометрический анализ структур почечной ткани с оценкой клубочкового аппарата, канальцев и интерстициального пространства. Установлено, что аллоксановый диабет вызывает выраженные деструктивные изменения в почках, характерные для диабетической нефропатии. Введение ПМК способствовало частичному восстановлению гистоархитектоники почечной ткани, улучшению морфометрических показателей и снижению признаков воспаления и дистрофии. Полученные данные подтверждают наличие умеренного нефропротекторного эффекта ПМК и его потенциал как средства дополнительной коррекции диабетических осложнений.
Ключевые слова аллоксан, диабетическая нефропатия, почки, пробиотический микробный консорциум, морфометрия, крысы, нефропротекторный эффект.
ВВЕДЕНИЕ
Одним из тяжёлых и распространённых осложнений заболевания сахарного диабета является диабетическая нефропатия – хроническое поражение почечной ткани, сопровождающееся нарушением фильтрационной функции, структурными изменениями в клубочках и канальцах, а также прогрессирующей почечной недостаточностью [1–3]. Установлено, что гипергликемия вызывает оксидативный стресс, активацию провоспалительных цитокинов и сосудистую дисфункцию, что приводит к повреждению нефронов и нарушению гистоархитектоники почек [4, 5].
Экспериментальные модели аллоксан-индуцированного диабета у крыс позволяют воспроизводить ключевые патологические изменения, характерные для диабетической нефропатии у человека. Аллоксан вызывает селективную деструкцию β-клеток поджелудочной железы, приводя к устойчивой гипергликемии и, как следствие, к морфофункциональным нарушениям в почках [2, 6].
На фоне растущего интереса к возможности немедикаментозной коррекции осложнений диабета внимание исследователей всё чаще обращается к пробиотикам и пробиотическим микробным консорциумам (ПМК). Пробиотики представляют собой живые микроорганизмы, способные восстанавливать микробиоту кишечника и оказывать системное метаболическое и противовоспалительное действие [7]. В исследованиях последних лет показано, что введение пробиотиков способствует снижению уровня уремических токсинов, улучшению показателей креатинина и мочевины, нормализации окислительного статуса [8, 9]. Некоторые штаммы пробиотических микроорганизмов, включая Lactobacillus plantarum, L. acidophilus и Bifidobacterium longum, продемонстрировали нефропротективный эффект в экспериментах на животных с сахарным диабетом (СД) за счёт снижения воспалительной инфильтрации, отека, нормализации толщины базальных мембран и снижения апоптоза в канальцевом эпителии [3, 10].
Однако, несмотря на наличие литературных данных, посвящённых изучению ренальных изменений при СД, влияние ПМК на гистологическую структуру почек при аллоксан-индуцированном диабете изучено недостаточно. Учитывая многофакторный характер патогенеза диабетической нефропатии, изучение защитных механизмов действия ПМК, в том числе на морфометрические и гистологические показатели почечной ткани, представляет высокую научную и практическую значимость.
В связи с вышеизложенным, целью данной работы явился анализ морфометрических показателей почек крыс после введения курса пробиотического микробного консорциума на фоне аллоксан-индуцированного диабета.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена в Центре коллективного пользования научным оборудованием «Экспериментальная физиология и биофизика» при кафедре физиологии человека и животных и биофизики в рамках программы исследований № АААА-А21-121011990099-6 «Физиологические механизмы биологического действия факторов разной природы и интенсивности» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского».
Эксперименты проводились на белых половозрелых крысах-самцах линии Wistar, которые были специально выведены для лабораторных исследований. Общая выборка составила 30 здоровых крыс, массой 300–350 грамм.
Согласно государственному стандарту РФ «ГОСТ 33216-2014, Руководство по содержанию и уходу за лабораторными животными, Правила содержания и ухода за лабораторными грызунами и кроликами, Правила оборудования помещений и организации процедур» – испытуемые животные содержались в адекватных условиях, в соответствии с тезисами вышеприведённого государственного норматива.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям этического комитета по биоэтике ФГАОУ ВО «Крымский федеральный университет им. В. И. Вернадского» (протокол № 5 от 2022 г.).
Животных разделили на 3 экспериментальные группы по 10 особей в каждой. В первой группе (Контроль, К) крысы содержались в стандартных условиях вивария, которым в течение 21 дня вводили по 3 мл питьевой воды. У животных второй группы (Ал) за 10 дней до начала эксперимента был смоделирован аллоксановый диабет путем внутрибрюшинного введения аллоксана – моногидрата (C4H2N2O4·H2O; компания «Диаэм», Россия) в дозировке по 100 мг/кг в течение трех дней [11]. Далее на протяжении 21 дня им вводили интрагастрально с использованием желудочного орального зонда по 3 мл питьевой воды.
Животным третьей группы (Ал+Пб) также был смоделирован аллоксановый диабет, после чего на 11-й день начали интрагастрально вводить 1 % раствор ПМК по 3 мл в течение последующего 21 дня.
Синтез тестируемого ПМК проводился на кафедре ботаники и физиологии растений и биотехнологий ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского» под руководством Ржевской В. С. ПМК включал штаммы пробиотических микроорганизмов: Lactobacillus parabuchneri ВКМ В-3553D, Lactobacillus plantarum ВКМ В-3552D, Lactobacillus acidophilus ВКМ В-3563D, Enterococcus faecium ВКМ В-3551D, Brettanomyces bruxellensis ВКМ Y-3064D. Биологическая концентрация бактерий ПМК составила 1,3∙109 КОЕ.
На 22-е сутки животных выводили из эксперимента путем декапитации на гильотине («НПК Открытая наука, Россия») под эфирным наркозом.
Подготовка гистологического материала почек осуществлена в ЦКП «Молекулярная биология» Ордена Трудового Красного Знамени Медицинский институт им. С. И. Георгиевского. Гистологические препараты почек готовили в соответствии со стандартными методиками. Фиксировали фрагменты почек в
10 %-м забуференном формалине (рН 7,2) в течение 24 часов. После этого осуществляли дегидратацию и пропитку парафином в микроволновом гистологическом процессоре LOGOS (Mielstone, Италия) с использованием программы, рекомендованной производителем. Пропитанные парафином кусочки органов заливали в блоки, из которых изготавливали полутонкие срезы толщиной
4 мкм. Срезы окрашивали гематоксилином и эозином [12].
Морфометрические измерения выполняли на микрофотографиях с помощью специализированного программного обеспечения Aperio Imagescope (версия 12.4.6.5003). Регистрировали следующие показатели: длина и ширина правой и левой почки (мкм); ширина коркового и мозгового вещества (мкм), площади клубочка с капсулой, капиллярных петель с интерстициальным пространством клубочка, мочевого пространства (мкм2); площади (мкм2) просвета проксимальных канальцев и дистальных канальцев, собирательных трубочек и тонкого сегмента петли Генле; количество почечных телец на единицу площади (у. е.). Эти показатели позволят выявить характерные для диабета структурные изменения, такие как диабетическая нефропатия, а также оценить динамику эффективности лечебных мероприятий.
Статистическую обработку и графическое представление экспериментальных данных проводили с использованием программ GraphPad Prism 8 (версия 8.4.3) (GraphPad Software, США) и Microsoft Excel 2010 (Microsoft Corporation, США). Проверку распределения данных на нормальность осуществляли с помощью критерия Шапиро-Уилка. Значимость различий между группами оценивали с помощью непараметрического критерия Краскела-Уоллиса. Множественные апостериорные сравнения значений показателей между группами проводили с помощью критерия Данна. В описании сравнения значений показателей в разных группах животных использовались %, которые рассчитывались по значениям медианы показателей соответствующих групп. Критический уровень значимости статистических гипотез (р) в данном исследовании принимали равным 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты исследования показали, что у крыс первой группы (К) на гистологических срезах почек наблюдали нормальную картину строения коркового и мозгового вещества почки. В корковом слое отмечается равномерно распределенные почечные тельца (рис. 1). Капилляры клубочков заполнены эритроцитами. Париетальный и висцеральный листки капсулы почечного тельца плотно прилегают друг к другу, так что пространство Боуменовой капсулы не определяется. Межклеточное пространство умеренно выражено, отсутствуют признаки отека и фиброза. Извитые канальцы плотные, их просвет минимальный, что свидетельствует о сохраненной реабсорбционной функции. Просветы этих канальцев неширокие, свободные. Между проксимальными канальцами выявлялись в значительно меньшем количестве поперечные срезы дистальных извитых канальцев. Эти структурные элементы имели следующие морфометрические параметры, представленные на рисунках 2, 3.
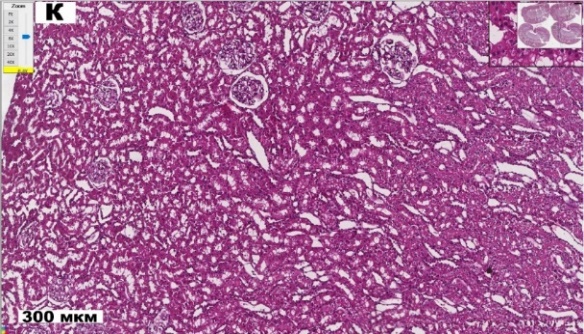
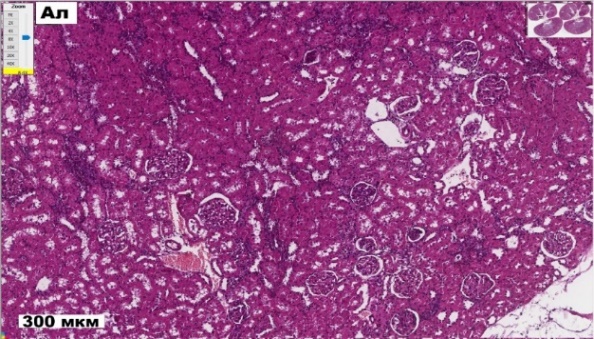
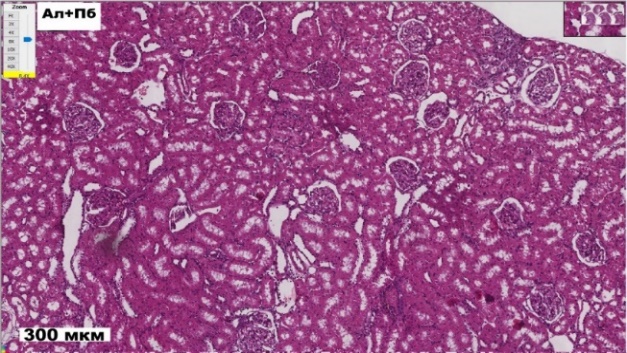
Рис. 1. Гистологические срезы коркового вещества почек крыс в контроле (К), с аллоксан-индуцированным диабетом (Ал) и при введении пробиотического микробного консорциума (Ал+Пр) (ув. х8).
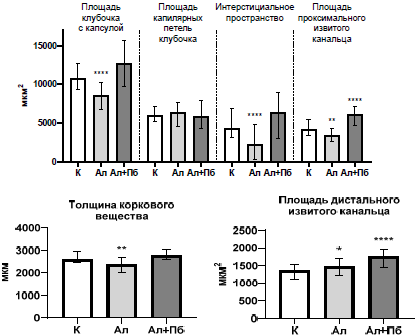
Рис. 2. Морфометрические показатели коркового вещества почек крыс в контроле (К), с аллоксан-индуцированным диабетом (Ал) и при введении пробиотического микробного консорциума (Пр)
Примечания: на графике представлены значения в виде медианы и нижнего и верхнего квартилей (Me (Q25:Q75)); * статистически значимое отличие по критерию Данна относительно значений показателей у крыс контрольной группы (p<0,05).
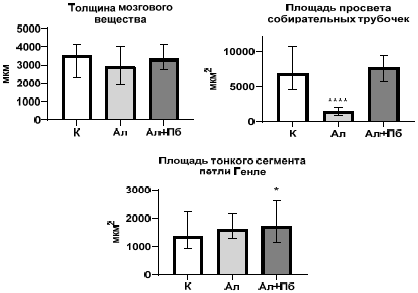
У животных второй группы (Ал) отмечается выраженная деструкция клубочков, увеличенное интерстициальное пространство и деформация капилляров (рис. 1). Значительное расширение канальцев, особенно проксимальных, свидетельствует об атрофии эпителия и нарушении реабсорбции. Выявлены вакуолизация и дистрофические изменения в канальцевом эпителии, умеренный интерстициальный отек и признаки воспаления, а также участки повреждения сосудов и возможного микроангиопатического процесса, характерного для диабетической нефропатии. Анализ морфометрических показателей почек крыс второй группы выявил уменьшение толщины коркового вещества на 8,48 %, а мозгового – на 17,65 % (р<0,0016), что может указывать на разрушение нефронов и потерю функциональной массы почки (рис. 2). Количество почечных телец снизилось на 23,08 % (р<0,0001), что указывает на повреждение нефронов. По сравнению с контрольной группой уменьшилась площадь клубочка с капсулой Шумлянского-Боумена на 19,89 % (р<0,0001), а также мочевого Боуменова пространства – на 47,54 % (р<0,0001), что указывает на повреждение фильтрационного аппарата почек. Площадь проксимальных извитых канальцев сократились на 19,01 % (р<0,0001), что свидетельствует об их атрофии и снижении реабсорбционной функции. Площадь собирательных трубочек мозгового вещества почек уменьшилась на 79,14 % (р<0,0001), а петли Генле, напротив, увеличилась на 16,89 % (р<0,02) по сравнению с соответствующими показателями у крыс в контроле (рис. 3).
Рис. 3. Морфометрические показатели мозгового вещества почек крыс в контроле (К), с аллоксан-индуцированным диабетом (Ал) и при введении пробиотического микробного консорциума (Ал+Пб)
Примечания: на графике представлены значения в виде медианы и нижнего и верхнего квартилей (Me (Q25:Q75)); * статистически значимое отличие по критерию Данна относительно значений показателей у крыс контрольной группы (p<0,05).
У крыс третьей группы (Ал+Пб) на гистосрезах почек также зарегистрированы признаки патологических изменении в корковом и мозговом веществах. Однако структура клубочков, их капиллярные сети более сохранны по сравнению со второй группой (Ал). Канальцы имеют меньший просвет, что указывает на улучшение их реабсорбционной способности, уменьшены дистрофические изменения в плотности клеточного состава эпителия канальцев. Снижен уровень отека и воспалительных изменений в интерстициальном пространстве по сравнению с гистосрезом почек крыс во второй группе (см. рис. 1).
Анализ морфометрических показателей почек крыс третьей группы выявил, что толщина коркового вещества была на уровне контрольных показателей. Площадь клубочка с капсулой Шумлянского-Боумена и Боуменова пространства увеличились на 17,63 % (р<0,0001) и 47,25 % (р<0,0001) соответственно по сравнению с контролем (рис. 2), что свидетельствует об улучшении фильтрации. Количество почечных телец также частично восстановилось, увеличившись на 15,00 % (р<0,0016) по сравнению со второй группой (Ал). Также отмечено увеличение площади проксимальных (на 43,65 %; р<0,0001) и дистальных (на 30,06 %; р<0,0001) извитых канальцев по сравнению с контролем, что говорит о восстановлении их функции. Состояние собирательных трубочек также улучшилось (площадь приблизилась к контрольным значениям), что говорит о нормализации экскреторной функции (рис. 3).
Полученные данные подтверждают, что аллоксан-индуцированный сахарный диабет вызывает выраженные морфологические и морфометрические нарушения в почечной ткани, характерные для диабетической нефропатии. У крыс второй группы выявлены признаки выраженной гломерулярной деструкции: уменьшение площади клубочков, сужение Боуменова пространства, расширение канальцев, вакуолизация эпителия и наличие интерстициального отека. Эти изменения соответствуют описанным в ряде работ, где показано, что хроническая гипергликемия приводит к развитию микроангиопатий, деструкции фильтрационного барьера, потере нефронов и снижению реабсорбционной функции почек [13, 14].
Уменьшение количества почечных телец, а также снижение толщины коркового вещества и площади фильтрационного аппарата (капсула Боумена, мочевое пространство) указывает на повреждение не только сосудистого, но и функционального компонента нефронов. Снижение площади и диаметра проксимальных канальцев подтверждает нарушение их реабсорбционной способности, что является ключевым проявлением диабетической тубулопатии [15].
На фоне введения ПМК в модели аллоксанового диабета у крыс третьей группы наблюдается частичное восстановление гистоархитектоники почечной ткани. Улучшение морфометрических показателей (увеличение площади клубочков, мочевого пространства, восстановление толщины коркового вещества и диаметра канальцев) свидетельствует об умеренном нефропротекторном эффекте ПМК. Это согласуется с результатами современных исследований, в которых описывается положительное влияние пробиотических штаммов на почечную функцию, связанное с уменьшением воспаления, снижением системной эндотоксикемии и улучшением барьерной функции кишечника [10, 16].
Снижение уровня интерстициального отека и уменьшение дистрофии канальцев у крыс третьей группы можно объяснить противовоспалительным и антиоксидантным действием метаболитов ПМК, таких как короткоцепочечные жирные кислоты (в частности бутират), которые способны модулировать иммунный ответ, снижать окислительный стресс и улучшать метаболизм [17].
Таким образом, результаты настоящего исследования показывают, что введение ПМК оказывает частичный нефропротекторный эффект, проявляющийся в улучшении морфологических и функциональных показателей почек.
ЗАКЛЮЧЕНИЕ
Проведённое экспериментальное исследование позволило установить, что аллоксан-индуцированный СД у крыс вызывает выраженные морфологические и морфометрические изменения в почечной ткани, соответствующие признакам диабетической нефропатии. Выявлены повреждения клубочкового аппарата, уменьшение площади Боуменова пространства, расширение канальцев, дистрофия эпителия и интерстициальный отёк. Эти изменения указывают на нарушение фильтрационной и реабсорбционной функций нефронов.
На фоне введения пробиотического микробного консорциума в модели аллоксанового диабета у животных зафиксировано частичное восстановление морфоархитектоники почечной ткани. Отмечено увеличение площади клубочков и мочевого пространства, восстановление толщины коркового вещества и нормализация параметров проксимальных и дистальных канальцев. Снижение степени отёка и дистрофии канальцевого эпителия может быть связано с противовоспалительным и антиоксидантным действием метаболитов пробиотических штаммов.
Полученные данные свидетельствуют об умеренно выраженном нефропротекторном эффекте пробиотического микробного консорциума, проявляющемся на уровне морфометрических показателей почек. Это подтверждает перспективность применения пробиотических штаммов как дополнительного средства немедикаментозной коррекции диабетических осложнений, в том числе – в рамках профилактики и терапии начальных стадий диабетической нефропатии.
Работа выполнена на оборудовании ЦКП «Экспериментальная физиология и биофизика» и ЦКП «Молекулярная биология» Ордена Трудового Красного Знамени Медицинский институт им. С. И. Георгиевского в рамках инициативной темы № АААА-А21-121011990099-6 «Физиологические механизмы биологического действия факторов разной природы и интенсивности» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского».
Список литературы
- Корнева Е. А. Диабетическая нефропатия: патогенез, диагностика и подходы к терапии / Е. А. Корнева // Медицинский совет. – 2020. – № 2. – С. 14–20.
- Котова М. Е. Морфологическая характеристика почек при моделировании сахарного диабета у белых крыс / М. Е. Котова // Вестник новых медицинских технологий. – 2016. – Т. 23, № 1. – С. 112–115.
- Полякова А. М. Влияние пробиотиков на морфофункциональные изменения почек при экспериментальном сахарном диабете / А. М. Полякова, Е. В. Орлова // Вопросы биологической, медицинской и фармацевтической химии. – 2022. – № 1. – С. 47–52.
- Navarro-González J. F. The role of inflammatory cytokines in diabetic nephropathy / J. F. Navarro-González, C. Mora-Fernández // Journal of the American Society of Nephrology. – 2011. – Vol. 21(8). – P. 1131–1142. – doi:10.1681/ASN.2010020227.
- Forbes J. M. Mechanisms of diabetic complications / J. M. Forbes, M. E. Cooper // Physiological Reviews. – 2008. – Vol. 88(1). – P. 137–179. – doi:10.1152/physrev.00045.2006.
- Lenzen S. The mechanisms of alloxan- and streptozotocin-induced diabetes / S. Lenzen // Diabetologia. – 2008. – Vol. 51. – P. 216–226. – doi:10.1007/s00125-007-0886-7.
- Andrade-Oliveira V. Adipokines as drug targets in diabetes and underlying disturbances / V.Andrade-Oliveira, N. S. Câmara, P. M. Moraes-Vieira // Journal of Diabetes Research. – 2015. – Vol. 2015. – Article ID 681612. – doi:10.1155/2015/681612.
- Kahleova H. Vegetarian diets in the prevention and treatment of type 2 diabetes / H. Kahleova, T. Pelikanova // Journal of the American College of Nutrition. – 2011. – Vol. 30(5). – P. 400–408. – doi:10.1080/07315724.2011.10719996.
- Ruan Y. The gut microbiome, probiotics and kidney diseases / Y. Ruan, J. Sun, J. He, F. Chen // Frontiers in Medicine. – 2022. – Vol. 9. – Article 889888. – doi:10.3389/fmed.2022.889888.
- Miraghajani M. Probiotic supplementation and kidney function in diabetic nephropathy: a randomized, double-blind, placebo-controlled trial / M. Miraghajani, P. Dehghan, N. Rafie [et al.] // Journal of Functional Foods. – 2021. – Vol. 86. – Article 104714. – doi:10.1016/j.jff.2021.104714.
- Данилова И. Г. Способ моделирования аллоксанового диабета / И. Г. Данилова, И. Ф. Гетте: Патент на изобретение № 2534411; заявл. 27.11.2014; опубл. 27.11.2014. – Бюл. № 33.
- Мустафина Л. Р. Частный курс гистологии: учебное пособие: в 2 частях / Л. Р. Мустафина, А. В. Герасимов, А. В. Потапов [и др.] / Томск: СибГМУ. – 2022. – С. 169.
- Киселев И. В. Морфологические изменения в почках при диабетической нефропатии у экспериментальных животных / И. В. Киселев, Е. И. Черкасова, И. А. Жукова // Морфология. – 2016. – Т. 149, № 4. – С. 73–77.
- Wu H. The role of inflammation and oxidative stress in diabetic kidney disease: updated mechanisms and therapeutic strategies / H. Wu, L. Kong, Y. Cheng, [et al.] // Biomed. Pharmacother. – 2020. – V. 131. – Article ID 110693. doi:10.1016/j.biopha.2020.110693.
- Alicic R. Z. Diabetic Kidney Disease: Challenges, Progress, and Possibilities / R. Z. Alicic, M. T. Rooney, K. R. Tuttle // Clin. J. Am. Soc. Nephrol. – 2017. – V. 12, № 12. – P. 2032–2045. doi:10.2215/CJN.11491116.
- Ranganathan N. Probiotic dietary supplementation in patients with stage 3 and 4 chronic kidney disease: a 6-month pilot scale trial / N. Ranganathan, E. A. Friedman, P. Tam [et al.] // Nutrients. – 2017. – V. 9, № 6. – Article ID 439. doi:10.3390/nu9060439
- Tang W. H. Gut microbiota in cardiovascular health and disease / W. H. Tang, T. Kitai, S. L. Hazen // Circulation Research. – 2017. – V. 120, № 7. – P. 1183–1196. doi:10.1161/circresaha.117.309715
THE EFFECT OF A PROBIOTIC MICROBIAL CONSORTIUM ON RENAL TISSUE IN RATS WITH ALLOXAN-INDUCED DIABETES
Dzheldubaeva E. R., Yarmolyuk N. S., Rzhevskaya V. S., Tumanyants K. N., Nazyrova L. E.
V. I. Vernadsky Crimean Federal University, Simferopol, Russian Federation
E-mail: delviza@mail.ru
Diabetic nephropathy is one of the most severe and widespread complications of diabetes mellitus. It is characterized by damage to the kidney’s filtration apparatus, structural destruction of glomeruli and tubules, inflammation, and progressive renal failure. Considering the multifactorial pathogenesis of this condition, studies on non-pharmacological approaches to its correction, including the use of probiotic microbial consortia (PMC) with anti-inflammatory, antioxidant, and metabolically active properties, are becoming increasingly relevant.
The aim of this study was to investigate morphometric and histological changes in kidney tissue in rats with alloxan-induced diabetes and to evaluate the nephroprotective effect of PMC. The experiment involved 30 male Wistar rats divided into three groups: control, diabetic, and diabetic with PMC administration. Diabetes mellitus was induced via intraperitoneal injections of alloxan at a dose of 100 mg/kg, administered three times. Rats in the third group received a 1 % solution of PMC intragastrically for 21 days. The consortium included the following strains: Lactobacillus parabuchneri, L. plantarum, L. acidophilus, Enterococcus faecium, and Brettanomyces bruxellensis.
Histological and morphometric analysis revealed significant nephron damage in diabetic rats, including thinning of the renal cortex, a reduced number of renal corpuscles, glomerular destruction, tubular atrophy, and interstitial edema. In rats treated with PMC, partial restoration of renal tissue architecture was observed, including improved glomerular condition, normalized tubular size, reduced inflammatory changes, and an increased number of functional nephrons.
The findings confirm a moderately expressed nephroprotective effect of the probiotic microbial consortium, demonstrated by improved morphological and functional kidney parameters in the setting of diabetic nephropathy. These results are consistent with current understanding of the systemic metabolic impact of probiotics and support their potential use as an adjunct therapy in the management of diabetic complications.
Keywords: alloxan, diabetic nephropathy, kidneys, probiotic microbial consortium, morphometry, rats, nephroprotective effect.
References
- Korneva E. A. Diabetic nephropathy: pathogenesis, diagnostics and treatment approaches, Medical Council, 2, 14 (2020).
- Kotova M. E. Morphological characteristics of the kidneys in modeling diabetes mellitus in white rats, Bulletin of New Medical Technologies, 23(1), 112 (2016).
- Polyakova A. M., Orlova E. V. The effect of probiotics on morphofunctional changes in the kidneys in experimental diabetes mellitus, Issues of Biological, Medical and Pharmaceutical Chemistry, 1, 47 (2022).
- Navarro-González J. F., Mora-Fernández C. The role of inflammatory cytokines in diabetic nephropathy, J. Am. Soc. Nephrol., 21(8), 1131 (2011). doi: 10.1681/ASN.2010020227.
- Forbes J. M., Cooper M. E. Mechanisms of diabetic complications, Physiol. Rev., 88(1), 137 (2008). doi: 10.1152/physrev.00045.2006.
- Lenzen S. The mechanisms of alloxan- and streptozotocin-induced diabetes, Diabetologia, 51, 216 (2008). doi: 10.1007/s00125-007-0886-7.
- Andrade-Oliveira V., Câmara N. S., Moraes-Vieira P. M. Adipokines as drug targets in diabetes and underlying disturbances, J. Diabetes Res., 2015, Article ID 681612. doi: 10.1155/2015/681612.
- Kahleova H., Pelikanova T. Vegetarian diets in the prevention and treatment of type 2 diabetes, J. Am. Coll. Nutr., 30(5), 400 (2011). doi: 10.1080/07315724.2011.10719996.
- Ruan Y., Sun J., He J., Chen F. The gut microbiome, probiotics and kidney diseases, Front. Med., 9, Article 889888 (2022). doi: 10.3389/fmed.2022.889888.
- Miraghajani M., Dehghan P., Rafie N., et al. Probiotic supplementation and kidney function in diabetic nephropathy: a randomized, double-blind, placebo-controlled trial, J. Funct. Foods, 86, Article 104714 (2021). doi: 10.1016/j.jff.2021.104714.
- Danilova I. G., Gette I. F. Method for modeling alloxan diabetes. Patent No. 2534411 (Filed 27.11.2014; Published 27.11.2014), Bulletin No. 33.
- Mustafina L. R., Gerasimov A. V., Potapov A. V., et al. Special Course of Histology: Textbook in 2 Parts, Tomsk: Siberian State Medical University, 169 p. (2022).
- Kiselev I. V., Cherkasova E. I., Zhukova I. A. Morphological changes in kidneys in diabetic nephropathy in experimental animals, Morphology, 149(4), 73 (2016).
- Wu H., Kong L., Cheng Y., et al. The role of inflammation and oxidative stress in diabetic kidney disease: updated mechanisms and therapeutic strategies, Biomed. Pharmacother., 131, Article ID 110693 (2020). doi: 10.1016/j.biopha.2020.110693.
- Alicic R. Z., Rooney M. T., Tuttle K. R. Diabetic Kidney Disease: Challenges, Progress, and Possibilities, Clin. J. Am. Soc. Nephrol., 12(12), 2032 (2017). doi: 10.2215/CJN.11491116.
- Ranganathan N., Friedman E. A., Tam P., et al. Probiotic dietary supplementation in patients with stage 3 and 4 chronic kidney disease: a 6-month pilot scale trial, Nutrients, 9(6), Article ID 439 (2017). doi: 10.3390/nu9060439.
- Tang W. H., Kitai T., Hazen S. L. Gut microbiota in cardiovascular health and disease, Circ. Res., 120(7), 1183 (2017). doi: 10.1161/circresaha.117.309715.