Ученые записки Крымского федерального университета имени В. И. Вернадского
Биология. Химия. Том 11 (77). 2025. № 2. С. 303–312.
УДК 591.5:579.222+57.084
DOI 10.29039/2413-1725-2025-11-2-303-312
ВЛИЯНИЕ ПРОБИОТИЧЕСКОГО МИКРОБНОГО КОНСОРЦИУМА НА ТРЕВОЖНОСТЬ КРЫС С АЛЛОКСАН-ИНДУЦИРОВАННЫМ САХАРНЫМ ДИАБЕТОМ
Ярмолюк Н. С., Джелдубаева Э. Р., Ржевская В. С., Туманянц К. Н., Аединова Д. З.
ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», Симферополь, Республика Крым, Россия
E-mail: nat_yarm@mail.ru
В работе представлено экспериментальное исследование влияния пробиотического микробного консорциума (ПМК) на уровень тревожности у крыс с аллоксан-индуцированным сахарным диабетом. Тревожность оценивалась с использованием поведенческого теста «приподнятый крестообразный лабиринт», являющегося методом оценки эмоционального состояния лабораторных животных. Результаты показали, что введение аллоксана вызывает достоверное увеличение индекса тревожности на всех сроках наблюдения, что свидетельствует о развитии нейропсихологических нарушений на фоне диабета. Применение ПМК приводило к частичному снижению тревожности у экспериментальных животных, что связано с нейропротекторным, противовоспалительным и антиоксидантным действием пробиотиков, опосредованным через ось «кишечник–мозг».
Ключевые слова: пробиотический микробный консорциум, аллоксан-идуцированный сахарный диабет, индекс тревожности, крысы.
ВВЕДЕНИЕ
Сахарный диабет (СД) представляет собой группу хронических метаболических заболеваний, характеризующихся не только гипергликемией, но и развитием вторичных неврологических и психоэмоциональных нарушений [1]. В наших предыдущих работах показано, что у крыс с аллоксановым диабетом статистически значимо уменьшается продолжительность поведенческих реакций (общей активности, стереотипного движения, средней скорости, общей пройденной дистанции и пр.) в тесте «инфракрасный актиметр» по сравнению с контрольной группой [2]. Как показано в ряде других исследований, у пациентов и экспериментальных животных с диабетом значительно повышается уровень тревожности и депрессивноподобного поведения [2, 3].
Известно, что одной из причин психоэмоциональных расстройств при диабете считается хронический воспалительный процесс и нарушение функции оси «микробиом–кишечник–мозг» [4]. Ряд исследований продемонстрировали, что микробиота кишечника играет важную роль при СД второго типа [5]. В работе L. Zhang и соавт. [6] показано, что симптомы у пациентов с СД можно улучшить, модифицировав микробиоту кишечника, что помогает обратить вспять нарушение толерантности к глюкозе и уровня глюкозы натощак при преддиабете. Изменения в составе кишечной микробиоты оказывают влияние на синтез нейротрансмиттеров, иммунную регуляцию и барьерную функцию кишечника, что в свою очередь связано с формированием тревожных и депрессивных состояний [7].
По мнению многих авторов, тревожность, как компонент психоэмоционального стресса, может влиять на возникновение СД второго типа [8], приводя к развитию метаболического синдрома [9, 10] и инсулинорезистентности [11, 12], а также может предшествовать развитию депрессии [2], что подчеркивает важность выявления тревожных расстройств.
Применение пробиотических микробных консорциумов (ПМК) рассматривается как перспективный метод коррекции нарушений поведения и эмоционального фона при метаболических заболеваниях. По данным исследований введение пробиотиков способствует нормализации микробиоты, снижению воспаления и улучшению показателей эмоционального состояния у животных с экспериментальным диабетом [13, 14].
Однако влияние ПМК на уровень тревожности при аллоксан-индуцированном диабете остаётся недостаточно изученным. Нет исследований оценки уровня тревожности с помощью валидных поведенческих тестов, таких как приподнятый крестообразный лабиринт (ПКЛ) – метода, который широко применяется для количественной оценки тревожного поведения у лабораторных животных [15]. Большинство работ посвящено исследованию пробиотиков в моделях СД второго типа, в то время как особенности поведенческих изменений при инсулинодефицитных состояниях требуют дальнейшего изучения.
В связи с вышеизложенным, целью данного исследования было изучение тревожности крыс при введении ПМК в модели аллоксан-индуцированного СД.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнялась в Центре коллективного пользования научным оборудованием «Экспериментальная физиология и биофизика» при кафедре физиологии человека и животных и биофизики в рамках программы исследований № АААА-А21-121011990099-6 «Физиологические механизмы биологического действия факторов разной природы и интенсивности» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского». Эксперимент был выполнен на белых половозрелых крысах-самцах линии Wistar, специально выведенные для лабораторных исследований. Общая выборка составила 30 здоровых крыс-самцов массой 260–300 г., со средней двигательной активностью, которые, согласно литературным данным [16], составляют большинство в популяции и, соответственно, у них развивается наиболее типичная реакция на любое воздействие.
Экспериментальные животные были разделены на три группы по 10 особей в каждой (рис. 1). Крысы первой группы «Контроль» (К) содержались в стандартных условиях вивария. Животным второй (Ал) и третьей (Ал+Пб) групп моделировали СД путем трехкратного внутрибрюшинного введения аллоксана, растворенного в физиологическом растворе, в количестве по 10 мг/100 г через 24 часа трехкратно [17]. В ходе исследования для выявления СД осуществлялся мониторинг уровня глюкозы в крови из надреза на хвосте крыс с помощью глюкометра «iCheck». Крысам третьей группы давали 1 % раствор ПМК, который вводили животным интрагастрально, используя оральный зонд для кормления мелких грызунов. Кратность введения ПМК один раз в сутки на протяжении 21 дня в виде 1 % раствора в дозе 81gКОЕ/мл, которая в пересчёте на массу тела крысы соответствует максимальной дозе 3 мл [18]. Крысам первой (К) и второй (Ал) групп вводили эквивалентный объем питьевой воды.

Рис 1. Схема проведения эксперимента.
Все манипуляции с крысами в ходе исследования проводились в соответствии с требованиями разработки и реализации доклинических исследований, а также с соблюдением этических норм и требований по гуманному отношению к подопытным животным.
Синтез исследуемого ПМК проводился на кафедре ботаники и физиологии растений и биотехнологии ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского» под руководством Ржевской В. С. В состав микробного консорциума вошли следующие штаммы пробиотических микроорганизмов: Lactobacillus parabuchneri ВКМ В-3553D, Lactobacillus plantarum ВКМ В-3552D, Lactobacillus acidophilus ВКМ В-3563D, Enterococcus faecium ВКМ В-3551D, Brettanomyces bruxellensis ВКМ Y-3064D. Все использованные штаммы депонированы во Всероссийской коллекции микроорганизмов (ВКМ). Биологическая концентрация бактерий ПМК составила 1,3∙109 КОЕ.
Исследование тревожности проводили в поведенческом тесте «Приподнятый крестообразный лабиринт» (ПКЛ), являющийся одной из наиболее информативных методик, которая может точно оценить нейротропные эффекты травмирующих факторов окружающей среды. В нашем исследовании ПКЛ представляет собой конструкцию, которая состоит из центральной площадки, а также двух «открытых рукавов» и двух «закрытых рукавов» с открытым верхом размерами 50х50 см, расположенных перпендикулярно друг другу. Высота над полом составляет 1 м.
В начале эксперимента каждое животное помещали в центр лабиринта, лицом к одному из открытых рукавов. Поведенческая активность крысы регистрировалась в течение 3 минут с помощью видеосистемы.
Автоматизированный анализ поведения осуществлялся с использованием программы EthoVision XT (Noldus, Нидерланды), которая автоматически анализирует данные, в том числе время пребывания, количество заходов животного в открытых и закрытых рукавах, а также длительность нахождения в центральной зоне.
Для количественной оценки тревожности рассчитывали индекс тревожности (ИТ) по формуле [15]:
ИТ= время в закрытых рукавах, с / общее время теста (180 с)
Низкий индекс тревожности (ближе к 0) свидетельствует о снижении уровня тревожности и большей исследовательской активности.
Статистическая обработка данных проводилась с использованием прикладного программного документа «GraphPad Prism 8» (GraphPad Software, Inc., США) и «Microsoft Excel 2016» (Microsoft Corp., США). Оценка достоверного уровня различий между экспериментальными группами проводилась с применением непараметрического критерия Краскелла-Уолиса. Достоверными показателями считаются показатели меньше р<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
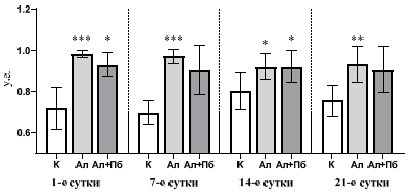
Анализ результатов исследования показал, что на протяжении всего эксперимента отмечается увеличение ИТ во всех экспериментальных группах (рис. 2). Так, во второй группе (Ал) на 1-е сутки отмечается увеличение ИТ на 35,6 % (p<0,001) по сравнению с контролем, что указывает на значительный рост тревожности. Это может быть связано с острым стрессовым ответом организма на введение аллоксана, а также с возникновением гипергликемии и нейротоксического эффекта. На 7-е сутки ИТ вырос на 38,0 % (p<0,001), относительно контрольных значений, что свидетельствует о продолжающихся нарушениях в организме. К этому моменту у крыс могут появляться более выраженные метаболические нарушения, такие как дисфункция центральной нервной системы. На 14-е и 21-е сутки изучаемый показатель увеличился на 16,6 % (p<0,01) и 28,0 % (p<0,01) соответственно по сравнению с контрольной группой, что может коррелировать с хроническим воздействием аллоксана и накоплением повреждений в организме. При этом следует отметить, что наибольший ИТ отмечается на 7-е сутки, а наименьший на 14-е (рис. 2).
Данные результаты у крыс второй группы в модели аллоксанового диабета согласуются с литературными данными, где показано, что аллоксан имеет выраженное повреждающее действие на β-клетки поджелудочной железы, вызывая гипергликемию, окислительный стресс и нарушения работы центральной нервной системы [19, 1]. Как отмечено в исследованиях Yiğit S. и соавт. [3], гипергликемия способствует нарушению целостности гематоэнцефалического барьера, активации воспалительных каскадов и дефициту нейротрансмиттеров, что ведёт к усилению тревожности. Немаловажными факторами являются вызванная гипергликемия и недостаток инсулина, которые могут привести к дефициту энергии в клетках мозга, что также способствует повышению тревожности.
Таким образом, наши данные подтверждают существующие литературные сведения о патогенетической роли гипергликемии и окислительного стресса в развитии тревожных расстройств при диабете. Хроническая гипергликемия, окислительный стресс и нейротоксическое действие аллоксана приводят к стойкому нарушению эмоционального состояния крыс, выражающемуся в повышении тревожности.
Рис. 2. Изменение индекса тревожности крыс с аллоксан-индуцированным диабетом и при дополнительном введении пробиотического микробного консорциума в тесте «Приподнятый крестообразный лабиринт».
Примечание: * – достоверность различий по критерию Данна относительно значений контрольной группы (*– p<0,05; ** – p<0,01; *** – p<0,001)
При дополнительном введении ПМК в модели аллоксаннового диабета у животных третьей группы (Ал+Пб) на 1-е сутки наблюдается увеличение ИТ на 27,3 % (p<0,05) относительно значений в контрольной группе, что в свою очередь меньше на 8,3 %, чем в группе Ал, что говорит о защитном эффекте ПМК, которому удается частично компенсировать негативное влияние аллоксана. На 7-е и 21-е сутки отмечается лишь тенденция к увеличению ИТ на 32,3 % и 24,0 % соответственно относительно показателей контрольной группы. Следовательно, отмечается стабилизация уровня тревожности, но она все еще остается на более высоком уровне по сравнению с контролем. На 14-е сутки введения ПМК отмечается наибольшее увеличение ИТ в третьей группе животных на 20,5 % (p<0,01) относительно данных контрольной группы. Это указывает на продолжающееся отрицательное воздействие аллоксана, но с меньшей силой, чем во второй группе (рис. 2). Это согласуется с данными Ghahremani Z. и соавт. [13], согласно которым пробиотики способны снижать уровень тревожности за счёт нормализации оси «кишечник–мозг», уменьшения уровня провоспалительных цитокинов и коррекции нейротрансмиттерного обмена. Именно восстановление микробного баланса является ключевым механизмом снижения тревожности, поскольку изменения в микробиоме кишечника обусловлено активацией воспалительных путей и нарушением синтеза серотонина и гамма-аминомасляной кислоты [7]. Показано, что ПМК способствует восстановлению кишечной микробиоты, снижению уровня системного воспаления и улучшению функциональной активности нейрональных сетей, вовлечённых в регуляцию эмоций [14, 4]. ПМК могут восстанавливать баланс кишечной микробиоты, что может способствовать уменьшению уровня тревожности, так как дисбиоз зачастую связан с повышенной тревожностью и депрессией.
Мозг и кишечник взаимодействуют в двустороннем режиме посредством иммунных, неврологических и эндокринных путей, что называется ось кишечник–головной мозг. Недавние исследования микробиоты кишечника как посредника в этом взаимодействии предоставили растущее количество научных доказательств того, что микробиота кишечника влияет на стресс и эмоциональные реакции, а также на расстройства, связанные со стрессом [20]. Между кишечником и мозгом существуют хорошо изученные двусторонние каналы связи, включающие нервные, эндокринные и воспалительные механизмы. Связь по этим каналам может регулироваться изменениями проницаемости кишечной стенки и гематоэнцефалического барьера [21, 22]. Пробиотики могут улучшать работу гематоэнцефалического барьера и снижать нейровоспаление, что защищает нейроны от повреждений. Это очень важно при диабете, так как гипергликемия и окислительный стресс могут отрицательно влиять на нервные клетки.
Таким образом, ПМК обладает антиоксидантными, противовоспалительными и нейропротекторными свойствами, что помогает частично возмещать отрицательное воздействие аллоксана. Это проявлялось в большей предпочтительности находиться в «открытых рукавах» и центре крестообразного лабиринта, что объясняет меньший уровень тревожности у крыс группы Ал+Пб по сравнению с крысами в группе Ал.
Исследования в данной области имеют важное значение, так как они свидетельствуют о том, что ПМК оказывают умеренно анксиолитическое действие, благодаря взаимосвязи между кишечником и головным мозгом. Понимание этих взаимосвязей открывает новые перспективы для разработки стратегий лечения, основанных на модуляции состава и функций микробиома.
ЗАКЛЮЧЕНИЕ
Проведено исследование уровня тревожности у крыс при введении пробиотического микробного консорциума в модели аллоксан-индуцированного диабета. Моделирование аллоксан-индуцированного сахарного диабета у крыс приводит к значительному и стойкому повышению уровня тревожности, что подтверждается достоверным увеличением индекса тревожности на всех сроках наблюдения по сравнению с контрольной группой.
Введение пробиотического микробного консорциума животным с аллоксановым диабетом частично нивелировало тревожные расстройства – наблюдается умеренное снижение индекса тревожности по сравнению с диабетической группой, что свидетельствует о модулирующем действии ПМК на поведение. Полученные данные согласуются с современными представлениями о влиянии микробиоты кишечника на психоэмоциональное состояние через ось «микробиом–кишечник–мозг», подтверждающими способность пробиотиков снижать уровень тревожности и нейровоспаления.
Таким образом, полученные результаты свидетельствуют о перспективности применения пробиотических микробных консорциумов как средства поведенческой коррекции тревожных нарушений при диабете первого типа.
Работа выполнена на оборудовании ЦКП «Экспериментальная физиология и биофизика» в рамках инициативной темы № АААА-А21-121011990099-6 «Физиологические механизмы биологического действия факторов разной природы и интенсивности» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского».
Список литературы
- Strachan M. W. J. Cognitive function, depression, and quality of life in patients with type 1 diabetes / M. W. J. Strachan I. J., Deary, F. M. E. Ewing, B. M. Frier // Diabetes Care. – 2011. – Vol. 24, № 4. – P. 775–778.
- Ярмолюк Н. С. Влияние пробиотического микробного консорциума на поведенческие реакции крыс с аллоксаниндуцированным сахарным диабетом / Н. С. Ярмолюк, Э. Р. Джелдубаева, В. С. Ржевская [и др.] // Ученые записки Крымского федерального университета имени В. И. Вернадского. Биология. Химия. – 2025. – Т. 11, № 1. – С. 260–272.
- Yiğit S. Effects of diabetes mellitus on anxiety and depression levels / S. Yiğit, E. Yiğit, M. Bozkurt // Neurosciences (Riyadh). – 2019. – Vol. 24, № 2. – P. 103–107.
- Cryan J. F. Mind-altering microorganisms: the impact of the gut microbiota on brain and behavior / J. F. Cryan, T. G. Dinan // Nature Reviews Neuroscience. – 2012. – Vol. 13. – P. 701–712.
- Halmos T. Physiological patterns of intestinal microbiota. The role of dysbacteriosis in obesity, insulin resistance, diabetes and metabolic syndrome / T. Halmos, I. Suba // Orv Hetil. – 2016. – V. 157, № 5. – P. 13–22.
- Zhang L. Microbiota and Type 2 Diabetes Mellitus: Association, Mechanism, and Translational Applications / L. Zhang, J. Chu, W. Hao [et al.] // Mediators Inflamm. – 2021. – V. 7. – P. 16–18.
- Dinan T. G., Gut–brain axis in 2016: Brain–gut–microbiota axis — mood, metabolism and behaviour / T. G. Dinan, J. F. Cryan // Nature Reviews Gastroenterology & Hepatology. – 2017. – V. 14. – P. 69–70.
- Гарганеева Н. П. Психосоциальные факторы, тревожные и депрессивные расстройства у пациентов с ишемической болезнью сердца: проблемы коморбидности и прогнозирования / Н. П. Гарганеева, Н. А. Корнетов, М. Ф. Белокрылова // Российский кардиологический журнал. – 2020. – T. 25, № 9. – C. 26–32.
- Petrlova B. Depressive disorders and the matabolic syndrome of the insulin resistance / B. Petrlova, H. Rosolva, Z Al // Semin. – 2004. – V. 4. – P. 161–165.
- Skilton M. R., Associations between anxiety, depression, and the metabolic syndrome / M. R. Skilton, P. Moulin, J. L. Terra [et al.] // Biol. Psychiatry. – 2007. – V. 62. – P. 251–1257.
- Bjorntorp P. Metabolic Implications of Body Fat Distribution / P. Bjorntorp // Diabetes Care. – 1991. – V. 14, № 12. – P. 1132–1143.
- Boyle S. Depressive Symptoms, Race, and Glucose Concentrations / S. Boyle R. Surwit [ et al.] // Diabetes Care. – 2007. – V. 3. – P. 567–578.
- Ghahremani Z. The protective effect of probiotic supplementation on depression, anxiety and stress in diabetes mellitus patients. A randomized double-blind clinical trial / Z. Ghahremani, M. Shabani, M. Ghanbarabadi [et al.] // Journal of Functional Foods. – 2021. – V. 85. – P. 104635.
- Sanchez M. Probiotics and prebiotics in the management of depressive symptoms: A systematic review / M. Sanchez, C. Darimont, V. Drapeau // Nutrients. – 2017. – V. 9, № 11. – P. 1220.
- Хусаинов Д. Р. Шестидневная динамика индекса тревожности высокотревожных крыс-самок при блокаде МАО-В / Д. Р Хусаинов, А. Н. Лукьянцева, Н. С. Трибрат [и др.] // Siberian Journal of Life Sciences and Agriculture. – 2023. – Т. 15, № 6. – С. 29–50.
- Чуян Е. Н. Влияние миллиметровых волн нетепловой интенсивности на развитие гипокинетического стресса у крыс с различными индивидуальными особенностями: Автореф. дис. канд. биол. наук. / Чуян Е. Н. – Симферополь, 1992. – С. 25.
- Данилова И. Г. Способ моделирования аллоксанового диабета / И. Г. Данилова, И. Ф. Гетте: Патент на изобретение № 2534411; заявл. 27.11.2014; опубл. 27.11.2014. – Бюл. № 33.
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под общей ред. член-корр. РАМН, проф. Р.У. Хабриева. – 2-изд., перераб. и доп. – М.: ОАО «Издательство «Медицина», 2005. – 832 с.
- Szkudelski T. The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas / Szkudelski T. // Physiological Research. – 2001. – V. 50. – P. 537–546.
- Izuno S. Role of Gut Microbiota in the Pathophysiology of Stress-Related Disorders: Evidence from Neuroimaging Studies / S. Izuno, K. Yoshihara, N. Sudo // Ann Nutr Metab. – 2021. – V. 77. – P. 4–10.
- Osadchiy V. The Gut-Brain Axis and the Microbiome: Mechanisms and Clinical Implications / V. Osadchiy, C. R. Martin, E. A. Mayer // Clin Gastroenterol Hepatol. – 2019. –Vol. 17, № 2. – P. 322–332.
- Sanchez M. Probiotics and prebiotics in the management of depressive symptoms: A systematic review / M. Sanchez, C. Darimont, V. Drapeau // Nutrients. – 2017. – V. 9, № 11. – P. 1220.
EFFECT OF PROBIOTIC MICROBIAL CONSORTIUM ON ANXIETY IN RATS WITH ALLOXAN-INDUCED DIABETES MELLITUS
Yarmolyuk N. S., Dzheldubaeva E. R., Rzhevskaya V. S., Tumanyants K. N., Aedinova D. Z.
V. I. Vernadsky Crimean Federal University, Simferopol, Russia
E-mail: nat_yarm@mail.ru
Diabetes mellitus is a chronic metabolic disorder that involves not only impaired glucose metabolism but also the development of secondary psychoemotional disturbances, including increased anxiety. Recently, growing attention has been paid to the role of the gut microbiota and the «gut–brain axis» in the pathogenesis of neurological complications of diabetes.
The aim of this study was to evaluate the effect of a probiotic microbial consortium composed of strains of Lactobacillus spp., Enterococcus faecium, and Brettanomyces bruxellensis on the anxiety level of rats with alloxan-induced diabetes mellitus. The diabetic model was reproduced by intraperitoneal administration of alloxan. Anxiety levels were assessed using the elevated plus maze behavioral test on days 1, 7, 14, and 21 after induction of alloxan-induced diabetes. The anxiety index was calculated based on the time the animals spent in the open arms of the maze.
The obtained results demonstrated that in the diabetic model group, the anxiety index was significantly elevated at all observation points compared to the control group, indicating the development of a sustained anxiety-like state. Administration of the probiotic microbial consortium to diabetic rats led to a decrease in anxiety index values across all time points compared to the untreated diabetic group, suggesting partial recovery of emotional status. These findings imply that the probiotic microbial consortium may possess anxiolytic properties mediated through anti-inflammatory effects, correction of microbial dysbiosis, and restoration of gut–brain axis functionality.
Thus, the probiotic microbial consortium can be considered a promising tool for the complex correction of psychoemotional disorders in insulin-deficient forms of diabetes, as well as a preventive approach to anxiety-related conditions associated with neuroinflammation and microbiota imbalance.
Keywords: probiotic microbial consortium, alloxan-induced diabetes mellitus, anxiety index, rats.
References
- Strachan M. W. J., Deary I. J., Ewing F. M. E., Frier B. M. Cognitive function, depression, and quality of life in patients with type 1 diabetes, Diabetes Care, 24, 4, 775 (2011).
- Yarmolyuk N. S. Dzheldubaeva E. R., Rzhevskaya V. S., Tumanyants K. N., Aedinova D. Z. Effect of probiotic microbial consortium on behavioral reactions of rats with alloxanin-induced diabetes mellitus, Scientific Notes of V. I. Vernadsky Crimean Federal University. Biology. Chemistry, 11, 1, 260 (2025).
- Yiğit S., Yiğit E., Bozkurt M. Effects of diabetes mellitus on anxiety and depression levels, Neurosciences (Riyadh), 24, 2, 103 (2019).
- Cryan J. F., Dinan T. G. Mind-altering microorganisms: the impact of the gut microbiota on brain and behavior, Nature Reviews Neuroscience, 13, 701 (2012).
- Halmos T., Suba I. Physiological patterns of intestinal microbiota. The role of dysbacteriosis in obesity, insulin resistance, diabetes and metabolic syndrome, Orv Hetil., 157, 5, 13 (2016).
- Zhang L., Chu J., Hao W., et al. Microbiota and Type 2 Diabetes Mellitus: Association, Mechanism, and Translational Applications, Mediators Inflamm., 7, 16 (2021).
- Dinan T.G., Cryan J. F. Gut–brain axis in 2016: Brain–gut–microbiota axis – mood, metabolism and behaviour, Nature Reviews Gastroenterology & Hepatology, 14, 69 (2017).
- Garganeeva N. P., Kornetov N. A., Belokrylova M. F. Psychosocial factors, anxiety and depressive disorders in patients with ischemic heart disease: problems of comorbidity and prognosis, Russian Cardiology Journal, 25, 9, 26 (2020).
- Petrlova B., Rosolva H., Al Z. Depressive disorders and the matabolic syndrome of the insulin resistance, Semin., 4, 161 (2004).
- Skilton M. R., Moulin P., Terra J. L. et al. Associations between anxiety, depression, and the metabolic syndrome, Biol. Psychiatry, 62, 251 (2007).
- Bjorntorp P. Metabolic Implications of Body Fat Distribution, Diabetes Care., 14, 12, 1132 (1991).
- Boyle S., Surwit R. et al. Depressive Symptoms, Race, and Glucose Concentrations, Diabetes Care, 3, 567 (2007).
- Ghahremani Z., Shabani M., Ghanbarabadi M. et al. The protective effect of probiotic supplementation on depression, anxiety and stress in diabetes mellitus patients. A randomized double-blind clinical trial, Journal of Functional Foods., 85, 104635 (2021).
- Sanchez M., Darimont C., Drapeau V. Probiotics and prebiotics in the management of depressive symptoms: A systematic review, Nutrients., 9, 11, 1220. (2017).
- Khusainov D. R., Lukyantseva A. N., Tribrat N. S. [et al.] Six-day dynamics of anxiety index of highly anxious male rats under MAO-B blockade, Siberian Journal of Life Sciences and Agriculture, 15, 6, 29 (2023).
- Chuyan E. Н. Influence of millimeter waves of non-thermal intensity on the development of hypokinetic stress in rats with different individual characteristics: Author’s abstract of Cand. of Biological Sciences, 25. (Simferopol, 1992).
- Danilova I. G., Gette I. F. Method of modeling alloxan diabetes, Patent for invention No. 2534411; avt. 27.11.2014; publ. 27.11.2014. Bulletin No. 33.
- Manual on experimental (preclinical) study of new pharmacological substances, Under the general editorship of Corresponding Member of the Russian Academy of Medical Sciences, Prof. R. U. Khabriev. – 2 ed., revision and supplement, 832 p. (Moscow: JSC “Publishing House ”Medicine”, 2005).
- Szkudelski T. The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas, Physiological Research., 50, 537 (2001).
- Izuno S., Yoshihara K., Sudo N. Role of Gut Microbiota in the Pathophysiology of Stress-Related Disorders: Evidence from Neuroimaging Studies, Ann Nutr Metab., 77, 4 (2021).
- Osadchiy V., Martin C. R., Mayer E. A. The Gut-Brain Axis and the Microbiome: Mechanisms and Clinical Implications, Clin Gastroenterol Hepatol., 17, 2, 322 (2019).
- Sanchez M., Darimont C., Drapeau V. Probiotics and prebiotics in the management of depressive symptoms: A systematic review, Nutrients., 9, 11, 1220. (2017).