Ученые записки Крымского федерального университета имени В. И. Вернадского
Биология. Химия. Том 11 (77). 2025. № 2. С. 344–351.
УДК 543.544:547.918
DOI 10.29039/2413-1725-2025-11-2-344-351
ДЕТЕКТИРУЮЩИЕ РЕАГЕНТЫ ДЛЯ ТРИТЕРПЕНОВЫХ ГЛИКОЗИДОВ РАСТЕНИЙ СЕМЕЙСТВА АРАЛИЕВЫХ
Гришковец В. И.1, Яковишин Л. А.2
1Институт биохимических технологий, экологии и фармации ФГАОУ ВО «Крымский федеральный университет им. В. И. Вернадского», Симферополь, Россия
2ФГАОУ ВО «Севастопольский государственный университет», Севастополь, Россия
Е-mail: vladgri@ukr.net
Проведена сравнительная оценка эффективности различных детектирующих реагентов с точки зрения предела обнаружения и различий в окраске хроматографических зон для разных рядов тритерпеноидов. Показано, что наиболее эффективными являются детектирующие реагенты на основе фосфорновольфрамовой кислоты с добавками ароматических альдегидов (пара-оксибензальдегида и ванилина). Оценка интенсивности окраски, цвета и оттенка хроматографических пятен и их изменения в процессе проявления хроматограмм позволяет сделать предварительные выводы о природе агликонной части гликозидов.
Ключевые слова: детектирующие реагенты, ТСХ, фосфорновольфрамовая кислота, тритерпеновые гликозиды, Araliaceae.
ВВЕДЕНИЕ
Детектирующие реагенты имеют большое значение в обнаружении и предварительном анализе тритерпеновых гликозидов в растениях. Для первой задачи важен предел обнаружения определенного реагента, а наличие специфической окраски существенно для предварительной оценки их принадлежности к определенному ряду тритерпеноидов.
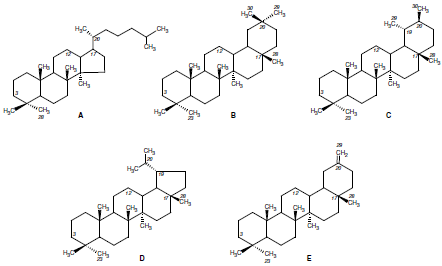
В растениях семейства аралиевых встречаются гликозиды тритерпеноидов следующих рядов: тетрациклические даммаранового ряда и пентациклические олеананового (β-амиринового), урсанового (α-амиринового), лупанового и 30-нор-олеананового ряда (рис. 1) [1].
Рис. 1. Тритерпены, образующие агликоны гликозидов растений семейства аралиевых: даммарановый (A), олеанановый (B), урсановый (C), лупановый (D) и 30-нор-олеанановый (E) ряды.
МАТЕРИАЛЫ И МЕТОДЫ
Выделение и установление строения индивидуальных или хроматографически неразделимых тритерпеновых гликозидов, исследованных в данной работе, детально описано в [1] и оригинальных публикациях, цитируемых в [1]. Даммарановые гликозиды проанализированы в аптечных галеновых препаратах корней женьшеня (настойка корней женьшеня).
Применяли следующие детектирующие растворы: 1) 2 г фосфорно-вольфрамовой кислоты в виде кристаллогидрата (H7[P(W2O7)6]⋅nН2О) и 0,5 г пара-оксибензальдегида в 50 мл смеси CHCl3–C2H5OH (1:1, по объему), 2) 2 г фосфорновольфрамовой кислоты в виде кристаллогидрата (H7[P(W2O7)6]⋅nН2О) и 0,5 г ванилина в 50 мл смеси CHCl3–C2H5OH (1:1, по объему) и 3) 2 г фосфорновольфрамовой кислоты в виде кристаллогидрата (H7[P(W2O7)6]⋅nН2О) в 50 мл 1 М раствора H2SO4.
ТСХ проводили на пластинках Silufol (ЧССР) и Sorbfil (Российская Федерация) марки ПТСХ-П-А-УФ-254 с размерами частиц силикагеля 5–7 мкм (тип сорбента СТХ-1А). Для элюирования использовали системы растворителей CHCl3–CH3OH–25% водный NH3 (100:20:3 и 100:30:5). Пластины после обработки детектирующими реагентами нагревали до 100–120 °С при помощи устройства для сушки пластин УСП-1М («Имид», Россия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В литературе предложено многочисленное количество детектирующих реагентов для тритерпеноидов и их гликозидов [2]. В их основе лежит какая-либо сильная нелетучая минеральная кислота (обычно серная) или ее смесь с солями металлов, являющихся типичными кислотами Льюиса (безводные хлориды алюминия, цинка, олова). Иногда реагент содержит дополнительно спирт и хлороформ. Опробованы и другие соли, не являющиеся типичными кислотами Льюиса – сульфаты кадмия, кобальта, хрома, меди, марганца, никеля и нитрат уранила в сочетании с серной кислотой. Эти реагенты не показали высокой эффективности, однако позволяли различать некоторые тритерпеноиды, а именно отличать гликозиды хедерагенина от гликозидов олеаноловой и эхиноцистовой кислот, то есть различать гликозиды двух наиболее часто встречающихся агликонов олеананового (β-амиринового) ряда [3, 4].
Выделим отдельно еще один тип реагентов, содержащих в качестве сильной минеральной кислоты гетерополикислоты – фосфорномолибденовую, фосфорновольфрамовую или кремневольфрамовую кислоты. Их применение к олеанановым гликозидам аралиевых рассмотрено в работе [5].
Фосфорномолибденовая кислота является реагентом общего назначения, позволяющим кроме терпеноидов детектировать липиды, антиоксиданты и прочие восстанавливающие вещества [2]. Но с тритерпеновыми гликозидами каких-либо явных различий в окраске пятен не обнаруживается, тогда как фосфорновольфрамовая и кремневольфрамовая кислоты дают явно различную окраску хроматографических зон при обработке спиртовыми растворами этих реактивов с последующим нагреванием хроматограмм до 100–120 °С. Предел обнаружения данных реактивов заметно понижается при добавлении серной кислоты, а различия в окраске хроматографических зон и интенсивность окраски еще более усиливаются при добавлении ароматических альдегидов – бензальдегида и, в особенности, пара-оксибензальдегида или ванилина (пара-окси-мета-метоксибензальдегида). Таким образом, в ходе нашей работы выработаны наиболее предпочтительные реагенты с точки зрения предела обнаружения и существенных различий в окраске хроматографических зон гликозидов с разными агликонами одной группы или разных групп. Это 4 % спиртовой или спиртово-хлороформный раствор фосфорновольфрамовой кислоты с добавкой 25 % по отношению к кислоте пара-оксибензальдегида или ванилина и раствор фосфорновольфрамовой кислоты в 1 М растворе серной кислоты.
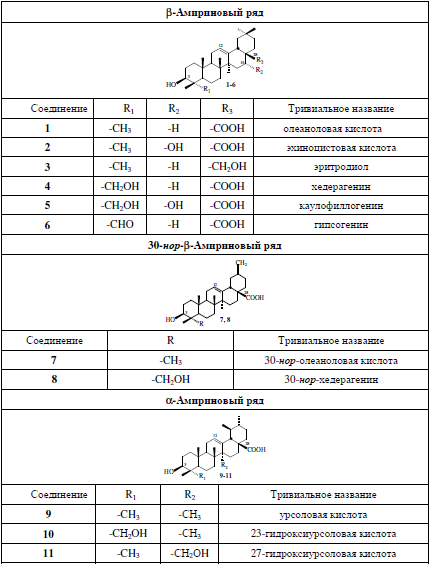
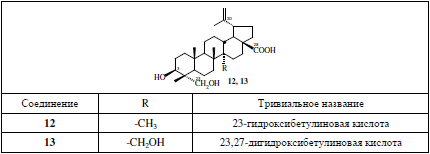
С этими реагентами были протестированы ранее выделенные гликозиды тритерпеноидов вышеуказанных рядов (табл. 1 и 2) – пентациклические олеананового ряда (олеаноловая и эхиноцистовая кислоты, эритродиол, хедерагенин, каулофиллогенин, гипсогенин), урсанового ряда (урсоловая кислота, 23-гидрокси- и 27-гидроксиурсоловые кислоты), лупанового ряда (23-гидроксибетулиновая кислота и 23,27-дигидроксибетулиновая кислота) и пентациклические 30-нор-олеананового ряда (30-нор-олеаноловая кислота и 30-нор-хередагенин) [1]. Кроме того, проанализированы гликозиды тетрациклических тритерпеноидов даммаранового ряда (в аптечных суммарных экстрактах корня женьшеня Panax ginseng).
При этом было замечено, что хроматографические зоны гликозидов β-амиринового ряда, а именно гликозидов олеаноловой (в подавляющем большинстве родов семейства аралиевых), эхиноцистовой кислот (в родах Dizygotheca, Hedera, Oreopanax, Trevesia, Acanthopanax, Fatsia, Cussonia и Tetrapanax) и эритродиола (Hedera) окрашиваются в розовые цвета, тогда как пятна гликозидов хедерагенина (в большинстве родов аралиевых – Hedera, Oreopanax, Trevesia, Kalopanax, Acanthopanax, Eleutherococcus, Schefflera, Fatsia и Cussonia), каулофиллогенина (Hedera) и гипсогенина (Fatsia) проявляются медленнее, вначале буровато-коричневого цвета, а через несколько минут приобретают устойчивую синюю или сине-фиолетовую окраску. При анализе структурных различий этих агликонов становится ясным, что наличие заместителя у метильной группы (С-23) и приводит к смене окраски с розовой на сине-фиолетовую. Эта же закономерность прослеживается и для изученных гликозидов α-амиринового ряда (23-гидроксиурсоловой кислоты) и лупанового (23-гидроксибетулиновая кислота и 23,27-дигидроксибетулиновая кислота) рядов, тогда как добавление гидроксильных групп в иные положения агликонной части приводит лишь к незначительному изменению цветового оттенка пятен. Однако наличие дополнительной 20(29)-двойной связи в агликонах 30-нор-тритерпеноидов (в гликозидах растений родов Hedera, Eleutherococcus, Neopanax и Pseudopanax) приводит к существенному увеличению интенсивности окраски и изменению цвета, так что зоны гликозидов 30-нор-олеаноловой кислоты при проявлении имеют интенсивный пурпурный цвет, а 30-нор-хедерагенина – интенсивный синий.
Интересной особенностью гликозидов лупанового ряда (встречаются в родах Acanthopanax, Oplopanax, Schefflera, Heteropanax, Cussonia и Scheffleropsis) является то, что при их детектировании хроматографические зоны вначале имеют желто-оранжевый цвет и лишь впоследствии приобретают розовые или фиолетовые оттенки.
Гликозиды тритерпеноидов α-амиринового ряда в растениях семейства аралиевых (в видах родов Aralia, Schefflera, Dizygotheca, Oreopanax, Tupidanthus, Scheffleropsis, Pseudopanax, Cussonia и Brassaia) обычно присутствуют в виде изомерных по агликону пар с аналогичными гликозидами β-амиринового ряда и хроматографически практически неразделимы (выявляются при анализе спектров 13С-ЯМР, где различия в химических сдвигов С-атомов кольца Е очень существенны). Но цвет хроматографических зон этих смесей имеет явно иной оттенок, нежели индивидуальных гликозидов β-амиринового ряда, а именно пятна гликозидов урсоловой кислоты, в отличие от гликозидов олеаноловой кислоты, приобретают хорошо заметный кирпично-красный оттенок, а гликозиды 23-гидроксиурсоловой, в отличие от изомерных гликозидов хедерагенина, дают более интенсивный фиолетовый оттенок.
Таблица 1
Структуры агликонов исследованных гликозидов α- и β-амириновых рядов
Таблица 2
Структуры агликонов исследованных гликозидов лупанового ряда
Хроматографические зоны гликозидов даммаранового ряда (в экстрактах корней Panax ginseng) при проявлении реактивами на основе фосфорновольфрамовой кислоты имеют лишь розовые оттенки, так как у них, несмотря на различия в структуре агликонов, всегда отсутствует гидроксильная группа у С-28, который соответствует атому С-23 у агликонов α- и β-амириновых рядов.
Причины появления окраски при использовании детектирующих реагентов на основе серной кислоты и солей с окислительными свойствами подробно рассмотрены в работах [6, 7] в отношении холестерина и сводятся к возникновению сопряженных полиеновых систем, возникающих в результате последовательных окислительных реакций сульфирования-десульфирования и протонирования полиенов с образованием енильных карбокатионов. Продукт красного цвета (λmax около 563 нм), обычно измеряемый в реакции Зака (с солями железа(III)), очевидно, является холестатетраенильным катионом, а сине-зеленый продукт в реакции Либермана–Бухарда (λmax около 620 нм) – пентаенильным катионом. По-видимому, и тритерпеновые гликозиды реагируют аналогично, так как у них подобный углеродный скелет колец А, B, C и лишь кольцо D может отличаться.
Таким образом, оценка интенсивности окраски и цветового оттенка хроматографических зон, а также их изменения в процессе проявления хроматограмм позволяет сделать предварительные выводы о природе агликонной части гликозидов.
ЗАКЛЮЧЕНИЕ
- Проведена сравнительная оценка эффективности различных детектирующих реагентов с точки зрения предела обнаружения и различий в окраске хроматографических зон для разных рядов тритерпеноидов.
- Показано, что наиболее эффективными являются детектирующие реагенты на основе фосфорновольфрамовой кислоты с добавками ароматических альдегидов.
- Оценка интенсивности окраски, цвета и оттенка хроматографических пятен и их изменения в процессе проявления хроматограмм позволяет сделать предварительные выводы о природе агликонной части гликозидов.
Список литературы
- Гришковец В. И. Тритерпеновые гликозиды аралиевых: выделение, установление строения, биологическая активность и хемотаксономическое значение / В. И. Гришковец. – Автореф. дис. … д-ра хим. наук. – Одесса. – 2004. – 36 с.
- Кирхнер Ю. Тонкослойная хроматография в 2 т. Т. 1 / Ю. Кирхнер. – М.: Мир, 1981. – 616 с.
- Яковишин Л. А. Детектирующие реагенты для ТСХ тритерпеновых гликозидов / Л. А. Яковишин // Химия природ. соедин. – 2003. – № 5. – С. 419–420.
- Яковишин Л. А. Использование нитрата уранила и пара-оксибензальдегида для обнаружения тритерпеновых гликозидов при хроматографическом анализе / Л. А. Яковишин // Ученые записки Таврического национального университета им. В. И. Вернадского. Сер. «Биология, химия». – 2005. – Т. 18 (58), № 2. – С. 145–148.
- Яковишин Л. А. Использование гетерополикислот для ТСХ-анализа тритерпеновых гликозидов / Л. А. Яковишин, В. И. Гришковец // Химия природ. соедин. – 2006. – № 2. – С. 196–197.
- Xiong Q. The Liebermann-Burchard reaction: sulfonation, desaturation, and rearrangment of cholesterol in acid / Q. Xiong, W. K. Wilson, J. Pang // Lipids. – 2007. – Vol. 42, № 1. – P. 87–96.
- Burke R. W. Mechanisms of the Liebermann-Burchard and Zak color reactions for cholesterol / R. W. Burke, B. I. Diamondstone, R. A. Velapoldi [et al.] // Clinical Chemistry. – 1974. – Vol. 20, № 7. – P. 794–801.
DETECTION REAGENTS FOR TRITERPENE GLYCOSIDES OF ARALIACEAE PLANTS
Grishkovets V. I.1, Yakovishin L. A.2
1V. I. Vernadsky Crimean Federal University, Simferopol, Crimea Republic, Russia
2Sevastopol State University, Sevastopol, Russia
E-mail: vladgri@ukr.net
A comparative evaluation of the effectiveness of various detecting reagents was carried out in terms of detection limit and differences in the coloration of chromatographic zones for different triterpenoid series. It was shown that the most effective detecting reagents are those based on phosphotungstic acid with the addition of aromatic aldehydes (para-hydroxybenzaldehyde and vanillin) and sulfuric acid.
It was demonstrated that the spots of glycosides from the β-amyrin series – namely oleanolic acid, echinocystic acid, and erythrodiol – are stained pink, whereas the spots of glycosides of hederagenin, caulophyllogenin, and gypsogenin appear more slowly, initially displaying a brownish color and after a few minutes acquiring a stable blue or blue-violet hue. Analysis of the structural differences of these aglycones reveals that the presence of a substituent at the methyl group (C-23) causes the color change from pink to blue-violet. This same pattern is observed for the studied glycosides of the α-amyrin series (23-hydroxyursolic acid) and the lupane series (23-hydroxybetulinic acid and 23,27-dihydroxybetulinic acid), while the addition of hydroxyl groups in other positions of the aglycone portion leads only to minor changes in the color hue of the spots.
The presence of an additional 20(29)-double bond in the aglycones of 30-nortriterpenoids results in a significant increase in color intensity and a change in hue. Thus, glycosides of 30-noroleanolic acid develop an intense purple color, while glycosides of 30-norhederagenin exhibit an intense blue color upon detection.
Glycosides of triterpenoids from the α-amyrin series have chromatographic zone colors that are distinctly different in hue compared to those of the β-amyrin series. Specifically, spots of ursolic acid glycosides, unlike those of oleanolic acid, develop a pronounced brick-red hue, and glycosides of 23-hydroxyursolic acid, unlike their isomeric counterparts of hederagenin, develop a more intense violet hue. An interesting feature of glycosides from the lupane series is that their chromatographic zones initially appear yellow-orange and only later acquire pink or violet shades. Chromatographic zones of glycosides from the dammarane series, when revealed with phosphotungstic acid-based reagents, exhibit only pink shades, as they always lack a hydroxyl group at C-28, despite structural differences in their aglyconеs.
Keywords: detection reagents, TLC, phosphotungstic acid, triterpene glycosides, Araliaceae.
References
- Grishkovets V. I. Triterpene glycosides of Araliaceae: isolation, structure determination, biological activity and chemotaxonomic significance, Author’s abstract of dissertation for academic degree of doctor of chemical sciences, 36 p. (Odessa, 2004). (in Ukr.).
- Kirchner J. G., Thin-layer chromatography, in 2 vol., Vol. 1, 616 p. (Mir, Moscow, 1981). (in Russ.).
- Yakovishin L. A., Developers for TLC of triterpene glycosides, Chemistry of Natural Compounds, 5, 419 (2003) (in Russ.).
- Yakovishin L. A., Use of uranyl nitrate and para-hydroxybenzaldehyde for the detection of triterpene glycosides in chromatographic analysis, Scientific Notes of Taurida V. I. Vernadsky National University. – Series: Biology, chemistry, 18 (2), 145 (2005). (in Russ.).
- Yakovishin L. A., Grishkovets V. I., Use of heteropolyacids for TLC analysis of triterpene glycosides, Chemistry of natural compound, 2, 196 (2006). (in Russ.).
- Xiong Q., Wilson W. K., Pang J., The Liebermann-Burchard reaction: sulfonation, desaturation, and rearrangment of cholesterol in acid, Lipids, 42 (1), 87 (2007).
- Burke R. W., Diamondstone B. I., Velapoldi R. A., Menis O., Mechanisms of the Liebermann-Burchard and Zak color reactions for cholesterol, Clinical Chemistry, 20 (7), 794 (1974).