Ученые записки Крымского федерального университета имени В. И. Вернадского
Биология. Химия. Том 11 (77). 2025. № 2. С. 265–280.
УДК 616-091.8:599.323
DOI 10.29039/2413-1725-2025-11-2-265-280
ИЗМЕНЕНИЯ ДВИГАТЕЛЬНОЙ АКТИВНОСТИ И УРОВНЯ ТРЕВОЖНОСТИ КРЫС РАЗНОГО ВОЗРАСТА ПРИ БЛОКИРОВАНИИ МОНОАМИНОКСИДАЗЫ-В
Хусаинов Д. Р., Аидинов И. Д., Туманянц К. Н., Семыкин В. А.
Институт биохимических технологий, экологии и фармации, ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», Симферополь, Республика Крым, Россия
E-mail: gangliu@yandex.ru
Предполагается, что в процессе старения подавление дофаминергической системы наблюдается и без выраженных патологических проявлений, но этот вопрос остается дискуссионным и особенно неоднозначно оценивается роль центрального дофамина в старческом увеличении уровня тревожности. В связи с отмеченным в настоящем исследовании определялись изменения двигательной активности и уровня тревожности крыс возрастом 7 месяцев, 12 и 24 месяца в условиях блокады моноаминоксидазы-В. При блокировании моноаминоксидазы-В и увеличении содержания центрального дофамина, получен однозначный результат, что с возрастом его значимость в контроле уровня тревожности снижается, что, вероятно, приводит к падению стрессоустойчивости и увеличению уровня тревожности и этот феномен проявляется уже при 12-ти месячном возрасте крыс.
Ключевые слова: двигательная активность, индекс тревожности, моноаминоксидаза, дофамин, возрастные изменения.
ВВЕДЕНИЕ
С возрастом наблюдается постепенное снижение двигательной активности человека [1] и животных [2]. В основе этого находится целый перечень естественных причин: функциональное ухудшение кровообращения особенно в микроциркуляторном русле, снижение подвижности суставов, снижение уровня метаболических процессов другие возрастные изменения [3], усиливают их влияние гиподинамия и гипокинезия [4], старческое одиночество [5]. Конечно, не маловажное значение имеют различного рода патологические процессы, связанные с травмами, нарушениями метаболизма, воспалительные процессы и ряд других, в том числе, возрастных заболеваний. Одним из важнейших факторов возрастного угнетения двигательной активности является не только снижение функциональных возможностей мышц, но и пластичности и общих функциональных возможностей центральной нервной системы и ее периферических отделов [6, 7]. Распространенным возрастным проявлением угнетения двигательной активности является двигательная заторможенность различных форм, преастения (в возрасте 65 лет у 48–50 % населения) и синдром старческой астении (в возрасте 65 лет у 10–13 % населения) в основе чего находятся не только двигательные, но и психоэмоциональные, когнитивные возрастные изменения и нарушения [8]. При этом, выраженность старческого угнетения когнитивных процессов в последние годы снижена, но общая направленность возрастных изменений остается неизменной [1]. Отметим, что возрастным изменениями характерно снижение устойчивости к стрессу, возрастание тревожности и тревоги, развитие продепрессивных проявлений [3]. Во всех перечисленных изменениях существенное значение имеет дофаминергическая система [9, 10], которая принимает участие в регуляции двигательной активности и психоэмоциональных функций. Бесспорное угнетение активности дофаминергической системы показано при старческой деменции, болезни Паркинсона [11] в ряде других заболеваний [10]. Предполагается, что в процессе старения подавление дофаминергической системы наблюдается и без выраженных патологических проявлений, но этот вопрос остается дискуссионным и особенно неоднозначно оценивается роль моноаминоксидазы и центрального дофамина [12, 13], в том числе в возрастном увеличении уровня тревожности условно здорового человека. В связи с отмеченным в настоящем исследовании была поставлена следующая цель: определить изменения двигательной активности и уровня тревожности крыс возрастом 7 месяцев, 12 и 24 месяца при блокировании МАО-В.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось в три экспериментальных этапа в период с 2022 по 2024 годы.
Первый экспериментальный этап.
Для исследования была сформирована экспериментальная выборка из 30 крыс-самцов линии Wistar (Филиал НИЦ «Курчатовский институт» – ПИЯФ – ПЛЖ «Рапполово») возрастом 7 месяцев. На всех этапах эксперимента соблюдались необходимые требования содержания животных по длине светового дня (12/12 часов), температурному режиму (20–24 0С), доступности питьевых растворов, для кормления использовался стандартизированный сухой корм ООО «Белгородские корма» ГОСТ 23469-2019, применялся стандартизированный посуточный кукурузный подстил для грызунов от ООО «Зилубаг». Кроме того, поддерживались условия стерильности растворов, шприцов и всех других использованных элементов.
Животные были разделены на следующие группы:
- группа 1 – 10 особей;
- группа 2 – 10 особей;
- группа 3 – 10 особей.
Все группы тестировались сначала в тесте «Открытое поле», через 10 дней в тесте «Крестообразный приподнятый лабиринт».
В тесте «Открытое поле» оценивалась двигательная активность и ИТ животных, в тесте «Крестообразный приподнятый лабиринт» – ИТ.
ИТ рассчитывался по формуле (tобщее–tотк)/tобщее, где tобщее – время тестирования в установке – 5 мин, tотк – суммарное время нахождения в открытых зонах тестовой установки. Для открытого поля tотк – это суммарное время в зонах 1 (центр) и 2 (пространство возле центра – внутренний круг, рис. 1); для КПЛ – суммарное время в центре и открытых рукавах (зона 1, рис. 2). Смысловой подход такого расчета достаточно простой: чем дольше животное находится в открытых зонах, тем меньше уровень тревожности. Следовательно, если tотк=tобщее, то ИТ минимален и равен нулю и, наоборот, если tотк=0 – ИТ максимален и равен единице.
Время нахождения каждой крысы в обоих тестовых установках составляло 5 минут. Этот отрезок времени записывался видеокамерой высокого разрешения, затем видеозапись автоматически анализировалась в программном комплексе Noldus EthoVision 12.
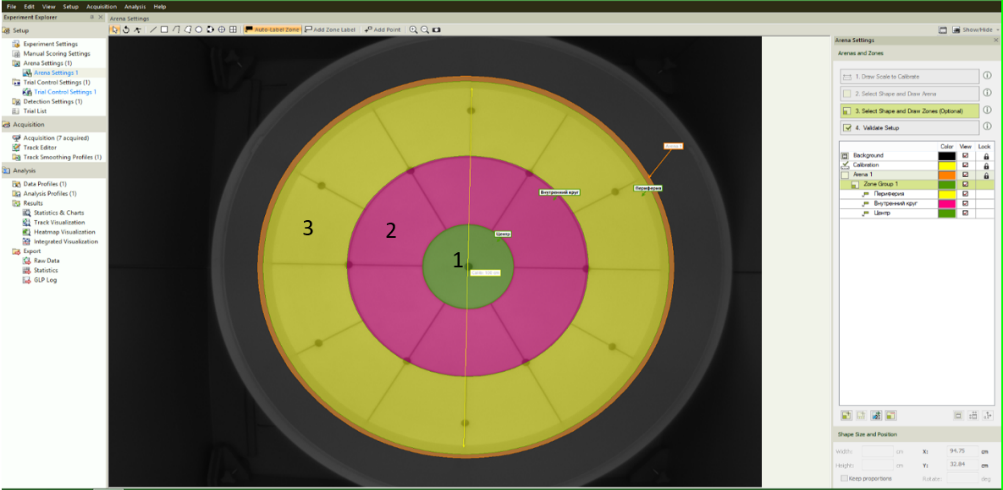
Рис. 1. Внешний вид арены открытого поля в программном пакете Noldus EthoVision.
Примечания: 1 – центр, 2 – внутренний круг, 3 – пристеночная зона.
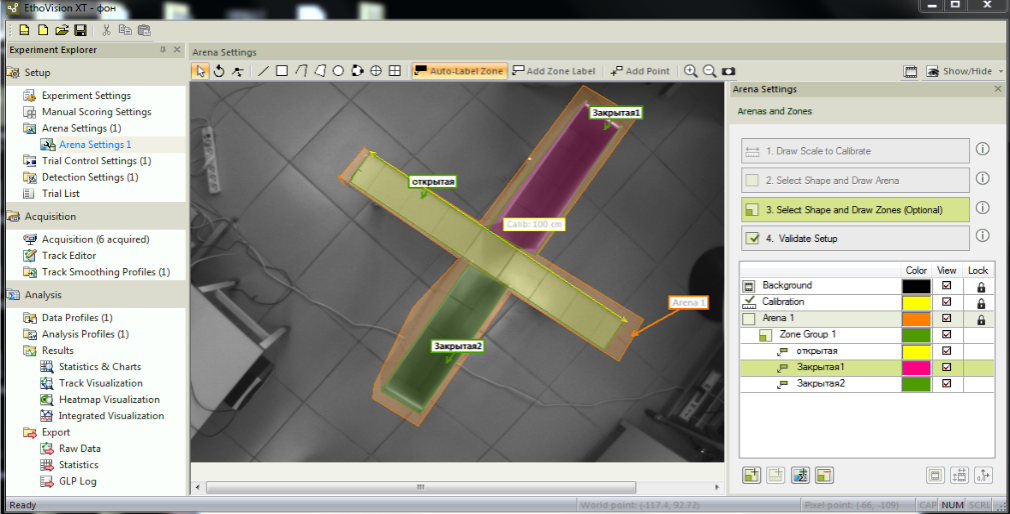
Рис. 2. Внешний вид арены крестообразного приподнятого лабиринта в программном пакете Noldus EthoVision.
Примечания: 1 – открытая зона (открытые рукава + центр), 2 – закрытая зона (закрытые рукава).
Спустя десять дней после описанных действий крысам группы 1 (возраст 7 месяцев) внутрибрюшинно вводили блокатор МАО-В селегилин в дозе 2,5 мг/кг и через 150 минут после введения блокатора проводили исследование поведенческой активности животных только в тесте «Открытое поле». Длительность блокады определялась согласно Borbe H. [14] и наших предыдущих исследований [15].
Второй экспериментальный этап.
На втором исследовательском этапе использовались животные группы 2 по достижении ими возраста 12 месяцев. Сначала проводилось исследование поведенческой активности животных в тесте «Открытое поле»; затем через 10 дней животным внутрибрюшинно вводили блокатор МАО-В селегилин в дозе 2,5 мг/кг и через 150 минут после введения блокатора проводили исследование поведенческой активности животных в тесте «Открытое поле».
Третий экспериментальный этап.
На третьем исследовательском этапе использовались животные группы 3 по достижении ими возраста 24 месяца. Отметим, что до этого возраста дожило 8 крыс. Далее на 8 крысах проводилось исследование поведенческой активности в тесте «Открытое поле». Через 10 дней животным внутрибрюшинно вводили блокатор МАО-В селегилин в дозе 2,5 мг/кг и через 150 минут после введения блокатора проводили исследование поведенческой активности животных в тесте «Открытое поле».
Статистический анализ всех массивов осуществлялся в программе GraphPadPrism 8.0 c использованием описательной статистики, критерия Шапиро-Уилка, дисперсия массивов сравнивалась с помощью критерия Барлета, для множественного сравнения применялся дисперсионный анализ и критерий Тьюки. В случае попарного сравнения зависимых выборок применялся, не смотря на нормальность распределения, Т-критерий Вилкоксона, в случае независимых массивов – Т-критерий Манна-Уитни; т.к. выборка n=10 и менее, все-таки, является недостаточно мощной для Т-критерия Стьюдента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В силу того, что исследование проводилось в несколько экспериментальных этапов и на каждом осуществлялся свой перечень исследовательских и действий анализа; считаем целесообразным изложить результаты согласно этим этапам анализа с рубрикацией каждого из них.
Анализ изначальных поведенческих показателей животных трех исследовательских групп.
Итак, в начале исследования было сформировано три группы животных одного возраста: группа 1 – 10 самцов возрастом 7 месяцев; группа 2 – 10 самцов возрастом 7 месяцев и группа 3 – 10 самцов возрастом 7 месяцев. Первоначально необходимо было оценить «стартовую» однотипность крыс всех трех выборок. Для этого поведенческие показатели животных были подвергнуты статистическому анализу по критериям Шапиро-Уилка, Барлета и Тьюки. В результате нормальное распределение подтвердилось для всех групп животных, как по значениям времени нахождения крыс в различных пространственных зонах тестовой установки, так и по ИТ. Также, применение критерия Барлета показало однородность дисперсии и дисперсионный анализ с применением критерия Тьюки межгрупповых отличий по показателю пройденной дистанции и скорости передвижения крыс в тесте «Открытое поле» не выявил (рис. 3).
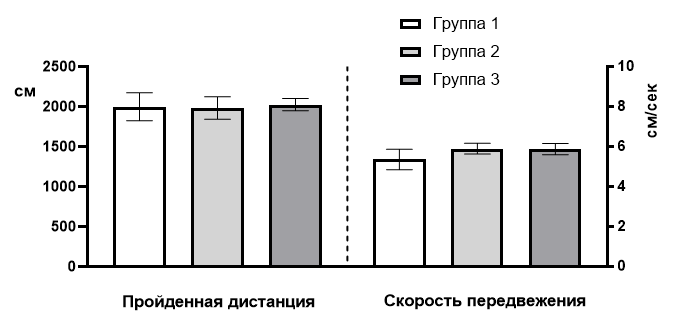
Рис. 3. Показатели пройденной дистанции и скорости передвижения крыс трех групп в тесте «Открытое поле».
Значение пройденной дистанции в группе 1 составило 1997,0±174,0 см, скорости передвижения – 5,36±0,51 см/сек; в группе 2 – 1982,0±140,1 см и 5,89±0,27 см/сек; в группе 3 – 2025,0±76,7 см и 5,87±0,28 см/сек.
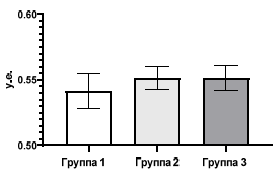
Дисперсионному анализу с применением критерия Тьюки подвергся и показатель ИТ, который был рассчитан по тесту «Открытое поле». В результате этого анализа межгрупповых отличий в уровне тревожности не обнаружено (рис. 4).
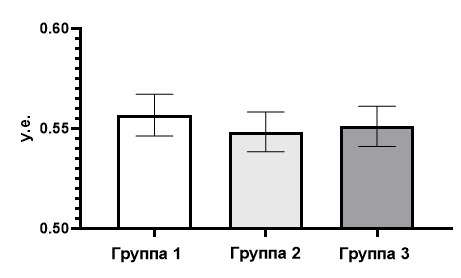
Рис. 4. Значение индекса тревожности крыс трех групп, рассчитанного по показателям теста «Открытое поле».
Показатель ИТ, который рассчитывался по тесту «Открытое поле» в группе 1 в среднем равнялся 0,56±0,01 у.е.; в группе 2 – 0,54±0,01 у.е.; в группе 3 – 0,55±0,012 у.е.
На данном экспериментальном этапе мы решили провести сравнительный анализ ИТ, который рассчитан по тесту «Открытое поле» с ИТ, рассчитанным в специализированном тесте по изучению уровня тревожности – «Крестообразный приподнятый лабиринт». Для этого животные всех трех групп спустя семь дней после тестирования в тесте «Открытое поле» тестировались в тесте «Крестообразный приподнятый лабиринт» по описанной в разделе методике в предшествующем разделе настоящей статьи.
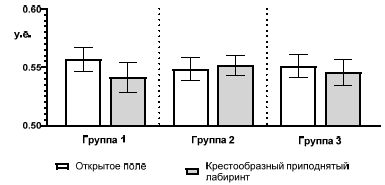
Так, в тесте «Крестообразный приподнятый лабиринт» показатель ИТ в группе 1 в среднем равнялся 0,54±0,012 у.е.; в группе 2 – 0,55±0,01 у.е.; в группе 3 – 0,55±0,01 у.е. (рис. 5).
Рис. 5. Значение индекса тревожности крыс трех групп, рассчитанного по показателям теста «Крестообразный приподнятый лабиринт».
Далее был проведен сравнительный анализ значения ИТ, рассчитанного по тестам «Открытое поле» и «Крестообразный приподнятый лабиринт» (рис. 6). В результате проведенного сравнительного анализа никаких отличий обнаружено не было.
Рис. 6. Сравнение индекса тревожности крыс трех групп, рассчитанного по показателям теста «Открытое поле» и «Крестообразный приподнятый лабиринт».
Таким образом, животные всех групп в рамках своего изначального уровня двигательной активности и тревожности характеризовались однородностью, которая необходима для нивелирования артефакта «стартовых» отличий.
Также, было показано, что ИТ, который рассчитывался по поведенческим показателям животных в тесте «Открытое поле» и в тесте «Крестообразный приподнятый лабиринт» имеет одинаковое значение; поэтому на последующих экспериментальных этапах для оценки уровня тревожности животных мы ограничились тестом «Открытое поле».
Сравнение поведенческих показателей животных разных возрастных групп.
После первого исследовательского этапа животные группы 2 находились в стандартных условиях вивария до достижения возраста 12 месяцев. При достижении указанного возраста проводилось исследование поведенческих реакций животных в тесте «Открытое поле».
Крысы третьей группы находились в стандартных условиях вивария до достижения возраста 24 месяцев. При достижении указанного возраста, также, проводилось исследование поведенческих реакций животных в тесте «Открытое поле».
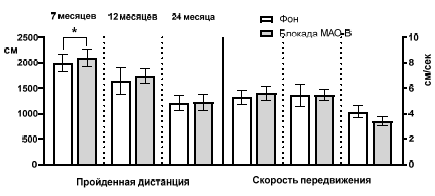
После, того, как были накоплены массивы данных поведенческих показателей в числовом виде, был осуществлен межгрупповой статистический анализ этих массивов. В результате было выявлено, что двигательная активность животных по показателю «пройденная дистанция» имеет линейную тенденцию к уменьшению, а «скорость передвижения» более консервативный показатель. Итак, у крыс (группа 1) возрастом 7 месяцев (результаты получены на первом экспериментальном этапе, который описан ранее по тексту) значение пройденной дистанции составило 1997,0±174,0 см, скорости передвижения – 5,36±0,51 см/сек. Крысы возрастом 12 месяцев за 5 минут нахождения в тестовом пространстве «Открытого поля» преодолели дистанцию в 1643,0±258,5 см со средней скоростью передвижения 5,43±0,86 см/сек без достоверного уровня отличий от соответствующих показателей крыс семимесячного возраста (рис. 7).
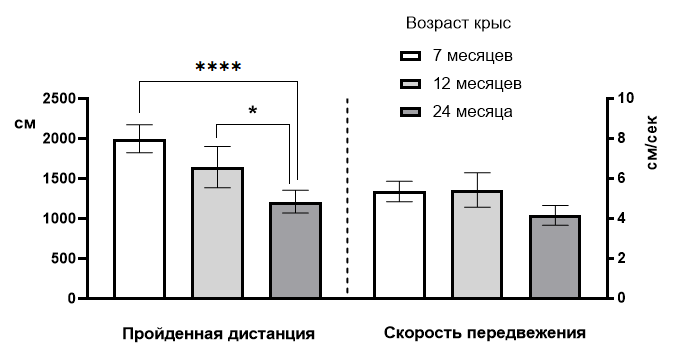
Рис. 7. Сравнение пройденной дистанции и скорости передвижения крыс разных возрастов в тесте «Открытое поле».
Примечания: * – отличия при р<0,05, **** – отличия при р<0,0001.
Крысы возрастом 24 месяца по показателю «пройденная дистанция» продемонстрировали значение в 1212,0±142,6 см с достоверным уровнем отличий от соответствующего показателя семимесячных животных при р<0,0001 и от годовалых крыс при р<0,05 (рис. 7).
Средняя скорость передвижения крыс возрастом 24 месяца составила 4,16±0,49 см/сек без достоверного уровня отличий от соответствующего показателя, как крыс семимесячного возраста, так и годовалых крыс (рис. 7).
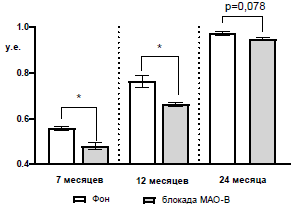
Далее было проведено сравнения ИТ между крысами трех возрастных групп и было показано, что этот показатель линейно возрастает с возрастом животных (рис. 8).
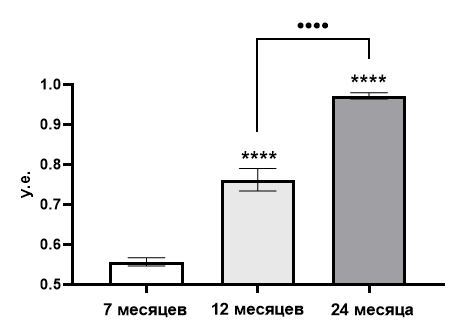
Рис. 8. Сравнение индекса тревожности крыс разных возрастов.
Примечания: **** – отличия при р<0,0001 от индекса тревожности крыс возрастом 7 месяцев; •••• – отличия при р<0,0001.
В группе крыс возрастом 7 месяцев ИТ в среднем равнялся 0,56±0,01 у.е., в группе животных возрастом 12 месяцев ИТ составил 0,76±0,03 у.е. при уровне отличий от семимесячных крыс р<0,0001. В группе крыс возрастом 24 месяца ИТ в среднем равнялся 0,97±0,01 у.е. при уровне отличий от семимесячных крыс р<0,0001 и от годовалых животных, также, при р<0,0001.
Таким образом, экспериментально доказано, что с возрастом у крыс линейно снижается показатель пройденной дистанции и увеличивается уровень тревожности.
Сравнение эффектов блокады МАО-В у животных разных возрастных групп.
На последующем экспериментальном этапе изучались эффекты блокады МАО-В у крыс трех возрастных групп: 7 месяцев, 12 месяцев и 24 месяца. Было выяснено, что у животных возрастом 7 месяцев спустя 150 минут блокады МАО-В наблюдается достоверное увеличение пройденной дистанции от 1997,0±174,0 см до 2112,0±168,4 см при р<0,05 (рис. 9). Все остальные показатели двигательной активности по всем возрастным группам оставались, по сути, неизменными.
Рис. 9. Сравнение пройденной дистанции и скорости передвижения крыс в разных возрастных группах до (фон) и после блокады МАО-В.
Примечания: * – отличия при р<0,05.
По показателю ИТ до и после блокады МАО-В во всех возрастных группах животных был получен однонаправленный эффект: спустя 150 минут блокады МАО-В ИТ достоверно снижался у крыс возрастом 7 и 12 месяцев, но у животных возрастом 24 месяца это уменьшение не достигало достоверного уровня значимости (рис. 8). Так, у семимесячных крыс до блокады МАО-В ИТ составлял 0,56±0,01 у.е., после блокады МАО-В – 0,48±0,015 у.е. при р<0,05; у годовалых животных до – 0,76±0,03 у.е., после – 0,66±0,01 у.е. при р<0,05; у двухлетних животных до – 0,97±0,01 у.е., после – 0,95±0,01 у.е. при р=0,078 (рис. 10).
По результатам настоящего исследования убедительно показано, что с возрастом постепенно снижается уровень двигательной активности и увеличивается ИТ. Полученные данные совпадают, как с результатами других авторов [1, 2, 16], так и с данными наших предыдущих исследований [17], но и дополняют их. Так, как правило, для возрастного сравнения обычно используются животные возрастом 6–7 месяцев и 16–20 месяцев [2, 9, 17], т.е. крайних возрастных позиций: «молодые» / «старые». Нам удалось экспериментально подтвердить, что и в позиции «зрелые» (возраст крыс 12 месяцев) уже проявляется линейный вектор на снижение двигательной активности и повышение ИТ. При этом, снижение двигательной активности еще не достигает достоверного уровня значимости, а ИТ увеличивается достоверно. Следовательно, показатель двигательной активности у крыс линии Wistar более сохранен в возрастном аспекте, чем механизмы контроля психоэмоциональных характеристик. Мы, в первую очередь, связывает этот экспериментальный факт со стрессоустойчивостью животных: тест «Открытое поле», хотя и является слабо оверсивным тестом, но, все-таки, моделирует стресс ситуацию, в которую помещаются экспериментальные животные. Значит с возрастом снижает устойчивость к стресс воздействиям, что совпадает с литературными данными [16, 18], но это снижение реализуется заметно раньше, чем начинает достоверно проявляться угнетение двигательной активности. Мы предполагаем, что стрессоустойчивость является более возрастозависимым показателем по сравнению с уровнем двигательной активности. Озвученное предположение требует дальнейшей экспериментальной верификации.
Рис. 10. Сравнение индекса тревожности крыс в разных возрастных группах до (фон) и после блокады МАО-В.
Примечания: * – отличия при р<0,05.
Также, в настоящем исследовании были сформированы выборки животных с изначальным уровнем ИТ порядка 0,55 у.е., что можно отнести к среднему уровню тревожности и показатели двигательной активности, также, находились в диапазоне среднего уровня, по крайней мере, по использованной для отбора выборке животных. Поэтому обнаруженные экспериментальные закономерности справедливы для крыс линии Wistar со средним уровнем тревожности и двигательной активности. Считаем, что у крыс с другими индивидуально-типологическими характеристиками уровня тревожности и двигательной активности качественные характеристики возрастных изменений не будут демонстрировать выраженного уровня различий, но количественные могут заметно отличаться. Например, выраженность изменений или возрастной диапазон их проявления, но это предположение, также, требует экспериментальной проверки.
Отметим, что по нашим результатам ИТ, определенный в тестах «Открытое поле» и «Крестообразный приподнятый лабиринт» совпал и не демонстрировал достоверного уровня отличий, что еще раз подтверждает адекватность методики оценки ИТ в тесте «Открытое поле». Конечно, для более детального и специализированного исследования проявлений тревожности остается тест «Крестообразный приподнятый лабиринт».
Касательно функциональной роли центрального дофамина, а мы связываем блокаду МАО-В с увеличением содержания центрального дофамина, по ИТ получен однозначный результат: с возрастом его значимость в контроле уровня тревожности снижается. Т.е. при старении активность дофаминергической системы уменьшается [11], что приводит к падению стрессоустойчивости и увеличению уровня тревожности. Отмеченная закономерность проявилась уже у крыс возрастом 12 месяцев.
По уровню двигательной активности получен не однозначный результат: следовало ожидать, что увеличение концентрации центрального дофамина окажет более выраженное влияние на возрастных крыс, но по экспериментальному факту, наоборот, отреагировали только «молодые» крысы возрастом 7 месяцев. Возможно, возрастные изменения в дофаминергической системе в первую очередь связаны не со снижением содержания центрального дофамина, а с падением плотности и чувствительности дофаминергических рецепторов. Отмеченному концепту соответствуют и результаты по возрастной динамике ИТ: с возрастом снижается эффективность влияния уровня центрального дофамина на ИТ.
ЗАКЛЮЧЕНИЕ
Таким образом, с возрастом у крыс линии Wistar наблюдается угнетение функциональной значимости дофаминергической системы, что выражается в снижении ее функциональной вовлеченности в контроль двигательного и психоэмоционального поведенческого фактора и эта закономерность проявляется линейно.
Работа выполнена на оборудовании ЦКП «Экспериментальная физиология и биофизика» и расходных материалах НКЦ «Технологии здоровья и реабилитации» в рамках инициативной темы № АААА-А21-121011990099-6.
Список литературы
- Gerstorf D. Today’s Older Adults Are Cognitively Fitter Than Older Adults Were 20 Years Ago, but When and How They Decline Is No Different Than in the Past. / Gerstorf D., Ram N., Drewelies J., Duezel S. [et al.] // Psychol Sci. – 2023. – 34(1). – Р. 22–34. doi: 10.1177/09567976221118541. Epub 2022 Oct 25. PMID: 36282991.
- Graber T. G. Measuring Exercise Capacity and Physical Function in Adult and Older Mice. / Graber T. G., Maroto R., Fry C. S., Brightwell C. R., Rasmussen B. B. // J Gerontol A Biol Sci Med Sci. – 2021 – 76(5): – 819–824. doi: 10.1093/gerona/glaa205. PMID: 32822475; PMCID: PMC8087272.
- Пристром М. С. Старение физиологическое и преждевременное. Современный взгляд на проблему. / Пристром М. С., Пристром С. Л., Семененков И. И. // Международные обзоры: клиническая практика и здоровье. – 2017. – №. 5–6. – С. 40–64.
- Кузнецова З. М. Двигательная активность как средство профилактики возрастных изменений / Кузнецова З. М., Максимова Е. Ф. // Педагогико-психологические и медико-биологические проблемы физической культуры и спорта. – 2007. – № 4 (5). – С. 28–38.
- Buchman A. S. Loneliness and the rate of motor decline in old age: the rush memory and aging project, a community-based cohort study. / Buchman A. S., Boyle P. A., Wilson R. S. et al. // BMC Geriatr – 2010. – 10. – Р. 77 https://doi.org/10.1186/1471-2318-10-77
- Wrucke D. J. Neural and muscular contributions to the age-related differences in peak power of the knee extensors in men and women. / Wrucke D. J., Kuplic A., Adam M. D., Hunter S. K., Sundberg C. W. // J Appl Physiol (1985). – 2024 – 137(4) – Р. 1021–1040. doi: 10.1152/japplphysiol.00773.2023. Epub 2024 Aug 29. PMID: 39205638; PMCID: PMC11486474.
- Guo Y. Sex disparities of human neuromuscular decline in older humans. / Guo Y., Jones E. J., Smart T. F. [et al.] // J Physiol. – 2025 – 603(1) – Р. 151–165. doi: 10.1113/JP285653. Epub 2024 Jun 10. PMID: 38857412; PMCID: PMC11702916.
- Gonzalez M. C. Cognitive and Motor Decline in Dementia with Lewy Bodies and Parkinson’s Disease Dementia. / Gonzalez M. C., Tovar-Rios D. A., Alves G. [et al.] // Mov Disord Clin Pract. – 2023 – 10(6) – Р. 980–986. doi: 10.1002/mdc3.13752. PMID: 37332651; PMCID: PMC10272890.
- Sagheddu C. Cognitive performance in aged rats is associated with differences in distinctive neuronal populations in the ventral tegmental area and altered synaptic plasticity in the hippocampus. / Sagheddu C., Stojanovic T., Kouhnavardi S. [et al.] // Front Aging Neurosci. – 2024 – 16 – 1357347. doi: 10.3389/fnagi.2024.1357347. PMID: 38469164; PMCID: PMC10926450.
- Sanfeliu C. New insights in animal models of neurotoxicity-induced neurodegeneration. / Sanfeliu C., Bartra C., Suñol C., Rodríguez-Farré E. // Front Neurosci. – 2024 – 17 – 1248727. doi: 10.3389/fnins.2023.1248727. PMID: 38260026; PMCID: PMC10800989.
- Soto I. Aging accelerates locomotor decline in PINK1 knockout rats in association with decreased nigral, but not striatal, dopamine and tyrosine hydroxylase expression. / Soto I., McManus R., Navarrete W. [et al.] // Exp Neurol. – 2024 – 376 – 114771. doi: 10.1016/j.expneurol.2024.114771. Epub 2024 Apr 4. PMID: 38580154.
- Tábi T. Selegiline: a molecule with innovative potential. / Tábi T., Vécsei L., Youdim M.B., Riederer P., Szökő É. // J Neural Transm (Vienna). – 2020. – 127(5). – Р. 831–842. doi: 10.1007/s00702-019-02082-0. Epub 2019 Sep 27. PMID: 31562557; PMCID: PMC7242272.
- Rossano F. Efficacy and safety of selegiline across different psychiatric disorders: A systematic review and meta-analysis of oral and transdermal formulations. / Rossano F., Caiazza C., Sobrino A., Solini N. [et al.] // Eur Neuropsychopharmacol. – 2023 – 72 – Р. 60–78. doi: 10.1016/j.euroneuro.2023.03.012. Epub 2023 Apr 21. PMID: 37087864.
- Borbe H. O. Kinetic evaluation of MAO-B-activity following oral administration of selegiline and desmethyl-selegiline in the rat / Borbe H. O., Niebch G., Nickel B. // Journal of Neural Transmission / Amine Oxidases and Their Impact on Neurobiology / P. Riederer and M. B. H. Youdim (eds.) // Proceedings of the 4th International Amine Oxidases Workshop, Wurzburg, Federal Republic of Germany, July 7-10, 1990. Springer-Verlag, Wien – New York. – P. 131–137. DOI: 10.1007/978-3-7091-9113-2_18
- Изменение индекса депрессивности у низко-, среднеи высокодепрессивных крыс в зависимости от длительности блокады моноаминоксидазы-В / Д. Р. Хусаинов, К. Н. Туманянц, И. Д. Аидинов, В. Р. Иванова // Ученые записки Крымского федерального университета имени В.И. Вернадского. Биология. Химия. – 2024. – Т. 10, № 4. – С. 217–229. – DOI 10.29039/2413-1725-2024-10-4-217-229. – EDN BRJIRJ.
- Gao X. Accelerated biological aging and risk of depression and anxiety: evidence from 424,299 UK Biobank participants. / Gao X., Geng T., Jiang M., Huang N., Zheng Y., Belsky D. W., Huang T. // Nat Commun. – 2023 – 14(1) – 2277. doi: 10.1038/s41467-023-38013-7.
- Participation of dopaminergic system in the dynamics of behavioral reactions of aging rats of both sexes under daily testing in the open field / E. Birukova, D. Khusainov, A. Chajka [et al.] // BIO Web of Conferences. – 2021. – Vol. 30. – P. 06003. – DOI 10.1051/bioconf/20213006003. – EDN ONVIPE.
- Srifuengfung M. Perioperative Anxiety and Depression in Older Adults: Epidemiology and Treatment. / Srifuengfung M., Abraham J., Avidan M. S., Lenze E. J. // Am J Geriatr Psychiatry. – 2023 – 31(11) – Р. 996–1008. doi: 10.1016/j.jagp.2023.07.002. Epub 2023 Jul 8. PMID: 37482501; PMCID: PMC10592367.
CHANGES IN MOTOR ACTIVITY AND ANXIETY LEVELS OF RATS OF DIFFERENT AGES UPON BLOCKING MONOAMINE OXIDASE-B
Khusainov D. R., Aidinov I. D., Tumanyants K. N., Semykin V. A.
Institute of Biochemical Technologies, Ecology and Pharmacy (structural division)
of the V. I. Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
E-mail: gangliu@yandex.ru
With age, there is a gradual decrease in motor activity in humans [1] and animals [2]. This is based on a whole list of natural causes: functional deterioration of blood circulation especially in the microcirculatory channel, decreased mobility of joints, decreased level of metabolic processes other age-related changes [3], hypodynamia and hypokinesia [4], senile loneliness [5] increase their influence. One of the most important factors of age-related suppression of motor activity is not only a decrease in the functional capabilities of muscles, but also in the plasticity and general functional capabilities of the central nervous system and its peripheral departments [6, 7]. Psychoemotional, cognitive age-related changes and disorders are essential [8]. It should be noted that age-related changes are characterised by a decrease in stress tolerance, an increase in anxiety and worry, and the development of prodepressive manifestations [3]. The dopaminergic system is of significant importance in all the above changes [9, 10]. Undeniable suppression of the activity of the dopaminergic system is shown in senile dementia, Parkinson’s disease [11] in a number of other diseases [10]. The question of involvement of the dopaminergic system in senile changes remains debatable and the role of monoamine oxidase and central dopamine [12, 13], including in the age-related increase in the anxiety level of a conditionally healthy person, is particularly ambiguous. In connection with the above-mentioned, the following objective was set in the present study: to determine the changes in motor activity and anxiety level in 7-month-old, 12-month-old and 24-month-old rats when MAO-B was blocked.
The study was conducted in three experimental phases from 2022 to 2024.
The first experimental stage.
An experimental sample of 30 male Wistar rats (animal kennel ‘Rappolovo’) aged 7 months was formed for the study. At all stages of the experiment, the necessary requirements for animal housing were observed in terms of daylight hours (12/12 hours), temperature regime (20–240 C), availability of drinking solutions, standardised dry fodder of LLC ‘Belgorodskaya Korma’ GOST 23469-2019 was used for feeding, standardised daily corn bedding for rodents from LLC ‘Zilubag’ was used. In addition, sterile conditions were maintained for solutions, syringes and all other items used.
The animals were divided into the following groups:
– group 1 – 10 species;
– group 2 – 10 species;
– group 3 – 10 species.
All groups were tested first in the ‘Open field’ test, 10 days later in the ‘Cross-shaped elevated maze’ test.
Motor activity and anxiety index (AI) of animals were evaluated in the ‘Open field’ test, and in the ‘Raised cross-shaped maze’ test – AI.
AI was calculated according to the formula (ttotal–topen)/ttotal, where ttotal is the time of testing in the setup – 5 min, topen is the total time spent in the open zones of the test setup. For the ‘Open field’, topen is the total time in zones 1 (centre) and 2 (space near the centre – inner circle, Fig. 1); for ‘Raised cross-shaped maze’ test – topen time in the centre and open arms (zone 1, Fig. 2). The semantic approach of this calculation is quite simple: the longer the animal stays in the open zones, the lower the level of anxiety. Consequently, if topen = ttotal, AI is minimal and equal to zero and, conversely, if topen = 0 – AI is maximal and equal to one.
Ten days after the described actions, rats of group 1 (age 7 months) were intraperitoneally injected with the MAO-B blocker selegiline at a dose of 2.5 mg/kg and 150 minutes after the blocker administration the behavioural activity of the animals was studied only in the ‘Open Field’ test. The duration of blockade was determined according to Borbe H. [14] and our previous studies [15].
Second experimental phase.
At the second research stage, animals of group 2 were used when they reached the age of 12 months. First, the study of behavioural activity of animals in the ‘Open field’ test was carried out; then after 10 days animals were intraperitoneally injected with MAO-B blocker selegiline at a dose of 2.5 mg/kg and 150 minutes after the blocker injection the study of behavioural activity of animals in the ‘Open field’ test was carried out.
The third experimental stage.
At the third research stage, animals of group 3 were used when they reached the age of 24 months. Note that 8 rats survived to this age. Further, the study of behavioural activity in the ‘Open Field’ test was carried out on 8 rats. After 10 days, animals were intraperitoneally injected with MAO-B blocker selegiline at a dose of 2.5 mg/kg, and 150 minutes after the blocker administration, the behavioural activity of animals was studied in the ‘Open Field’ test.
Statistical analysis of all arrays was performed in the GraphPadPrism 8.0 programme using descriptive statistics, the Shapiro-Wilk criterion, the variance of the arrays was compared using the Barlet criterion, and for multiple comparisons the analysis of variance and Tukey test were used. In the case of pairwise comparison of dependent samples, the Wilcoxon T-criterion was used, despite the normality of the distribution, and in the case of independent arrays, the Mann-Whitney T-criterion was used.
It was shown that animals of all groups within their initial level of motor activity and anxiety were characterised by homogeneity, which is necessary for levelling the artifact of ‘starting’ differences. Also, it was shown that AI, which was calculated from the behavioural indicators of animals in the ‘Open field’ test and in the ‘Cross-shaped elevated maze’ test, has the same value; therefore, in the subsequent experimental stages we limited ourselves to the ‘Open field’ test to assess the level of anxiety of animals.
Comparison of behavioural performance of animals of different age groups.
Thus, in rats (group 1) aged 7 months (the results were obtained at the first experimental stage, which is described earlier in the text), the value of the travelled distance was 1997.0±174.0 cm and the speed of movement was 5.36±0.51 cm/sec. Rats aged 12 months for 5 minutes of being in the test space ‘Open field’ overcame the distance of 1643,0±258,5 cm with an average speed of movement 5,43±0,86 cm/sec without a significant level of differences from the corresponding indicators of rats of seven months of age. The 24-month-old rats showed a value of 1212.0±142.6 cm in terms of ‘distance travelled’ with a significant level of difference from the corresponding index of seven-month-old animals at p<0.0001 and from one-year-old rats at p<0.05 (Fig. 5).
The mean speed of movement of 24-month-old rats was 4.16±0.49 cm/sec with no significant level of differences from the corresponding index of both seven-month-old rats and one-year-old rats at p<0.0001 and from one-year-old rats at p<0.05 (Fig. 5).
In the group of rats aged 7 months AI averaged 0.56±0.01 units, in the group of animals aged 12 months AI was 0.76±0.03 units at the level of differences from seven-month-old rats p<0.0001. In the group of rats aged 24 months AI averaged 0.97±0.01 u. at the level of differences from seven-month-old rats p<0.0001 and from one-year-old animals, also, at p<0.0001.
Thus, it is experimentally proved that with age in rats linearly decreases the index of the travelled distance and increases the level of anxiety.
Comparison of the effects of MAO-B blockade in animals of different age groups.
At the subsequent experimental stage, the effects of MAO-B blockade were studied in rats of three age groups: 7 months, 12 months and 24 months. It was found out that in 7-month-old animals after 150 minutes of MAO-B blockade there was a significant increase in the travelled distance from 1997.0±174.0 cm to 2112.0±168.4 cm at p<0.05 (Fig. 7). All other indices of motor activity remained essentially unchanged in all age groups.
A unidirectional effect was obtained for AI before and after MAO-B blockade in all age groups of animals: after 150 minutes of MAO-B blockade, AI significantly decreased in 7- and 12-month-old rats, but in 24-month-old animals this decrease did not reach a significant level of significance (Fig. 8). Thus, in seven-month-old rats before MAO-B blockade, AI was 0.56±0.01 units, after MAO-B blockade – 0.48±0.015 units at p<0.05; in one-year-old animals before – 0.76±0.03 units, after – 0.66±0.01 u. at p<0.05; in two-year-old animals before – 0.97±0.01 u., after – 0.95±0.01 u. at p=0.078 (Fig. 8).
Thus, with age in Wistar rats there is a suppression of the functional importance of the dopaminergic system, which is expressed in a decrease in its functional involvement in the control of motor and psychoemotional behavioural factors, and this pattern is linear.
Keywords: motor activity, anxiety index, monoamine oxidase, dopamine, age-related changes.
References
- Gerstorf D., Ram N., Drewelies J., Duezel S., Eibich P., Steinhagen-Thiessen E., Liebig S., Goebel J., Demuth I., Villringer A., Wagner G. G., Lindenberger U., Ghisletta P. Today’s Older Adults Are Cognitively Fitter Than Older Adults Were 20 Years Ago, but When and How They Decline Is No Different Than in the Past, Psychol Sci., 34(1), 22 (2023) doi: 10.1177/09567976221118541.
- Graber T. G., Maroto R., Fry C. S., Brightwell C. R., Rasmussen B. B. Measuring Exercise Capacity and Physical Function in Adult and Older Mice, J Gerontol A Biol Sci Med Sci., 76(5), 819 (2021). doi: 10.1093/gerona/glaa205. PMID: 32822475; PMCID: PMC8087272.
- Pristrom M. S., Pristrom S. L., Semenenkov I. I. Aging physiologic and premature. A modern view of the problem, International Reviews: clinical practice and health, 5-6, 40 (2017).
- Kuznetsova Z. M., Maksimova E. F. Motor activity as a means of prevention of age-related changes, Pedagogico-psychological and medico-biological problems of physical culture and sport, 4 (5), 28 (2007).
- Buchman A. S., Boyle P. A., Wilson R. S. et al. Loneliness and the rate of motor decline in old age: the rush memory and aging project, a community-based cohort study. BMC Geriatr, 10, 77 (2010). https://doi.org/10.1186/1471-2318-10-77
- Wrucke D. J., Kuplic A., Adam M. D., Hunter S. K., Sundberg C. W. Neural and muscular contributions to the age-related differences in peak power of the knee extensors in men and women. J Appl Physiol (1985), 137(4), 1021 (2024) doi: 10.1152/japplphysiol.00773.2023.
- Guo Y., Jones E. J., Smart T. F., Altheyab A., Gamage N., Stashuk D. W., Piasecki J., Phillips B. E., Atherton P. J., Piasecki M. Sex disparities of human neuromuscular decline in older humans. J Physiol. 603(1), 151 (2025) doi: 10.1113/JP285653.
- Gonzalez M. C., Tovar-Rios D. A., Alves G., Dalen I., Williams-Gray C. H., Camacho M., Forsgren L., Bäckström D., Lawson R. A., Macleod A. D., Counsell C. E., Paquet C., DeLena C., D’Antonio F., Pilotto A., Padovani A., Blanc F., Falup-Pecurariu C., Lewis S. J. G., Rejdak K., Papuc E., Hort J., Nedelska Z., O’Brien J., Bonanni L., Marquié M., Boada M., Pytel V., Abdelnour C., Alcolea D., Beyer K., Tysnes O. B., Aarsland D., Maple-Grødem J. Cognitive and Motor Decline in Dementia with Lewy Bodies and Parkinson’s Disease Dementia. Mov Disord Clin Pract., 10(6), 980 (2023) doi: 10.1002/mdc3.13752.
- Sagheddu C., Stojanovic T., Kouhnavardi S., Savchenko A., Hussein A. M., Pistis M., Monje F. J., Plasenzotti R., Aufy M., Studenik C. R., Lubec J., Lubec G. Cognitive performance in aged rats is associated with differences in distinctive neuronal populations in the ventral tegmental area and altered synaptic plasticity in the hippocampus. Front Aging Neurosci., 16, 1357347 (2024) doi: 10.3389/fnagi.2024.1357347. PMID: 38469164; PMCID: PMC10926450.
- Sanfeliu C., Bartra C., Suñol C., Rodríguez-Farré E. New insights in animal models of neurotoxicity-induced neurodegeneration. Front Neurosci., 17, 1248727 (2024) doi: 10.3389/fnins.2023.1248727.
- Soto I., McManus R., Navarrete W., Kasanga E. A., Doshier K., Nejtek V. A., Salvatore M. F. Aging accelerates locomotor decline in PINK1 knockout rats in association with decreased nigral, but not striatal, dopamine and tyrosine hydroxylase expression. Exp Neurol., 376, 114771. (2024) doi: 10.1016/j.expneurol.2024.114771. Epub 2024 Apr 4. PMID: 38580154.
- Tábi T., Vécsei L., Youdim M. B., Riederer P., Szökő É. Selegiline: a molecule with innovative potential. J Neural Transm (Vienna), 127(5), 831 (2020) doi: 10.1007/s00702-019-02082-0.
- Rossano F., Caiazza C., Sobrino A., Solini N., Vellucci A., Zotti N., Fornaro M., Gillman K., Cattaneo C. I., Van den Eynde V., Birkenhager T. K., Ruhé H. G., Stahl S., Iasevoli F., de Bartolomeis A. Efficacy and safety of selegiline across different psychiatric disorders: A systematic review and meta-analysis of oral and transdermal formulations. Eur Neuropsychopharmacol., 72, 60 (2023) doi: 10.1016/j.euroneuro.2023.03.012. Epub 2023 Apr 21. PMID: 37087864.
- Borbe H. O., Niebch G., Nickel B. Kinetic evaluation of MAO-B-activity following oral administration of selegiline and desmethyl-selegiline in the rat / Journal of Neural Transmission / Amine Oxidases and Their Impact on Neurobiology / P. Riederer and M. B. H. Youdim (eds.) // Proceedings of the 4th International Amine Oxidases Workshop, Wurzburg, Federal Republic of Germany, 131 (Springer-Verlag, Wien – New York, July 7-10, 1990.). DOI: 10.1007/978-3-7091-9113-2_18
- Khusainov D. R., Tumanyants K. N., Aidinov I. D., Ivanova V. R. Changes in the index of depression in low-, medium- and high-depressed rats depending on the duration of monoamine oxidase-B blockade, Scientific Notes of V.I. Vernadsky Crimean Federal University. Biology. Chemistry, 10, 4, 217 (2024). DOI 10.29039/2413-1725-2024-10-4-217-229. – EDN BRJIRJ.
- Gao X., Geng T., Jiang M., Huang N., Zheng Y., Belsky D. W., Huang T. Accelerated biological aging and risk of depression and anxiety: evidence from 424,299 UK Biobank participants. Nat Commun., 14(1), 2277. (2023) doi: 10.1038/s41467-023-38013-7. Erratum in: Nat Commun. 14(1), 5970 (2023) doi: 10.1038/s41467-023-41786-6. PMID: 37080981; PMCID: PMC10119095.
- Birukova E., Khusainov D., Chajka A. [et al.] Participation of dopaminergic system in the dynamics of behavioral reactions of aging rats of both sexes under daily testing in the open field, BIO Web of Conferences, 30, 06003 (2021) DOI 10.1051/bioconf/20213006003. – EDN ONVIPE.
- Srifuengfung M., Abraham J., Avidan M. S., Lenze E. J. Perioperative Anxiety and Depression in Older Adults: Epidemiology and Treatment. Am J Geriatr Psychiatry, 31(11), 996 (2023) doi: 10.1016/j.jagp.2023.07.002. Epub 2023 Jul 8. PMID: 37482501; PMCID: PMC10592367