Ученые записки Крымского федерального университета имени В. И. Вернадского
Биология. Химия. Том 11 (77). 2025. № 2. С. 281–302.
УДК 616.379-008.64: 57.084.1
DOI 10.29039/2413-1725-2025-11-2-281-302
МЕТАБОЛИЧЕСКИЕ НАРУШЕНИЯ У КРЫС С АЛЛОКСАН-ИНДУЦИРОВАННЫМ ДИАБЕТОМ
Чуян Е. Н., Ливенцов С. Ю., Дворецкая Н. И.
Федеральное государственное автономное образовательное учреждение высшего
образования «Крымский федеральный университет им. В. И. Вернадского», Симферополь,
Республика Крым, Россия
E-mail: elena-chuyan@rambler.ru
Сахарный диабет является глобальной медико-социальной проблемой, требующей разработки новых подходов к изучению его патогенеза и лечения. Данное исследование посвящено анализу особенностей биохимических сдвигов у крыс линии Wistar (n=28) при аллоксановом диабете через два месяца после его индукции (внутрибрюшинно трижды по 100 мг/кг через сутки в суммарной дозе 300 мг/кг). Изменения биохимических показателей сыворотки крови крыс свидетельствуют о существенном нарушении углеводного, жирового, белкового и энергетического обменов и развитии воспалительного процесса, что может быть следствием нарушения функций и структуры не только поджелудочной железы, но и почек, печени, кровеносных сосудов и других органов. Установлены признаки органного поражения, включая деструктивные изменения в мышечной ткани, нарушение функций печени и ранние проявления диабетической нефропатии.
Ключевые слова: сахарный диабет; аллоксан-индуцированный диабет; биохимические показатели крови крыс; углеводный, жировой, белковый, энергетический обмены.
ВВЕДЕНИЕ
Сахарный диабет (СД) представляет собой одно из наиболее распространённых неинфекционных заболеваний, сопровождающееся хронической гипергликемией, обусловленной недостаточной секрецией инсулина или развитием резистентности к его действию. Распространение этого заболевания в настоящее время носит характер пандемии, и, согласно прогнозам, к середине XXI века количество больных СД превысит 700 миллионов человек [1]. Этиология инсулинозависимого диабета (СД 1 типа) полностью не изучена. Разрушение β-клеток при СД происходит медленно и постепенно, а механизм и последовательность патогенетических процессов до конца не выяснены. Однако если дефицит инсулина становится близким к абсолютному (при котором разрушается около 85 %
β-клеток), то развиваются тяжелые метаболические нарушения и наступает клиническая стадия заболевания, а хроническая гипергликемия приводит к развитию окислительного и нитрозативного стрессов, вторичных осложнений в виде различных видов микро- и макроангиопатий, способствуя поражению сердечно-сосудистой системы, почек, печени, нервной системы и других органов, что приводит к нетрудоспособности и инвалидизации населения [2–4].
Для исследования этиологии и патогенеза СД, а также разработки новых терапевтических подходов к его лечению широко применяются негенетические экспериментальные модели, основанные на повреждении островкового аппарата поджелудочной железы химическими агентами, в которых используются гидрофильные β-клеточные глюкозные аналоги, такие как аллоксан, стрептозотоцин, хлорозотоцин, ципрогептадин и др. [5–7]. Одним из наиболее часто используемых диабетогенных соединений для моделирования экспериментального диабета у лабораторных животных считается аллоксан (2, 4, 5, 6 – тетраоксипиримидин,
5, 6 – диоксиурацил), благодаря доступности и высокой эффективности. Его действие связано со структурным сходством с глюкозой и способностью селективно разрушать β-клетки островков Лангерганса, моделируя состояние, сходное с СД 1 типа [8–10].
В многочисленных исследованиях установлено, что на фоне введения аллоксана у лабораторных животных развиваются патологические изменения разной степени тяжести – от частичного нарушения секреции инсулина до тотального некроза
β-клеток поджелудочной железы, что препятствует регулирующему влиянию инсулина на метаболизм углеводов, белков и липидов и сопровождается патологиями почек, печени и других органов, а, следовательно, высокой летальностью животных [6, 11–13]. Проявления экспериментальной патологии во многом зависят от выбранной дозы соединения, пути его введения, частоты и временного интервала между инъекциями, вида, линии и возраста лабораторных животных, длительности исследования и некоторых других факторов, что позволяет моделировать раннюю или позднюю стадии СД. Поэтому представляется целесообразным разрабатывать собственные протоколы моделирования экспериментального аллоксан-индуцированного диабета в соответствии с поставленными целями исследования.
В наших исследованиях показано, что дробное введение аллоксана в суммарной дозе 300 мг/кг (троекратно по 100 мг/кг через сутки) приводит к наиболее выраженным метаболическим нарушениям, зарегистрированным на 30-е сутки после введения суммарной дозы соединения, на фоне статистически значимого снижения летальности крыс по сравнению с традиционным однократным введением аллоксана в дозах 150 и 200 мг/кг [13]. Известно, что после введения препарата у лабораторных животных развиваются нарушения обменных процессов, связанные с развитием СД, однако отдалённые последствия аллоксан-индуцированного диабета остаются малоизученными, что ограничивает возможность использования этой модели для исследования эффективности антидиабетических соединений в хронических экспериментах.
В связи с этим целью настоящего исследования явился анализ особенностей биохимических сдвигов у крыс линии Wistar при аллоксановом диабете через два месяца после его индукции.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальная часть исследования выполнена на базе Центра коллективного пользования научным оборудованием «Экспериментальная физиология и биофизика» кафедры физиологии человека и животных и биофизики Института биохимических технологий, экологии и фармации Крымского федерального университета имени В. И. Вернадского (ФГАОУ ВО «КФУ им. В. И. Вернадского»).
Эксперименты с животными выполнялись в соответствии с ГОСТ Р 53434-2009 от 02.12.2009, правилами лабораторной практики при проведении доклинических исследований, этическими стандартами, утвержденными правовыми актами Российской Федерации, ГОСТ 33215-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур», Директивой 2010/63/EU Европейского парламента и совета Европейского союза по охране животных, «European Convention for the Protectionof Vertebrate Animals Used for Experimental and other Scientific Purposes (ETS 123)», Strasbourg, 1986, рекомендациями Комиссии по биоэтике ФГАОУ ВО «КФУ им. В.И. Вернадского» (протокол №5 от 19.05.2022).
В работе использовались половозрелые самцы крыс линии Wistar (n=28), полученные из питомника лабораторных животных «Рапполово» (ФГБУ «Петербургский институт ядерной физики им. Б.П. Константинова» НИЦ «Курчатовский институт»). Содержание животных осуществлялось в условиях вивария при температуре 18–22°С и естественном цикле смены освещения на подстиле на основе кукурузных початков (ООО «Зилубаг», Россия). Крысы имели свободный доступ к воде и сбалансированному гранулированному корму ЛБК-120 (ЗАО «Тосненский комбикормовый завод», Россия). Животные не имели видимых патологий, физических отклонений или травм, не участвовали ранее в экспериментах, демонстрировали типичное для здоровых особей поведение. Перед началом исследования все особи прошли двухнедельный карантин и адаптацию к экспериментальным условиям, включая процедуру привыкания к контакту с человеком (хэндлинг). Средняя масса тела крыс в эксперименте составляла 257,60±24,64 г, средний возраст – 120,00±12,00 дней.
Перед началом эксперимента все животные были рандомным образом распределены на две группы: контрольную (К; n=10) и экспериментальную (Алл; n=18).
Модель аллоксан-индуцированного диабета создавали путём внутрибрюшинного введения крысам из экспериментальной группы (Алл) раствора аллоксан-моногидрата (C₄H₂N₂O₄·H₂O; «Диаэм», Россия) внутрибрюшинно трижды по 100 мг/кг в физиологическом растворе (0,2 мл) с интервалом в сутки, что обеспечивало суммарную дозу 300 мг/кг [13, 14]. Животные контрольной группы получали эквивалентный объём физиологического раствора (0,2 мл) в те же сроки.
В ходе исследования измеряли массу животных, поскольку она характеризует общее физиологическое состояние организма. Для этого всех животных взвешивали на весах AND DL-120 (Япония) перед введением аллоксана, а также на 7, 14, 21, 28, 35, 42, 49, 56, 61 сутки наблюдения.
Для анализа динамики гипергликемии, которая является характерным признаком СД, в эти же сроки наблюдения определяли концентрацию глюкозы (ммоль/л) в крови, отобранной из надреза кончика хвоста, с использованием тест-анализатора уровня сахара в крови (АйЧек (iCheck), Тайвань).
На 61-й день эксперимента в 10:00 утра проводили эвтаназию животных согласно требованиям, изложенным в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1997) методом декапитации на гильотине («НПК Открытая наука», Россия). Образцы крови, полученные из шейных вен, собирали в вакуумные пробирки с разделительным гелем для выделения сыворотки.
В сыворотке крови, которую получали путем двукратного центрифугирования (по 10 минут при 1300 g, 25°С) исследовали показатели, утвержденные ВОЗ и являющиеся критериями диагностики СД и других нарушений гликемии [15, 16].
Для оценки углеводного обмена в сыворотке крови определяли концентрации глюкозы (ммоль/л) с использованием метода Триндера [17], гликированного гемоглобина (HbA1c, %) – методом ионообменной жидкостной хроматографии [18], инсулина – хемилюминесцентным методом [19].
Оценка липидного обмена проводилась на основании содержания общего холестерина (ОХС, ммоль/л) и триглицеридов (ТГ, ммоль/л), измеренных модифицированным методом Триндера по Roeschlau [20, 21]. Уровни холестерина липопротеидов низкой (ЛПНП, ммоль/л) и высокой плотности (ЛПВП, ммоль/л) определяли с применением холестериноксидазной реакции и количественного метода Триндера [17, 22]. На основании полученных данных рассчитывали индекс атерогенности по формуле:
ИА = (ОХС – ЛПВП) / ЛПВП.
Для оценки белкового обмена измеряли концентрацию общего белка (ОБ, г/л) биуретовым методом [23], альбумина (г/л) в реакции с бромкрезоловым зелёным [24], мочевой кислоты (мкмоль/л) – уреазно-пероксидазным двухреагентным методом [25], мочевины (ммоль/л) – уреазным кинетическим ферментативным методом, а креатинина (мкмоль/л) – кинетическим методом Яффе без депротеинизации [24].
Лабораторное исследование активности ключевых метаболических ферментов, участвующих в биохимических процессах организма, включало анализ концентрации лактатдегидрогеназы (ЛДГ) оптимизированным кинетическим методом Генри с пируватом [26, 27], альфа-амилазы ферментативным фотометрическим тестом [28], креатинкиназы (КФК) – методом иммуноингибирования [27], гамма-глутамилтрансферазы (ГГТ) – у льтрафиолетовым методом [28], аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) – с применением УФ-метода без добавления пиридоксальфосфата [29], щелочной фосфатазы (ЩФ) – кинетическим фотометрическим методом [30]. Результаты были представлены в международных единицах активности ферментов (Ед/л).
Показатели пигментного обмена печени оценивали по уровню общего и прямого билирубина, определяемых фотометрическим методом с использованием 2,4-дихлоранилина [31]. Концентрации билирубина выражались в мкмоль/л.
Содержание С-реактивного белка (СРБ, мг/л) в сыворотке крови определяли методом высокочувствительной иммунотурбидиметрии, основанным на измерении конечной точки реакции антиген–антитело, при чувствительности метода около 0,13 мг/л и диапазоне измерений от 0 до 140 мг/л [32, 33].
Для статистической обработки данных и визуализации результатов использовали программы STATISTICA версии 12 (Statsoft, США) и Microsoft Excel 2010 (Microsoft Corporation, США). Проверку распределения данных на соответствие нормальному закону выполняли с применением критерия Шапиро–Уилка. Поскольку в большинстве случаев распределение не соответствовало нормальному, сравнение групп проводили с использованием непараметрического критерия Манна-Уитни. В таблицах, графиках и тексте данные представлены в формате медианы и квартильного размаха (Me (Q25:Q75)). Для описания различий между группами использовали процентные изменения, рассчитываемые по медианным значениям соответствующих групп. В исследовании критический уровень значимости статистических гипотез принимался равным 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При моделировании СД в эксперименте путем введения аллоксана смертность среди животных составляет обычно от 30 до 60 % [34]. В нашем исследовании расчет уровня смертности у крыс после введения диабетогенных доз аллоксана показал, что она составила 33,33 %. В контрольной группе гибель животных зарегистрирована не была.
Известно, что развитие СД 1 типа сопровождается снижением массы тела. Полученные результаты показали (рис. 1), что к концу эксперимента масса тела контрольных крыс существенно возросла (на 44,23 % относительно исходного уровня; p=0,009), тогда как масса тела экспериментальных животных снизилась на 12,80 % относительно исходного уровня и на 42,89 % по сравнению с значением этого показателя в контрольной группе крыс (p=0,023), что согласуется с результатами наших предыдущих исследований [13].
Развитие аллоксан-индуцированного диабета привело к изменению углеводного обмена у крыс. Концентрация глюкозы в периферической крови крыс контрольной группы на протяжении всего срока наблюдения (61 сутки) колебалась в пределах физиологической нормы: от 3,9 (3,3; 4,5) до 4,7 (4,6; 5,1) ммоль/л. При этом у крыс экспериментальной группы наблюдалось резкое повышение уровня глюкозы, достигавшее максимума на 7 – 14 сутки – 22,0 (19,7; 27,1) – 21,7 (18,85; 26,45) ммоль/л. В дальнейшем, начиная с 21-х суток наблюдения, зарегистрирована тенденция к снижению значений этого показателя, однако уровень глюкозы вышел на плато, продолжая достоверно превышать показатели контрольной группы на всём протяжении наблюдения (рис. 2), а на 61 сутки эксперимента гликемия в сыворотке крови составила 21,20 (19,40; 24,40) ммоль/л, превышая значения контрольной группы на 443,59 % (p<0,001) (табл. 1), что указывает на нарушение утилизации глюкозы клетками и развитие стойкого диабетического состояния [35–37].
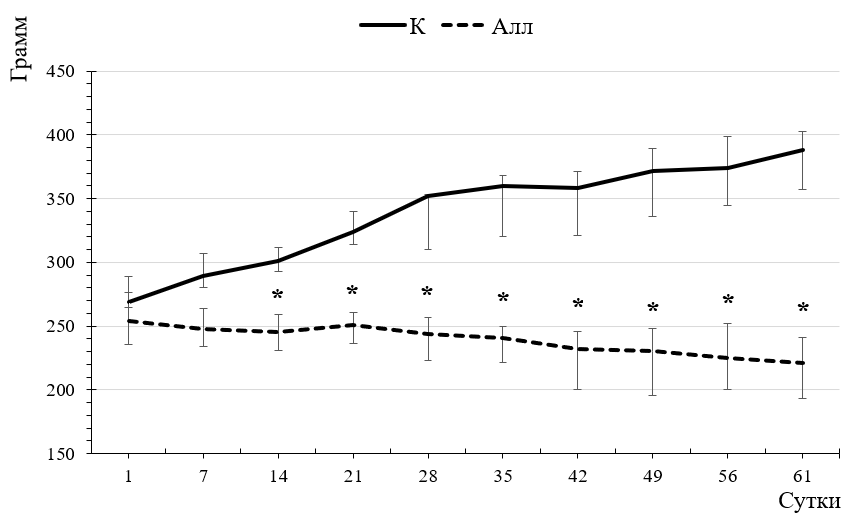
Рис. 1. Динамика массы тела (г) крыс контрольной (К) и экспериментальной (Алл) групп в течение всего срока наблюдения.
Примечание: на графике представлены значения в виде медианы и нижнего и верхнего квартилей (Me (Q25:Q75)); * статистически значимое отличие по критерию Манна-Уитни относительно значений показателей у крыс контрольной группы (p < 0,05).
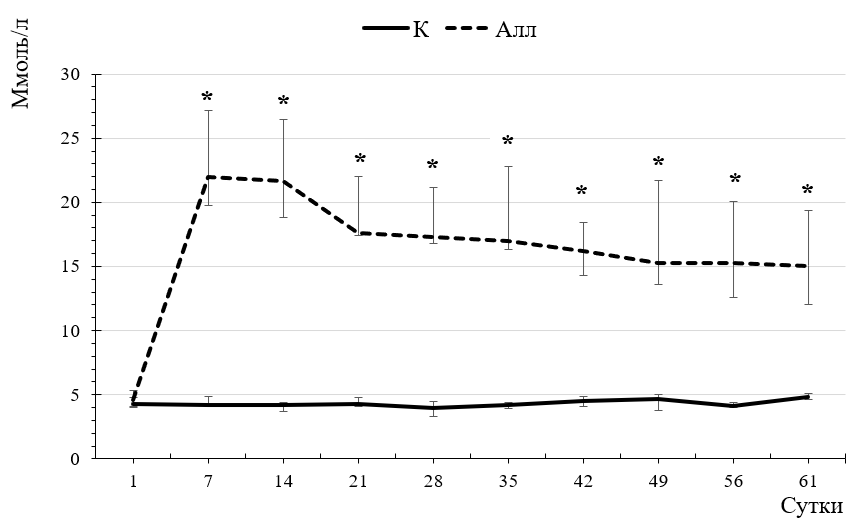
Рис. 2. Динамика концентрации глюкозы (ммоль/л) в периферической крови крыс контрольной (К) и экспериментальной (Алл) групп в течение всего срока наблюдения.
Примечание: то же, что на рис. 1.
Таблица 1
Изменение показателей углеводного обмена в сыворотке крови крыс в условиях развития аллоксан-индуцированного диабета (Me (Q1:Q3))
| Группа Показатели | Контроль (1) n=10 | Аллоксан (2) n=18 |
| Глюкоза (ммоль/л) | 3,90 (3,70; 3,95) | 21,20 (19,40;24,40) p1,2<0,001 |
| Гликированный гемоглобин (%) | 4,40 (4,00;4,60) | 6,90 (6,90;7,80) p1,2<0,001 |
| Инсулин (мкМЕ/мл) | 0,70 (0,65;0,70) | 0,30 (0,20;0,0) p1,2<0,001 |
Примечание: n – количество животных в группе; p1,2 – уровень значимости отличий между
1 и 2 группами животных по критерию Манна-Уитни.
Содержание гликированного гемоглобина в крови является биомаркером развития и течения СД, отражает длительность и степень гипергликемии. Считается, что этот показатель является более точным гликемическим индикатором, чем концентрация глюкозы в крови, поскольку более устойчив к стрессу и не зависит от приема пищи [38]. Уровень гликированного гемоглобина (HbA1c) у животных экспериментальной группы на 61-е сутки был достоверно выше значений контрольной группы на 56,82 % (p<0,001) (табл. 2).
Длительное состояние гипергликемии запускает в организме процессы гликирования белков, активизируются процессы неферментативного гликозилирования мембран эритроцитов и белков цитозоля. Повышение уровня HbA1c влияет на эффективность кислородтранспортной функции эритроцитов, поскольку HbA1c имеет повышенное сродство к O2, что затрудняет его возврат в клетки микроциркуляторного русла, и способствует развитию тканевой гипоксии [3, 38].
Таким образом, полученные данные подтверждают развитие стойкого и длительного гипергликемического состояния у крыс экспериментальной группы. Известно, что основным механизмом развития гипергликемии при аллоксан-индуцированном диабете является разрушение β-клеток островкового аппарата поджелудочной железы, что вызывает снижение синтеза и секреции в кровь инсулина [5, 39].
На 61-е сутки наблюдения у экспериментальных животных было выявлено достоверное снижение уровня инсулина на 57,14 % (p<0,001) по сравнению с контрольной группой (табл. 1). Эти данные согласуются с результатами других авторов [40–44] и отражают развитие выраженной инсулинопении. Поскольку инсулин играет роль ингибитора глюконеогенеза, то дефицит инсулина при СД вызывает интенсификацию этого процесса. Кроме того, выведение глюкозы из организма происходит с необходимым для этого процесса количеством воды и электролититов, в результате чего в организме наступает обезвоживание за счет образования кетоновых тел (ацетоацетата и β-гидроксибутирата), которые зарегистрированы у крыс с аллоксан-индуцированным диабетом в наших предыдущих исследованиях [13] и потери емкости бикарбонатной буферной системы крови с индукцией кетоацидоза [45].
Таблица 2
Изменение биохимических показателей белкового обмена в сыворотке крови крыс в условиях развития аллоксан-индуцированного диабета (Me (Q1:Q3))
| Группа Показатели | Контроль (1) n=10 | Аллоксан (2) n=18 |
| Общий белок (г/л) | 81,00 (78,50; 85,00) | 60,00 (58,00; 63,00) p1,2<0,001 |
| Мочевина (ммоль/л) | 7,60 (7,50; 8,15) | 11,30 (10,50; 11,60) p1,2<0,001 |
| Креатинин (мкмоль/л) | 78,00 (76,00; 81,50) | 38,50 (36,00; 40,00) p1,2<0,001 |
| Мочевая кислота (мкмоль/л) | 257,00 (218,50; 257,50) | 377,00 (321,00; 399,00) p1,2<0,001 |
| Альбумин (г/л) | 42,00 (41,00; 43,00) | 33,00 (32,00; 34,00) p1,2<0,001 |
Примечание: то же, что и в табл. 1.
Таким образом, развитие аллоксан-индуцированного диабета приводит к стойкому нарушению углеводного обмена, а инсулинопения препятствует регулирующему влиянию гормона на метаболизм не только глюкозы, но и белков и липидов.
Развитие аллоксан-индуцированного диабета в течение двух месяцев существенно отразилось на биохимических показателях, характеризующих белковый обмен.
Ранее нами были описаны изменения белкового обмена у крыс с аллоксан-индуцированным диабетом спустя 31 сутки после введения препарата [13]. Настоящее исследование подтвердило эти данные и показало, что выявленные изменения сохраняются у крыс в течение двух месяцев после введения суммарной дозы аллоксана (табл. 2). Зарегистрировано снижение содержания общего белка (на 25,93 %) на фоне значительного повышения уровня мочевины (на 48,66 %) по сравнению со значениями данных показателей у крыс контрольной группы (p<0,001), что характерно при развитии СД [46–48]. Выявленная гипопротеинемия может быть связана как с обезвоживанием организма, на что указывалось выше, так и с повышенным распадом белков, о чем свидетельствует снижение концентрации креатинина в сыворотке крови (на 50,64 %; p<0,001), поскольку его концентрация в моче и сыворотке крови коррелирует с оценкой мышечной массы. Выявлена также связь между снижением уровня креатинина в сыворотке крови с гиперфильтрацией почечных клубочков и с повышенным метаболическим риском СД [47, 48].
Выявлено, что у животных с аллоксан-индуцированным диабетом уровень мочевой кислоты в сыворотке крови, спустя два месяца после введения препарата, был повышен на 46 % (p<0,001) по сравнению с контрольной группой (табл. 2). Мочевая кислота является конечным продуктом обмена пуриновых оснований и в физиологических концентрациях обладает антиоксидантными свойствами, однако при избыточном накоплении может приобретать прооксидантные свойства и усиливать оксидативный стресс. Гиперурикемия свидетельствует о нарушении пуринового обмена, нарушении её экскреции почечными канальцами и может быть следствием диабетического кетоацидоза [49]. У животных экспериментальной группы наблюдалось достоверное снижение концентрации альбумина, основного плазменного белка, регулирующего онкотическое давление, поддерживающего кислотно-щелочной баланс и обладающего антиоксидантной активностью, на 21,43 % (p<0,001) по сравнению с контрольной группой (табл. 2), что указывает на наличие альбуминурии – маркера повреждения почек, связанного с нарушением фильтрационной функции и ранними проявлениями диабетической нефропатии [50–52].
Таким образом, на фоне гипергликемии и дефицита инсулина у крыс экспериментальной группы произошло нарушение белкового обмена, что связано с повышенным распадом тканевых белков, нарушением пуринового обмена и проявлениями диабетической нефропатии.
Через два месяца после индукции СД у животных произошли изменения показателей, характеризующие липиднный обмен (табл. 3).
Таблица 3
Изменение биохимических показателей липидного обмена в сыворотке крови крыс в условиях развития аллоксан-индуцированного диабета (Me (Q1:Q3))
| Группа Показатели | Контроль (1) n=10 | Аллоксан (2) n=18 |
| Холестерин (ммоль/л) | 1,54 (1,48; 1,59) | 2,22 (2,15; 2,44) p1,2<0,001 |
| Триглицериды (ммоль/л) | 1,10 (1,05; 1,16) | 2,10 (1,71; 2,33) p1,2<0,001 |
| ЛПВП (ммоль/л) | 0,85 (0,84; 0,92) | 0,31 (0,30; 0,35) p1,2<0,001 |
| ЛПНП (ммоль/л) | 0,20 (0,16; 0,22) | 1,48 (1,40; 1,50) p1,2<0,001 |
Примечание: то же, что и в табл. 1.
У крыс с аллоксан-индуцированным диабетом, содержание общего холестерина и триглицеридов достоверно возросло на 44,16 % и 90,91 % соответственно относительно показателей в контрольной группе (p<0,001), что свидетельствует о выраженной гиперхолестеринемии и согласуется с литературными данными о влиянии аллоксан-индуцированного диабета на уровень этих показателей [13, 35, 36, 53].
Избыточное образование триглицеридов в гепатоцитах вследствие массивного поступления свободных жирных кислот в печень приводит к развитию стеатоза, а также секреции повышенного количества триглицеридов в составе липопротеинов очень низкой, а затем и низкой плотности, способствующих накоплению продуктов их перекисного окисления и в итоге к повреждению гепатоцитов и к их некрозу [54].
Изменения также коснулись и фракций холестерина в составе липопротеидов: уровень ЛПВП, играющих важную роль в транспорте холестерина из периферических тканей в печень, снизился на 63,53 % относительно значения показателя контрольной группы (p<0,001), а концентрация ЛПНП, напротив, возросла на 640 % (p<0,001) относительно значений у животных в контроле. Установлено, что наличие глюкозы в среде окисления ЛПНП приводит к интенсификации их свободнорадикального окисления вследствие продукции супероксидных анион радикалов в процессе аутоокисления глюкозы [55]. В результате изменения соотношения основных фракций холестерина у крыс с аллоксановым диабетом индекс атерогенности составил 6,00 (5,93;6,62), что в 7,6 раз выше, чем у крыс в контрольной группе (p<0,001) и указывает на наличие у животных с аллоксановым диабетом атеросклеротических изменений сосудистого русла и высокий риск развития диабетической ангиопатии [56, 57].
Результатом гипергликемии, избыточного накопления продуктов неферментативного гликозилирования в клетках, а также нарушения белкового и липидного обменов является истощение энергетических ресурсов, причем глубина сдвигов энергопродуцирующего аппарата коррелирует с тяжестью метаболических нарушений, что подчеркивает тесную связь между энергетическими и пластическими нарушениями. Действительно, у животных с аллоксан-индуцированным диабетом выявлено существенное изменение активности ферментов сыворотки крови (рис. 3). Так, содержание КФК в сыворотке крови, одного из ключевых ферментов, участвующих в обеспечении энергетических процессов, особенно в мышечной и нервной тканях, снизилось на 71,15 % (p<0,001).
Содержание альфа-амилазы в сыворотке крови крыс с аллоксановым диабетом снизилось на 61,35 % (p<0,001) по сравнению с контролем, поскольку на фоне хронической гипергликемии, оксидативного стресса и воспаления при СД 1 типа разрушаются не только β-клетки поджелудочной железы, но страдает и экзокринная часть органа [58, 59]. Кроме того, аутоиммунные процессы при СД могут вызывать образование аутоантител к α-амилазе, что дополнительно снижает её активность Таким образом, уменьшение содержания α-амилазы при СД1 обусловлено как структурными изменениями в поджелудочной железе, так и аутоиммунными механизмами, что отражает нарушение экзокринной функции органа [60].
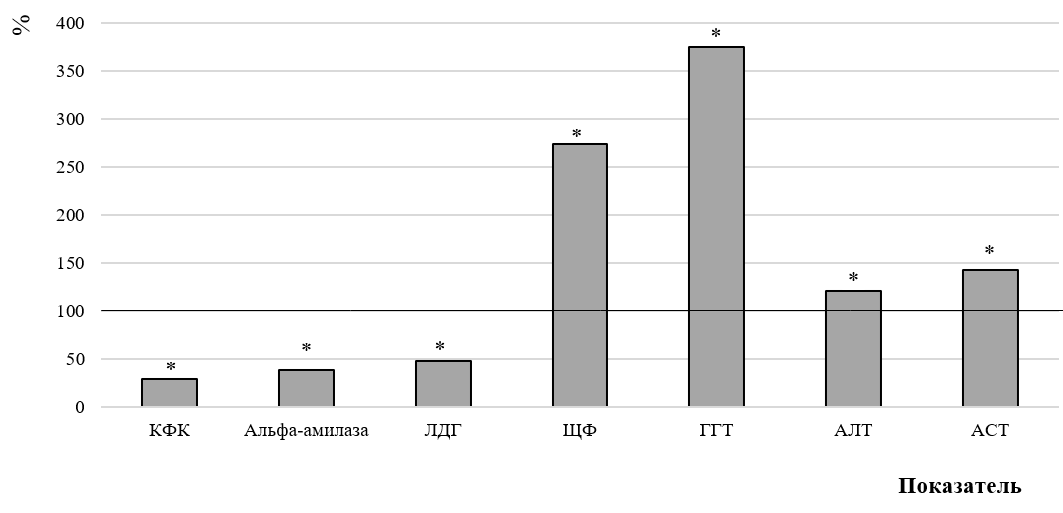
Рис. 3. Изменение показателей ферментного обмена в сыворотке крови крыс в условиях развития аллоксан-индуцированного диабета (в % относительно значений у животных контрольной группы, принятых за 100 %).
Развитие СД вызывает нарушения функциональной и ферментативной активности печени, в результате чего из ее ткани высвобождается большое количество ферментов внутриклеточной локализации. Печень является одним из центральных органов, участвующих в регуляции метаболических процессов, и при развитии инсулинозависимого сахарного диабета в ней наблюдаются выраженные изменения, связанные с усилением липолиза, глюконеогенеза, а также с ростом активности ферментов, вовлечённых в катаболизм и синтез глюкозы [61]. В условиях инсулинорезистентности печень активирует синтез глюкозы с использованием субстратов глюконеогенеза – лактата, аминокислот и глицерина, при этом одновременно усиливается гликогенолиз и снижается активность гликогенеза, что в совокупности приводит к устойчивому повышению уровня глюкозы в крови [62].
У животных с аллоксан-индуцированным диабетом, спустя два месяца после введения препарата, зафиксировано статистически значимое повышение активности АЛТ на 57,87 % (p=0,005), АСТ на 43,1 % (p=0,001), ЩФ в 2,7 раза по сравнению с контрольной группой (p<0,001), ГГТ на 275 % (p<0,001) по сравнению с контрольной группой. АЛТ участвует в глюкозо-аланиновом цикле, способствуя образованию пирувата, предшественника глюконеогенеза, и глутамата, необходимого для цикла мочевины. Основная локализация АЛТ приходится на гепатоциты, а его повышение в плазме крови является маркером повреждения печёночных клеток. АСТ, в отличие от АЛТ, помимо печени содержится практически во всех органах и принимает участие в функционировании малат-аспартатного шунта, способствуя образованию оксалоацетата, играющего ключевую роль в цикле трикарбоновых кислот (Кребса), что отражает нарушения энергетического обмена как в печени, так и в мышечной и сердечной тканях.
ЩФ локализуется в мембранах желчных канальцев и участвует в процессах выделения желчи, катализируя отщепление фосфатных групп [63]. Рост активности этого фермента при СД может быть обусловлен развитием холестатических явлений вследствие нарушения экскреторной функции печени, что сопровождается усилением синтеза фермента в гепатоцитах [64]. ГГТ представляет собой мембраносвязанный фермент, преимущественно локализованный в эпителии желчных протоков и почечных канальцев, который играет важную роль в антиоксидантной защите клеток, участвуя в транспорте аминокислот за счёт переноса γ-глутамильного остатка с глутатиона [65]. Повышение активности данного фермента рассматривается как индикатор оксидативного стресса, возникающего в условиях стеатогепатоза, характерного для диабетических нарушений обмена веществ [66].
На фоне указанных изменений зарегистрировано снижение содержания в сыворотке крови ЛДГ на 51,99 % (p=0,025) по сравнению с контрольной группой (рис. 3), которая катализирует обратимое превращение пирувата в лактат в процессе анаэробного гликолиза, и её активность служит маркером использования углеводов в условиях недостатка кислорода. Снижение уровня ЛДГ может отражать угнетение этого пути утилизации глюкозы, а также переход клеток на альтернативные пути получения энергии, включая β-окисление жирных кислот и кетогенез, что характерно для инсулинозависимого диабета [61].
На фоне описанных изменений активности ферментов у животных с индуцированным диабетом отмечено снижение уровня общего билирубина на 29,63 % (p<0,001) по сравнению с контролем (табл. 4), что может отражать нарушение процессов образования и метаболизма билирубина в условиях углеводного дисбаланса. При этом изменения содержания прямого и непрямого билирубина также статистически значимо отличались (p<0,001).
Таблица 4
Изменение билирубина в сыворотке крови крыс при развитии аллоксан-индуцированного диабета (Me (Q1:Q3))
| Группа Показатели | Контроль (1) n=10 | Аллоксан (2) n=18 |
| Билирубин общий (мкмоль/л) | 2,70 (2,55; 3,10) | 1,90 (1,80; 2,00) p1,2<0,001 |
| Билирубин прямой (мкмоль/л) | 1,30 (1,20; 1,35) | 1,12 (0,90; 1,30) p1,2<0,001 |
| Билирубин непрямой (мкмоль/л) | 1,60 (1,30; 1,90) | 0,70 (0,50; 1,10) p1,2<0,001 |
Примечание: то же, что и в табл. 1.
Билирубин является конечным продуктом катаболизма гема в системном кровотоке, который образуется под действием гем-оксидазы (HMOX), фермента, который расщепляет циклический тетрапиррольный гем на биливердин, монооксид углерода и двухвалентное железо. В обзоре [67] представлена подробная информация об экспериментальных и клинических доказательствах связи между HMOX, билирубином и различными патологиями, в которых установлено, что уровень билирубина в сыворотке крови отрицательно коррелирует с факторами риска, такими как артериальная гипертензия, СД, метаболический синдром и ожирение. Эти данные не только показывают защитное действие билирубина как такового, но и продуктов катаболического пути гемолиза, таких как биливердин и монооксид углерода, а также ключевых ферментов этого пути (гем-оксидазы и биливердин-редуктазы). Также было показано, что билирубин существенно влияет на систему комплемента со всеми возможными защитными последствиями [68]. В соответствии с этими данными, существуют исследования, которые продемонстрировали отрицательную взаимосвязь между уровнем билирубина в сыворотке крови и уровнем С-реактивного белка [69], что согласуется с результатами, полученными в настоящем исследовании (рис. 4) и ещё раз подчёркивает защитную роль билирубина в патогенезе хронических заболеваний, в том числе СД.
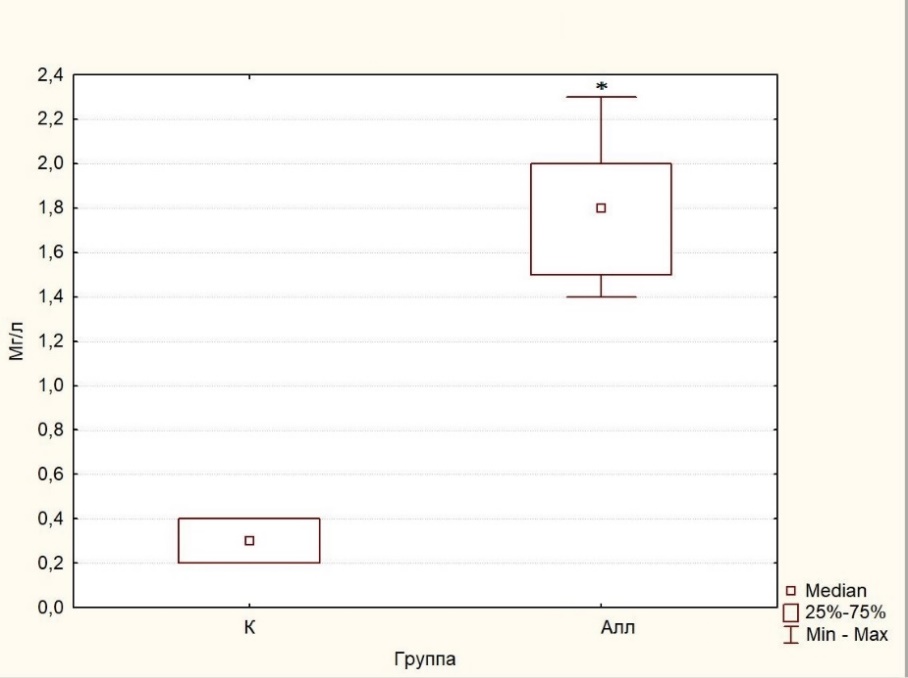
Рис. 4. Изменение С-реактивного белка (мг/л) в плазме крови крыс контрольной (К) и экспериментальной (Алл) групп.
Содержание С-реактивного белка, который синтезируется гепатоцитами, спустя два месяца после введения суммарной дозы аллоксана, увеличилось в 6 раз по сравнению с контролем (p<0,001), что указывает на выраженное воспаление. Гипергликемия в крови стимулирует выработку избыточного количества свободных радикалов, в том числе активных форм кислорода и активных форм азота, которые вызывают окислительный стресс, воспалительную реакцию, характеризующуюся повышением уровня С-реактивного белка в крови [70–72].
Таким образом, развитие аллоксан-индуцированного диабета сопровождается выраженными нарушениями функции печени, что проявляется активацией глюконеогенеза, повышением активности ферментов АЛТ и АСТ, свидетельствующих о повреждении гепатоцитов и нарушении аминокислотного обмена. Достоверный рост активности ГГТ и ЩФ указывает на развитие оксидативного стресса, нарушение антиоксидантной защиты и возможные холестатические изменения, ассоциированные с жировой инфильтрацией печени. Совокупность полученных данных отражает глубокую метаболическую перестройку в гепатоцитах при диабете, связанную как с дефицитом инсулина, так и с хронической гипергликемией, ведущие к избыточному захвату глюкозы гепатоцитами и последующему ее фосфорилированию [73]. Значимые патологические изменения печеночной ткани при СД 1 подтверждены в экспериментальных моделях [74] и клинических исследованиях [75].
ЗАКЛЮЧЕНИЕ
Проведённое исследование показало, что дробное внутрибрюшинное введение аллоксана в суммарной дозе 300 мг/кг формирует у экспериментальных животных устойчивую и воспроизводимую модель СД 1 типа с умеренной летальностью (33,33 %), прогрессирующей потерей массы тела и выраженными метаболическими нарушениями, которые сохраняются в течение двух месяцев, а, следовательно, позволяют использовать данную модель в хронических экспериментах с целью поиска новых терапевтических подходов к лечению этого заболевания и его осложнений. Данная экспериментальная модель достоверно воспроизводит ключевые звенья патогенеза инсулинозависимого диабета тяжелой степени и может быть рекомендована для проведения длительных экспериментальных исследований, тестирования лекарственных средств и оценки эффективности подходов, направленных на коррекцию метаболических и органных нарушений при СД.
Выявленные изменения биохимических показателей сыворотки крови крыс свидетельствуют о существенном нарушении углеводного, жирового, белкового и энергетического обменов, развитии воспалительного процесса и оксидативного стресса, что может быть следствием нарушения функций и структуры не только поджелудочной железы, но и печени, почек, кровеносных сосудов и других органов. Установлены признаки органного поражения в мышечной ткани, нарушение функции печени и ранние проявления диабетической нефропатии.
Полученные результаты дополняют современные представления о механизмах развития СД, глубине метаболических сдвигов в условиях экспериментального аллоксанового диабета и могут служить основой для дальнейших исследований в области этиологии и патогенеза печеночной патологии при СД.
Работа выполнена в рамках программы исследований № АААА-А21-121011990099-6 «Физиологические механизмы биологического действия факторов разной природы и интенсивности» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского».
Список литературы
- Sun H. IDF diabetes atlas: global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045 / H. Sun, P. Saeedi, S. Karuranga [et al.] // Diabetes Res. Clin. Pract. – 2022. – Vol. 183. – P. 109–119.
- Stanifer J. W. Prevalence, risk factors, and complications of diabetes in the Kilimanjaro region: a population-based study from Tanzania / J. W. Stanifer, C. R. Cleland, G. J. Makuka [et al.] // PLoS One. – 2016. – Vol. 11, No. 10. – P. e0164428.
- Дедов И. И. Сахарный диабет в Российской Федерации: распространенность, заболеваемость, смертность, параметры углеводного обмена и структура сахароснижающей терапии по данным федерального регистра сахарного диабета, статус 2017 г. / И. И. Дедов, М. В. Шестакова, О. К. Викулова [и др.] // Сахарный диабет. – 2018. – Т. 21, № 3. – С. 6–17.
- Jwad M. Types of diabetes and their effect on the immune system / M. Jwad, H. Yousif Al-Fatlawi, P. D. Student // J. Adv. Pharm. Pract. – 2022. – Vol. 4, No. 1. – P. 21–30.
- Lenzen S. The mechanisms of alloxan- and streptozotocin-induced diabetes / S. Lenzen // Diabetologia. – 2008. – Vol. 51. – P. 216–226.
- Пальчикова Н. А. Гормонально-биохимические особенности аллоксановой и стрептозотоциновой моделей экспериментального диабета / Н. А. Пальчикова, Н. В. Кузнецова, О. И. Кузьминова, В. Г. Селятицкая // Бюл. СО РАМН. – 2013. – Т. 33, № 6. – С. 18–24.
- Zakaria Z. Z. Animal models in type 2 diabetes mellitus research: pros and cons / Z. Z. Zakaria, M. N. Ahmad, N. A. Qinna // Jordan J. Agric. Sci. – 2021. – Vol. 17. – P. 425–440. – DOI: 10.35516/jjas.v17i4.
- Gati M. A. Physiological and histological study of experimental diabetes mellitus by alloxan / M. A. Gati // Int. J. Adv. Res. – 2016. – Vol. 4, No. 3. – P. 1814–1818.
- Бафаев Ж. Т. Особенности типологических свойств животных в клиническом течении экспериментальной модели аллоксанового диабета / Ж. Т. Бафаев, А. А. Мавланов, З. Н. Хамидова // Новый день в медицине. – 2022. – Т. 1, № 39. – С. 257–263.
- Rashmi P. Rodent models for diabetes / P. Rashmi, A. Urmila, A. Likhit [et al.] // 3 Biotech. – 2023. – Vol. 13. – P. 80. – DOI: 10.1007/s13205-023-03488-0.
- Elsner M. Importance of the GLUT2 glucose transporter for pancreatic beta cell toxicity of alloxan / M. Elsner, M. Tiedge, B. Guldbakke [et al.] // Diabetologia. – 2002. – Vol. 45, No. 11. – P. 1542–1549.
- Radenković M. Experimental diabetes induced by alloxan and streptozotocin: the current state of the art / M. Radenković, M. Stojanović, M. Prostran // J. Pharmacol. Toxicol. Methods. – 2016. – Vol. 78. – P. 13–31.
- Чуян Е. Н. Особенности изменения биохимических показателей крови крыс в условиях разных экспериментальных моделей аллоксан-индуцированного диабета / Е. Н. Чуян, С. Ю. Ливенцов, Н. И. Дворецкая // Учёные записки КФУ им. В. И. Вернадского. Серия: Биология. Химия. – 2025. – Т. 11 (77), № 1. – С. 226–249.
- Данилова И. Г. Способ моделирования аллоксанового диабета / И. Г. Данилова, И. Ф. Гетте: Патент на изобретение № 2534411; заявл. 27.11.2014; опубл. 27.11.2014. – Бюл. № 33.
- Care D. American Diabetes Association. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes–2019 // Diabetes Care. – 2019. – Vol. 42, Suppl. 1. – P. S13–S28. – DOI: 10.2337/dc19-S002.
- Дедов И. И. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. И. И. Дедова, М. В. Шестаковой, А. Ю. Майорова. – 9-й вып. // Сахарный диабет [Интернет]. – 2019. – Т. 22, № 1S. – DOI: 10.14341/DM221S1.
- Barcham D. An improved color reagent for the determination of blood glucose by the oxidase systeme / D. Barcham, P. Trinder // Analyst. – 1972. – Vol. 97, No. 151. – P. 142–145.
- Little R. R. Standardization of HbA1c Measurement / R. R. Little, C. L. Rohlfing, D. B. Sacks // Clin. Chem. – 2007. – Vol. 53, No. 6. – P. 810–817. – DOI: 10.1373/clinchem.2007.091967.
- Sacks D. B. Insulin assays and reference values / D. B. Sacks // Diabetes Metab. – 2007. – Vol. 33, No. 5. – P. 459–464. – DOI: 10.1016/S1262-3636(07)80059-5.
- Allain C. Enzymatic determination of total serum cholesterol / C. Allain, L. Poon, G. Chan [et al.] // Clin. Chem. – 1974. – Vol. 20, No. 4. – P. 470–475.
- Roeschlau P. Enzymatische Bestimmung des Gesampt-Cholesterins in Serum / P. Roeschlau, E. Bernt, W. A. Gruber // Clin. Chem. Clin. Biochem. – 1974. – Vol. 12, No. 5. – P. 226–227.
- Nauk M. Measurement of high-density-lipoprotein cholesterol / M. Nauk, D. Wiebe, G. Warnick // Handbook of Lipoprotein Testing. – 2nd ed. – Washington DC: AACC Press, 2001. – P. 221–244.
- Cornall A. G. Determination of serum proteins by means of the biuret reaction / A. G. Cornall, C. J. Bardawill, M. M. David // J. Biol. Chem. – 1949. – Vol. 177, No. 2. – P. 751–766.
- Burtis C. A. Tietz Textbook of Clinical Chemistry and Molecular Diagnostics / C. A. Burtis, E. R. Ashwood, D. E. Bruns. – 5th ed. – St. Louis: Elsevier, 2012.
- Fossati P. Use of 3,5-dichloro-2-hydroxybenzenesulfonic acid/4-aminophenazone chromogenic system in direct enzymic assay of uric acid in serum and urine / P. Fossati, L. Prencipe, G. Berti // Clin. Chem. – 1980. – Vol. 26, No. 2. – P. 227–231.
- Henry R. J. Revised spectrophotometric methods for the determination of glutamic-oxalacetic transaminase, glutamic-pyruvic transaminase, and lactic acid dehydrogenase / R. J. Henry, N. Chiamori, O. J. Golub, S. Berkman // Am. J. Clin. Pathol. – 1960. – Vol. 34. – P. 381–398. – DOI: 10.1093/ajcp/34.4_ts.381.
- Stein W. Creatine kinase (total activity), creatine kinase isoenzymes and variants / W. Stein // In: Clinical Laboratory Diagnostics: Use and Assessment of Clinical Laboratory Results. – Frankfurt: TH-Books Verlagsgesellschaft, 1998. – P. 71–80.
- Долгов В. В. Клиническая лабораторная диагностика. Национальное руководство. Том 1 / В. В. Долгов, В. В. Меньшиков. – М.: ГЭОТАР-Медиа, 2013.
- Moss D. W. Clinical enzymology / D. W. Moss, A. R. Henderson // In: Tietz Textbook of Clinical Chemistry. – 3rd ed. – Philadelphia: WB Saunders Company, 1999. – P. 617–721.
- Fachbach F. Age-dependent reference limits of several enzymes in plasma at different measuring temperatures / F. Fachbach, B. Zawta // Klin. Lab. – 1992. – Vol. 38. – P. 555–561.
- Guder W. G. The quality of diagnostic samples / W. G. Guder, B. Zawta [et al.]. – 1st ed. – Darmstadt: GIT Verlag, 2001. – P. 14–15.
- Claus D. R. Radioimmunoassay of human C-reactive protein and levels in normal sera / D. R. Claus, A. P. Osmand, H. Gewurz // J. Lab. Clin. Med. – 1976. – Vol. 87. – P. 120–128.
- Hind C. R. H. The role of serum C-reactive protein (CRP) measurement in clinical practice / C. R. H. Hind, M. B. Pepys // Int. Med. – 1984. – Vol. 5. – P. 112–151.
- Ярмолинская М. И. Экспериментальные модели сахарного диабета 1-го типа / М. И. Ярмолинская, Н. Ю. Андреева, Е. И. Абашова, Е. В. Мишарина // Журнал акушерства и женских болезней. – 2019. – Т. 68. № 2. – C. 109–118.
- Эльбекьян К. С. Особенности протекания аллоксан-индуцированного сахарного диабета у экспериментальных крыс / К. С. Эльбекьян, А. Б. Ходжаян, Ф. А. Биджиева [и др.] // Медицинский вестник Северного Кавказа. – 2019. – Т. 14, № 1.2. – С. 264–267.
- Биджиева Ф. А. Биохимические особенности аллоксан-индуцированного сахарного диабета / Ф. А. Биджиева // Медицинский алфавит. – 2018. – Т. 31, № 2. – С. 12–14.
- Fajarwati I. Administration of alloxan and streptozotocin in Sprague Dawley rats and the challenges in producing diabetes model / I. Fajarwati, D. D. Solihin, T. Wresdiyati, I. Batubara // IOP Conf. Ser.: Earth Environ. Sci. – 2023. – Vol. 1174, No. 1. – P. 012035.
- Maleki V. The effect of resveratrol on advanced glycation end products in diabetes mellitus: a systematic review / V. Maleki [et al.] // Arch. Physiol. Biochem. – 2020. – Vol. 126, No. 6. – P. 1–10.
- Яшанова М. И. Валидность моделей экспериментального диабета для изучения окислительного стресса / М. И. Яшанова, Т. Г. Щербатюк, В. Ю. Николаев // Журн. медико-биологических исследований. – 2019. – Т. 7, № 1. – С. 66–78. – DOI: 10.17238/issn2542-1298.2019.7.1.66.
- Джафарова Р. Э. Сравнительное исследование различных моделей аллоксан-индуцированного сахарного диабета / Р. Э. Джафарова // Казанский медицинский журнал. – 2013. – № 6.
- Игнатчик Д. А. Влияние аллоксана и стрептозотоцина на уровень инсулина и систему глутатиона в тканях животных [Электронный ресурс] / Д. А. Игнатчик // Актуальные проблемы современной медицины и фармации 2020: сб. тез. докл. LXXIV Междунар. науч.-практ. конф. студентов и молодых ученых, 15–17 апр. Минск, 2020 г. / Под ред. А. В. Сикорского, В. Я. Хрыщановича. – Минск: БГМУ, 2020. – С. 146.
- Ломаева С. В. Особенности обмена биополимеров соединительной ткани в печени крыс с аллоксановым диабетом / С. В. Ломаева, И. Ф. Гетте, Т. С. Булавинцева [и др.] // Бюл. сиб. медицины. – 2013. – Т. 12, № 6. – С. 38–42.
- Михайличенко В. Ю. Эффект трансплантации культуры клеток поджелудочной железы при аллоксановом сахарном диабете у крыс в эксперименте / В. Ю. Михайличенко, С. С. Столяров // Междунар. журн. прикладных и фундаментальных исследований. – 2015. – № 9. – С. 670–672.
- Данилова И. Г. Цитокиновая регуляция регенераторных процессов в поджелудочной железе при аллоксановом сахарном диабете у крыс и его коррекции соединением ряда 1,3,4-тиадиазина и липоевой кислотой / И. Г. Данилова, В. В. Емельянов, И. Ф. Гетте [и др.] // Мед. иммунология. – 2018. – Т. 20, № 1. – С. 35–44.
- Kitabchi A. E. Thirty years of personal experience in hyperglycemic crises: diabetic ketoacidosis and hyperglycemic hyperosmolar state / A. E. Kitabchi, G. E. Umpierrez, J. N. Fisher, M. B. Murphy, F. B. Stentz // J. Clin. Endocrinol. Metab. – 2008. – Vol. 93. – P. 1541–1552. – DOI: 10.1210/jc.2007-2577.
- Harita N. Lower serum creatinine is a new risk factor of type 2 diabetes: the Kansai healthcare study / N. Harita, T. Hayashi, K. K. Sato [et al.] // Diabetes Care. – 2009. – Vol. 32. – P. 424–426.
- Lorenzo C. Risk of type 2 diabetes among individuals with high and low glomerular filtration rates / C. Lorenzo, S. D. Nath, A. J. Hanley [et al.] // Diabetologia. – 2009. – Vol. 52. – P. 1290–1297.
- Hjelmesæth J. Low serum creatinine is associated with type 2 diabetes in morbidly obese women and men: a cross-sectional study / J. Hjelmesæth, J. Røislien, N. Nordstrand [et al.] // BMC Endocr. Disord. – 2010. – Vol. 10. – P. 6.
- Мадянов И. В. Мочевая кислота и сахарный диабет. Промежуточные итоги многолетних исследований / И. В. Мадянов // Здравоохранение Чувашии. – 2017. – № 2. – С. 59–64.
- Шестакова М. В. Сахарный диабет и хроническая болезнь почек: возможности прогнозирования, ранней диагностики и нефропротекции в XXI веке / М. В. Шестакова // Терапевт. архив. – 2016. – Т. 88, № 6. – С. 84–88.
- Лебедева Н. О. Маркеры доклинической диагностики диабетической нефропатии у пациентов с сахарным диабетом 1 типа / Н. О. Лебедева, О. К. Викулова // Сахарный диабет. – 2012. – № 2. – С. 38–45.
- Климонтов В. В. Хроническая болезнь почек при сахарном диабете / В. В. Климонтов, А. И. Корбут // Терапевт. архив. – 2020. – № 5. – С. 58–58.
- Mistry J. Antidiabetic activity of mango peel extract and mangiferin in alloxan-induced diabetic rats / J. Mistry, M. Biswas, S. Sarkar [et al.] // Futur. J. Pharm. Sci. – 2023. – Vol. 9. – P. 22.
- Kleiner D. E. Histology of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis in adults and children / D. E. Kleiner, H. R. Makhlouf // Clin. Liver Dis. – 2016. – Vol. 20, No. 2. – P. 293–312.
- Lankin V. Z. The initiation of the free radical peroxidation of low density lipoproteins by glucose and its metabolite methylglyoxal: a common molecular mechanism of vascular wall injury in atherosclerosis and diabetes / V. Z. Lankin, G. G. Konovalova, A. K. Tikhaze [et al.] // Mol. Cell. Biochem. – 2014. – Vol. 395. – P. 241–252.
- Van L. S. High-density lipoprotein at the interface of type 2 diabetes mellitus and cardiovascular disorders / L. S. Van [et al.] // Curr. Pharm. Des. – 2010. – Vol. 16. – P. 1504–1516.
- Андрейченко И. А. Информативность изменений биохимических параметров сыворотки крови при сахарном диабете 2-го типа / И. А. Андрейченко, С. Д. Галкин // Вестн. новых мед. технологий. – 2011. – № 4. – С. 184–186.
- Kusmartseva I. Temporal analysis of amylase expression in control, autoantibody-positive, and type 1 diabetes pancreatic tissues / I. Kusmartseva, M. Beery, H. Hiller [et al.] // Diabetes. – 2020. – Vol. 69, No. 1. – P. 60–66. – DOI: 10.2337/db19-0554.
- Ross J. J. Exocrine pancreatic enzymes are a serological biomarker for type 1 diabetes staging and pancreas size / J. J. Ross, C. H. Wasserfall, R. Bacher [et al.] // Diabetes. – 2021. – Vol. 70, No. 4. – P. 944–954. – DOI: 10.2337/db20-0995.
- Endo T. Amylase α-2A autoantibodies: novel marker of autoimmune pancreatitis and fulminant type 1 diabetes / T. Endo, S. Takizawa, S. Tanaka [et al.] // Diabetes. – 2009. – Vol. 58, No. 3. – P. 732–737. – DOI: 10.2337/db08-0493.
- Eprintsev A. T. Expression levels and activity of rat liver lactate dehydrogenase isoenzymes in alloxan diabetes / A. T. Eprintsev, I. R. Bondareva, N. V. Selivanova // Biochem. (Moscow), Suppl. Series B: Biomedical Chemistry. – 2022. – Vol. 16, No. 3. – P. 210–215.
- Сатторова М. А. Эуфорбин-3 и Глабра на течение патологического процесса аллоксан-индуцированного сахарного диабета / М. А. Сатторова, М. А. Мустафакулов // Modern Educational System and Innovative Teaching Solutions. – 2024. – Т. 1, № 1. – С. 202–210.
- Мусатов О. В. Активность щелочной фосфатазы сыворотки крови в зависимости от вида операции при ранах печени, селезёнки и почки в эксперименте / О. В. Мусатов, С. А. Зурнаджан, А. В. Коханов // Астраханский мед. журн. – 2017. – Т. 12, № 2. – С. 63–69.
- Бутолин Е. Г. Изменение содержания минеральных веществ в костной ткани у крыс с экспериментальным диабетом / Е. Г. Бутолин [и др.] // Вестн. Удмуртского ун-та. Сер. Биология. Науки о Земле. – 2017. – Т. 27, № 3. – С. 332–337.
- Терентьева М. Г. Изменение активности гамма-глутамилтрансферазы в тканях печени у крольчат в разные фазы постнатального онтогенеза / М. Г. Терентьева, Н. В. Мардарьева, Н. В. Щипцова // Вестн. Ульяновской гос. сельскохоз. акад. – 2021. – № 3 (55). – С. 151–155.
- Собирова Д. Р. Роль и взаимодействие креатинфосфокиназы и гамма-глутамилтранспептидазы в развитии сахарного диабета и их значение в патогенезе бронхолёгочных заболеваний / Д. Р. Собирова. – 2024.
- Vítek L. The role of bilirubin in diabetes, metabolic syndrome, and cardiovascular diseases / L. Vítek // Front. Pharmacol. – 2012. – Vol. 3. – P. 55.
- Basiglio C. L. Complement activation and disease: protective effects of hyperbilirubinaemia / C. L. Basiglio, S. M. Arriaga, F. Pelusa [et al.] // Clin. Sci. – 2010. – Vol. 118. – P. 99–113.
- Hwang H. J. Relationship between bilirubin and C-reactive protein / H. J. Hwang, S. W. Lee, S. H. Kim // Clin. Chem. Lab. Med. – 2011. – Vol. 49. – P. 1823–1828.
- Richardson S. J. The prevalence of enteroviral capsid protein Vp1 immunostaining in pancreatic islets in human type 1 diabetes / S. J. Richardson, A. Willcox, A. J. Bone, A. K. Foulis, N. G. Morgan // Diabetologia. – 2009. – Vol. 52. – P. 1143–1151.
- Asmat U. Diabetes mellitus and oxidative stress – a concise review / U. Asmat, K. Abad, K. Ismail // Saudi Pharm. J. – 2016. – Vol. 24, No. 5. – P. 547–553.
- Suryadinata R. V. Effectiveness of lime peel extract (Citrus aurantifolia Swingle) against C-reactive protein levels in alloxan-induced Wistar rats / R. V. Suryadinata, A. Lorensia, K. Sefania // Glob. Med. Health Commun. – 2021. – Vol. 9, No. 1. – P. 23–28.
- Ferrer J. C. Control of glycogen deposition / J. C. Ferrer, C. Favre, R. R. Gomis, J. M. Fernández-Novell, M. García-Rocha, N. de la Iglesia [et al.] // FEBS Lett. – 2003. – Vol. 546, No. 1. – P. 127–132. – DOI: 10.1016/S0014-5793(03)00565-9.
- Jiang S. Hepatic functional and pathological changes of type 1 diabetic mice in growing and maturation time / S. Jiang, X. Tang, K. Wang, Y. Liang, Y. Qian, C. Lu [et al.] // J. Cell. Mol. Med. – 2019. – Vol. 23, No. 8. – P. 5794–5807. – DOI: 10.1111/jcmm.14504.
- Буеверов А. О. Поражение печени при сахарном диабете 1-го типа / А. О. Буеверов, А. В. Зилов // Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. – 2021. – Т. 31, № 2. – С. 7–13. – DOI: 10.22416/1382-4376-2021-31-2-7-13.
METABOLIC DISORDERS IN RATS WITH ALLOXAN-INDUCED DIABETES
Chuyan E. N., Liventsov S. Yu., Dvoretskaya N. I.
Federal State Autonomous Educational Institution of Higher Education «Crimean Federal University
named after V. I. Vernadsky», Simferopol, Republic of Crimea, Russia
E-mail: elena-chuyan@rambler.ru
Diabetes mellitus is a global medical and social problem that requires the development of new approaches to studying its pathogenesis and treatment. This study is devoted to analyzing the features of biochemical shifts in Wistar rats (n=28) with alloxan-induced diabetes two months after its induction (administered intraperitoneally three times at 100 mg/kg, with a total dose of 300 mg/kg).This experimental model reliably reproduces the key mechanisms of the pathogenesis of severe insulin-dependent diabetes and can be recommended for long-term experimental studies, drug testing, and evaluating the effectiveness of approaches aimed at correcting metabolic and organ dysfunctions in diabetes mellitus.
Changes in the biochemical parameters of rat blood serum indicate significant disturbances in carbohydrate, lipid, protein, and energy metabolism, the development of inflammatory processes, and oxidative stress, which may result from impaired function and structure not only of the pancreas but also of the kidneys, liver, blood vessels, and other organs.Signs of organ damage have been identified, including destructive changes in muscle tissue, impaired liver function, and early manifestations of diabetic nephropathy.The obtained results expand current understanding of the mechanisms of diabetes development, the extent of metabolic disturbances under experimental diabetes conditions, and may serve as a basis for further studies on the etiology and pathogenesis of liver pathology in diabetes.
Keywords: diabetes mellitus; alloxan-induced diabetes; biochemical blood parameters in rats; carbohydrate, lipid, protein, and energy metabolism.
References
- Sun H., Saeedi P., Karuranga S. IDF diabetes atlas: global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045, Diabetes Res. Clin. Pract, 183 (2022).
- Stanifer J. W., Cleland C. R., Makuka G. J. [et al.] Prevalence, risk factors, and complications of diabetes in the Kilimanjaro region: a population-based study from Tanzania, PLoS One. (2016).
- Dedov I. I., Shestakova M. V., Vikulova O. K. Saharnyj diabet v Rossijskoj Federacii: rasprostranennost’, zabolevaemost’, smertnost’, parametry uglevodnogo obmena i struktura saharosnizhayushchej terapii po dannym federal’nogo registra saharnogo diabeta, status 2017 g., Saharnyj diabet, 21, 3 (2018).
- Jwad M., Yousif Al-Fatlawi H., Student P. Types of diabetes and their effect on the immune system, J. Adv. Pharm. Pract, 4, 1 (2022).
- Lenzen S. The mechanisms of alloxan- and streptozotocin-induced diabetes, Diabetologia, 51 (2008).
- Pal’chikova N. A., Kuznecova N. V., Kuz’mínova O. I., Selyatickaya V. G. Gormonal’no-biohimicheskie osobennosti alloksanovoj i streptozotocinovoj modelej eksperimental’nogo diabeta, Byul. SO RAMN, 33, 6 (2013).
- Zakaria Z. Z., Ahmad M. N., Qinna N. A. Animal models in type 2 diabetes mellitus research: pros and cons, Jordan J. Agric. Sci., 17 (2021).
- Gati M. A. Physiological and histological study of experimental diabetes mellitus by alloxan, Int. J. Adv. Res., 4, 3 (2016).
- Bafaev Zh. T., Mavlanov A. A., Hamidova Z. N. Osobennosti tipologicheskih svojstv zhivotnyh v klinicheskom techenii eksperimental’noj modeli alloksanovogo diabeta, Novyj den’ v medicine, 1, 39 (2022).
- Rashmi P., Urmila A., Likhit A. [et al.] Rodent models for diabetes, 3 Biotech, 13 (2023).
- Elsner M., Tiedge M., Guldbakke B. Importance of the GLUT2 glucose transporter for pancreatic beta cell toxicity of alloxan, Diabetologia, 45, 11 (2002).
- Radenković M., Stojanović M., Prostran M. Experimental diabetes induced by alloxan and streptozotocin: the current state of the art, J. Pharmacol. Toxicol. Methods, 78 (2016).
- Chuyan E. N., Livencov S. Yu., Dvoreckaya N. I. Osobennosti izmeneniya biohimicheskih pokazatelej krovi krys v usloviyah raznyh eksperimental’nyh modelej alloksan-inducirovannogo diabeta, Uchyonye zapiski KFU im. V. I. Vernadskogo. Seriya: Biologiya. Himiya, 11 (77), 1 (2025).
- Danilova I. G., Gette I. F. Sposob modelirovaniya alloksanovogo diabeta, Patent № 2534411, 2014.
- Care D. American Diabetes Association. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes–2019, Diabetes Care, 42, Suppl. 1 (2019).
- Dedov I. I., Shestakova M. V., Majorov A. Yu., Vikulova O. K., Galstyan G. R., Kuraeva T. L. [et al.] Algoritmy specializirovannoj medicinskoj pomoshchi bol’nym saharnym diabetom, Saharnyj diabet, 22, 1S (2019).
- Barcham D., Trinder P. An improved color reagent for determination of blood glucose by oxidase systeme, Analyst, 97, 151 (1972).
- Little R. R., Rohlfing C. L., Sacks D. B. Standardization of HbA1c Measurement, Clin. Chem., 53, 6 (2007).
- Sacks D. B. Insulin assays and reference values, Diabetes Metab., 33, 5 (2007).
- Allain C., Poon L., Chan G. [et al.] Enzymatic determination of total serum cholesterol, Clin. Chem., 20, 4 (1974).
- Roeschlau P., Bernt E., Gruber W. A. Enzymatische Bestimmung des Gesampt-Cholesterins in Serum, Clin. Chem. Clin. Biochem., 12, 5 (1974).
- Nauk M., Wiebe D., Warnick G. Measurement of high-density-lipoprotein cholesterol, Handbook of Lipoprotein Testing, 2nd ed., AACC Press, Washington DC (2001).
- Cornall A. G., Bardawill C. J., David M. M. Determination of serum proteins by biuret reaction, J. Biol. Chem., 177, 2 (1949).
- Burtis C. A., Ashwood E. R., Bruns D. E. Tietz Textbook of Clinical Chemistry and Molecular Diagnostics, 5th ed., Elsevier, St. Louis (2012).
- Fossati P., Prencipe L., Berti G. Use of 3,5-dichloro-2-hydroxybenzenesulfonic acid/4-aminophenazone chromogenic system for uric acid assay, Clin. Chem., 26, 2 (1980).
- Henry R. J., Chiamori N., Golub O. J., Berkman S. Revised spectrophotometric methods for transaminases and lactate dehydrogenase, Am. J. Clin. Pathol., 34 (1960).
- Stein W. Creatine kinase (total activity), isoenzymes and variants, Clinical Laboratory Diagnostics, TH-Books, Frankfurt (1998).
- Dolgov V. V., Men’shikov V. V. Klinicheskaya laboratornaya diagnostika. Nacional’noe rukovodstvo. Tom 1. (M.: GEOTAR-Media, 2013).
- Moss D. W., Henderson A. R. Clinical enzymology, In: Tietz Textbook of Clinical Chemistry, 3rd ed. – (Philadelphia: WB Saunders Company, 1999).
- Fachbach F., Zawta B. Age-dependent reference limits of several enzymes in plasma at different measuring temperatures, Klin. Lab., 38 (1992).
- Guder W. G., Zawta B. [et al.] The quality of diagnostic samples. – 1st ed. (Darmstadt: GIT Verlag, (2001).
- Claus D. R., Osmand A. P., Gewurz H. Radioimmunoassay of human C-reactive protein and levels in normal sera, J. Lab. Clin. Med., 87 (1976).
- Hind C. R. H., Pepys M. B. The role of serum C-reactive protein (CRP) measurement in clinical practice, Int. Med., 5 (1984).
- Yarmolinskaya M. I., Andreeva N. Yu., Abashova E. I., Misharina E. V. Eksperimental’nye modeli saharnogo diabeta 1-go tipa, Zhurnal akusherstva i zhenskih boleznej, 68, №2 (2019).
- El’bek’yan K. S., Hodzhayan A. B., Bidzhieva F. A. [i dr.] Osobennosti protekaniya alloksan-inducirovannogo saharnogo diabeta u eksperimental’nyh krys, Medicinskij vestnik Severnogo Kavkaza, 14, 1.2 (2019).
- Bidzhieva F. A. Biohimicheskie osobennosti alloksan-inducirovannogo saharnogo diabeta, Medicinskij alfavit, 31, 2 (2018).
- Fajarwati I., Solihin D. D., Wresdiyati T., Batubara I. Administration of alloxan and streptozotocin in Sprague Dawley rats and challenges in producing diabetes model, IOP Conf. Ser.: Earth Environ. Sci., 1174, 1 (2023).
- Maleki V. [et al.] The effect of resveratrol on advanced glycation end products in diabetes mellitus: a systematic review, Arch. Physiol. Biochem., 126, 6 (2020).
- Yashanova M. I., Shcherbatyuk T. G., Nikolaev V. Yu. Validnost’ modelej eksperimental’nogo diabeta dlya izucheniya okislitel’nogo stressa, Zhurn. mediko-biologicheskih issledovanij, 7, 1 (2019).
- Dzhafarova R. E. Sravnitel’noe issledovanie razlichnyh modelej alloksan-inducirovannogo saharnogo diabeta, Kazanskij medicinskij zhurnal, 6 (2013).
- Ignatchik D. A. Vliyanie alloksana i streptozotocina na uroven’ insulina i sistemu glutationa v tkanyah zhivotnyh [Elektronnyj resurs], Aktual’nye problemy sovremennoj mediciny i farmacii 2020: sb. tez. dokl. LXXIV Mezhdunar. nauch.-prakt. konf. studentov i molodyh uchenyh, 15–17 apr. Minsk, 2020. (Minsk: BGMU, 2020).
- Lomaeva S. V., Gette I. F., Bulavinceva T. S. Osobennosti obmena biopolimerov soedinitel’noj tkani v pecheni krys s alloksanovym diabetom, Byul. sib. mediciny, 12, 6 (2013).
- Mihajlichenko V. Yu., Stolyarov S. S. Effekt transplantacii kul’tury kletok podzheludochnoj zhelezy pri alloksanovom saharnom diabete u krys v eksperimente, Mezhdunar. zhurn. prikladnyh i fundamental’nyh issledovanij, 9 (2015).
- Danilova I. G., Emel’yanov V. V., Gette I. F. Citokinovaya regulyaciya regeneratornyh processov v podzheludochnoj zheleze pri alloksanovom saharnom diabete u krys i ego korrekcii soedineniem ryada 1,3,4-tiadiazina i lipoevoj kislotoj, Med. immunologiya, 20, 1 (2018).
- Kitabchi A. E., Umpierrez G. E., Fisher J. N., Murphy M. B., Stentz F. B. Thirty years of personal experience in hyperglycemic crises: diabetic ketoacidosis and hyperglycemic hyperosmolar state, J. Clin. Endocrinol. Metab., 93 (2008).
- Harita N., Hayashi T., Sato K. K. Lower serum creatinine is a new risk factor of type 2 diabetes: the Kansai healthcare study, Diabetes Care, 32 (2009).
- Lorenzo C., Nath S. D., Hanley A. J. Risk of type 2 diabetes among individuals with high and low glomerular filtration rates, Diabetologia, 52 (2009).
- Hjelmesæth J., Røislien J., Nordstrand N. Low serum creatinine is associated with type 2 diabetes in morbidly obese women and men: a cross-sectional study, BMC Endocr. Disord., 10 (2010).
- Madyanov I. V. Mochevaya kislota i saharnyj diabet. Promezhutochnye itogi mnogoletnih issledovanij, Zdravoohranenie Chuvashii, 2 (2017).
- Shestakova M. V. Saharnyj diabet i hronicheskaya bolezn’ pochek: vozmozhnosti prognozirovaniya, rannej diagnostiki i nefroprotekcii v XXI veke, Terapevt. arhiv, 88, 6 (2016).
- Lebedeva N. O., Vikulova O. K. Markery doklinicheskoj diagnostiki diabeticheskoj nefropatii u pacientov s saharnym diabetom 1 tipa, Saharnyj diabet, 2 (2012).
- Klimontov V. V., Korbut A. I. Hronicheskaya bolezn’ pochek pri saharnom diabete, Terapevt. arhiv, 5 (2020).
- Mistry J., Biswas M., Sarkar S. Antidiabetic activity of mango peel extract and mangiferin in alloxan-induced diabetic rats, Futur. J. Pharm. Sci., 9 (2023).
- Kleiner D. E., Makhlouf H. R. Histology of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis in adults and children, Clin. Liver Dis., 20, 2 (2016).
- Lankin V. Z., Konovalova G. G., Tikhaze A. K. The initiation of the free radical peroxidation of low density lipoproteins by glucose and its metabolite methylglyoxal: a common molecular mechanism of vascular wall injury in atherosclerosis and diabetes, Mol. Cell. Biochem., 395 (2014).
- Van L. S. High-density lipoprotein at the interface of type 2 diabetes mellitus and cardiovascular disorders, Curr. Pharm. Des., 16 (2010).
- Andrejchenko I. A., Galkin S. D. Informativnost’ izmenenij biohimicheskih parametrov syvorotki krovi pri saharnom diabete 2-go tipa, Vestn. novyh med. tekhnologij, 4 (2011).
- Kusmartseva I., Beery M., Hiller H. Temporal analysis of amylase expression in control, autoantibody-positive, and type 1 diabetes pancreatic tissues, Diabetes, 69, 1 (2020),
- Ross J. J., Wasserfall C. H., Bacher R. Exocrine pancreatic enzymes are a serological biomarker for type 1 diabetes staging and pancreas size, Diabetes, 70, 4 (2021).
- Endo T., Takizawa S., Tanaka S. Amylase α-2A autoantibodies: novel marker of autoimmune pancreatitis and fulminant type 1 diabetes, Diabetes, 58, 3 (2009).
- Eprintsev A. T., Bondareva I. R., Selivanova N. V. Expression levels and activity of rat liver lactate dehydrogenase isoenzymes in alloxan diabetes, Biochem. (Moscow), Suppl. Ser. B: Biomed. Chem., 16, 3 (2022).
- Sattorova M. A., Mustafakulov M. A. Euforbin-3 i Glabra na techenie patologicheskogo processa alloksan-inducirovannogo saharnogo diabeta, Modern Educational System and Innovative Teaching Solutions, 1, 1 (2024).
- Musatov O. V., Zurnadzhan S. A., Kohanov A. V. Aktivnost’ shchelochnoj fosfatazy syvorotki krovi v zavisimosti ot vida operacii pri ranah pecheni, selezyonki i pochki v eksperimente, Astrahanskij med. zhurn., 12, 2 (2017).
- Butolin E. G. [i dr.] Izmenenie soderzhaniya mineral’nyh veshchestv v kostnoj tkani u krys s eksperimental’nym diabetom, Vestn. Udmurtskogo un-ta. Ser. Biologiya. Nauki o Zemle, 27, 3 (2017).
- Terent’eva M. G., Mardar’eva N. V., Shchipcova N. V. Izmenenie aktivnosti gamma-glutamiltransferazy v tkanyah pecheni u krol’chat v raznye fazy postnatal’nogo ontogeneza, Vestn. Ul’yanovskoj gos. sel’skohoz. akad., 3 (55) (2021).
- Sobirova D. R. Rol’ i vzaimodejstvie kreatinfosfokinazy i gamma-glutamiltranspeptidazy v razvitii saharnogo diabeta i ih znachenie v patogeneze bronholyogochnyh zabolevanij (2024).
- Vítek L. The role of bilirubin in diabetes, metabolic syndrome, and cardiovascular diseases, Front. Pharmacol., 3 (2012).
- Basiglio C. L., Arriaga S. M., Pelusa F. [et al.] Complement activation and disease: protective effects of hyperbilirubinaemia, Clin. Sci., 118 (2010).
- Hwang H. J., Lee S. W., Kim S. H. Relationship between bilirubin and C-reactive protein, Clin. Chem. Lab. Med., 49 (2011).
- Richardson S. J., Willcox A., Bone A. J., Foulis A. K., Morgan N. G. The prevalence of enteroviral capsid protein Vp1 immunostaining in pancreatic islets in human type 1 diabetes, Diabetologia, 52 (2009).
- Asmat U., Abad K., Ismail K. Diabetes mellitus and oxidative stress – a concise review, Saudi Pharm. J., 24, 5 (2016).
- Suryadinata R. V., Lorensia A., Sefania K. Effectiveness of lime peel extract (Citrus aurantifolia Swingle) against C-reactive protein levels in alloxan-induced Wistar rats, Glob. Med. Health Commun., 9, 1 (2021).
- Ferrer J. C., Favre C., Gomis R. R., Fernández-Novell J. M., García-Rocha M., de la Iglesia N. [et al.] Control of glycogen deposition, FEBS Lett., 546, 1 (2003).
- Jiang S., Tang X., Wang K., Liang Y., Qian Y., Lu C. [et al.] Hepatic functional and pathological changes of type 1 diabetic mice in growing and maturation time, J. Cell. Mol. Med., 23, 8 (2019).
- Bueverov A. O., Zilov A. V. Porazhenie pecheni pri saharnom diabete 1-go tipa, Ros. zhurn. gastroenterologii, gepatologii, koloproktologii, 31, 2 (2021).



