Ученые записки Крымского федерального университета имени В. И. Вернадского
Биология. Химия. Том 11 (77). 2025. № 2. С. 3–16.
УДК 574.24:579.64
DOI 10.29039/2413-1725-2025-11-2-3-16
ОЦЕНКА ЭФФЕКТИВНОСТИ ПРИМЕНЕНИЯ КОМПЛЕКСА МИКРООРГАНИЗМОВ ПРИ ВЫРАЩИВАНИИ SORGHUM BICOLOR (L.) В АГРОСИСТЕМАХ ПРЯМОГО ПОСЕВА И ТРАДИЦИОННОЙ СИСТЕМЫ
Абдурашитова Э. Р., Абдурашитов С. Ф., Паштецкий В. С.
ФГБУН «Научно-исследовательский институт сельского хозяйства Крыма», Симферополь,
Россия
Е-mail: elvi-jadore@mail.ru
Оценивали водный статус растений, биологическую активность ризосферы и биомассу семян Sorghum bicolor под действием комплекса микроорганизмов (КМ) и агросистем в условиях чернозема южного. В засушливые годы (2018г., 2020 г.) установлено снижение активности пероксидаз и эмиссии углекислого газа в прямом посеве в сравнении с традиционной системой до 3,9 раз и 1,4 раза соответственно. В среднем за годы исследования биомасса зерна в различных системах земледелия была одинаковой, в то же время применение КМ способствовало ее повышению на 0,07 т/га при традиционной системе и 0,23 т/га при прямом посеве. Корреляционный анализ выявил обратную зависимость между биомассой зерна и активностью пероксидаз (r = -0,74 в 2018 г., r = -0,67 в 2020 г.), а также сильную отрицательную связь с эмиссией CO₂ ризосферы (r = -0,88 в 2020 г.). Таким образом, комбинирование биотехнологических и агротехнологических методов балансирует работу ризосферного микробоценоза и повышает продуктивность сорго в условиях засухи.
Ключевые слова: Sorghum bicolor (L.) Moench; прямой посев; водный дефицит; эмиссия углекислого газа; активность пероксидаз; биомасса зерна; корреляция.
ВВЕДЕНИЕ
В мировом земледелии сорго зерновое занимает 70–75 млн га. Среди злаков сорго содержит самое высокое количество фитохимических веществ, включая антоцианы, каротиноиды, фенольные кислоты, конденсированные дубильные вещества и др. [1]. Его зерно идет на производство спирта и спиртосодержащих напитков, в качестве продуктов питания человека и корма для животных и др. [2, 3]. Известно, что из растений сорго выделен биогербицид сорголеон, подавляющий рост сорняков [4], который позволит уменьшить зависимость производителей продовольственных культур от синтетических гербицидов. Сорго обладает высокой засухоустойчивостью, что делает его перспективным для культивирования в степи в условиях зон рискованного аграрного производства.
В то же время выращивание сельскохозяйственных культур требует экологически обоснованного подхода, что обеспечивается применением биотехнологических приемов, способствующих активизации микробиома почвы, оптимизации минерализационных процессов и повышению рентабельности продукции в различных условиях [5–8]. Так, в прикорневой зоне (ризосфере) происходит взаимодействие между растением, почвой и ассоциативными микроорганизмами (PGPR – plant growth promoting microorganisms, ростстимулирующие ризобактерии). Это взаимодействие играет ключевую роль в возникающих связях между ними [9], содействует защите от патогенов, ростстимуляции, повышению устойчивости к аномальным колебаниям температуры [10, 11].
Стресс, вызванный резкими изменениями погодно-климатических условий, важнейший фактор негативного влияния на биохимические процессы в период вегетации растений [12]. Водный статус и его генетическая детерминация у разных генотипов играют особую роль в экстремальных условиях при формировании адаптивных реакций и продуктивности в онтогенезе, что оказывает особое влияние на вегетативное и генеративное размножение растений [13]. Исследована потенциальная роль PGPR в придании устойчивости к водному стрессу [14, 15], в том числе применение арбускулярных микоризных грибов с сорго зерновым [16].
Ранее показано, что применение прямого посева способствуют сохранению агрофизических и биологических свойств почвы. Комплексный подход применения микроорганизмов и прямого посева в земледелии повышает общую биогенность почв [17]. Альтернативное решение применения биопрепаратов вместо химических средств, а прямого посева вместо традиционной системы, дополняют способы по адаптации растений к водному и температурному стрессу. Сигналом стрессоустойчивости почв и растений служит увеличение активности антиоксидантных ферментов [18]. Почвенные ферменты участвуют в многоступенчатых процессах разложения и синтеза органических соединений ароматического ряда, оказывают влияние на рост и поглощение питательных веществ растениями [19].
Цель работы – оценить водный статус растений, биологическую активность ризосферы и биомассу зерна сорго зернового под действием комплекса микроорганизмов и различных агросистем в условиях чернозема южного.
МАТЕРИАЛЫ И МЕТОДЫ
Стационарный эксперимент по исследованию влияния систем земледелия и комплекса микроорганизмов (КМ) на сохранение плодородия пахотных земель заложен в 2015 году на опытном поле ФГБУН «НИИСХ Крыма» (с. Клепинино, 45°31’48.36″N, 34°11’47.88″E) на площади 3,8 га. Почва – чернозем южный мицелярно-карбонатный слабогумусированный, развитый на лессовидных легких глинах [20, 21]. Мощность гумусового горизонта до 40 см, всего гумусового слоя – до 70 см. Количество гумуса (по Тюрину) – 2,4–2,6 %, подвижного фосфора (по Мачигину) – 1–2,5 мг/100 г почвы, подвижного калия – 18–28 мг/100 г почвы. Исследуются традиционная система для условий Крыма (с применением вспашки и рыхлением почвы до и во время вегетации культур) и ресурсосберегающая (по технологии прямого посева без обработки почвы). Для обоих систем земледелия применяется чередование пяти культур. По условиям стационарного опыта заложен двухфакторный эксперимент: фактор А – агросистема традиционная или ресурсосберегающая, фактор Б – наличие или отсутствие инокуляции комплексом микроорганизмов (КМ); со следующими вариантами: 1. Прямой посев (ПП) без обработки семян КМ; 2. Прямой посев с обработки семян КМ (ПП с КМ);
3. Традиционная система (ТС) без обработки семян КМ; 4. ТС – обработка семян КМ (ТС с КМ). Соответственно факторам опыта и проводилось сравнение. Учетная площадь эксперимента 1,8 га. Полевая повторность трехразовая.
Условия проведения эксперимента
В 2018 году гидротермический коэффициент (ГТК) за вегетационный период (апрель-август) составил 0,65, что соответствует интенсивности засухи – слабая [22]. Зима характеризовалась неустойчивой погодой со значительным недобором осадков и высокой температурой воздуха после зимнего периода. В 2019 году в период вегетации культуры наблюдали благоприятные условия для развития, а ГТК=0,78 – отсутствие засухи. В период активного роста растений июнь–июль осадков выпало выше на 61,0 и 26,2 мм среднемноголетней. В 2020 году погода характеризовалась резкими аномальными отклонениями. В марте наблюдали сухую погоду, количество осадков в 12,9 раза ниже, а температура в 2,6 раза выше среднемноголетних значений. По количеству осадков весна острозасушливая, выпало всего 44 мм, в т.ч. только один хозяйственно-полезный дождь. В этот год ГТК составил 0,59 – засуха средней интенсивности.
Биологические объекты
Сорго зерновое (Sorghum bicolor (L.) Moench) сорта Крымбел (селекция Крымского федерального университета им. В. И. Вернадского), представляет собой однолетнее самоопыляющееся растение. Комплекс микроорганизмов (КМ) состоит из штаммов Крымской коллекции (https://ckp-rf.ru/catalog/usu/507484/): Paenibacillus рolуmуха П (основная функция защита от фитопатогенов), Lelliottia nimipressuralis 32-3 (ростстимуляция и фосфатмобилизация), Agrobacterium radiobacter 204 (улучшение азотного питания) и ассоциация грибов арбускулярной микоризы Rhizophagus sp. P3. Бактерии применяли в предпосевной инокуляции семян из расчета 106 КОЕ на семя, а грибы вносили вместе с семенами в почву в количестве 20–30 колонизирующих единиц на семя.
Лабораторные анализы
Отбор проб растений и ризосферы проводили в фазу выметывания (июль, через 2–2,5 месяца поле посева). Растения (n=15 на вариант) выкапывали с земляным комом и переносили в лабораторию для анализа. Пока растения не потеряли тургор, проводили определение водного статуса через определение водного дефицита и относительной тургесцентности согласно методу, описанному в Практикуме под ред. Третьякова Н. Н. [23]. С каждого растения пробочным сверлом диаметром 8 мм делали по 10 высечек, которые взвешивали на аналитических весах трижды: непосредственно после вырезания (mi), после насыщения влагой (через 2 часа экспозиции в воде) (mn), после высушивания для определения абсолютно сухой массы (mas). Расчет водного дефицита проводили по формуле (1)
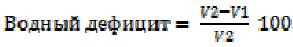
, (1)
где V1 – исходное содержание воды в высечках (mi – mas), V2 – количество воды, насыщающее орган (mn – mi).
Расчет относительной тургесцентности по формуле (2)
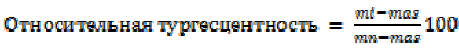
, (2)
где mi – исходная масса высечек, mn – масса высечек после насыщения влагой, mas – абсолютно сухая масса высечек.
Степень относительной засухоустойчивости оценивали по Гончаровой [24] на основе данных о водном дефиците: высокая при водном дефиците до 10 %, средняя – 10–20 %, при 20 % и более – низкая.
За ризосферу принимали кусочки почвы, непосредственно прилегающие к корням размером не более 5 мм, которые использовали свежие, но все результаты пересчитывали на абсолютно сухую почву (а.с.п.). Активность пероксидаз определяли колориметрическим методом [25]. Для этого 50 г ризосферы (n=3) заливали 100 мл 0,5 н. раствора нитрата аммония и взбалтывали 30 мин. Суспензию отфильтровали через фильтр с синей лентой. К 10 мл фильтрата (взято 2 аналитические повторности) прилили 1 мл 0,3 % гваякола и 1 мл 0,05 н. Н2О2. Реактивы перемешивали и компостировали при 27 °С в течении 1 часа. В результате компостирования раствор изменял цвет на розовый, интенсивность которого детектировали на фотоэлектроколориметре КФК-2 с зеленым светофильтром в кювете 10 мм. Параллельно для построения калибровочного графика оценивали серию разведений нитрата серебра. Активность фермента рассчитывали по формуле (3).
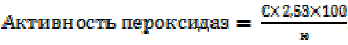
, (3)
где С – показатель по калибровочному графику, мг/мл Ag; н – навеска почвы (а.с.п.), г; 2,53 – пересчет на мкМоль гваякола.
Интенсивность эмиссии СО2 в ризосфере определяли титриметрическим методом в модификации Макарова [26]. Навеску почвы 5 г (n=3) помещали в виалу, которую опускали в другой сосуд, содержащий 20 мл свежеприготовленного раствора 0,1 н. гидроксида натрия. Сосуд герметично закрывали пробкой и компостировали при 27 °С в течении 5 суток. Завершив компостирование, вынимали виалу с почвой, а к раствору, насыщенному углекислым газом, приливали 2 мл 50 % раствора хлорида бария, 2–3 капли 0,1 % спиртового раствора фенолфталеина. Полученную смесь титровали 0,1 н. раствором соляной кислоты. Холостая проба не содержала почву
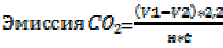
, (4)
где V1 – объем 0,1 Н раствора НСl, израсходованный на титрование холостой пробы, мл.; V2 – объем кислоты, израсходованный на титрование исследуемой пробы, мл.; н – навеска почвы (а.с.п.), г; t – время экспозиции, сутки.
Биомассу семян учитывали в фазу полной зрелости растений из расчета на 14 % влажность. Сбор семян проводили комбайном Sampo-500 (n=3).
Статистический анализ
Полученные данные представлены в виде средней арифметической ± стандартной ошибки средней![]() [27]. В оценке значимости различий по биомассе семян использовали дисперсионный анализ, а именно наименьшую существенную разность двухфакторного эксперимента на 5 % уровне значимости. Для корреляционного анализа использовали программные возможности Statistica 10.0 по протоколу Пирсона.
[27]. В оценке значимости различий по биомассе семян использовали дисперсионный анализ, а именно наименьшую существенную разность двухфакторного эксперимента на 5 % уровне значимости. Для корреляционного анализа использовали программные возможности Statistica 10.0 по протоколу Пирсона.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Дефицит влаги отрицательно воздействует на развитие растений, особенно, если это почвенно-воздушная засуха. Оценка результатов исследования сорго зернового за 2018–2020 годы показало, что действие комплекса микроорганизмов на водный дефицит растений проявилось только в 2019 году снижением его на 7,1 % (табл. 1). Также отметили два года подряд (2019–2020 гг.) при традиционной системе показатель уменьшался на 4,1–6,1 %, чем при прямом посеве.
Таблица 1
Уровень водного дефицита растений S. bicolor под влиянием агросистем и предпосевной инокуляции семян комплексом микроорганизмов (КМ), (чернозем южный, 2018-2020 гг.)
|
Вариант опыта |
Водный дефицит растений, % |
||
|
2018 год |
2019 год |
2020 год |
|
|
Прямой посев |
22,2±0,8 |
28,9±1,8 |
17,4±1,3 |
|
ПП с КМ |
24,6±3,0 |
21,8±2,7 |
16,6±0,3 |
|
Традиционная система |
22,2±2,0 |
22,8±3,4 |
13,3±1,7 |
|
ТС с КМ |
25,3±2,3 |
26,4±1,5 |
14,1±0,4 |
Вода составляет 70–95 % от массы растительной клетки. Степень насыщенности ею показывает относительная тургесцентность, которая изменяется в противоположном направлении водному дефициту. При применении комплекса микроорганизмов в 2019 году получили положительный эффект в прямом посеве, зарегистрировав увеличение относительной тургесцентности листьев сорго на 9,5 % от контроля без инокуляции (табл. 2). Полевой эксперимент показал увеличение насыщаемости водой клеток растения при традиционной системе на 4,1–7,3 % по сравнению с системой no-till в условиях 2019 и 2020 гг.
Таблица 2
Относительная тургесцентность растений S. bicolor под влиянием агросистем и предпосевной инокуляции семян комплексом микроорганизмов (КМ), (чернозем южный, 2018–2020 гг.)
|
Вариант опыта |
Относительная тургесцентность растений, % |
||
|
2018 год |
2019 год |
2020 год |
|
|
Прямой посев ( ПП) |
77,8±0,8 |
60,4±2,1 |
82,6±1,3 |
|
ПП с КМ |
75,4±3,0 |
69,9±3,7 |
83,4±0,3 |
|
Традиционная система |
77,8±2,0 |
67,7±4,9 |
86,7±1,7 |
|
ТС с КМ |
74,7±2,3 |
63,4±2,5 |
85,9±0,4 |
Согласно показателям водного баланса в растениях возможно сделать вывод о степени засухоустойчивости сорго. По результатам определения водного дефицита установлена низкая степень засухоустойчивости растений в 2018 и 2019 гг., в 2020 г – средняя.
Пероксидаза катализирует окисление органических соединений почвы за счет кислорода перекиси водорода и органических перекисей, и поступает в почву в виде прижизненных выделений корней растений и микроорганизмов. Далее образующиеся соединения взаимодействуют с аминокислотами и пептидами, образуя молекулы гумусовых кислот [19]. В ходе трехлетнего эксперимента выявлено, что активность пероксидаз в ризосфере сорго в условиях системы no-till более стабильна год от года, варьируя в пределах 6,4–17,2 %, а при традиционной системе показано значительное изменение активности до 4,3 раз (табл. 3). Эффект резкого повышения функционирования фермента при традиционной системе в 2020 году по сравнению с предыдущими годами связан с выпадением перед анализом одного хозяйственно-полезного дождя. Это является подтверждением нестабильности ферментативной активности в ризосфере при традиционной агросистеме, сильно зависящей от погодных условий. В то же время применение предпосевной инокуляции семян КМ в основном способствовало снижению активности пероксидазы как при традиционной системе, так и при прямом посеве на 13,8–58,0 %, допуская в некоторые годы для различных систем увеличение показателя. Возможно, это связано с тем, что интродуцированные микроорганизмы восполняют ресурсы минеральных веществ, необходимых как растению, так и другим участникам биохимических процессов в ризосфере за счет альтернативных источников, не используя органические компоненты субстрата, на которые нацелена пероксидаза.
Таблица 3
Влияние предпосевной инокуляции семян сорго зернового комплексом микроорганизмов (КМ), выращенной при различных системах земледелия на активность пероксидаз ризосферы, (чернозем южный, 2018–2020 гг.)
|
Вариант опыта |
Активность пероксидаз, мкмоль C7H8O2 /100 г почвы |
||
|
2018 год |
2019 год |
2020 год |
|
|
Прямой посев |
2,80±0,03 |
2,99±0,04 |
2,40±0,04 |
|
ПП с КМ |
2,32±0,03 |
1,99±0,04 |
4,60±0,04 |
|
Традиционная система |
3,04±0,00 |
2,17±0,06 |
9,27±0,04 |
|
ТС с КМ |
3,30±0,02 |
1,87±0,01 |
3,89±0,02 |
Из литературных данных известно, что дыхание почвы обычно повышается с изменением величины пористости пахотного слоя или в период интенсивного обмена веществ у растений [28]. Также показатели почвенного дыхания на основе эмиссии углекислого газа дают представление об активности почвенных микробиомов и позволяют оценить потери органического вещества вследствие процессов минерализации. Анализ полученных нами данных за 2018–2020 гг. показал снижение эмиссии CO2 на 9,1–20,7 %, а значит и активности минерализационных процессов, в прямом посеве в ризосфере сорго при применении КМ (табл. 4), что, скорее всего, указывает на получение энергии за счет других источников в данный момент вегетации культуры (фаза выметывания). В традиционной системе выделение углекислого газа изменялось не значительно при сравнении вариантов без обработки и с обработкой КМ, но в течении трех лет проведения эксперимента являлось неустойчивым (диапазон варьирования 8,0–44,6 %) по сравнению с ресурсосберегающей технологией (диапазон 14,6–29,9 %).
Таблица 4
Эмиссия углекислого газа ризосферы S. bicolor под влиянием агросистем и комплекса микроорганизмов (КМ), (чернозем южный, 2018-2020 гг.)
|
Вариант опыта |
Эмиссия углекислого газа, мг / г почвы |
||
|
2018 год |
2019 год |
2020 год |
|
|
Прямой посев |
160,8±8,4 |
112,8±5,6 |
137,4±7,6 |
|
ПП с КМ |
146,2±0,0 |
89,4±7,4 |
125,5±4,3 |
|
Традиционная система |
171,7±0,1 |
103,4±2,1 |
186,7±12,9 |
|
ТС с КМ |
170,9±0,4 |
118,0±2,2 |
186,7±7,4 |
Результирующим показателем изучения эффективности применения различных биотехнологий, в том числе бактеризации, и систем земледелия является продуктивность растений. Биомасса зерна для S. bicolor – это основной используемый в народном хозяйстве продукт. Согласно полученным данным масса зерна S. bicolor под воздействием исследуемых систем земледелия не различалась (1,53 т/га в среднем за три года). Значительная прибавка продуктивности культуры 6,9–40,0 % (0,11–0,6 т/га) получена при применении КМ в системе прямого посева в 2018 и 2020 годах, а также в один год (2020) при традиционной технологии выращивания – 15,6 % (0,17 т/га). Это в среднем за три года повысило получаемую продукцию на 15,0 % (0,23 т/га) по ресурсосберегающей технологии и на 4,6 % (0,07 т/га) – по ТС. По биомассе зерна при прямом посеве, как в случае с эмиссией СО2, так и в случае с активностью пероксидаз, отмечены более стабильные показатели в течении 2018-2020 гг., чем при ТС.
Таблица 5
Биомасса зерна S. bicolor под влиянием агросистем и комплекса микроорганизмов (чернозем южный, 2018-2020 гг.)
|
Вариант опыта |
Биомасса зерна, т/га |
|||
|
2018 год |
2019 год |
2020 год |
Среднее за 2018–2020 гг. |
|
|
Прямой посев |
1,50 |
1,50 |
1,59 |
1,53 |
|
ПП с КМ |
2,10 |
1,47 |
1,70 |
1,76 |
|
Традиционная система |
1,50 |
2,01 |
1,09 |
1,53 |
|
ТС с КМ |
1,53 |
2,00 |
1,26 |
1,60 |
|
НСР05, фактор А, фактор Б |
0,30 |
0,03 |
0,10 |
|
Примечание: НСР05 – наименьшая существенная разность.
Корреляционный анализ изученных параметров в активную фазу роста растений показал схожие сильные связи между погодно-климатическими условиями 2018 и 2020 годов, характеризующимися повышенным температурным режимом и отсутствием осадков в некоторые критические фазы вегетации сорго зернового. Повышение биомассы зерна отрицательно коррелировало с активностью пероксидаз ризосферы r = ‑0,74 и r = ‑0,67 соответственно в 2018 и 2020 годах (рис. 1).
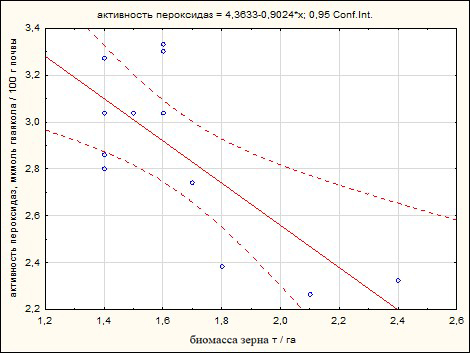
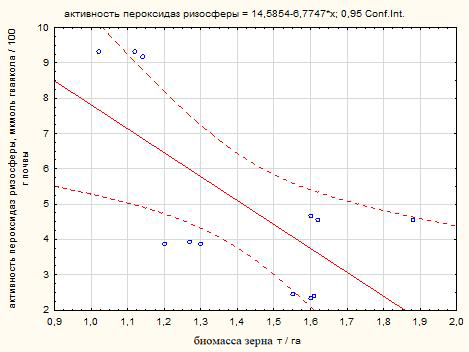
А Б
Рис. 1. Диаграмма рассеяния связи активности пероксидаз ризосферы и биомассы зерна сорго зернового в 2018 (А) и 2020 (Б) годах (чернозем южный).
Особенно ярко выражено влияние засухи при традиционном посеве, не смотря на повышенную относительную тургесцентность в этом варианте эксперимента. 2019 год отмечен сменами периодов переувлажнения почвы количеством осадков, превышающих среднемноголетние показатели, и периодов с умеренной засухой и не выявил связей изучаемых показателей с урожайностью.
Установлена отрицательная сильная корреляция дыхание почвы с зерновой продуктивностью сорго с r= ‑0,88 в полевом эксперименте 2020 года (рис. 2).
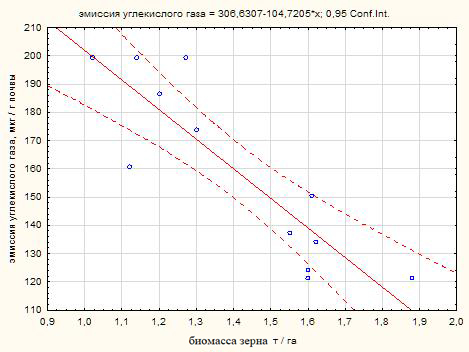
Рис. 2. Диаграмма рассеяния связи эмиссии углекислого газа с биомассой зерна сорго зернового (чернозем южный, 2020 г.)
При регидратации почвы, подвергшейся засухе, минерализуется органическое вещество, что приводит к резкому увеличению бактериальной популяции по сравнению с почвами, которые не были подвержены стрессу [29]. Есть подтверждение, что устойчивые к засухе микроорганизмы секретируют смеси растворенных веществ, например трегалозу, которые используются для защиты как своей клетки от неблагоприятных условий среды [30]. Полученные нами результаты подтверждают приведенные выше литературные данные прямыми корреляционными связями. При прямом посеве установили повышение биомассы зерна в сравнение с традиционной в 2020 году, что, возможно, связано с незначительным количеством выпадения осадков в период активного роста растений, и превышение его в июне месяце, способствовавшее удержанию влаги в ризосфере и активизации некоторых групп микроорганизмов [31] и ферментов. Полученные результаты и сопоставление их с литературными данными свидетельствуют о том, что биоагенты микробных препаратов повышают адаптацию растений сорго при смене длительной засухи к благоприятным погодным условиям или наоборот. Так растения, которые в начале испытывали недостаток воды и ростовые процессы угнетались, после выпадения даже незначительных осадков в течение активной фазы дали прибавку биомассы зерна (2018 и 2020 год).
ЗАКЛЮЧЕНИЕ
Влияние КМ на величину относительной тургесцентности и водного статуса в полевом эксперименте отмечено только 2019 г в варианте прямого посева в сторону повышения насыщаемости клеток водой и засухоустойчивости растений. Применение КМ способствует оптимизации функциональной деятельности ферментов пероксидаз и эмиссии углекислого газа в ризосфере. В условиях 2018 и 2020 гг. установлено снижение активности пероксидаз и эмиссии углекислого газа в прямом посеве в сравнении с традиционной агросистемой до 3,9 раз и 1,4 раза соответственно. В среднем за годы исследования биомассы зерна в различных системах земледелия была одинаковой, в тоже время применение КМ способствовало ее повышению на 0,07 т/га при традиционной системе и на 0,23 т/га при технологии прямого посева. Установленные корреляционные связи активности пероксидаз ризосферы, эмиссии углекислого газа с биомассой зерна указывают на то, что применение комплекса микроорганизмов содействует оптимизации функционирования аборигенной микрофлоры, что показано результатом их жизнедеятельности (ферментативной активностью) и адаптации растений к засушливым условиям.
Работа выполнена в рамках государственного задания № 0834-2019-0005 «Экологическое обоснование альтернативных способов улучшения плодородия почвы при разных системах земледелия»
Список литературы
-
- Mohamed H. I. Sorghum: nutritional factors, bioactive compounds, pharmaceutical and application in food systems: A review / H. I. Mohamed, E. M. Fawzi, A. Basit, R. Kaleemullah Lone [et al.] // Phyton-International Journal of Experimental Botany. – 2022. – Vol. 91, No 7. – P. 1303–1325.
- Зотеев В. С. Зерновое сорго в кормлении лактирующих коров / В. С. Зотеев, Г. А. Симонов, А. К. Антимонов // Молочное и мясное скотоводство. – 2018. – № 7. – С. 34–38.
- Сыркина Л. Ф. Сорго зерновое как возможный источник сырья для переработки на крахмал и спирт / Л. Ф. Сыркина, Ю. Ю. Никонорова // Вестник КрасГАУ. – 2020. – № 10(163). – С. 95–100.
- Uddin M. R. Herbicidal activity of formulated sorgoleone, a natural product of Sorghum root exudate / M. R. Uddin, S. U. Park, F. E. Dayan, J. Y. Pyon // Pest Management Science. – 2014. – Vol. 70, No 2. – P. 252–257.
- Shukla S. K. Deep Tillage, Soil Moisture Regime, and Optimizing N Nutrition for Sustaining Soil Health and Sugarcane Yield in Subtropical India / S. K. Shukla, R. L. Yadav, R. Gupta, A. K. Singh, S. K. Awasthi, A. Gaur // Communications in Soil Science and Plant Analysis. – 2018. – Vol. 49, No 4. – P. 444–462.
- Аипова Р. Биологические препараты в органическом земледелии / Р. Аипова, А. Б. Абдыкадырова, A. A. Курманбаев // Биотехнология и селекция растений. – 2019. – № 2(4). – С. 36–41.
- Suman J. Microbiome as a Key Player in Sustainable Agriculture and Human Health / J. Suman, A. Rakshit, S. D. Ogireddy, S. Singh, C. Gupta, J. Chandrakala // Frontiers in Soil Science. – 2022. – Vol. 2. – P. 821589.
- Volobueva O. The influence of biological products and growth regulators on the yield and quality indicators of pea seeds of various varieties / O. Volobueva, I. Seregina, S. Belopukhov, M. Grigoryeva, V. Trukhachev, A. Manokhina, N. Kozlov // Brazilian Journal of Biology. – 2024. – Vol. 84. – P. e280312.
- Venturi V. Signaling in the rhizosphere / V. Venturi, C. Keel // Trends in Plant Science. – 2016. – Vol. 21, No 3. – P. 187–198.
- Андронов Е. Е. Анализ показателей почвенного микробиома в процессах, связанных с почвообразованием, трансформацией органического вещества и тонкой регуляции вегетационных процессов / Е. Е. Андронов, Е. А. Иванова, Е. В. Першина, О. В. Орлова, Ю. В. Круглов, А. А. Белимов, И. А. Тихонович // Бюллетень почвенного института им. В. В. Докучаева. – 2015. – № 80. – С. 83–93.
- Дубинина М. Н. Роль почвенных микробиологических сообществ в формировании агрономически ценной водопрочной структуры / М. Н. Дубинина, В. А. Лыхман // Вестник Донского государственного аграрного университета. – 2019. – № 3-1. – С. 82–87.
- Ха Т. З. Ключевой стимулятор роста растений – ризобактерии / Т. З. Ха, А. В. Канарский, З. А. Канарская [и др.] // Вестник Поволжского государственного технологического университета. Серия: Лес. Экология. Природопользование. – 2020. – № 3(47). – С. 58–73.
- Черных Е. П. Влияние экологических факторов и периода вегетации на содержание биологически активных веществ в некоторых видах растительного сырья Красноярского края / Е. П. Черных, Л. А. Мильшина, О. В. Гоголева, Г. Г. Первышина // Вестник КрасГАУ. – 2012. – № 11(74). – С. 128–131.
- Kumar P. G. In vitro Screening for Abiotic Stress Tolerance in Potent Biocontrol and Plant Growth Promoting Strains of Pseudomonas and Bacillus spp. / P. G. Kumar, S. K. Mir Hassan Ahmed, S. Desai, A. E. Leo Daniel, R. Abdul // International Journal of Bacteriology. – 2014. – Vol. 2014. – 6 p.
- Лебедев В. Н. Оценка эффективности обработки семян капустных культур ассоциативными ризобактериями в условиях нормального увлажнения и почвенной засухи / В. Н. Лебедев, Г. А. Воробейков, Г. А. Ураев // Успехи современного естествознания. – 2021. – № 5. – С. 13–18.
- Абдурашитов С. Ф. Ростстимулирующий эффект симбиотических микроорганизмов на сорго под действием вододефицита / С. Ф. Абдурашитов, К. С. Грицевич, А. И. Алексеева, Э. Р. Абдурашитова // Сибирский вестник сельскохозяйственной науки. – 2025. – Т. 55, № 1 (314). – С. 41–51.
- Nosheen A. Pseudomonas putida improved soil enzyme activity and growth of kasumbha under low input of mineral fertilizers / A. Nosheen, H. Yasmin, R. Naz, A. Bano, R. Keyani, I. Hussain // Soil Science and Plant Nutrition. – 2018. – Vol. 64, No 4. – P. 520–525.
- Зинченко М. К. Ферментативная активность аграрных почв Верхневолжья / М. К. Зинченко, С. И. Зинченко, А. А. Борин, О. П. Камнева // Современные проблемы науки и образования. – 2017. – № 3. – С. 143.
- Хазиев Ф. Х. Функциональная роль ферментов в почвенных процессах / Ф. Х. Хазиев // Вестник академии наук РБ. – 2015. – Т. 20, № 2(78). – С. 14–24.
- Драган Н. А. Почвенные ресурсы Крыма / Н. А. Драган. – Симферополь: Доля, 2004. – 208 с.
- Карта почв России [Электронный ресурс]. – Режим доступа: https://soil-db.ru/map?lat=45.5541&lng=35.5408&zoom=9&feature=35693. – Дата обращения: 22.03.2025.
- Страшная А. И. Автоматизированная технология мониторинга и расчета количества декад с почвенной и атмосферно-почвенной засухой под зерновыми культурами / А. И. Страшная, И. Э. Пурина, О. В. Чуб, О. И. Задорнова, Т. С. Чекулаева // Труды Гидрометцентра России. – 2013. – Вып. 349. – С. 161–175.
- Практикум по физиологии растений / Под ред. Н. Н. Третьякова, Т. В. Карнауховой, Л. А. Паничкина. – 3-е изд., перераб. и доп. – М.: Агропромиздат, 1990. – 271 с.
- Гончарова Э. А. Водный статус культурных растений и его диагностика / Э. А. Гончарова; под ред. В. А. Драгавцева. – СПб.: ВИР, 2005. – 112 с.
- Грицаенко З. М. Методи біологічних та агрохімічних досліджень рослин та ґрунтів / З. М. Грицаенко, А. О. Грицаенко, В. П. Карпенко. – Київ: ЗАТ «НІЧЛАВА», 2003. – 320 с.
- Методические рекомендации по оценке токсического действия пестицидов на микрофлору почвы / под общ. рук. Ю. В. Круглова. – М., 1981. – 43 с.
- Доспехов Б. А. Методика полевого опыта / Б. А. Доспехов. – М.: Агропромиздат, 1985. – 351 с.
- Туев Н. А. Микробиологические процессы гумусообразования / Н. А. Туев. – М.: Агропромиздат, 1989. – 239 с.
- Denef K. Influence of dry–wet cycles on the interrelationship between aggregate, particulate organic matter, and microbial community dynamics / K. Denef, J. Six, H. Bossuyt, S. D. Frey, E. T. Elliott, R. Merckx // Soil Biology and Biochemistry. – 2001. – Vol. 33. – P. 1599–1611.
- Julca I. Xeroprotectants for the stabilization of biomaterials. Review / I. Julca, M. Alaminos, J. González-López, M. Manzanera // Biotechnology Advances. – 2012. – Vol. 30, No 6. – P. 1641–1654.
- Manzanera M. Dealing with water stress and microbial preservation / M. Manzanera // Environmental Microbiology. – 2020. – Vol. 00. – 9 p.
EVALUATION OF THE EFFICIENCY OF USING A COMPLEX OF MICROORGANISMS IN CULTIVATING SORGHUM BICOLOR (L.) IN DIRECT SEEDING AND TRADITIONAL SYSTEMS
Abdurashytova E. R., Abdurashytov S. F., Pashtetskiy V. S.
Research Institute of Agriculture of Crimea, Simferopol, Republic of Crimea, Russian Federation
E-mail: elvi-jadore@mail.ru
In world agriculture, grain sorghum occupies 70-75 million hectares. Its grain is used to produce alcohol and alcoholic beverages, as human food and animal feed, etc. Growing agricultural crops requires an environmentally sound approach, which is ensured by the use of biotechnological techniques that promote the activation of the soil microbiome, optimization of mineralization processes and increased profitability of products in various conditions. The potential role of PGPR in imparting resistance to water stress, including the use of arbuscular mycorrhizal fungi with grain sorghum, has been studied. Direct seeding helps to preserve the agrophysical and biological properties of the soil. An integrated approach to the use of microorganisms and direct seeding in agriculture increases the overall biogenicity of soils and complements the methods for plant adaptation to water and temperature stress. The purpose of the work is to assess the water status of plants, the biological activity of the rhizosphere and the biomass of grain sorghum under the influence of a complex of microorganisms and various agrosystems in the conditions of southern chernozem. The assessment was carried out in a stationary field experiment to study the effect of the traditional farming system and direct seeding and the use of sorghum seed inoculation with a complex of microorganisms (CM) on the preservation of soil fertility. A stationary experiment to study the influence of farming systems and a complex of microorganisms (CM) on the preservation of the fertility of arable lands was established in 2015 on the experimental field of the Federal State Budgetary Scientific Institution “Research Institute of Agriculture of Crimea”. According to the conditions of the stationary experiment, a two-factor experiment was established: factor A is a traditional or resource-saving agrosystem, factor B is the presence or absence of inoculation with a complex of microorganisms (CM); with the following options: 1. Direct seeding (DS) without seed treatment with CM; 2. Direct seeding with seed treatment with CM (DS with CM); 3. Traditional system (TS) without seed treatment with CM; 4. TS – seed treatment with CM (TS with CM). The complex of microorganisms (CM) consists of strains of the Crimean collection(https://ckp-rf.ru/catalog/usu/507484/): Paenibacillus рolуmуха П (main function: protection against phytopathogens), Lelliottia nimipressuralis 32-3 (growth stimulation and phosphate mobilization), Agrobacterium radiobacter 204 (improving nitrogen nutrition) and the association of arbuscular mycorrhiza fungi Rhizophagus sp. P3. The parameters of plant water status and biological activity of the sorghum rhizosphere were selected: water deficit level, relative turgidity, grain biomass, peroxidase activity and rhizosphere carbon dioxide emission. Weather and climatic conditions were characterized by weak and moderate drought intensity in 2018 and 2020, respectively, and no drought in 2019. Based on the results of determining the water deficit, it was established: low – 2018 and 2019, and 2020 – medium degree of drought resistance of plants in all experimental variants. The effect of CM on the value of relative turgidity and water status in the field experiment was noted only in 2019 in the direct seeding variant towards increasing the saturation of cells with water and drought resistance of plants. The use of CM helps to optimize the functional activity of peroxidase enzymes and carbon dioxide emissions in the rhizosphere. Under the conditions of 2018 and 2020, a decrease in peroxidase activity and carbon dioxide emissions in direct seeding was found compared to the traditional system by up to 3.9 times and 1.4 times, respectively. On average, over the years of the study, the grain biomass in various farming systems was the same, while the use of CM contributed to its increase by 0.07 t / ha in the traditional system and 0.23 t / ha in direct seeding. Correlation analysis of the studied parameters in the active phase of plant growth showed similar relationships in 2018 and 2020 between the grain biomass of plants with peroxidase activity r = -0.74 and r = -0.67, respectively. The correlation between grain biomass and rhizosphere carbon dioxide emissions with r= -0.88 was revealed in a 2020 field experiment. The established correlations between the activity of rhizosphere peroxidases, carbon dioxide emissions and grain biomass indicate that the use of a complex of microorganisms helps to optimize the functioning of the native microflora, which is shown by the result of their vital activity (enzymatic activity) and the adaptation of plants to dry conditions. Thus, the integrated approach of using biotechnological and agrotechnological methods in growing grain sorghum promotes the adaptive work of the native microflora, which is demonstrated by the result of their vital activity (biological activity) and an increase in the biomass of plant grains under dry conditions.
Keywords: Sorghum bicolor (L.) Moench; no-till; water deficit; carbon dioxide emission; peroxidase activity; grain biomass; correlation.
References
- Mohamed H. I., Fawzi E. M., Basit A. and Kaleemullah Lone R., Sorghum: nutritional factors, bioactive compounds, pharmaceutical and application in food systems: A review, Phyton-Int. J. Exp. Bot., 91 (7), 1303 (2022).
- Zoteev V. S., Simonov G. A. and Antimonov A. K., Grain sorghum in feeding lactating cows, Molochn. Myasn. Skotov., 7, 34 (2018).
- Syrkina L. F. and Nikonorova Yu. Yu., Grain sorghum as a potential raw material for starch and alcohol production, Vestn. KrasGAU, 10 (163), 95 (2020).
- Uddin M. R., Park S. U., Dayan F. E. and Pyon J. Y., Herbicidal activity of formulated sorgoleone, a natural product of sorghum root exudate, Pest Manag. Sci., 70(2), 252 (2014).
- Shukla S. K., Yadav R. L., Gupta R., Singh A. K., Awasthi S. K. and Gaur A., Deep Tillage, Soil Moisture Regime, and Optimizing N Nutrition for Sustaining Soil Health and Sugarcane Yield in Subtropical India, Commun. Soil Sci. Plant Anal., 49 (4), 444 (2018).
- Aipova R., Abdykadyrova A. B. and Kurmanbaev A. A., Biological preparations in organic farming, Biotechnol. Sel. Rast., 2 (4), 36 (2019).
- Suman J., Rakshit A., Ogireddy S. D., Singh S., Gupta C. and Chandrakala J., Microbiome as a Key Player in Sustainable Agriculture and Human Health, Front. Soil Sci., 2, 821589 (2022).
- Volobueva O., Seregina I., Belopukhov S., Grigoryeva M., Trukhachev V., Manokhina A. and Kozlov N., The influence of biological products and growth regulators on the yield and quality indicators of pea seeds of various varieties, Braz. J. Biol., 84, e280312 (2024).
- Venturi V. and Keel C., Signaling in the rhizosphere, Trends Plant Sci., 21(3), 187 (2016).
- Andronov E. E., Ivanova E. A., Pershina E. V., Orlova O. V., Kruglov Yu. V., Belimov A. A. and Tikhonovich I. A., Analysis of soil microbiome indicators in processes related to soil formation, organic matter transformation and fine regulation of vegetation processes, Byull. Pochv. Inst. Dokuchaeva, (80), 83 (2015).
- Dubinina M. N. and Lykhman V. A., The role of soil microbial communities in the formation of agronomically valuable water-resistant structure, Vestn. Don. Gos. Agrar. Univ., 3-1, 82 (2019).
- Kha T. Z., Kanarsky A. V., Kanarskaya Z. A. et al., Key plant growth stimulators – rhizobacteria, Vestn. Povolzh. Gos. Tekhnol. Univ., Ser.: Les. Ekol. Prirodopol’z., 3 (47), 58 (2020).
- Chernykh E. P., Milshina L. A., Gogoleva O. V. and Pervyshina G. G., Influence of ecological factors and vegetation period on the content of biologically active substances in some plant raw materials of Krasnoyarsk Territory, Vestn. KrasGAU, 11 (74), 128 (2012).
- Kumar P. G., Mir Hassan Ahmed S. K., Desai S., Leo Daniel A. E. and Abdul R., In vitro Screening for Abiotic Stress Tolerance in Potent Biocontrol and Plant Growth Promoting Strains of Pseudomonas and Bacillus spp., Int. J. Bacteriol., 2014, 6 (2014).
- Lebedev V. N., Vorobeikov G. A. and Uraev G. A., Evaluation of the effectiveness of seed treatment of cabbage crops with associative rhizobacteria under normal moisture and soil drought conditions, Usp. Sovrem. Estestvozn., 5, 13 (2021).
- Abdurashtov S. F., Gricevich K. S., Alekseeva A. I. and Abdurashtova E. R., Growth-stimulating effect of symbiotic microorganisms on sorghum under water deficit, Sib. Vestn. S-kh. Nauki, 55 (1), 41 (2025).
- Nosheen A., Yasmin H., Naz R., Bano A., Keyani R. and Hussain I., Pseudomonas putida improved soil enzyme activity and growth of kasumbha under low input of mineral fertilizers, Soil Sci. Plant Nutr., 64 (4), 520 (2018).
- Zinchenko M. K., Zinchenko S. I., Borin A. A. and Kamneva O. P., Enzymatic activity of agricultural soils in the Upper Volga region, Sovrem. Probl. Nauki Obraz., 3, 143 (2017).
- Khaziev F.Kh., Functional role of enzymes in soil processes, Vestn. Akad. Nauk RB, 20 (2), 14 (2015).
- Dragan N.A., Soil Resources of Crimea, 208 p. (Dolya, Simferopol, 2004).
- Soil Map of Russia, https://soil-db.ru/map?lat=45.5541&lng=35.5408&zoom=9&feature=35693 (accessed: 22.03.2025).
- Strashnaya A. I., Purina I. E., Chub O. V., Zadornova O. I. and Chekulayeva T. S., Automated technology for monitoring and calculating the number of decades with soil and atmospheric-soil drought under grain crops, Tr. Gidrometcent. Ross., 349, 161 (2013).
- Workshop on Plant Physiology, edited by Tretyakov N. N., Karnaukhova T. V. and Panichkin L. A., 271 p. (Agropromizdat, Moscow, 1990).
- Goncharova E. A., Water Status of Cultivated Plants and Its Diagnostics, edited by Dragavtsev V. A., 112 p. (VIR, St. Petersburg, 2005).
- Gritsaenko Z. M., Gritsaenko A. O. and Karpenko V. P., Methods of Biological and Agrochemical Research of Plants and Soils, 320 p. (NICHLAVA, Kyiv, 2003).
- Guidelines for Assessing the Toxic Effects of Pesticides on Soil Microflora, edited by Kruglov Yu. V., 43 p. (Moscow, 1981).
- Dospekhov B. A., Methodology of Field Experiment, 351 p. (Agropromizdat, Moscow, 1985).
- Tuev N. A., Microbiological Processes of Humus Formation, 239 p. (Agropromizdat, Moscow, 1989).
- Denef K., Six J., Bossuyt H., Frey S. D., Elliott E. T. and Merckx R., Influence of dry-wet cycles on the interrelationship between aggregate, particulate organic matter, and microbial community dynamics, Soil Biol. Biochem., 33, 1599 (2001).
- Julca I., Alaminos M., González-López J. and Manzanera M., Xeroprotectants for the stabilization of biomaterials. Review, Biotechnol. Adv., 30 (6), 1641 (2012).
- Manzanera M., Dealing with water stress and microbial preservation, Environ. Microbiol., 23 (7), 3351 (2021).



