Ученые записки Крымского федерального университета имени В. И. Вернадского
Биология. Химия. Том 11 (77). 2025. № 2. С. 85–98.
УДК 612.282; 612.216.2
DOI 10.29039/2413-1725-2025-11-2-85-98
РЕСПИРАТОРНЫЕ РЕАКЦИИ НА ВВЕДЕНИЕ АДЕНОЗИНТРИФОСФАТА В ОБЛАСТЬ РЕТРОТРАПЕЦИЕВИДНОГО ЯДРА У КРЫС
Конашенкова А. Т., Ведясова О. А., Инюшкин А. Н.
Самарский национальный исследовательский университет имени академика С. П. Королева, Самара, Россия
Е-mail: o.a.vedyasova@gmail.com
Ретротрапециевидное ядро (РТЯ) играет ключевую роль в центральной хеморецепции, участвует в регуляции дыхания, обеспечивая центральный респираторный хеморефлекс в ответ на гиперкапнию и гипоксию. Активность нейронов РТЯ контролируется многими нейромедиаторными системами, среди которых до конца не установлена роль пуринергических механизмов. В настоящем исследовании изучены изменения паттерна внешнего дыхания и биоэлектрической активности диафрагмальной мышцы при микроинъекциях АТФ, как агониста Р2-рецепторов, в область РТЯ у наркотизированных крыс, дышащих атмосферным воздухом неизмененного газового состава. Показано, что в этих условиях воздействие АТФ на РТЯ усиливает внешнее дыхание и стимулирует инспираторную залповую активность диафрагмы. Полученные данные указывают на участие пуринергической системы, в частности Р2-рецепторов РТЯ, в регуляции дыхания в условиях нормоксии.
Ключевые слова: регуляция дыхания, ретротрапециевидное ядро, Р2-рецепторы, аденозинтрифосфат (АТФ), микроинъекции, внешнее дыхание, электромиограмма диафрагмальной мышцы.
ВВЕДЕНИЕ
В настоящее время вопросы нейрохимической регуляции дыхания вызывают у исследователей особый интерес, что обусловлено задачей поиска новых методов профилактики и лечения респираторных заболеваний, связанных с поражением структур центральной нервной системы [1], а также необходимостью дальнейшего развития представлений о вкладе структур головного мозга [2], в том числе различных отделов центральной респираторной нейронной сети (РНС), в механизмы формирования ритма и паттерна дыхания [3]. Одним из отделов РНС, значение которых требует более глубокого изучения, является ретротрапециевидное ядро (РТЯ).
РТЯ представляет собой небольшую популяцию нейронов, идентификация которых долгое время была затруднена из-за их морфологической идентичности клеткам прилегающих структур дыхательного центра [4]. Точное местоположение в ростральной вентролатеральной медуллярной области и физиологическое значение РТЯ удалось установить благодаря экспрессии на поверхности цитоплазматических мембран его нейронов уникального набора маркеров. К ним относятся нейромедин B, калиевый канал TASK-2, протон-активируемый рецептор GPR4, транспортер VGLUT2 и фактор транскрипции PHOX2B [4–6], которые обусловливают принадлежность РТЯ к хемочувствительным структурам мозга и его участие в регуляции дыхания [7]. Опыты на срезах продолговатого мозга новорожденных крыс показали, что сразу после рождения нейроны РТЯ характеризуются значительной импульсной активностью, что позволяет предполагать их вклад в механизм формирования первого вдоха [6]. Также было установлено, что у крыс гипоплазия РТЯ нарушает центральный хеморефлекс [8], а у человека генетические патологии нейронов данной области вызывают врожденный центральный гиповентиляционный синдром [9]. В настоящее время РТЯ рассматривается как важная структура вентролатеральной области мозгового ствола, которая входит в состав центральной РНС. Это ядро участвует в регуляции дыхательного ритма за счет связей с пейсмейкерными нейронами комплекса пре-Бетцингера [10] и в формировании оптимальных параметров легочной вентиляции, благодаря связям с премоторными нейронами РНС, тем самым выполняя важную гомеостатическую функцию [11].
Вовлечение РТЯ в центральный контроль за функцией дыхания опосредуется различными нейромедиаторными механизмами [12–14]. На данном этапе изучения РТЯ среди нейромедиаций, обеспечивающих его функционирование, вызывает интерес пуринергическая система, широко представленная в головном мозге, в том числе в структурах РНС. Исследование функций пуринергической системы в РНС очень актуально, особенно с учетом данных о потенциальном вкладе пуринома у недоношенных и новорожденных млекопитающих в формирование чувствительности к гипоксическому угнетению дыхания. Так, экспериментально доказано участие пуринома, в частности таких его компонентов, как АТФ и Р2-рецепторы, в опосредовании возбуждающей вентиляционной реакции на гипоксическую стимуляцию в ряде отделов РНС, например, в комплексе пре-Бетцингера [15]. Однако в целом значение пуринергической сигнализации в деятельности разных дыхательных ядер изучено в недостаточной степени. Это относится и к РТЯ, где обнаружены секретируемые астроцитами и нейронами молекулы АТФ, активирующие прилегающие к ним нервные и глиальные клетки [16].
Сведения об участии пуринома РТЯ в регуляции дыхания весьма неоднозначны. По некоторым данным, инъекции АТФ в РТЯ усиливают дыхание и одновременно повышают кровяное давление при гипоксии, что объясняется в аспекте участия пуринергических механизмов в модуляции активности медуллярных хемосенсорных нейронов [13]. В качестве наиболее вероятной мишени для АТФ в РТЯ указываются пуриновые рецепторы Р2-типа [17]. В экспериментах на крысах in vivo и in vitro с билатеральными микроинъекциями агонистов и блокаторов разных подтипов P2-рецепторов в данное ядро показано, что на фоне гипоксии и гиперкапнии этот тип рецепторов опосредует участие АТФ в хеморефлекторном контроле дыхания, но при этом ставится под сомнение роль рецепторов подтипа P2Y1 в возникновении наблюдаемых кардиореспираторных реакций [18]. То есть, рецепторные механизмы реализации респираторных эффектов пуриновых сигнальных молекул в РТЯ пока до конца не ясны. Кроме того, остается открытым вопрос об участии пуринергической системы РТЯ в регуляции дыхания в условиях нормоксии. Все сказанное свидетельствует о том, что роль пуринергических механизмов в области РТЯ, включая модулирующий эффект АТФ на респираторную активность данного ядра, нуждается в дальнейшем детальном изучении и понимании.
Цель нашего исследования заключалась в анализе участия АТФ, как агониста пуриновых рецепторов, в механизмах регуляции дыхания на уровне РТЯ у крыс, дышащих обычным атмосферным воздухом.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследования использовались взрослые нелинейные крысы массой тела 180–220 г. Эксперименты выполнены в соответствии с этическим стандартом проведения исследований на животных, утвержденным правовыми актами РФ, принципами Базельской декларации и рекомендациями комиссии по биоэтике биологического факультета Самарского национального исследовательского университета имени академика С. П. Королева (протокол № 2 от 10.03.2024). Животные случайным образом были разделены на контрольную (n=6) и опытную (n=10) группы. Крыс наркотизировали уретаном (1,6 г/кг, внутрибрюшинно), располагали на операционном столике, проводили трахеостомию и открывали доступ к диафрагмальной мышце через разрез на боковой поверхности туловища. Затем животных переносили в стереотаксическую установку СЭЖ- 3, жестко фиксировали голову и обнажали поверхность черепа. В черепе высверливали трепанационное отверстие, через которое по стереотаксическим координатам (11,3 мм каудальнее брегмы; 2,0 мм латеральнее срединного шва; 8,8 мм вглубь от дорсальной поверхности мозга [8]) вводили в РТЯ стеклянную микроканюлю с диаметром кончика 30–50 мкм, герметично закрепленную на игле микрошприца («Hamilton», Швейцария). Крысам экспериментальной группы делали микроинъекции 0,2 мкл раствора АТФ (аденозинтрифосфата динатриевая соль, «Silko Research Laboratories», Индия) в концентрации 10–7 Моль/л, приготовленного методом разведения в искусственной спинномозговой жидкости (ИСМЖ). Концентрацию АТФ для микроинъекций подбирали с учетом литературных данных [18]. Контрольная группа получала микроинъекцию аналогичного количества ИСМЖ.
Запись респираторных эффектов в контроле и опыте проводили до и в течение 30 минут после микроинъекций. Регистрировали параметры паттерна внешнего дыхания с использованием миниатюрного спирографа, соединенного с трахеостомической трубкой, и одновременно при помощи электромиографа записывали биоэлектрическую активность диафрагмальной мышцы, отводимую унилатерально двухигольчатым электродом. Сигналы от спирографа и электромиографа передавали на персональный компьютер и анализировали в программе PowerGraph 3.3 Professional (ООО «Интероптика-C», Россия). На спирограммах определяли длительность вдоха (Tвд, с), длительность выдоха (Tвыд, с), дыхательный объем (ДО, мл). Рассчитывали объемную скорость инспираторного потока (Vинс, мл/с), частоту дыхания (ЧД, мин–1), минутный объем дыхания (МОД, мл/мин). На электромиограммах (ЭМГ) диафрагмальной мышцы оценивали длительность инспираторных залпов (ДЗ, с), межзалповых интервалов (МЗИ, с), максимальную амплитуду осцилляций в залпе (МАО, усл. ед.).
Статистическую обработку проводили с помощью пакета программ SigmaPlot 12.5. Нормальность распределения данных проверяли в тесте Шапиро-Уилка. Изменение показателей относительно исходного уровня оценивали при помощи парного t-теста, для сопоставления реакций в эксперименте и контроле использовали t-тест. Корреляционный анализ выполняли с помощью теста Спирмена, рассчитывая коэффициент корреляции r. Первичные данные в статье представлены как среднее значение ± стандартная ошибка среднего (M±SEM). Статистически значимыми считали различия при p<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе исследования установлено, что микроинъекции АТФ в РТЯ оказывают стимулирующее действие на респираторную активность крыс, о чем свидетельствует динамика амплитудных и частотных параметров спирограммы и ЭМГ диафрагмальной мышцы в процессе экспозиции.
Среди изменений частотных параметров паттерна внешнего дыхания в первую очередь следует отметить учащение дыхательного ритма, на что указывало увеличение ЧД, определенным образом коррелировавшее с изменениями других спирографических показателей (табл. 1, рис. 1).
Таблица 1
Коэффициенты корреляции между изменениями частотных и объемных параметров паттерна внешнего дыхания у крыс после микроинъекции
АТФ в РТЯ
| Время экспозиции | ЧД и Те | МОД и ЧД | МОД и ДО | |||
|---|---|---|---|---|---|---|
| r | p | r | p | r | p | |
| 1 мин | -0,97 | < 0,001 | 0,89 | < 0,001 | 0,50 | > 0,05 |
| 2 мин | -0,98 | < 0,001 | 0,96 | < 0,001 | 0,75 | < 0,05 |
| 3 мин | -0,98 | < 0,001 | 0,86 | < 0,01 | 0,11 | > 0,05 |
| 4 мин | -0,97 | < 0,001 | 0,85 | < 0,01 | 0,46 | > 0,05 |
| 5 мин | -0,98 | < 0,001 | 0,85 | < 0,01 | 0,57 | > 0,05 |
| 10 мин | -0,99 | < 0,001 | 0,75 | < 0,05 | 0,96 | < 0,001 |
| 15 мин | -0,99 | < 0,001 | 0,96 | < 0,001 | 0,89 | < 0,001 |
| 30 мин | -0,99 | < 0,001 | 0,93 | < 0,001 | 0,75 | < 0,05 |
Практически сразу после микроинъекции АТФ (с 1-й по 10-ю минуты) отмечался статистически значимый рост ЧД относительно исходного уровня (от 71,88±3,44 мин–1 до 78,86±4,10 мин–1), что в среднем составляло 9,7 % (p<0,01) и превышало показатели контроля (p<0,05). В контрольной серии существенных изменений ЧД у крыс не наблюдалось (рис. 1, А).
Учащение дыхания у экспериментальных животных обусловливалось сопутствующей динамикой длительности обеих фаз дыхательного цикла. В течение всего периода регистрации наблюдалось уменьшение Твд в среднем на 9,3 % (p<0,05) от исходной величины (рис. 1, Б). Уменьшение Твыд после микроинъекции АТФ в РТЯ происходило в более коротком временном диапазоне (со 2-й по 4-ю минуты) и составляло в среднем 8,5 % (p<0,05) по сравнению с фоновыми значениями (рис. 1, В).
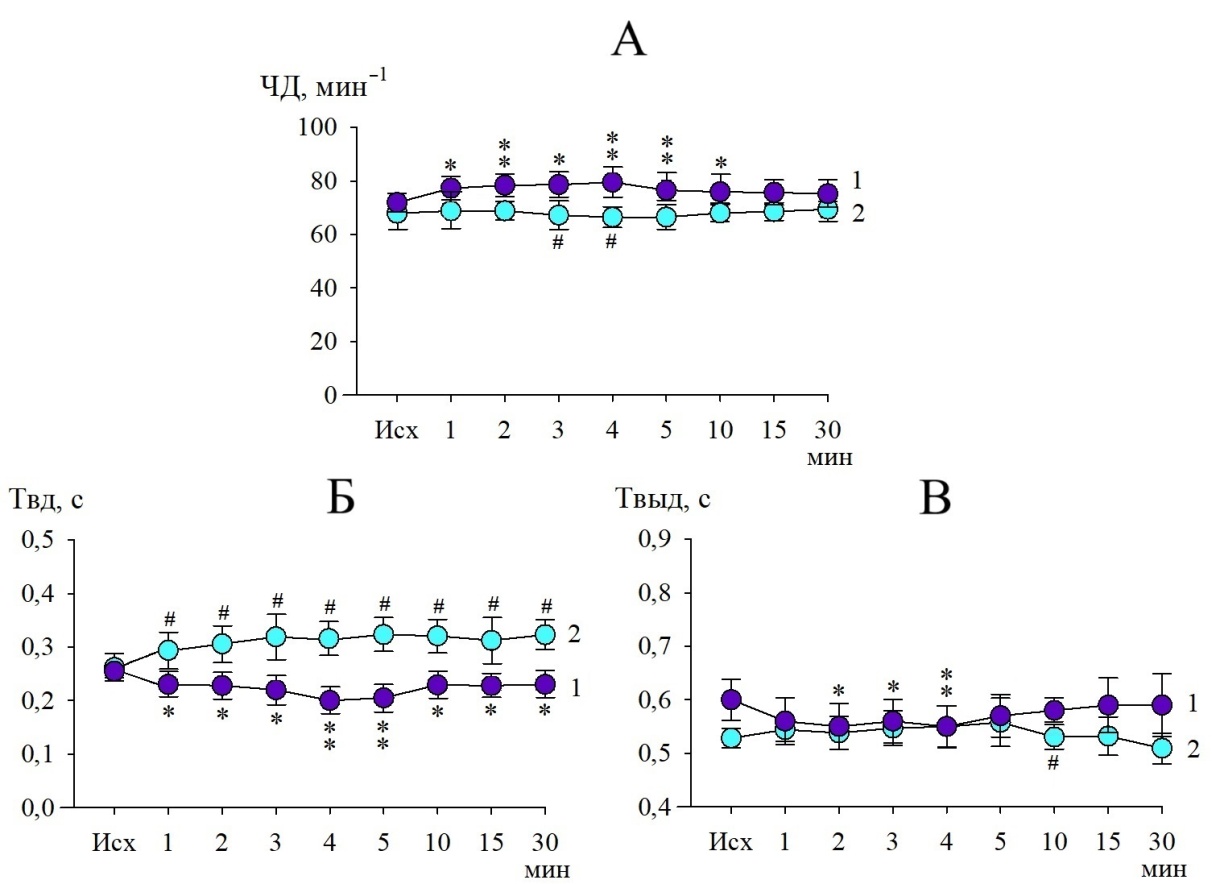
Рис. 1. Изменения частотных параметров внешнего дыхания после микроинъекции в РТЯ раствора АТФ (10–7 М). Обозначения: А – частота дыхания;
Б – длительность вдоха; В – длительность выдоха; кривая 1– эксперимент; кривая 2 – контроль; *(p<0,05), **(p<0,01) – статистически значимые различия с исходным уровнем; #(p<0,05) – различия между экспериментом и контролем.
Отмеченные в опыте изменения Твд и Твыд статистически значимо отличались от изменений в контроле (p<0,05). Обращают внимание результаты корреляционного анализа, показавшего наличие выраженной связи ЧД с изменениями только экспираторной фазы дыхательного цикла (табл. 1), что позволяет говорить о неоднозначном вкладе пуринергических механизмов РТЯ в модуляцию активности нейронов, регулирующих продолжительность вдоха и выдоха. Дополнительным основанием для такого предположения служат данные об особенностях взаимодействия РТЯ с бульбоспинальными инспираторными и экспираторными нейронами ростральной и каудальной вентральных респираторных групп продолговатого мозга [19–21].
Что касается объемных параметров внешнего дыхания, то они при действии АТФ на РТЯ значимо увеличивались, внося свой вклад в итоговое усиление легочной вентиляции, о чем свидетельствует характер спирограмм (рис. 2, А).
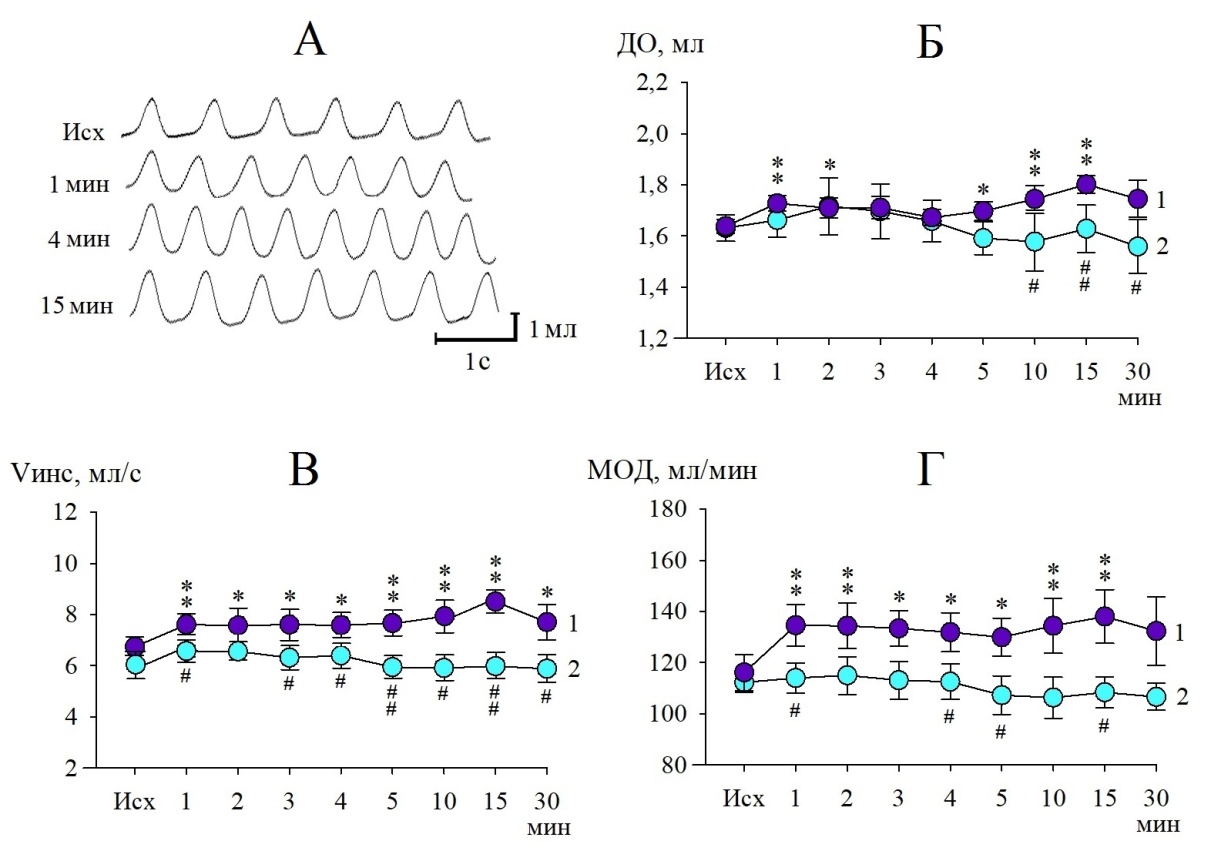
Рис. 2. Изменения объемных параметров внешнего дыхания после микроинъекции в РТЯ раствора АТФ (10–7 М). Обозначения: А – спирограммы, зарегистрированные в разные сроки экспозиции; Б – дыхательный объем;
В – объемная скорость инспираторного потока; Г – минутный объем дыхания; кривая 1– эксперимент; кривая 2 – контроль; *(p<0,05), **(p<0,01) – статистически значимые различия с исходным уровнем; #(p<0,05), ##(p<0,01) – различия между экспериментом и контролем.
После введения в РТЯ агониста пуриновых рецепторов отмечался постепенный прирост ДО (рис. 2, Б), который на 1-й минуте составлял 8,5 % (p<0,01) от исходного значения (1,64±0,03 мл). По мере действия агониста этот эффект усиливался, и на 15-й минуте наблюдений ДО возрастал до 1,85±0,04 мл, то есть превышал исходный уровень на 13,2 % (p<0,01). С учетом литературных данных, допустимо считать, что наблюдаемое усиление ДО в сочетании с выше отмеченным уменьшением Твд являются результатом модулирующего влияния АТФ на рецепторы P2Y2/4 в РТЯ и отражают участие пуринергической передачи в механизмах стимуляции центрального генератора инспираторной активности [15].
Выраженным приростом в ответ на микроинъекцию АТФ в РТЯ характеризовалась и величина Vинс. Динамика Vинс зависела как от уменьшения Твд (r=-0,92; р<0,01), так и от увеличения ДО (r=0,77; р<0,05). Уровень Vинс плавно нарастал от 1-й минуты экспозиции (12,9 % от фона; р<0,01) к 15-й минуте (25,3 % от фона; р<0,01). Отмеченные изменения Vинс статистически значимо (р<0,01) различались с реакциями у контрольных животных (рис. 2, В).
Стимулирующее действие АТФ на РТЯ наглядно проявилось усилением МОД. Исходно МОД составлял 116,54±10,03 мл/мин. В течение первой половины экспозиции его величина достигала 137,01±15,02 мл/мин (р<0,01) и далее существенно не менялась. Изменения МОД при действии АТФ на РТЯ достоверно превышали отклонения данного показателя у животных в контрольной серии (рис. 2, Г). Характерно, что в первые 5 минут наблюдений у экспериментальных крыс на прирост МОД в большей степени влияло увеличение ЧД, в то время как на 10–30-й минутах экспозиции равноценным фактором роста МОД стало также увеличение ДО, что подтверждается усилением положительных корреляций между этими параметрами (табл. 1).
Микроинъекции АТФ в РТЯ оказывали также стимулирующее действие на биоэлектрическую активность диафрагмальной мышцы (рис. 3, А). На ЭМГ отмечалось увеличение частоты инспираторных залповых разрядов за счет уменьшения длительности как самих залпов, так и межзалповых интервалов.
Наиболее выраженное изменение ДЗ (от 0,33±0,02 с до 0,29±0,02 с) достигалось в интервале с 3-й по 5-ю минуты от начала воздействия АТФ (рис. 3, Б), что в среднем соответствовало уменьшению на 12,2 % (р<0,05) от исходного уровня. Тенденция укорочения МЗИ была зафиксирована в том же временном интервале (рис. 3, В) и практически с той же выраженностью (9,6 %; р<0,05). Эти изменения сопровождались ростом амплитуды осцилляций в инспираторных залпах в среднем на 10,9 % (р<0,05) по сравнению с исходным значением (рис. 3, Г). Указанные реакции диафрагмальной мышцы значимо превышали изменения в контроле (р<0,05).
Подтверждением стимулирующего влияния активации пуриновых рецепторов области РТЯ на легочную вентиляцию и активность инспираторных мышц служит наличие и характер корреляционной зависимости между параметрами спирограммы и ЭМГ диафрагмальной мышцы. Так, следует отметить положительную корреляционную связь (r>0,70; p<0,01) между укорочением Твыд на спирограмме и МЗИ на ЭМГ диафрагмы в ходе всей экспозиции. Положительные корреляции наблюдались также между уменьшением длительности вдоха и инспираторных залпов диафрагмы на 4-й (r=0,83; p<0,05), 15-й (r=0,74; p<0,05) и 30-й (r=0,75; p<0,05) минутах экспозиции. Изменения ДО и МАО положительно коррелировали между собой на 1-й (r=0,82; p<0,05), 4-й (r=0,75; p<0,05) и 5-й (r=0,78; p<0,05) минутах эксперимента. Одновременно отмечалась сильная отрицательная корреляционная связь между Твыд и изменениями ЧД.
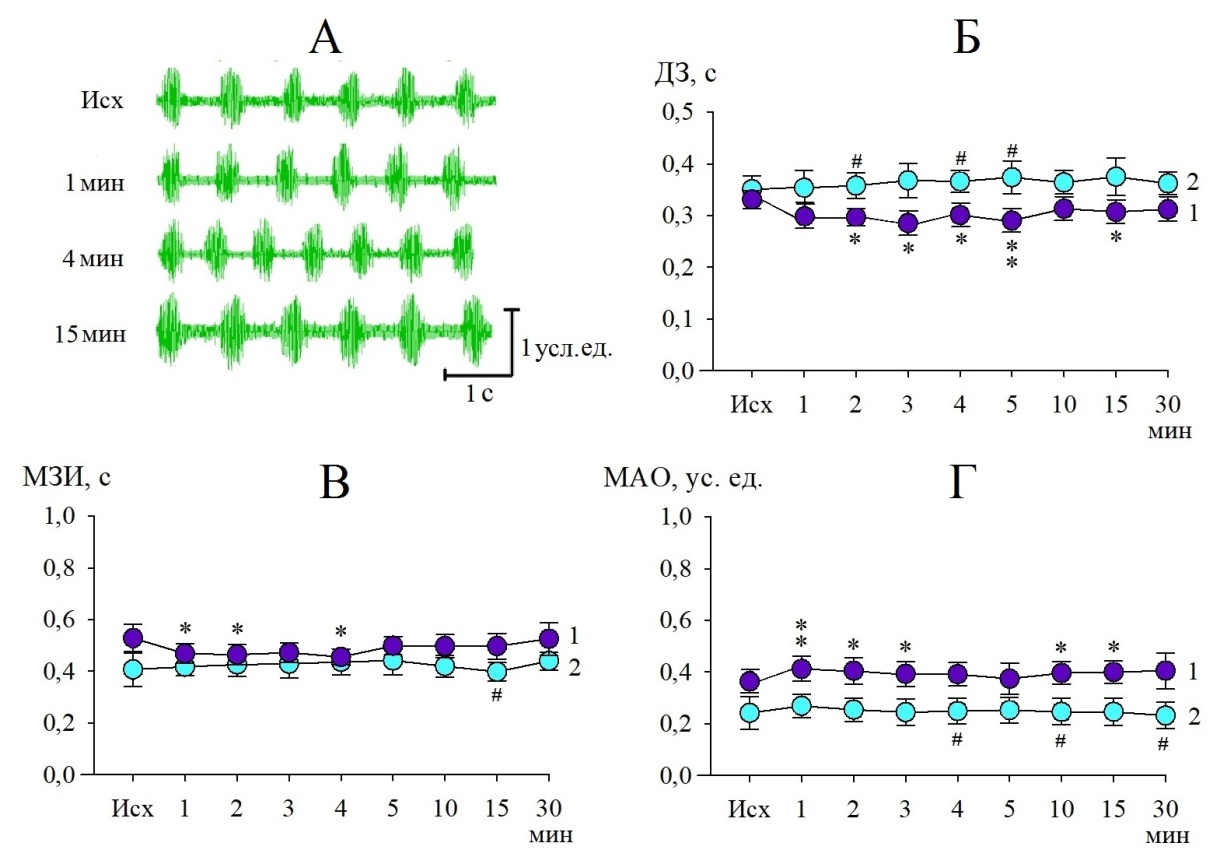
Рис. 3. Изменения параметров залповой активности диафрагмальной мышцы после микроинъекции в РТЯ раствора АТФ (10–7 М). Обозначения: А – ЭМГ, зарегистрированные в разные сроки экспозиции; Б – длительность залпов;
В – межзалповый интервал; Г – максимальная амплитуда осцилляций в залпе; кривая 1– эксперимент; кривая 2 – контроль; *(p<0,05), **(p<0,01) – статистически значимые различия с исходным уровнем; #(p<0,05) – различия между экспериментом и контролем.
Характер реакций диафрагмальной мышцы и внешнего дыхания, зарегистрированных в настоящем исследовании у наркотизированных крыс с микроинъекциями АТФ в РТЯ, укладываются в рамки представлений о том, что активация пуриновых рецепторов в продолговатом мозге стимулирует моторный инспираторный выход из дыхательного центра [22]. Полученные в работе данные согласуются с описанными в литературе результатами плетизмографической регистрации усиления легочного дыхания в ответ на введение АТФ в РТЯ у бодрствующих крыс, что объясняется активацией пуриновых рецепторов Р2-типа, поскольку введение их неселективного блокатора (PPADS) в РТЯ ослабляло реакции дыхания на гиперкапнию и гипоксию [18]. Вклад Р2-рецепторов в стимуляцию дыхания нейронами РТЯ также подтверждается сведениями о том, что микроинъекция PPADS в изучаемое ядро снижает частоту и амплитуду залпов диафрагмальной мышцы у крыс [23].
Респираторные эффекты микроинъекций АТФ в РТЯ могут быть объяснены с позиций активации разных типов Р2-рецепторов, в том числе метаботропных P2Y и ионотропных P2X [13]. В пользу того, что на уровне РТЯ функционируют оба типа рецепторов, свидетельствует тот факт, что при действии АТФ на РТЯ активность его нейронов модулируется двумя путями. Так, контакт АТФ с постсинаптическими P2Y-рецепторами оказывает на нейроны РТЯ возбуждающее влияние, а при активации ионотропных P2X-рецепторов, расположенных пресинаптически, происходит угнетение нейронов РТЯ [24]. Высказывается предположение, что это угнетение, возможно, является следствием высвобождения ГАМК и глицина тормозными интернейронами, на терминалях которых локализованы P2X-рецепторы. Несмотря на то, что P2X-рецепторы широко представлены в различных отделах мозга [25], их роль в деятельности РНС до конца не ясна. В то же время имеются свидетельства того, что утрата подтипа P2X7 области РТЯ у нокаутных крыс вызывает нерегулярное дыхание на фоне сердечной недостаточности, а при восстановлении их экспрессии нарушения регуляции дыхания устраняются [26].
В отношении P2Y-рецепторов установлено, что на уровне РТЯ экспрессируются несколько их подтипов [4, 23], из которых в регуляции дыхания, предположительно, участвуют P2Y2 и P2Y4. Эти подтипы активируются эндогенным АТФ, выделяющимся астроцитами и аксональными терминалями, поступающими из ядра солитарного тракта, в условиях гиперкапнии и гипоксии [13]. Что касается результатов нашей работы, то на их основе можно говорить, что указанные подтипы P2Y-рецепторов РТЯ могут опосредовать реализацию респираторных эффектов АТФ и в условиях нормоксии.
ЗАКЛЮЧЕНИЕ
Таким образом, в ходе проведенного исследования получены данные, подтверждающие участие пуринергической системы на уровне РТЯ в регуляции дыхания у крыс, дышащих атмосферным воздухом обычного состава. Основанная на анализе собственных и литературных данных оценка молекулярных механизмов действия АТФ, как важнейшего компонента пуринома, на РТЯ позволяет заключить, что важную роль в реализации респираторных эффектов АТФ играют Р2Y-рецепторы. Взаимодействие АТФ с рецепторами данного типа в области РТЯ вызывает стимуляцию внешнего дыхания и инспираторной залповой активности диафрагмальной мышцы, что указывает на вклад пуринергической сигнализации в формирование инспираторного драйва из РНС к дыхательным мотонейронам. Обращает внимание, что обусловленное воздействием АТФ усиление дыхания наблюдается не только в условиях измененного газового гомеостаза, о чем говорится во многих публикациях, но и в условиях нормоксии, что подтверждается нашими данными. Этот факт позволяет рассматривать пуринергические механизмы РТЯ не только в контексте поддержания жизнедеятельности организма при гипоксических и гиперкапнических состояниях, но и в аспекте регуляции дыхания в условиях оптимального газового баланса. В плане развития этой точки зрения перспективным является экспериментальное исследование роли различных подтипов пуриновых Р2Y-рецепторов РТЯ в модуляции респираторных реакций в условиях нормального газового гомеостаза.
Список литературы
- Manganelli F. Brainstem involvement and respiratory failure in COVID-19 / F. Manganelli, M. Vargas, A. Iovino [et al.] // Neurol. Sci. – 2020. – Vol. 41, No 7. – P. 1663–1665. https://doi.org/10.1007/s10072-020-04487-2
- Губаревич Е. А. Микроинъекции раствора хлорида кобальта в инфралимбическую кору подавляют реакции систем кровообращения и дыхания анестезированной крысы на микроэлектростимуляцию латеральной орбитальной коры / Е. А. Губаревич, Т. Н. Кокурина, Г. И. Рыбакова [и др.] // Российский физиологический журнал им. И. М. Сеченова. – 2024. – Т. 110, № 2. – С. 216–229. DOI: 10.31857/S0869813924020058
- Guyenet P. G. Rostral ventrolateral medulla, retropontine region and autonomic regulations / P. G. Guyenet, R. L. Stornetta // Auton. Neurosci. – 2022. – Vol. 237. – 102922. https://doi: 10.1016/j.autneu.2021.102922
- Guyenet P. G. The retrotrapezoid nucleus: central chemoreceptor and regulator of breathing automaticity / P. G. Guyenet, R. L. Stornetta, G. M. P. R. Souza [et al.] // Trends. Neurosci. – 2019. – Vol. 42, No 11. – P. 807–824. DOI: 10.1016/j.tins.2019.09.002
- Kumar N.N. PHYSIOLOGY. Regulation of breathing by CO2 requires the proton-activated receptor GPR4 in retrotrapezoid nucleus neurons / N.N. Kumar, A. Velic, J. Soliz [et al.] // Science. – 2015. – Vol. 348. – P. 1255–1260. DOI: 10.1126/science.aaa0922
- Shi Y. Neuromedin B expression defines the mouse retrotrapezoid nucleus / Y. Shi, R. L. Stornetta, D. S. Stornetta [et al.] // J. Neurosci. – 2017. – Vol. 37(48). – P. 11744–11757. DOI: 10.1523/jneurosci.2055-17.2017
- Gonye E. C. Intrinsic molecular proton sensitivity underlies GPR4 effects on retrotrapezoid nucleus neuronal activation and CO2-stimulated breathing / E. C. Gonye, Y. Shi, K. Li [et al.] // J. Neurosci. – 2024. – Vol. 44(36). – e0799242024. DOI: 10.1523/Jneurosci.0799-24.2024
- Souza G. Contribution of the retrotrapezoid nucleus and carotid bodies to hypercapnia- and hypoxia-induced arousal from sleep / G. Souza, R. L. Stornetta, D. S. Stornetta [et al.] // J. Neurosci. – 2019. – Vol. 39(49). – P. 9725–9737. DOI: 10.1523/JNEUROSCI.1268-19.2019
- Петрова Н. А. Синдром врожденной центральной гиповентиляции. Опыт НМИЦ им. В. А. Алмазова / Н. А. Петрова, А. В. Брызжин, Д. П. Фофанова [и др.] // Российский журнал персонализированной медицины. – 2023. – Т. 3, № 2. – С. 57–67. DOI: 10.18705/2782-3806-2023-3-2-57-67
- Bochorishvili G. Pre-Bötzinger complex receives glutamatergic innervation from galaninergic and other retrotrapezoid nucleus neurons / G. Bochorishvili, R. L. Stornetta, M. B. Coates, P. G. Guyenet // J. Comp. Neurol. – 2012. – Vol. 520, No 5. – P. 1047–1061. https://doi: 10.1002/cne.22769
- Souza G. M. P. R. Neuromedin B-expressing neurons in the retrotrapezoid nucleus regulate respiratory homeostasis and promote stable breathing in adult mice / G. M. P. R. Souza, D. S. Stornetta, Y. Shi [et al.]. // J. Neurosci. – 2023. – Vol. 39(49). – P. 9725–9735. DOI: 10.1523/jneurosci.0386-23.2023
- Guyenet P. G. Proton detection and breathing regulation by the retrotrapezoid nucleus / P. G. Guyenet, D. A. Bayliss, R. L. Stornetta [et al.] // J. Physiol. – 2016. – Vol. 594, No 6. – P. 1529–1551. DOI: 10.1113/JP271480
- Moreira T. S. The retrotrapezoid nucleus and the neuromodulation of breathing / T. S. Moreira, C. R. Sobrinho, B. Falquetto [et al.] // J. Neurophysiol. – 2021. – Vol. 125, No 3. – P. 699–719. DOI: 10.1152/jn.00497.2020
- Будаев А. И. Респираторные реакции на микроинъекции антагониста ГАМКв-рецепторов 2-гидроксисаклофена в ретротрапециевидное ядро у крыс / А. И. Будаев, О. А. Ведясова, А. Т. Конашенкова, Т. Е. Ковалева // Современные вопросы биомедицины. – 2022. – Т. 6, № 2. DOI: 10.51871/2588-0500_2022_06_02_4
- Reklow R. J. The purinome and the preBötzinger complex – a ménage of unexplored mechanisms that may modulate/shape the hypoxic ventilatory response / R. J. Reklow, T. S. Alvares, Y. Zhang [et al.] // Front. Cell. Neurosci. – 2019. – Vol. 13. – P. 365. DOI: 10.3389/fncel.2019.00365
- Wenker I. C. Astrocytes in the retrotrapezoid nucleus sense H+ by inhibition of a Kir4.1-Kir5.1-like current and may contribute to chemoreception by a purinergic mechanism / I. C. Wenker, O. Kréneisz, A. Nishiyama, D. K. Mulkey // J. Neurophysiol. – 2010. – Vol. 104, No 6. – P. 3042–3052. DOI: 10.1152/jn.00544.2010
- Sobrinho C. R. Purinergic signaling contributes to chemoreception in the retrotrapezoid nucleus but not the nucleus of the solitary tract or medullary raphe / C. R. Sobrinho, I. C. Wenker, E. M. Poss [et al.] // J. Physiol. – 2014. – Vol. 592, No 6. – P. 1309–1323. DOI: 10.1113/jphysiol.2013.268490
- Barna B. F. Purinergic receptor blockade in the retrotrapezoid nucleus attenuates the respiratory chemoreflexes in awake rats / B. F. Barna, A. C. Takakura, D. K. Mulkey, T. S. Moreira // Acta Physiol. (Oxf). – 2016. – Vol. 217, No 1. – P. 80–83. DOI:10.1111/apha.12637
- Lindsey B. G. Computational models and emergent properties of respiratory neural networks / B. G. Lindsey, I. A. Rybak, J. C. Smith // Compr. Physiol. – 2012. – Vol. 2, No 3. – P. 1619–1670. DOI: 10.1002/cphy.c110016
- Guyenet P. G. Neural control of breathing and CO2 homeostasis / P. G. Guyenet, D. A. Bayliss // Neuron. – 2015. – Vol. 87, No 5. – P. 946–961. DOI: 10.1016/j.neuron.2015.08.001
- Silva J. N. Neuroanatomical and physiological evidence that the retrotrapezoid nucleus/parafacial region regulates expiration in adult rats / J. N. Silva, F. M. Tanabe, T. S. Moreira, A. C. Takakura // Respir. Physiol. Neurobiol. – 2016. – Vol. 227. – P. 9–22. DOI: 10.1016/j.resp.2016.02.005.
- Funk G. D. Neuromodulation: purinergic signaling in respiratory control / G. D. Funk // Compr. Physiol. – 2013. – Vol. 3, No 1. – P. 331–363. DOI:10.1002/cphy.c120004
- Hawkins V. E. Purinergic regulation of vascular tone in the retrotrapezoid nucleus is specialized to support the drive to breathe / V. E. Hawkins, A. C. Takakura, A. Trinh [et al.] // ELife. – 2017. – Vol. 6. – e25232. DOI:10.7554/eLife.25232
- Mulkey D. K. Purinergic P2 receptors modulate excitability but do not mediate pH sensitivity of RTN respiratory chemoreceptors / D. K. Mulkey, A. M. Mistry, P. G. Guyenet, D. A. Bayliss // J. Neurosci. – 2006. – Vol. 26(27). – P. 7230–7233. DOI: 10.1523/JNEUROSCI.1696-06.2006
- Andrejew R. The P2X7 receptor: central hub of brain diseases / Andrejew R., Oliveira-Giacomelli Á., Ribeiro D. E. [et al.] // Front. Mol. Neurosci. – 2020. – Vol. 13. – P. 124. DOI: 10.3389/fnmol.2020.00124.
- Toledo C. Potential role of the retrotrapezoid nucleus in mediating cardio-respiratory dysfunction in heart failure with preserved ejection fraction / C. Toledo, D. Ortolani, F. C. Ortiz [et al.] // Front. Physiol. – 2022. – Vol. 13. – 863963. DOI:10.3389/fphys.2022.863963
RESPIRATORY REACTIONS TO ADENOSINE TRIPHOSPHATE ADMINISTRATION IN THE AREA OF THE RETROTRAPEZIOID NUCLEUS IN RATS
Konashenkova A. T., Vedyasova O. A., Inyushkin A. N.
Samara National Research University, Samara, Russia
E-mail: o.a.vedyasova@gmail.com
The research of neurochemical mechanisms of respiratory regulation is very relevant, which is due to the need for further development of ideas about the role of various parts of the central respiratory neural network in the generation of breathing rhythm and pattern. In this aspect, the retrotrapezoid nucleus (RTN) is of interest, which is the main chemosensory structure of the medulla and provides the central chemoreflex under conditions of hypercapnia and hypoxia. Various neurotransmitters, including adenosine triphosphate (ATP), participate in the modulation of respiration at the RTN level. It is known that ATP provides purinergic signaling in the RTN during hypercapnia and hypoxia. However, under normoxia, the role of ATP in the regulation of respiration by RTN structures not been sufficiently studied.
The aim of our research was to analyze the participation of ATP, as an agonist of purinergic receptors, in the mechanisms of respiratory control at the level of the RTN in rats breathing normal atmospheric air.
The reasearch performed on adult rats weighing 180-220 g, anesthetized with urethane, in which the respiratory effects of microinjections of an ATP solution into the RTN were studied. Microinjections were carry out through a glass microcannula (tip diameter 30-50 μm), introduced into the brain according to stereotaxic coordinates. Control animals were injected with artificial cerebrospinal fluid into the RTN. In rats, the external respiration pattern was recorded using a spirograph connected to a tracheostomy tube, and simultaneously bioelectrical activity of the diaphragm was recorded on an electromyograph by bipolar needle electrodes Changes in frequency and volume parameters of spirogram and electromyogram (EMG) were analyzed.
It has been established that microinjections of ATP into the RTN increase the respiratory activity of rats breathing atmospheric air of normal composition, as evidenced by changes in external respiration and EMG of the diaphragm. Analysis of spirogram revealed an increase in the respiratory rate (due to a decrease in the duration of inspiration and expiration), an increase in tidal volume, volumetric rate of inspiratory flow and minute lung ventilation compared to the initial level and control. Microinjections of ATP into the RTN also had a stimulating effect on the bioelectrical activity of the diaphragmatic muscle. The EMG showed an increase in the frequency of inspiratory burst discharges in combination with a decrease in the duration of both, the themselves bursts and interbursts intervals, relative to the initial values. These effects were accompanied by an increase in the amplitude of oscillations in inspiratory discharges. The observed reactions of the diaphragm statistically significantly exceeded the changes in control rats. The obtained results fit into the framework of the concept that activation of purine receptors in the medulla oblongata stimulates motor inspiratory output from the respiratory center. Taking into account the literature data, the increase in lung ventilation and bioelectrical activity of the diaphragm in response to ATP microinjections into the RTN may be explained by the activation of P2Y-type purinergic receptors.
Thus, data obtained confirming the participation of the purinergic system at the level of the RTN in the respiration control in rats breathing atmospheric air of normal composition. Based on the analysis of our own and literary data, the assessment of the molecular mechanisms of action of ATP, as the most important component of the purinome, allows us to conclude that P2Y receptors play an important role in the implementation of the respiratory effects of ATP in the RTN area. The interaction of ATP with receptors of this type in the RTN region causes stimulation of external respiration and inspiratory burst activity of the diaphragmatic muscle, which indicates the contribution of purinergic signaling to the formation of inspiratory drive from the central respiratory neural network to respiratory motor neurons. It is noteworthy that the increase in respiration caused by the effect of ATP on the RTN is observed not only under conditions of altered gas homeostasis, as indicated by many publications, but also under normoxia, which is confirmed by our data. This fact allows us to consider the purinergic mechanisms of the RTN not only in the context of maintaining the body’s vital functions under hypoxic and hypercapnic conditions, but also in the aspect of regulating respiration under conditions of optimal gas balance.
Keywords: regulation of respiration, retrotrapezoid nucleus, P2 receptors, adenosine triphosphate (ATP), microinjections, external respiration, electromyogram of the diaphragm.
References
- Manganelli F., Vargas M., Iovino A., Iacovazzo C., Santoro L., Servillo G. Brainstem involvement and respiratory failure in COVID-19. Neurol. Sci., 41, 7, 1663 (2020). https://doi.org/10.1007/s10072-020-04487-2
- Gubarevich E. A., Kokurina T. H., Rybakova G. I., Tumanova T. S., Aleksandrov V. G. Cobalt microinjections into the infralimbic cortex of the anesthetized rat suppresses circulatory and respiratory reactions to the microelectrostimulation of the lateral orbital cortex. Russian journal of physiology, 110, 2, 216 (2024). DOI: 10.31857/S0869813924020058
- Guyenet P. G., Stornetta R. L. Rostral ventrolateral medulla, retropontine region and autonomic regulations. Auton. Neurosci., 237, 102922 (2022). https://doi: 10.1016/j.autneu.2021.102922
- Guyenet P. G., Stornetta R. L., Souza G. M. P. R., Abbott S. B. G., Shi Y., Bayliss D. A. The retrotrapezoid nucleus: central chemoreceptor and regulator of breathing automaticity. Trends Neurosci., 42, 11, 807 (2019). DOI: 10.1016/j.tins.2019.09.002
- Kumar N. N., Velic A., Soliz J., Shi Y., Li K., Wang S., Weaver J. L., Sen J., Abbott S. B., Lazarenko R. M., Ludwig M. G., Perez-Reyes E., Mohebbi N., Bettoni C., Gassmann M., Suply T., Seuwen K., Guyenet P. G., Wagner C.A., Bayliss D. A. PHYSIOLOGY. Regulation of breathing by CO2 requires the proton-activated receptor GPR4 in retrotrapezoid nucleus neurons. Science, 348(6240), 1255 (2015). DOI: 10.1126/science.aaa0922
- Shi Y., Stornetta R. L., Stornetta D. S., Onengut-Gumuscu S., Farber E. A., Turner S. D., Guyenet P. G., Bayliss D.A. Neuromedin B expression defines the mouse retrotrapezoid nucleus. J. Neurosci., 37(48), 11744 (2017). DOI: 10.1523/jneurosci.2055-17.2017
- Gonye E. C., Shi Y., Li K., Clements R. T., Xu W., Bayliss D. A. Intrinsic molecular proton sensitivity underlies GPR4 effects on retrotrapezoid nucleus neuronal activation and CO2-stimulated breathing. J. Neurosci., 44(36): e0799242024 (2024). DOI: 10.1523/Jneurosci.0799-24.2024
- Souza G., Stornetta R. L., Stornetta D. S., Abbott S., Guyenet P. G. Contribution of the retrotrapezoid nucleus and carotid bodies to hypercapnia- and hypoxia-induced arousal from sleep. J. Neurosci., 39(49), 9725 (2019). DOI: 10.1523/JNEUROSCI.1268-19.2019
- Petrova N. A., Bryzzhin A. V., Fofanova D. P., Kolbina N. Yu., Pervunina T. M., Artamonova I. N., Borodin A. V. Сongenital central hypoventilation syndrome. Experience Almazov National Medical Research Centre. Russian Journal for Personalized Medicine, 3, 2, 57 (2023). DOI: 10.18705/2782-3806-2023-3-2-57-67
- Bochorishvili G., Stornetta R. L., Coates M. B., Guyenet P. G. Pre-Bötzinger complex receives glutamatergic innervation from galaninergic and other retrotrapezoid nucleus neurons. J. Comp. Neurol., 520, 5, 1047 (2012). https://doi: 10.1002/cne.22769
- Souza G. M. P. R., Stornetta D. S., Shi Y., Lim E., Berry F. E., Bayliss D. A., Abbott S. B. G. Neuromedin B-expressing neurons in the retrotrapezoid nucleus regulate respiratory homeostasis and promote stable breathing in adult mice. J. Neurosci., 43(30), 5501 (2023). DOI: 10.1523/jneurosci.0386-23.2023
- Guyenet P. G., Bayliss D. A., Stornetta R. L., Ludwig M. G., Kumar N. N., Shi Y., Burke P. G., Kanbar R., Basting T. M., Holloway B. B., Wenker I. C. Proton detection and breathing regulation by the retrotrapezoid nucleus. J. Physiol., 594, 6, 1529 (2016). DOI: 10.1113/JP271480
- Moreira T. S. Sobrinho C. R., Falquetto B., Oliveira L. M., Lima J. D., Mulkey D. K., Takakura A. C. The retrotrapezoid nucleus and the neuromodulation of breathing. J. Neurophysiol., 125, 3, 699 (2021). DOI: 10.1152/jn.00497.2020
- Budaev A. I., Vedyasova O. A., Konashenkovа A. T., Kovaleva Т. E. Respiratory reactions to microinjections of the antagonist of GABAв-receptors 2-hydroxysaclofen into the retrotrapezoid nucleus in rats. Modern Issues of Biomedicine, 6, 2 (2022). DOI: 10.51871/2588-0500_2022_06_02_4
- Reklow R. J., Alvares T. S., Zhang Y., Miranda Tapia A. P., Biancardi V., Katzell A. K., Frangos S. M., Hansen M. A., Toohey A. W., Cass C. E., Young J. D., Pagliardini S., Boison D., Funk G. D. The purinome and the preBötzinger complex – a ménage of unexplored mechanisms that may modulate/shape the hypoxic ventilatory response. Front. Cell. Neurosci., 13, 365 (2019). DOI: 10.3389/fncel.2019.00365
- Wenker I. C., Kréneisz O., Nishiyama A., Mulkey D. K. Astrocytes in the retrotrapezoid nucleus sense H+ by inhibition of a Kir4.1-Kir5.1-like current and may contribute to chemoreception by a purinergic mechanism. J. Neurophysiol., 104, 6, 3042 (2010). DOI: 10.1152/jn.00544.2010.
- Sobrinho C. R., Wenker I. C., Poss E. M., Takakura A. C., Moreira T. S., Mulkey D. K. Purinergic signaling contributes to chemoreception in the retrotrapezoid nucleus but not the nucleus of the solitary tract or medullary raphe. J. Physiol., 592, 6, 1309 (2014). DOI: 10.1113/jphysiol.2013.268490
- Barna B. F., Takakura A. C., Mulkey D. K., Moreira T. S. Purinergic receptor blockade in the retrotrapezoid nucleus attenuates the respiratory chemoreflexes in awake rats. Acta Physiol. (Oxf), 217, 1, 80 (2016). DOI:10.1111/apha.12637
- Lindsey B. G., Rybak I. A., Smith J. C., Computational models and emergent properties of respiratory neural networks. Compr. Physiol., 2, 3, 1619 (2012). DOI: 10.1002/cphy.c110016
- Guyenet P. G., Bayliss D. A. Neural control of breathing and CO2 homeostasis. Neuron, 87, 5, 946 (2015). DOI: 10.1016/j.neuron.2015.08.001
- Silva J. N., Tanabe F. M., Moreira T. S., Takakura A. C. Neuroanatomical and physiological evidence that the retrotrapezoid nucleus/parafacial region regulates expiration in adult rats. Respir. Physiol. Neurobiol., 227, 9 (2016). DOI: 10.1016/j.resp.2016.02.005
- Funk G. D. Neuromodulation: purinergic signaling in respiratory control. Compr. Physiol., 3, 1, 331 (2013). DOI:10.1002/cphy.c120004
- Hawkins V. E., Takakura A. C., Trinh A., Malheiros-Lima M. R., Cleary C. M., Wenker I. C., Dubreuil T., Rodriguez E. M., Nelson M. T., Moreira T. S., Mulkey D. K. Purinergic regulation of vascular tone in the retrotrapezoid nucleus is specialized to support the drive to breathe. ELife, 6, e25232 (2017). DOI: 10.7554/eLife.25232
- Mulkey D.K., Mistry A.M., Guyenet P.G., Bayliss D.A. Purinergic P2 receptors modulate excitability but do not mediate pH sensitivity of RTN respiratory chemoreceptors. J. Neurosci., 26(27), 7230 (2006). DOI: 10.1523/JNEUROSCI.1696-06.2006
- Andrejew R., Oliveira-Giacomelli Á., Ribeiro D. E., Glaser T., Arnaud-Sampaio V. F., Lameu C., Ulrich H. The P2X7 receptor: central hub of brain diseases. Front. Mol. Neurosci., 31, 13, 124 (2020). DOI: 10.3389/fnmol.2020.00124.
- Toledo C., Ortolani D., Ortiz F. C., Marcus N. J., Del Rio R. Potential role of the retrotrapezoid nucleus in mediating cardio-respiratory dysfunction in heart failure with preserved ejection fraction. Front. Physiol., 13, 863963 (2022). DOI: 10.3389/fphys.2022.863963



