Analysis of the drug Alcoholic extract from the seminal glands (Brown-Séquard liquid) D. Kalenichenko of the early 20th century
Анализ лекарственного препарата Алкогольная вытяжка
из семенных желез (секаровская жидкость) Д. Калениченко начала XX века
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №2, 2024
Publication text (PDF):Download
UDK: 543.42:615.361:615.074
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Yakovishin L. A. Sevastopol State University, Sevastopol, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-2-316-326
PAGES:from 316 to 326
STATUS:Published
LANGUAGE:Russian
KEYWORDS: аlcoholic extract from the seminal glands D. Kalenichenko, Brown-Séquard liquid, Organotherapeutic Laboratory of D. Kalenichenko, D. K. Kalenichenko, organopreparations, pharmaceutical analysis, IR-Fourier spectroscopy, UV-Vis spectroscopy.
ABSTRACT (ENGLISH):
At the end of the 19th – beginning of the 20th century, organopreparations (products based on extracts from various animal organs) became widespread in Russia and abroad. Extracts from the seminal glands were very popular among them. Such extracts can contain a variety of compounds: proteins, enzymes, amino acids, lipids, antioxidants, hormones (testosterone, etc.), biogenic polyamines (including spermine), vitamins and minerals.
At the beginning of the 20th century, the Organotherapeutic Laboratory of D. Kalenichenko began to produce the drug Alcoholic extract from the seminal glands (Brown-Séquard liquid; Liquor testiculorum spirituos). Initially, on the label of this product, in addition to Extractum testiculorum, the name Spermin was also indicated. It was produced according to the method of Dr. A. F. Telnikhin without heating and the use of chemical reactions. The Organotherapeutic Laboratory of D. Kalenichenko was founded in 1903 in Moscow. An extract from the seminal glands of D. Kalenichenko was used for neurasthenia, hysteria, neuralgia, insomnia, senile decrepitude, gout, rheumatism, anemia, arteriosclerosis, tuberculosis, diabetes, headaches, sexual impotence, cardiac dysfunction.
The spectrum contains an absorption band at 1555 cm–1, which can be attributed to bending vibrations of the NH3+ and NH groups of biogenic amines (spermine, etc.). The band at 1634 cm–1 is associated with asymmetric bending vibrations of their NH3+ group.
The IR spectrum of the drug film revealed absorption bands characteristic of the zwitterionic form of amino acids: amino acid band I at 1634 cm–1 (asymmetric bending vibrations of NH3+), amino acid band II (symmetric bending vibrations of NH3+) at 1555 cm–1, as well as bands of asymmetric and symmetric stretching vibrations of COO– at 1583 and 1410 cm–1, respectively. In addition, absorption bands characteristic of a peptide bond may also fall into these areas. These are amide I (1634 cm–1; C=O) and amide II (1555 cm–1; NH) bands.
In the IR spectrum of the drug film, the most intense absorption band is at 1707 cm–1, corresponding to vibrations of the carbonyl group. The absorption band of the C–O bond in the Extract spectrum at 1189 cm–1 may be associated with the accumulation of oxidation products (hydroperoxides, epoxides). This absorption band is the most intense in the region of 1000–1300 cm–1. The IR spectrum of the drug film is similar to that for a long-term storage sample of oleic acid, with the exception of the absorption region of 1500–1650 cm–1, associated with vibrations of the bonds of nitrogen-containing compounds.
Thus, the presence of amino acids, proteins, biogenic amines and mainly carboxylic acids was established in the drug.
ВВЕДЕНИЕ
В конце XIX – начале XX века в России и за рубежом широкое распространение получили органопрепараты – средства на основе вытяжек из различных органов животных [1, 2]. Среди них были очень популярны вытяжки из семенных желез. Такие экстракты могут содержать разнообразные соединения: белки, ферменты, аминокислоты, липиды, антиоксиданты, гормоны (тестостерон и др.), биогенные полиамины (в том числе спермин; рис. 1), витамины и минеральные вещества [3–7].
Рис. 1. Спермин.
В начале XX века Органотерапевтическая лаборатория Дмитрия Константиновича Калениченко стала выпускать препарат Алкогольная вытяжка из семенных желез (секаровская жидкость) Liquor testiculorum spirituos (рис. 2) [8–12]. Первоначально на этикетке этого средства кроме Extractum testiculorum указывалось еще название Спермин. Она изготовлялась по способу доктора Тельнихина Аполлинария Федотовича без нагревания и использования химических реакций [12–15]. Для получения препарата семенные железы перетирались с кварцевым песком и затем экстрагировались [12]. Органотерапевтическая лаборатория Д. Калениченко была основана в 1903 г. в Москве [8, 11]. Находилась она в его доме № 10 на Большом Козловском переулке [8, 11, 16].
Вытяжка из семенных желез лаборатории Д. Калениченко применялась при неврастении, истерии, невралгии, бессоннице, старческой дряхлости, подагре, ревматизме, малокровии, артериосклерозе, туберкулёзе, диабете, головных болях, половом бессилии, расстройстве сердечной деятельности. Назначали ее после родов, операций, кровопотерь и перенесенных болезней (инфлюэнцы, сифилиса и других) [8–12]. Отпускалась из аптек по рецепту. Использовалась в больницах и госпиталях по всей России, в том числе и в Крыму, например, в госпитале № 12 Красного Креста в Симферополе [9, 10]. Была удостоена высших наград на выставках в Париже, Лондоне, Брюсселе и др. [8, 11]. Препарат часто подделывали, поэтому производитель принимал меры для его защиты [11].


Рис. 2. Склянка из-под Алкогольной вытяжки из семенных желез (секаровской жидкости) Органотерапевтической лаборатории Д. Калениченко (фото автора статьи).
Вытяжка из семенных желез Органотерапевтической лаборатории Д. Калениченко конкурировала на российском фармацевтическом рынке начала XX века с другим известным органопрепаратом Спермином Пеля (Органотерапевтический институт профессора доктора Пеля и сыновей, г. Санкт-Петербург), а также рядом других подобных средств [2, 10, 12]. Но в отличие от препарата лаборатории Д. Калениченко, содержащей множество веществ, Спермин Пеля был монопрепаратом, т.к. включал спермина моногидрохлорид (рис. 1) [2].
Ранее было проведено исследование препарата Спермин Пеля капли (Essentia Spermini-Poehl) [17]. Данная статья посвящена ИК-спектроскопическому и спектрофотометрическому анализу образца лекарственного средства Алкогольная вытяжка из семенных желез (секаровская жидкость) Органотерапевтической лаборатории Д. Калениченко.
МАТЕРИАЛЫ И МЕТОДЫ
Вещества. Использовали образец лекарственного препарата Алкогольная вытяжка из семенных желез (секаровская жидкость) Liquor testiculorum spirituos Органотерапевтической лаборатории Д. Калениченко (г. Москва, Россия), выпущенного в начале XX в. Образцу около 110–120 лет. Препарат сохранился в виде высохшей пленки бежевого цвета на дне склянки. Он был укупорен корковой пробкой с подложенной вощеной бумагой. Анализировали пленку препарата, ее спиртовой раствор и черный налет с пробки. Для получения раствора к пленке препарата приливали 96 % водный этанол (в соотношении 1 мг препарата на 1 мл 96 % раствора этанола), смесь перемешивали и фильтровали. Использовали олеиновую (ч.; образцу около 40 лет) и стеариновую кислоты (ч.).
ИК-Фурье-спектроскопия. Вещества для съемки спектров использовали без предварительной подготовки. Для получения ИК-спектров пробы олеиновой кислоты и спиртового раствора пленки лекарственного препарата наносили в виде капли. ИК-спектры получены на ИК-Фурье-спектрометре ФТ-801 (СИМЕКС, Россия) с универсальной оптической приставкой НПВО-A (нарушенного полного внутреннего отражения) с алмазным элементом и встроенным мини-монитором. Спектры получены в области 4000–550 см–1 (спектральное разрешение 4 см–1; 25 сканов). Для работы с ИК-спектрометром ФТ-801 использовали программу ZaIR 3.5 (СИМЕКС, Россия).
ИК-спектр пленки препарата Алкогольная вытяжка из семенных желез
(ν, см-1): 3339 (ОН, NH, NH3+), 3005 (СН), 2922 (CH), 2853 (СН), 2676 (ОН), 1707 (C=O), 1634 (NH3+, аминокислотная полоса I – NH3+, амид I – С=О), 1583 (СОО–), 1555 (NH3+, NH, аминокислотная полоса II – NH3+, амид II – NH), 1506 (Ar), 1462 (СН), 1433 (СН), 1410 (ОН, СОО–), 1377 (СН), 1277 (С–О), 1242 (СН), 1189 (С–О), 1083 (C–OH, С–N), 1052 (C–OH, С–N), 968 (С–О в С–О–О), 934 (ОН), 723 (СН), 679 (HO–C–O, СН в цис –СН=СН–), 604 (ОН, СН, NH).
ИК-спектр спиртового раствора пленки препарата Алкогольная вытяжка из семенных желез (ν, см-1): 3330 (ОН, NH, NH3+), 2973 (CH), 2927 (СН), 2891 (СН), 1707 (С=О), 1650 (Н–О–Н, NH), 1452 (СН), 1415 (ОН), 1380 (CН), 1327 (СН), 1274 (СН), 1086 (C–OH, С–N), 1044 (C–OH, С–N), 879 (СН, С–С), 802 (С–С–О), 595 (ОН, Н–О–Н, NH, СН).
ИК-спектр черного налета с пробки препарата Алкогольная вытяжка из семенных желез (ν, см-1): 3339 (ОН, NH, NH3+), 3005 (СН), 2917 (CH), 2849 (СН), 2676 (ОН), 1709 (C=O), 1621 (Н–О–Н, NH), 1621 (Н–О–Н, NH, NH3+), 1574 (СОО–), 1537 (СОО–), 1502 (Ar), 1465 (СН), 1433 (СОО–), 1416 (СОО–, ОН), 1378 (CH), 1341 (СН), 1317 (СН), 1285 (C–O), 1209 (СН), 1172 (С–О), 1112 (C–OH, С–N), 1094
(C–OH, С–N), 1033 (C–OH, С–N), 1012 (C–OH, С–N), 957 (С–О, СН, С–N, С–С), 936 (ОН), 722 (СН), 661 (СН, NH, Н–О–Н, ОН), 625 (ОН, NH).
ИК-спектр олеиновой кислоты (ν, см-1): 3300–2500 (ОН), 3007 (СН), 2919 (CH), 2851 (СН), 2670 (ОН), 1706 (C=O), 1462 (СН), 1434 (СН), 1412 (ОН), 1377 (СН), 1278 (С–О), 1241 (СН), 1174 (С–О в С–О–С и С–О–О), 1117 (С–ОН), 1091 (C–OH), 967 (С–О в С–О–О), 941 (ОН), 848 (С–О–Соксирановое кольцо), 722 (СН), 688 (HO–C–O), 606 (ОН, СН).
ИК-спектр стеариновой кислоты (ν, см-1): 3300–2500 (ОН), 3008 (СН), 2953 (СН), 2913 (CH), 2871 (СН), 2846 (СН), 2677 (ОН), 1694 (C=O), 1471 (СН), 1462 (СН), 1428 (СН), 1411 (ОН), 1354 (СН), 1330 (СН), 1312 (СН), 1296 (С–О), 1278 (СН), 1259 (СН), 1240 (СН), 1221 (СН), 1202 (СН), 1123 (С–ОН), 1103 (С–ОН), 940 (ОН), 888 (СН), 809 (С–С–О), 759 (СН), 727 (СН), 720 (СН), 688 (HO–C–O), 611 (ОН, СН).
Спектрофотометрия. Спектр поглощения получен при температуре 25 °С на двулучевом сканирующем спектрофотометре LEKI SS2110UV (MEDIORA OY, Финляндия) в кварцевых кюветах (l = 1 см). Для работы со спектрофотометром использовали встроенное программное обеспечение SS2110UV.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ИК-спектроскопический анализ пленки препарата Алкогольная вытяжка из семенных желез. В ИК-спектре пленки препарата (рис. 3, спектр 1) наблюдается широкая полоса поглощения при 3339 см–1, обусловленная валентными колебаниями связей ОН, NH и NH3+. Полосы поглощения валентных колебаний связей С–Н присутствуют при 2922 и 2853 см–1, а деформационных колебаний – при 1462, 1433, 1377 и 1242 см–1. Слабая полоса при 3005 см–1 относится к поглощению связи =С–Н в –CH=CH–.
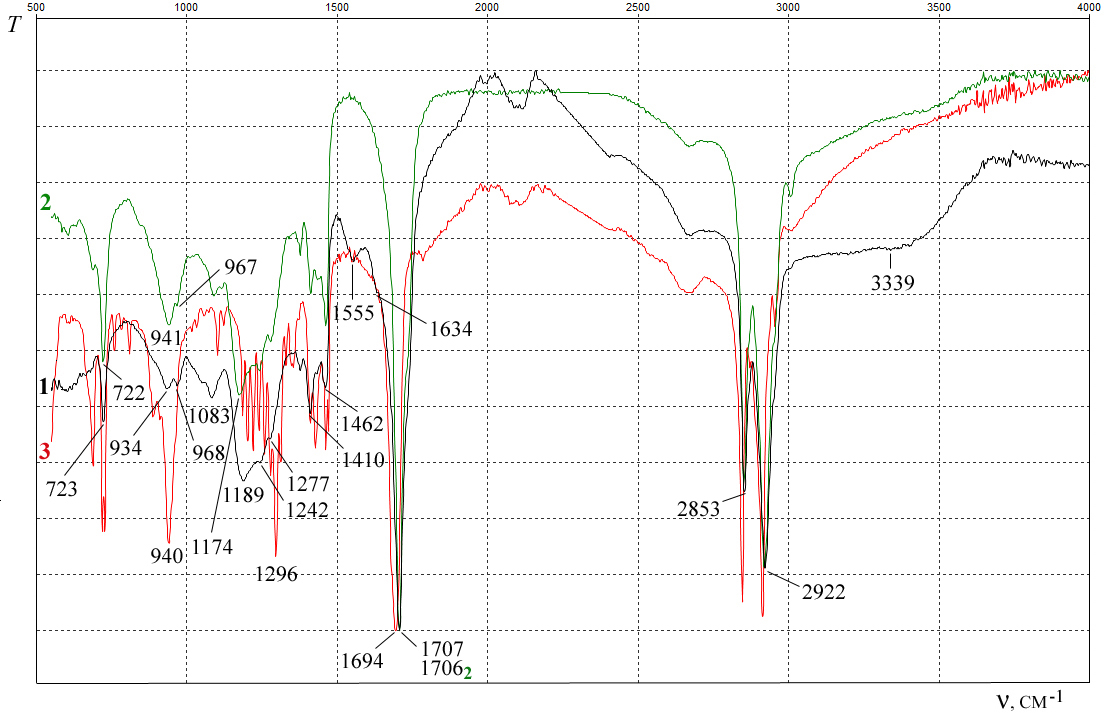
Рис. 3. ИК-спектры пленки препарата Алкогольная вытяжка из семенных желез (спектр 1), олеиновой кислоты (спектр 2) и стеариновой кислоты (спектр 3).
В спектре имеется полоса поглощения при 1555 см–1, которая может быть отнесена к деформационным колебаниям групп NH3+ и NH биогенных аминов (спермина и др.). Полоса 1634 см–1 связана с асимметричными деформационными колебаниями их группы NH3+.
В ИК-спектре пленки препарата обнаружены полосы поглощения, характерные для цвиттер-ионной формы аминокислот: аминокислотная полоса I при 1634 см–1 (асимметричные деформационные колебания NH3+), аминокислотная полоса II (симметричные деформационные колебания NH3+) при 1555 см–1, а также полосы асимметричных и симметричных валентных колебаний СОО– при 1583 и 1410 см–1 соответственно. Кроме того, в указанные области могут попасть и полосы поглощения, характерные для пептидной связи. Это полосы амид I (1634 см–1; С=О) и амид II (1555 см–1; NH). Слабая полоса колебаний ароматического кольца найдена при 1506 см–1.
В ИК-спектре пленки препарата самой интенсивной является полоса поглощения при 1707 см–1, соответствующая колебаниям карбонильной группы (рис. 3, спектр 1). Поглощение группы С=О у сложных эфиров находится при
1735–1750 см–1 [18]. Однако, в этой области спектра препарата поглощение не наблюдается. В тестикулярных извлечениях животных может присутствовать тестостерон. Однако полоса поглощения кето-группы у атома С-3 тестостерона находится в области более низких частот из-за сопряжения с двойной связью [18]. Таким образом, полоса при 1707 см–1 может быть связана с поглощением группы С=О карбоновых кислот.
Действительно, при длительном хранении жиров происходит их автокаталитический гидролиз, приводящий к образованию свободных высших карбоновых кислот. Кроме того, липиды подвергаются окислению, продуктами которого могут также являться карбоновые кислоты. Поглощение С=О в СООН димеров карбоновых кислот составляет около 1710 см–1 [19]. На наличие карбоновых кислот в препарате указывает чрезвычайная высокая интенсивность поглощения С=О, которая в кетонах и сложных эфирах значительно меньше [18].
В спектре препарата широкая полоса неплоских деформационных колебаний ОН димеров карбоновых кислот, имеющая среднюю интенсивность, находится при 934 см–1. Полосы при 1410 и 1277 см–1 вызваны плоскими деформационными колебаниями О–Н и валентными колебаниями С–О карбоновых кислот.
Животные жиры могут включать до 50 % олеиновой кислоты [20]. ИК-спектр пленки лекарственного препарата похож на таковой для образца олеиновой кислоты длительного хранения (около 40 лет) (рис. 3, спектр 2), за исключением области поглощения 1500–1650 см–1, связанной с колебаниями связей азотсодержащих соединений. Непредельные карбоновые кислоты постепенно автоокисляются, образуя сначала гидропероксиды. В дальнейшем они могут дать эпоксиды, карбоновые кислоты и прочие соединения [21].
Полосы поглощения связи С–О в спектре Вытяжки при 1189 см–1 и в спектре олеиновой кислоты при 1174 см–1 могут быть связаны с накоплением продуктов окисления (гидропероксиды, эпоксиды), т.к. в данной области наблюдается поглощение в спектрах гидропероксидов [22] и эпоксидов [23]. Данные полосы поглощения являются самыми интенсивными в области 1000–1300 см–1, тогда как у чистой олеиновой кислоты в этой области преобладает полоса валентных колебаний С–О карбоксильной группы при 1285 см–1 [24]. У стеариновой кислоты это полоса 1296 см–1 (рис. 3, спектр 3).
Полоса поглощения связи С–О в С–О–О препарата найдена при 968 см–1 (рис. 3, спектр 1). У образца олеиновой кислоты эта полоса поглощения находится при 967 см–1 (рис. 3, спектр 2).
При отсутствии контакта с воздухом и действия света непредельные карбоновые кислоты могут длительно сохраняться. Так, например, при анализе покрытий волос древнеегипетских мумий (I тысячелетие до н.э.) было установлено, что степень окисления олеиновой и других непредельных карбоновых кислот невелика из-за условий захоронения [20]. В нашем случае герметичность склянки препарата Алкогольная вытяжка из семенных желез со временем была утрачена, из-за чего процесс окисления непредельных кислот усилился.
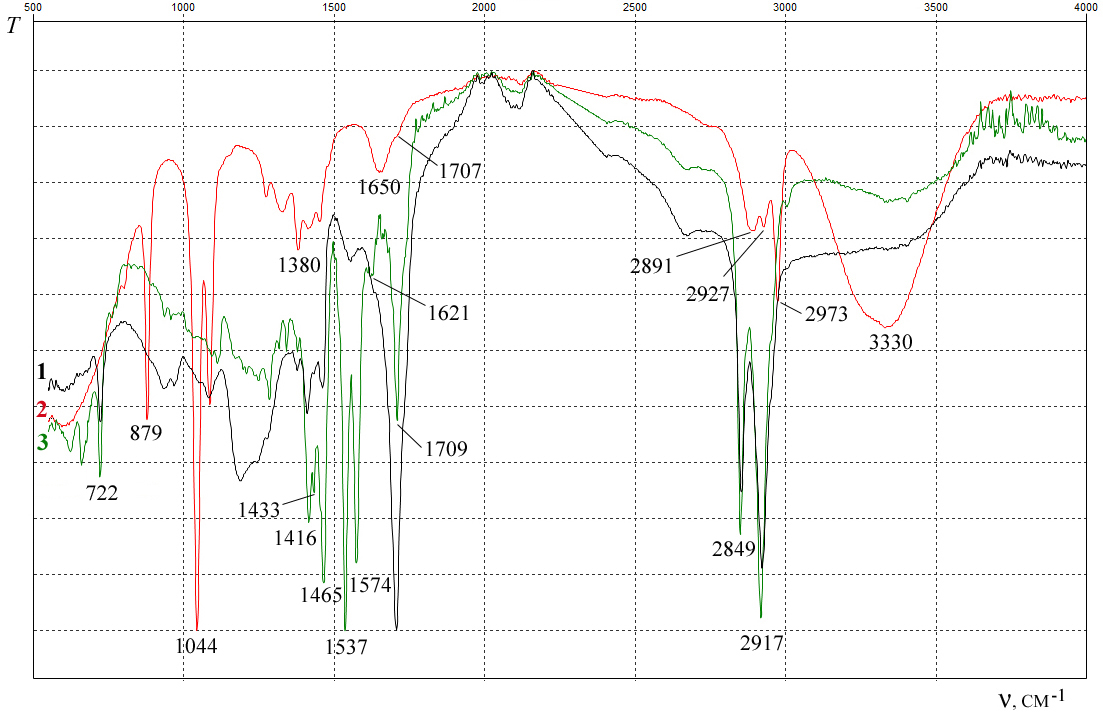
Рис. 4. ИК-спектры пленки препарата Алкогольная вытяжка из семенных желез (спектр 1), спиртового раствора пленки препарата (спектр 2) и черного налета с пробки препарата (спектр 3).
Это привело к образованию различных продуктов окисления и распада в виде налета черного цвета, который образовался под пробкой склянки с препаратом. В ИК-спектре его образца самыми интенсивными являются полосы поглощения 2917 и 2849 см–1 (валентные колебания связей С–Н; рис. 4, спектр 3). Кроме того, сильные полосы найдены при 1416 (симметричные валентные колебания COO–), 1433 (симметричные валентные колебания COO–), 1465 (деформационные колебания CH), 1537 (асимметричные валентные колебания COO–), 1574 (асимметричные валентные колебания COO–) и 1709 см–1 (С=О). Полосы асимметричных валентных колебаний COO– имеют большую интенсивность, чем полосы симметричных валентных колебаний. Эта область ИК-спектра совпадает со спектрами кальциевых солей стеариновой, олеиновой и других высших карбоновых кислот [25]. Полоса при 1709 см–1 соответствует колебаниям связи C=O у димеров карбоновых кислот [19].
ИК-спектр спиртового раствора пленки препарата (рис. 4, спектр 2) в основном оказался идентичен таковому для 96 % водного раствора этанола. В спектре в области 1707 см–1 наблюдается полоса поглощения С=О, которая перекрывается полосой поглощения при 1650 см–1 (деформационные колебания молекул воды).
Электронная спектроскопия. В электронном спектре этанольного раствора препарата, полученного растворением его пленки в 96 % водном этаноле, имеется слабое поглощение около 280 нм (рис. 5), соответствующее n→π*-переходу группы С=О [18]. Аналогичное поглощение было отмечено у коммерческих образцов олеиновой кислоты [26].
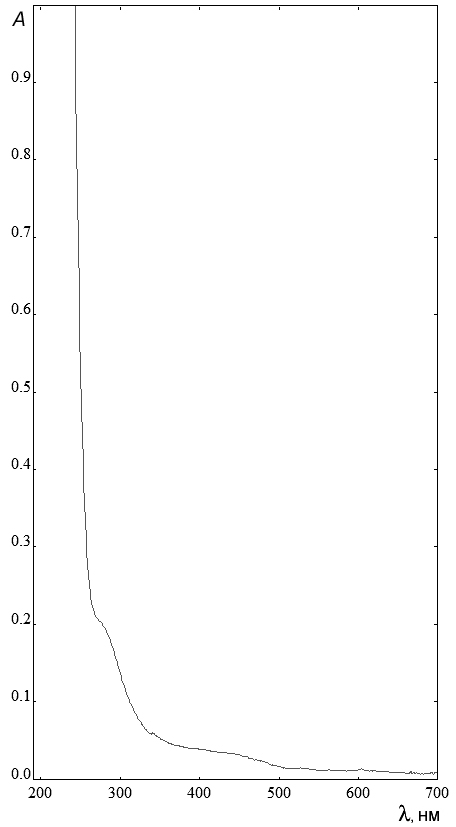
Рис. 5. Спектр поглощения раствора пленки препарата Алкогольная вытяжка из семенных желез (растворитель – 96 % водный этанол).
Работа выполнена на оборудовании Севастопольского государственного университета.
ЗАКЛЮЧЕНИЕ
- Впервые проведен детальный ИК-спектроскопический анализ с приставкой НПВО лекарственного препарата Алкогольная вытяжка из семенных желез, произведенного Органотерапевтической лабораторией Д. Калениченко (г. Москва) в начале XX в.
- В препарате установлено присутствие аминокислот, белков, биогенных аминов и в основном карбоновых кислот.
- Uspensky D. M., Organotherapy. Healing properties of animal organs. New methods of treating diseases using the Brown-Séquard method, 402 p. (Prince V. P. Meshchersky, St. Petersburg, 1896). (in Russ.).
- Poehl A., Tarchanoff P. J., Poehl Alf., Wachs P., Rational organotherapy with reference to urosemiology, 239 p. (P. Blakiston’s Son & Co., Philadelphia, 1906).
- Juyena N. S., Stelletta C., Seminal plasma: an essential attribute to spermatozoa, J. Androl., 33 (4), 536 (2012).
- Mann T., The biochemistry of semen, 240 p. (Methuen, London; Wiley, New York, 1954).
- Picard J. Y., Goulut C., Bourrillon R., Josso N., Biochemical analysis of bovine testicular anti-Müllerian hormone, FEBS Lett., 195 (1–2), 73 (1986).
- Meyer M. F., Kreil G., Aschauer H., The soluble hyaluronidase from bull testes is a fragment of the membrane-bound PH-20 enzyme, FEBS Lett., 413 (2), 385 (1997).
- Kesterson H., Woerner D. R., Engle T. E., Martin J. N., Delmore R. J., Belk K. E., Nutrient analysis of raw beef variety meat items, Meat Muscle Biol., 2 (2), 35 (2018).
- Extract from the seminal glands, New time, 14644, Dec. 3, 12 (1916). (in Russ.).
- Organotherapeutic method of treating diseases, Russian will, № 176, Jul. 27, 6 (1917). (in Russ.).
- Organotherapeutic method of treating diseases, Irkutsk life, № 252, Nov. 5, 5 (1917). (in Russ.).
- Extract from the seminal glands. Caution, Kievlyanin, № 231, Aug. 21, 4 (1916). (in Russ.).
- Treatment with spermine and extracts from the seminal glands of animals is by no means the same thing, Saratov Bulletin, № 257, Nov. 21, 5 (1912). (in Russ.).
- Telnikhin A. F., My method of preparing spermine, 6 p. (Y. Trey, St. Petersburg, 1898). (in Russ.).
- Telnikhin A. F., The present position of the doctrine about the effect of spermine on humans, about the preparation of its preparations used for the use of patients, 15 p. (V. F. Kirshbaum, St. Petersburg, 1908). (in Russ.).
- Telnikhin A. F., The present position of the doctrine about the effect of spermine on humans, about the preparation of its preparations used for the use of patients and about the risk associated with injecting them under the skin: Report made on May 10, 1903 at the regular meeting of the Society of Kyiv Doctors, 24 p. (M. I. Akinfiev and I. V. Leontyev, St. Petersburg, 1903). (in Russ.).
- All Moscow. Address and reference book for 1913. 20th year of publication, 589 p. (City printing house, Moscow, 1913). (in Russ.).
- Yakovishin L. A., Analysis of the drug Spermine Poehl from the times of Imperial Russia, Scientific Notes of V. I. Vernadsky Crimean Federal University. Biology. Chemistry, 9 (2), 293 (2023). (in Russ.).
- Kazitsyna L. A., Kupletskaia N. B., Application of UV, IR, NMR and mass spectroscopy in organic chemistry, 240 p. (Izd-vo MSU, Moscow, 1979). (in Russ.).
- Nakanishi K., Infrared spectra and structure of organic compounds, 216 p. (Mir, Moscow, 1965). (in Russ.).
- Yatsishina E. B., Pozhidaev V. M., Sergeeva Y. E., Malakhov S. N., Slushnaya I. S., An integrated study of the hair coating of ancient egyptian mummies, J. Analyt. Chem., 75 (2), 262 (2020). (in Russ.).
- Thomas A., Matthäus B., Fiebig H.-J., Fats and fatty oils. Ullmann’s encyclopedia of industrial chemistry, 84 p. (Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 2015).
- Shreve O. D., Heether M. R., Knight H. B., Swern D., Infrared absorption spectra of some hydroperoxides, peroxides, and related compounds, Anal. Chem., 23 (2), 282 (1951).
- Rahman M. A., Mubarak N. M., Azmi I. S., Jalil M. J., Sustainable approach for catalytic green epoxidation of oleic acid with applied ion exchange resin, Sci. Rep., 13 (1), 15470 (2023).
- Larkin P. J., Infrared and raman spectroscopy: principles and spectral interpretation, 239 p. (Elsevier Inc., Amsterdam, 2011).
- Filopoulou A., Vlachou S., Boyatzis S. C., Fatty acids and their metal salts: A review of their infrared spectra in light of their presence in cultural heritage, Molecules, 26 (19), 6005 (2021).
- Misic Z., Šišak Jung D., Sydow G., Kuentz M., Understanding interactions of oleic acid with basic drugs in solid lipids on different biopharmaceutical levels, J. Excipients Food Chem., 5 (2), 113 (2014).



