PHENOLOGICAL PARAMETERS AND ANATOMICAL FEATURES OF CAREX CARYOPHYLLEA LATOURR. (CYPERACEAE) WHEN AFFECTED BY THE SMUT FUNGUS ANTHRACOIDEA CARYOPHYLLEAE KUKKONEN IN THE MOUNTAINOUS CRIMEA
ФЕНОЛОГИЧЕСКИЕ ПОКАЗАТЕЛИ И АНАТОМИЧЕСКИЕ ОСОБЕННОСТИ CAREX CARYOPHYLLEA LATOURR. (CYPERACEAE) ПРИ ПОРАЖЕНИИ ГОЛОВНЕВЫМ ГРИБОМ ANTHRACOIDEA CARYOPHYLLEAE KUKKONEN В ГОРНОМ КРЫМУ
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №1, 2024
Publication text (PDF): Download
UDK: 581.8: 582.285.22
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Prosiannikova I. B., Federal V.I. Vernadsky Crimean University, Simferopol, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-1-207-222
PAGES:from 207 to 222
STATUS:Published
LANGUAGE:Russian
KEYWORDS: phenological spectrum, anatomical structure, smut fungus Anthracoidea caryophylleae, host plant Carex caryophyllea.
ABSTRACT (ENGLISH):
Mycological studies were conducted during the 2022 growing season in the vicinity of the village. «Nauchny» research of the Bakhchisarai district of the Republic of Crimea on one of the spurs of the Sel-Bukhra mountain (658.2 m above sea level) on one homogeneous test area measuring 15.0 x 81.0 m (total area of 1215 m2, slope steepness 20 °). The trial area is part of the landscape and recreational park of regional significance «Nauchny», a protected area facility (Republic of Crimea, Russia, area ‒ 965 hectares) [5]. The IUCN category of the park is V (Protected Landscape).
The total projected coverage of the site is 90 %. The natural vegetation of the studied area is represented by oak-hornbeam woodlands, where the feeding plant Carex caryophyllea Latourr. forms quite large numerous curtains in the clearings. The phenological spectra were compiled according to the method of Beideman [6]. For anatomical studies and detection of hyphae of mycelium and sporulation of the fungus in plant tissues, a fixative of the following composition was used: ethyl alcohol, 50 % 90 ml; glacial acetic acid 5 ml; formalin 5 ml [7]. The resulting anatomical sections were stained with fluoroglucin with hydrochloric acid. Photofixation of anatomical sections of C. caryophyllea vegetative organs was performed using a photodetector mounted on a medical direct microscope CX31RTSF, Olympus (Philippines). Healthy and diseased plants or parts of them were herbalized with the preparation of standard labels [8]. Identification of samples of the smut fungus Anthracoidea caryophylleae Kukkonen on the leaves of the host plant was carried out using a standard method using a determinant [1], and the name of the host plant is presented from sources [9]. The taxonomic status of the fungi species is given according to the interactive database Index Fungorum [2, 10].
For the first time, new data on the phenospectrums of the feeding plant C. caryophyllea (Cyperaceae) and the smut fungus A. caryophylleae have been obtained. The phenological spectra of C. caryophyllea and the smut fungus A. caryophylleae were obtained for the first time; it was revealed that the laying of the ustospores and their distribution occurs during the phase of mass flowering and fruiting of the feeding plant (from the first decade of May to the first decade of July). The anatomical structure of healthy and smut-infested plants has been studied. C. caryophyllea, which showed that the root forms root hairs of the panicoid type, primary bark with a well-developed aerenchyma is laid under the integumentary tissue ‒ rhizoderm. The root is characterized by a polyarchic stele with a large number of strands of phloem and xylem (while the number of xylem rays in the stele is at least 7‒8). It was revealed that the anatomical structure of the stem of C. caryophyllea has a typical bundle type of structure characteristic of perennial herbaceous plants from the Cyperaceae family. The presence of aerenchyma in the stem and root indicates the ability of the plant to tolerate flooding. The leaf of the feeding plant C. caryophyllea, when there is a lack of moisture, is able to fold due to the presence of bulliform cells on the adaxial side and its type of structure corresponds to the isolateral type. Based on the totality of the anatomical structure of the vegetative organs, C. caryophyllea can be attributed to the ecological group of xeromesophytes. The analysis of the anatomical structure of the vegetative organs of the infected C. caryophyllea plant did not reveal the presence of diffuse mycelium of the smut fungus A. caryophylleae; infection of plants occurs anew annually and is local in nature.
ВВЕДЕНИЕ
Умеренно-холодный и влажный климат Крымских гор с элементами средиземноморского климата способствует развитию флоры разнообразного видового состава и столь же разнообразной фитотрофной микобиоты. По уточненным современным данным порядок Головневые грибы (порядок Ustilaginales, класс Ustomycetes, отдел Basidiomycota) насчитывает около 1350 видов из более чем 68 родов, большей частью приуроченных к одному роду или виду растения и отличающихся узкой специализацией. В целом, они поражают свыше 4000 видов цветковых растений [1, 2]. Сведения о видовом составе головневых грибов Крыма постоянно пополняются новыми данными [3]. Изучение взаимодействия фитопатогена (головневого гриба) и ценопопуляции питающего растения, а также закономерностей протекания их жизненных циклов, сроки и способы инфекции, анализ феноспектров ассоциированной пары гриб-растение и особенностей анатомического строения растений под влиянием инфекции является актуальной научной проблемой. По данным литературы [4] исследования взаимосвязей головневого гриба Anthracoidea caryophylleae Kukkonen и питающего растения Carex caryophyllea Latourr. (Cyperaceae) в Горном Крыму ранее не проводились, в связи с чем нами впервые был составлен фенологический спектр растения-хозяина и гриба-паразита, описана его органотропная локализация и влияние на анатомическое строение питающего растения C. caryophyllea.
МАТЕРИАЛЫ И МЕТОДЫ
Микологические исследования проводились в течение вегетационного сезона 2022 года в окрестностях пгт. Научный Бахчисарайского района Республики Крым на одном из отрогов горы Сель-Бухра (658,2 м н.у.м.) на одной однородной пробной площади размером 15,0 х 81,0 м (общей площадью 1215 м², крутизна склона 20 °). Пробная площадь входит в состав ландшафтно-рекреационного парка регионального значения «Научный», объекта ООПТ (Республика Крым, Россия, площадь ‒ 965 га) [5]. Категория МСОП парка — V (Охраняемый ландшафт).
Для пробной площади характерно мозаичное сочетание участка степной шибляковой растительности – сообщества, слагаемого гемиксерофильными листопадными кустарниками и низкорослыми кустообразными деревьями, а также «дубков» – участков дубового и дубового-грабового леса, с преобладанием низкорослого дуба пушистого (Quercus pubescens Willd.). Травостой пробной площади преимущественно слагают: Bothriochloa ischaemum (L.) Keng, Potentilla recta L., Festuca valesiaca Schleich. ex Gaudin, Carex caryophyllea на полянах образует довольно крупные многочисленные куртины (рис. 1). Общее проективное покрытие участка составляет 90 %.

Рис. 1. Локализация пробной площади: А ‒ ‒ картографическое обозначение;
Б – фрагмент пробной площади (фото автора).
Фиксация материала. Фенологические спектры составлены по методике И. Н. Бейдеман [6]. Для анатомических исследований и выявления гиф мицелия и спороношения гриба в растительных тканях использовали фиксатор следующего состава: этиловый спирт, 50 % ˗ 90 мл; ледяная уксусная кислота ˗ 5 мл; формалин ˗ 5 мл [7]. Полученные анатомические срезы окрашивали флюороглюцином с соляной кислотой. Фотофиксацию анатомических срезов вегетативных органов C. caryophyllea проводили с помощью фотонасадки, установленной на микроскоп медицинский прямой CX31RTSF, Olympus (Филиппины).
Здоровые и больные растения или их части гербаризировали с составлением стандартных этикеток [8]. Идентификацию образцов головневого гриба A. caryophylleae на листьях растения-хозяина проводили стандартным методом с помощью определителя [1], а название растения-хозяина представлено по источнику [9]. Таксономический статус вида гриба приведен согласно интерактивной базе Index Fungorum [10].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Осока гвоздичная (C. caryophyllea) ‒ евро-сибирский вид, распространенный в Центральной и Западной Европе. В России встречается в основном в европейской части в Крыму, а также на Кавказе, на юге Западной и Восточной Сибири [11]. C. caryophyllea – многолетняя поликарпическая трава, у которой корневище остается жизнеспособным на протяжении всего онтогенеза особи и ежегодно весной формирует новые побеги [11].
На пробной площади в течение вегетационного периода 2022 года с периодичностью, необходимой для проведения фенологических наблюдений, нами были проведены выездные исследования, в ходе которых нами были проанализированы и описаны основные фенологические фазы C. caryophyllea.
Фенологический спектр растения C. caryophyllea, представленный в таблице 1, отражает основные фазы жизненного цикла растения на протяжении вегетационного сезона.
Анализ фенологического спектра C. caryophyllea показал, что начало вегетации приходится на первую-вторую декаду марта, фаза бутонизации и начало цветения растений наблюдается с третьей декады марта и по третью декаду апреля, к периоду массового цветения и началу созревания плодов растение приступает в течение мая. В июне наблюдается период массового созревания плодов. Полное созревание плодов (орешков) и переход к фазе покоя наблюдается в первой-второй декадах июля (табл. 1).
Сопоставление фенологического спектра C. caryophyllea с фазой закладки спороношения устоспор головневым грибом A. caryophyllea, показало, что закладка головневых спор под оболочкой перидия в женском соцветии осоки и их дальнейшее распространение происходит в фазу массового плодоношения (формирования мешочков и орешков внутри них) питающего растения (рис. 2). Это явление наблюдается в период с первой декады мая по первую декаду июля (табл. 2).
Таблица 1
Фенологический спектр Carex caryophyllea Latourr. (Cyperaceae) (2022 г.)
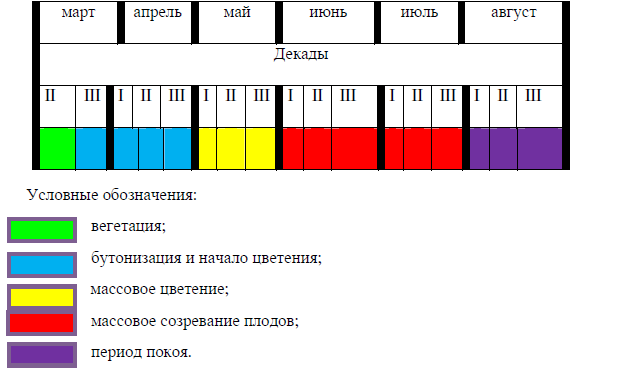
Таблица 2
Фенологический спектр головневого гриба Anthracoidea caryophyllea Kukkonen (2022 г.)
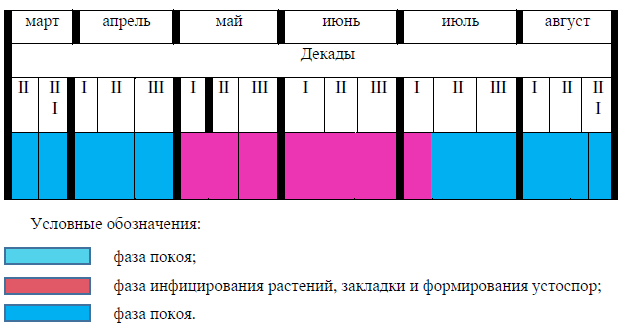
Со второй декады июля наблюдалось массовое осыпание устоспор A. caryophyllea, предназначенных для перезимовки головневого гриба, а с первой декады августа отмечен переход питающих растений к фазе покоя.

Рис. 2. Внешний вид здорового (1) и пораженного (2) соцветия Осоки гвоздичной (Carex caryophyllea) в стадии формирования плодов; 3 ‒ устоспоры головневого гриба Anthracoidea caryophylleae.
Для выяснения особенностей локализации (локальный или диффузный мицелий) и возможного распространения в тканях питающего растения мицелия головневого гриба A. caryophylleae мы провели сравнительное анатомическое исследование вегетативных органов (корень, стебель, лист) здоровых и зараженных растений C. caryophyllea.
Известно, что корневая система у представителей рода Осока (Carex L.) мочковатого типа. Первичный корень отмирает через 2–3 месяца после прорастания семян и заменяется системой придаточных корней, образующихся в зоне кущения побегов [11]. Для них характерно первичное анатомическое строение до конца их жизни, так как вторичные боковые меристемы – камбий и феллоген у них не образуются. Основные черты строения корня у осок неизменны, но существуют анатомические различия, обусловленные их местообитанием. И. Л. Лотова [12] выделяет в строении корня три основные типа ткани: покровная ткань, основная ткань и система проводящих тканей.
Анатомическое строение корня. Анатомические срезы корня C. caryophyllea, произведенные в конце фазы цветения растений-начала плодоношения (первая декада июля), показали, что на поперечном срезе корня осоки четко различимы две основные зоны: первичная кора и центральный цилиндр корня. Наружный слой корня – ризодерма или эпиблема состоит из слоя тонких клеток с неутолщенными стенками, выполняет функцию адсорбции и несет корневые волоски (рис. 3). Корневые волоски или типичные корневые волоски (typical root hairs, TRH) представляют собой трубчатые выросты ризодермальных клеток и увеличивают поглощающую поверхность корня [13, 14]. Выделяют два типа корневых волосков: фестукоидный и паникоидный. Для фестукоидного типа характерно наличие чередующихся коротких и длинных клеток, которые образуются под острым углом относительно поверхности ризодермы [15]. У Carex caryophyllea мы наблюдаем формирование корневых волосков паникоидного типа: корневые волоски примерно одинаковой длины отходят перпендикулярно по отношению поверхности ризодермы (рис. 3).
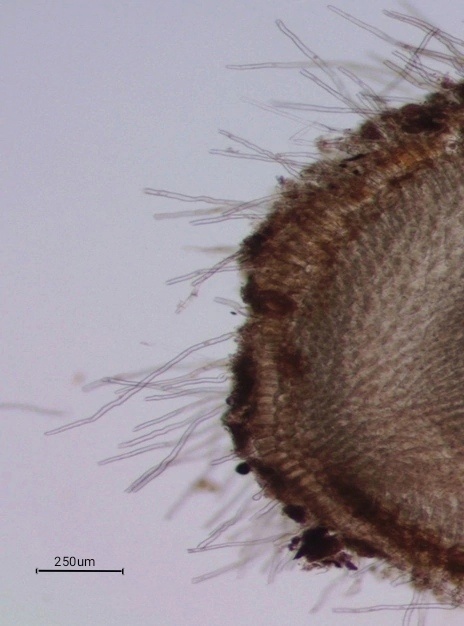
Рис. 3. Корневые волоски паникоидного типа у Carex caryophyllea.
Основная ткань корня представлена первичной корой. Известно, что в корне растений первичная кора дифференцирована на экзо-, мезо- и эндодерму [12]. Под покровной тканью ‒ ризодермой располагается первичная кора, в которую через корневые волоски поступает вода с растворенными минеральными веществами, а далее она поступает в центральный цилиндр. У C. caryophyllea из клеток, подстилающих ризодерму, развивается многослойная экзодерма, состоящая из 4–5 слоев мелких, плотно расположенных и опробковевших клеток, выполняющих функцию довольно прочной покровной ткани (рис. 4).
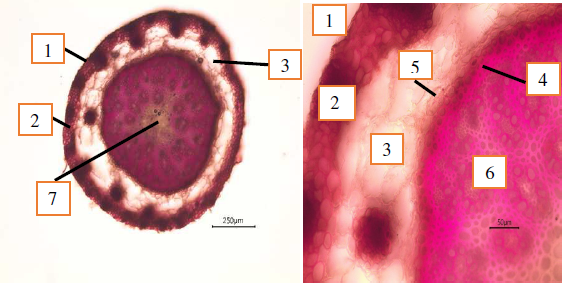
Рис. 4. Анатомическое строение корня здорового растения Carex caryophyllea:
1 – ризодерма; 2 – многослойная экзодерма; 3 – мезодерма (аэренхима);
4 – эндодерма с поясками Каспари; 5 ‒ перицикл; 6 ‒ центральный цилиндр с флоэмой и ксилемой; 7 – сердцевина.
Известно, что во время засушливого периода экзодерма часто становится внешним защитным слоем в корне за счет отмирания ризодермы [16, 17]. Формирование аэренхимы, которую мы наблюдаем у осоки гвоздичной, это – частный случай дифференциации мезодермы (паренхимы) и она может иметь как лизигенное [18], так и схизогенное происхождение [19]. У Carex caryophyllea за экзодермой следуют рыхло расположенные с большим количеством межклетников клетки мезодермы, выполняющие функцию аэренхимы (рис. 4). Вообще наличие аэренхимы в корнях связывают с адаптацией растений к возможным условиям затопления. Далее следует четко выраженный, самый внутренний слой коры, который прилегает к центральному цилиндру ‒ эндодерма, клетки которой имеют эллиптическую форму и утолщения в виде поясков Каспари, обладающих утолщенными радиальными и тангентальными стенками за счет отложения лигнина и суберина.
Напротив слоя эндодермы, содержащего пропускные клетки, расположены сосуды протоксилемы. Известно, что функционально эндодерма носит барьерный характер для регуляции потока ионов по апопласту в двух противоположных направлениях: от коры к стеле и в обратном направлении – от стелы корня к коре [20, 21]. Далее за эндодермой следует однослойный перицикл. В центральном цилиндре проводящие ткани у C. caryophyllea образуют радиальный проводящий пучок. Для питающего растения характерна полиархная стела округлой формы, с большим количеством тяжей флоэмы и ксилемы. При этом число лучей ксилемы в стеле составляет не менее 7–8 лучей, а в самом центре корня располагается паренхима сердцевины (рис. 4).
Для многих представителей головневых грибов свойственно развитие диффузного мицелия, пронизывающего своими гифами ткань всего растения. Мицелий часто бывает многолетним, локализуясь в корневой системе и уже весной ежегодно отрастающие побеги проявляют признаки поражения грибом-паразитом. Проведенный сравнительный анализ анатомического строения корня здорового и зараженного головневым грибом Anthracoidea caryophylleae растения-хозяина C. caryophyllea показал, что диффузный мицелий не был обнаружен (рис. 5).
Как видно, из данных рисунка 5, анатомическое строение корня зараженного растения имело сходный план строения в сравнении со здоровым растением осоки гвоздичной.
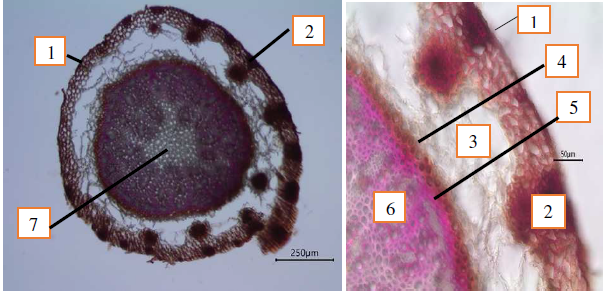
Рис. 5. Анатомическое строение корня растения Carex caryophyllea, зараженного головневым грибом Anthracoidea caryophylleae: 1 – ризодерма;
2 – многослойная экзодерма; 3 – мезодерма (аэренхима); 4 – эндодерма с поясками Каспари; 5 ‒ перицикл; 6 ‒ центральный цилиндр с тяжами флоэмы и ксилемы;
7 – паренхима сердцевины.
Анатомическое строение стебля C. caryophyllea. Стебель, имеющий в поперечной разрезе треугольную форму, снаружи покрыт эпидермой, состоящей из довольно мелких клеток с хорошо развитой кутикулой. Наружные тангентальные стенки клеток эпидермы значительно утолщены (рис. 6). За эпидермой следует первичная кора, состоящая из клеток основной паренхимы, имеющей типичное строение. К периферии стебля клетки паренхимы мельче, а к центру стебля крупнее. В первичной коре располагаются закрытые, коллатеральные проводящие пучки. Крупные проводящие пучки чередуются с более мелкими.
Следует отметить, что склеренхима в проводящих пучках хорошо развита и формирует мощную склеренхимную обкладку вокруг проводящих элементов, особенно она развита над флоэмой. В проводящем пучке осоки ксилема представлена несколькими сосудами: два крупных, пористых и несколько мелких – кольчатых сосудов. Между проводящими пучками располагается аэренхима, имеющая крупные межклетники и воздухоносные ходы с хлорофиллоносной тканью (рис. 6).
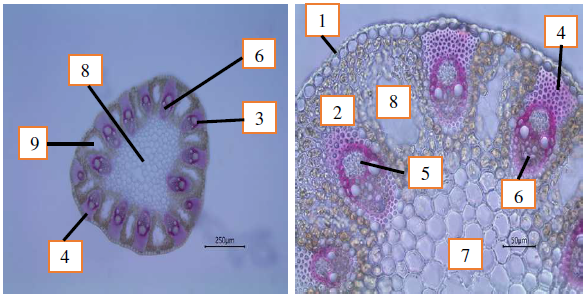
Рис. 6. Анатомическое строение стебля здорового растения Carex caryophyllea: 1 – эпидерма; 2 – хлоренхима; 3 – проводящие пучки; 4 – склеренхима; 5 – флоэма; 6 – ксилема; 7 – паренхима сердцевины; 8 ‒ аэренхима.
Над участками хлоренхимы в эпидерме располагаются устьица. Благодаря такому анатомическому строению у осоки гвоздичной проводящие пучки как бы «подвешены» на мощных субэпидермальных тяжах, состоящих из склеренхимы. Наличие аэренхимы также свидетельствует о способности растения переносить затопление. Сердцевина при этом в стебле полностью сохраняется (рис. 6). Анализ анатомического строения стебля больного растения C. caryophyllea, проведенный нами, не выявил локализации диффузного мицелия головневого гриба A. caryophylleae в стебле питающего растения (рис. 7).
Анатомическое строение листа. Листорасположение у осок очередное, трехрядное. Листовая пластинка у C. caryophyllea имеет линейную форму, параллельное жилкование, причем все жилки идут вдоль листовой пластинки, формируя многочисленные анастомозы. Устьичный аппарат у осоки гвоздичной ‒ парацитного типа. Лист является односкладчатым. Он покрыт клетками эпидермы, причем на адаксиальной стороне клетки эпидермы в 2‒3 раза крупнее аналогичных клеток на абаксиальной стороне. Клетки эпидермы листа крупноклетные, с адаксиальной стороны имеют утолщенные наружные стенки с хорошо развитой кутикулой (рис. 8).

Рис. 7. Анатомическое строение стебля Carex caryophyllea, зараженного головневым грибом Anthracoidea caryophylleae: 1 – эпидерма; 2 – хлоренхима;
3 – проводящие пучки; 4 – склеренхима; 5 – флоэма; 6 – ксилема; 7 –хлоренхима;
8 – сердцевина; 9 ‒ аэренхима.
Кроме того, на адаксиальной стороне листа C. caryophyllea присутствуют буллиформные (пузыревидные) клетки ‒ это большие эпидермальные клетки, имеющие пузырчатую форму и предназначенные для скручивания листьев для минимизации потери воды при неблагоприятных условиях или в условиях водного стресса растений. Считается, что они играют роль в разворачивании растущих листьев, а также в скручивании и раскручивании взрослых листьев в ответ на чередование сухих и влажных периодов [22]. Данный тип клеток характерен для некоторых травянистых однодольных растений (например, у представителей семейств Poaceae и Cyperaceae).
Ранее в литературе эти клетки называли моторными, или двигательными, считая, что они ответственны за свертывание листовых пластинок в трубочку, происходящее в сухую погоду. Длительный эффект объясняли изменением тургора и объема пузыревидных клеток: при их уменьшении листья свертываются, а при увеличении ‒ расправляются. Современные представления наибольшую роль в свертывании листьев отводят субэпидермальным тяжам склеренхимы, которые подсыхают и сокращаются в сухую погоду, а пузыревидные клетки лишь облегчают и регулируют этот процесс [12]. Действительно, представления о роли буллиформных клеток в связи с накоплением научных фактов со временем претерпевают изменения.
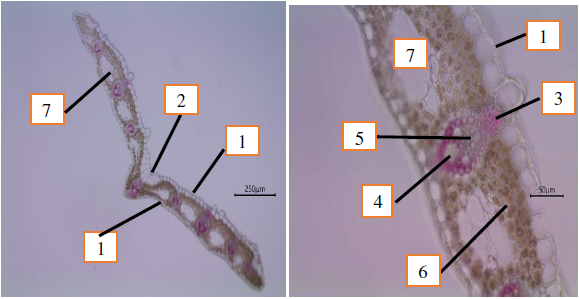
Рис. 8. Анатомическое строение здорового листа Carex caryophyllea:
1 – эпидерма; 2 – буллиформные (пузыревидные) клетки; 3 – склеренхимная обкладка проводящего пучка; 4 – флоэма; 5 – ксилема; 6 – мезофилл; 7 – аэренхима.
Мезофилл листа C. caryophyllea представлен однородной тканью, состоящей из нескольких рядов клеток, содержащих крупные хлоропласты. Между клетками мезофилла листа хорошо развиты межклетники и аэренхима. В листе имеется главная жилка и ряд боковых жилок. Центральная жилка представлена крупным закрытым коллатеральным проводящим пучком, окруженным однослойной паренхимной обкладкой и над флоэмой, присутствует также хорошо развитая склеренхимная обкладка проводящего пучка (рис. 8) Мезофилл листа у осоки однородный (диффузный), фотосинтезирующая паренхима расположена с верхней стороны листа в виде 3‒5 слоев округлой формы клеток, а с нижней стороны ˗ в виде 1‒2 слоев клеток. В анатомическом отношении такой вид строения листа соответствует изолатеральному типу (рис. 8).
Анализ анатомического строения листа больного растения C. caryophyllea, проведенный нами, не выявил локализации диффузного мицелия и спороношения головневого гриба A. caryophylleae (рис. 9), следовательно развивающаяся инфекция развивается заново ежегодно и носит локальный характер и затрагивая только соцветия осоки.
В целом, по совокупности анатомических признаков вегетативных органов, данный вид можно отнести к экологической группе ксеромезофиты, что соответствует типу экоморфы, характерной для данного вида растения и отмеченной в монографии В. Н. Голубева [23] «Биологическая флора Крыма».
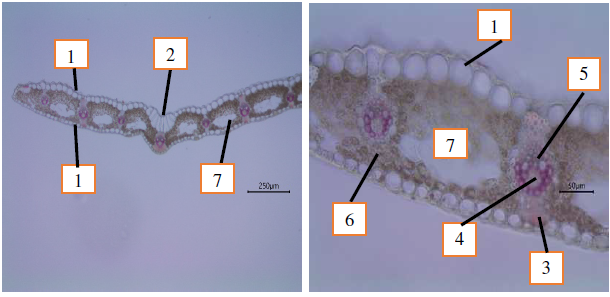
Рис. 9. Анатомическое строения листа Carex caryophyllea, зараженного головневым грибом Anthracoidea caryophylleae: 1 – эпидерма; 2 – буллиформные клетки; 3 – склеренхимная обкладка проводящего пучка; 4 – флоэма; 5 – ксилема;
6 – мезофилл; 7 – аэренхима.
ЗАКЛЮЧЕНИЕ
- Сопоставление фенологического спектра C. caryophyllea с фазой формирования спороношения головневым грибом A. caryophyllea, показало, что закладка устоспор и их распространение происходит в фазу массового цветения и плодоношения питающего растения (с первой декады мая по первую декаду июля).
- Анатомическое исследование вегетативных органов C. caryophyllea, показало, что корень формирует корневые волоски паникоидного типа, под покровной тканью ‒ ризодермой закладывается первичная кора с хорошо развитой аэренхимой. Для корня характерна полиархная стела с большим количеством тяжей флоэмы и ксилемы (при этом число лучей ксилемы в стеле составляет не менее 7‒8).
- Выявлено, что анатомическое строение стебля C. caryophyllea имеет типичный пучковый тип строения, характерный для многолетних травянистых растений из семейства Cyperaceae. Наличие аэренхимы в стебле и корне свидетельствует о способности растения переносить затопление. Лист C. caryophyllea при нехватке влаги способен складываться благодаря наличию на адаксиальной стороне буллиформных клеток и в анатомическом отношении его строение соответствует изолатеральному типу. По совокупности анатомических признаков вегетативных органов C. caryophyllea можно отнести к экологической группе ксеромезофиты, что подтверждает тип экоморфы [20].
- Проведенный анализ анатомического строения вегетативных органов зараженного растения C. caryophyllea не выявил диффузного мицелия головневого гриба A. caryophylleae, при этом заражение растений развивается заново ежегодно и носит локальный характер, затрагивая лишь соцветия.
- Karatygin I. V., Azbukina Z. M., The determinant of the fungi USSR. Order of Smut, Ustilagaceae of family, Issue 1. (Publishing House of Science, Leningrad, 1989).
- Vánky K., Biodiversity and conservation of smut fungi (Ustilaginomycetes p.p. and Microbotryales) reflected in Vánky, Ustilaginales exsiccata no., Mycol. Balcan. (2004)
- Prosyannikova I. B., Guseva A. A., Grishkovets V. I. The influence of the smut fungus Sporisorium andropogonis (Opiz) Vanky. on the state of the cenopopulation of Bothriochloa ischaemum (L.) Keng. (Poaceae) In the Mountainous Crimea, Scientific notes of the V. I. Vernadsky Crimean Federal University Biology. Chemistry, 3 (69), 4, 187 (2017).
- Dudka I. O., Geluta V. P., Tichonenko Y. A. et al., Fungi natural areas Crimea (Institute of botany named after M.G. Cholododny), (Phytosotsiotsentr, Kiev, 2004).
- Protected areas of Russia [electronic resource]. Access mode: http://oopt.aari.ru/oopt/Nauchny (reference date: 15.02.2024).
- Beideman I. N. Methodology for studying the phenology of plants and plant communities (Nauka Novosibirsk, 1974).
- Barykina R. P., Veselova T. D., Devyatov A. G., etc. Handbook of Botanical microtechnics. Fundamentals and methods (MSU publishing house, Moscow, 2004.).
- Blagoveshchenskaya E. Y., Phytopathogenic micromycetes: educational guide (Publishing house Lenand, Moskow, 2015).
- Plantarium. Plants and lichens of Russia and neighboring countries: an open online atlas and plant determinant [Electronic resource]. – Access mode: http://www.plantarium.ru (reference date: 12.02.2024).
- Index Fungorum [electronic resource]. 2003. Access mode: http://www.indexfungorum.org [website, version 1.00] (reference date: 12.02.2024).
- Egorova T. S. Sedges (Carex L.) of Russians and neighboring states (within the former USSR)/edited by A. L. Takhtajan. (St. Petersburg State Chemical Farm. acad.; St. Louis: Missouri. bot. sto, St. Petersburg, 1999).
- Lotova L. I. Botany. Morphology and anatomy of higher plants: Textbook. 3rd edition (KomKniga, Moskow, 2007).
- Miller R. M., Smith C. I., Jastrow J. D., Bever J. D. Mycorrhizal status of genus Carex (Cyperaceae), Am J Bot, 86, 547 (1999).
- Ghosh A., Bhujel S., Maiti G. G. Occurrence of mycorrhizae in some species of Carex (Cyperaceae) of the Darjeeling Himalayas, India, International Journal of Life Science and Pharma Research, 4, 1, 1 (2014).
- Kardashevskaya V. E. Cereals: Textbook. (Publishing house of the Yakut University, Moskow, 2003).
- Stasovski E., Peterson C. A. Effects of drought and subsequent rehydration on the structure, vitality, and permeability of Allium cepa adventitious roots, Canadian journal of Botany, 71, 5, 700 (1993).
- Enstone D. E., Peterson C. A., Ma F. Root endodermis and exodermis: structure, function, and responses to the environment, Journal of Plant Growth Regulation, 21, 4, 335 (2002).
- Visser E. J. W., Bogemann G. M., Van De Steeg H. M., Pierik R., Blom C. W. P. M. Flooding tolerance of Carex species in relation to field distribution and aerenchyma formation, New Phytologist, 148, 1, 93 (2000).
- Tarshis L. G. Anatomy of the underground organs of higher vascular plants (Ural Branch of the Russian Academy of Sciences, Yekaterinburg, 2007).
- Singh C., Jacobson L. The radial and longitudinal path of ion movement in roots, Physiologia Plantarum,41, 1, 59 (1977).
- Bücking H. et al. The fungal sheath of ectomycorrhizal pine roots: an apoplastic barrier for the entry of calcium, magnesium, and potassium into the root cortex? Journal of Experimental Botany, 53, 374, 1659 (2002).
- Arber A. The Gramineae: A Study of Cereal, Bamboo and Grass, (Cambridge University Press, “Botany and Gardening ‒ Life Sciences”, 2010).
- Golubev V. N. Biological flora of Crimea, (NBS-NNTs, Yalta, 1996).



