CHANGES IN MOTOR ACTIVITY IN RATS UPON ADMINISTRATION OF PROBIOTICS IN A MODEL OF DYSBIOSIS
Изменение двигательной активности крыс при введении
пробиотика в условиях моделирования дисбиоза
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №2, 2024
Publication text (PDF):Download
UDK: 663.18: 591.1
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Dzheldubaeva E. R., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Yarmolyuk N. S., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Rzhevskaya V. S., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Orudzhaliev A. V., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Tumanyants K. N. V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-2-32-42
PAGES:from 32 to 42
STATUS:Published
LANGUAGE:Russian
KEYWORDS: chronic stress, experimental animals, board with holes, vertical activity, horizontal activity, preservatives, benzoic acid, sorbic acid.
ABSTRACT (ENGLISH):
Studying the effects of new microbiotic consortia of probiotics on the psycho-physiological activity in animals and humans is relevant both in normal conditions and in models of dysbiosis – antibiotic-induced stress. However, despite the widespread popularity of probiotics among the general public, there are conflicting clinical results for many probiotic strains and compositions, making their study relevant.
The aim of this study was to identify changes in motor activity in rats upon administration of a new microbial consortium – the probiotic “Probiovit”, which includes Lactobacillus acidophilus, Lactococcus lactis, Lactobacillus casei, Lactobacillus plantarum, Saccharomyces cerevisiae.
Experiments were conducted on white sexually mature female Wistar rats, specifically bred for laboratory research, weighing 220–240 g, with average motor activity and low emotional reaction in the “open field” test, which most individuals in the population exhibit, resulting in a typical reaction to various factors in animals.
The animals’ motor activity was investigated using the “infrared actimeter” system. This is an analogue of the “open field” test, where behavior recording is automated. The level of differences between the experimental groups was assessed using the Mann-Whitney U-test.
The research results showed that a two-week administration of the probiotic “Probiovit” led to an increase in motor activity and exploratory behavior in rats. This was manifested in a greater preference of the animals for open field zones, increased movement speed, and a higher number of crossings through the central zone of the test compared to the control group. Improved spatial orientation and increased stereotypical behavior were noted. This may indicate an anxiolytic effect of probiotics, i.e., a reduction in the level of anxiety and fear in rats of this group, manifested in a greater preference for open areas and reduced time spent in protected areas.
Administration of antibiotics resulted in a decrease in motor activity (overall activity and movement stereotypes), increased resting periods of rats in the actimeter, reduced exploratory interest, and deterioration in overall condition.
In the case of combined administration of probiotics and antibiotics, there was a tendency for an increase in overall activity relative to the control group, a decrease in resting periods, with values higher than those in the group of animals to which antibiotics were administered, but lower than those in the probiotic group. Animals showed a greater preference for central field zones compared to the control group, indicating a synergistic effect – a reduction in the negative side effects of antibiotics with combined use of probiotics and antibiotics.
The obtained data may serve as the basis for clinical recommendations, which may be applicable in assessing the effectiveness of antibiotics and probiotics in general. Research in this area is important for understanding the complex relationships between the gut and the brain, as well as for finding new treatment strategies based on the influence on the composition and functions of the microbiome.
ВВЕДЕНИЕ
На данный момент многочисленные исследования подтверждают влияние микробиоты кишечника на разнообразные заболевания у человека, включая воспалительные заболевания кишечника [1, 2], синдром раздраженного кишечника [3], аллергии [4], неврологические [5], метаболические [6] расстройства и другие. Последние научные исследования выявили связь между составом микробиоты кишечника и центральной нервной системой (ЦНС). В литературе все чаще встречается «ось микробиота-кишечник-мозг» (КМО, microbiota-gut-brain axis) [7]. Так, показана способность метаболитов микробного происхождения прямо или опосредовано через метаболические и нейроэндокринные механизмы модифицировать функции нервной системы [8, 9]. Воздействие микробиоты на ЦНС приводит к существенным изменениям в поведении.
Известно, что применение пробиотиков является эффективным терапевтическим методом, уменьшающим негативные последствия влияния микробиоты [10]. Показано, что многие пробиотики имеют анксиолитический и антидепрессивный эффекты, оказывают психобиотические влияния на эмоциональную, когнитивную, системную и центральную сферы психофизиологической активности у животных и людей, доказано наличие сигнальных механизмов, существующие между микробиомом и ЦНС [11].
Сбалансированность микробиоты может нарушаться «при превышении интенсивности негативных внешних воздействий над пороговыми значениями адаптационной системы организма» [12] и при сдвигах в метаболической активности самой микрофлоры [13]. Одной из наиболее частых причин нарушений является воздействие на нее антибактериальными препаратами [14]. Эффективность любого пробиотика в доклинических экспериментах исследуют на модели дисбиоза – антибиотико-индуцированного стресса у животных, что позволяет оценить физиологические показатели при антибиотикотерапии.
Однако, хотя использование пробиотиков получило широкую популярность среди общественности, существуют противоречивые клинические результаты для многих пробиотических штаммов и составов, что делает актуальным их для изучения. На сегодняшний день активно ведутся поиски новых видов пробиотиков, обладающих высокой биологической и клинической активностями, позволяющих заменить многие лекарственные средства, обладающие побочным действием.
В связи с вышеизложенным целью данной работы явилось выявление изменений двигательной активности у крыс при введении нового микробного консорбциума – пробиотика «Пробиовит» при моделировании дисбиоза при комбинированном введении антибиотика.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнялась в Центре коллективного пользования научным оборудованием «Экспериментальная физиология и биофизика» при кафедре физиологии человека и животных и биофизики в рамках программы исследований № АААА-А21-121011990099-6 «Физиологические механизмы биологического действия факторов разной природы и интенсивности» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского».
Синтез нового пробиотика был проведен на кафедре ботаники и физиологии растений и биотехнологий ФГАОУ ВО «Крымский федеральный университет имени В.И. Вернадского» под руководством Ржевской В. С. Из имеющихся микроорганизмов (зарегистрированы в ВКПМ) составлен микробный консорциум пробиотика «Пробиовит», включающий Lactobacillus acidophilus, Lactococcus lactis, Lactobacillus casei, Lactobacillus plantarum, Saccharomyces cerevisiae.
Эксперименты выполнены на белых половозрелых крысах-самках линии Wistar, которые были специально выведены для лабораторных исследований. Общая выборка животных составила 60 здоровых крыс, массой 220–240 г. Было выделено четыре группы животных (рис. 1):
- Группа «Контроль» (К) – крысы содержались в стандартных условиях вивария, которым в течение 14 дней путем зондирования вводили эквивалентный объем питьевой воды.
- Группа «Пробиотик» (ПБ) – крысы, которым вводили интрагастрально 1 % раствор пробиотика «Пробиовит» по 3 мл путём зондирования в течение 14 дней.
- Группа «Антибиотик» (АБ) – крысы, которым путём зондирования через глотку вводили антибиотик широкого спектра действия из группы тетрациклинов «Доксициклин» в дозе по 5 мг/кг в течение 14 дней с целью моделирования дисбиоза.
- Группа «Сочетание» (АБ+ПБ) – крысы, которым комбинированно давали антибиотик и пробиотик в течение 14 дней.
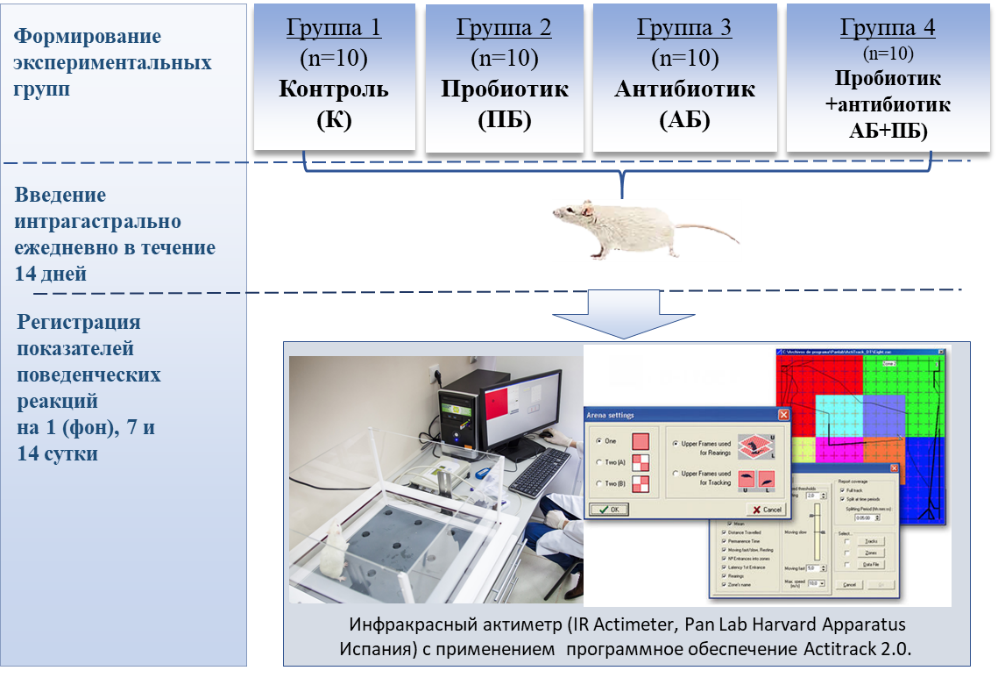
Рис. 1. Общий план проведения эксперимента.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям этического комитета по биоэтике ФГАОУ ВО «Крымский федеральный университет им. В. И. Вернадского» (протокол № 5 от 2022 г.).
Двигательную активность животных исследовали в системе «инфракрасный актиметр». Это аналог теста «открытое поле», где регистрация поведения проводится автоматизировано. Использовали специализированную рабочую станцию размером 45 х 45 см с прозрачными полипропиленовыми стенками высотой 20 см, представляющую собой актиметр (IR Actimeter, Pan Lab Harvard Apparatus Испания) с двумя инфракрасными рамками, выполняющих роль датчиков движений. Для управления рабочей станцией и сбора данных использовали программное обеспечение Actitrack 2.0 (Pan Lab Harvard Apparatus, Испания) (см. рис. 1.). Длительность тестирования 3 мин.
В качестве основных показателей двигательной активности применяли общую активность (у.е.), стереотипные движения (у.е.), двигательную активность (у.е.), среднюю скорость (см/с) и общую дистанцию (см) перемещения, период покоя (с), количество эпизодов подъемов на заднии лапы (у.е.), общую активность в периферических и центральной зонах (у. е)
Статистическая обработка полученных данных выполнялась с использованием прикладного программного документа «STATISTICA – 10.0» (StatSoft, США). Так как разброс данных переменных разнился с нормальным, проводилась оценка достоверного уровня различий между испытуемыми группами по U-критерию Манна-Уитни.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты исследования показали, что у животных второй группы (ПБ) на 14 день отмечается увеличение общей активности крыс на 31,49 % (р˂0,05) относительно значений контрольной группы (рис. 2). Увеличились и продолжительности стереотипных движений на 38,73 % (р˂0,05), общей двигательной активности на 18,02 % (р≤0,05), общей пройденной дистанции на 24,41 % (р˂0,05) соответственно относительно значений животных в контроле. Это сопровождало и увеличение средней скорости у крыс данной группы на 7 день – на 25,56 % (р˂0,05), а на 14 день – на 37,42 % (р˂0,05) соответственно, относительно значений контрольной группы животных. После введения пробиотика количество эпизодов подъёма на 14 день увеличилось на 18,67 % (р˂0,05) относительно значений контрольной группы
Таким образом, у группы ПБ было выявлено повышение общей активности на фоне контроля, так же они проявляли больше интереса к исследованию новой территории. Изменилось время общей активности в центральных и периферических зонах поля. Так, на седьмой день введения пробиотика данное соотношение составило 1 : 8, а на четырнадцатый день – 1 : 6 (в контрольной группе данный показатель был 1 : 14), то есть отмечалось больше предпочтительности животными центральных открытых зон поля, увеличение скорости перемещения и в большем числе пересечений через центральную зону теста по сравнению с показателями контрольной группы (рис. 3). Увеличение двигательной активности и исследовательского поведения крыс второй группы (ПБ) можно объяснить различными физиологическими механизмами влияния пробиотиков на организм.
Таким образом, двухнедельное введение пробиотика способствовало увеличению двигательной активности и исследовательского поведения крыс в тесте открытое поле. Это проявлялось в большей предпочтительности животными открытых зон поля, увеличении скорости перемещения и большем числе пересечений через центральную зону теста по сравнению с показателями контрольной группы. У животных экспериментальной группы ПБ отмечены улучшение ориентации в пространстве и увлечение стереотипного поведения. Это может свидетельствовать об анксиолитическом эффекте пробиотиков, то есть снижении уровня тревожности и страха крыс данной группы, что проявляется в большей предпочтительности открытых зон и уменьшенном времени проведения в защищенных участках.
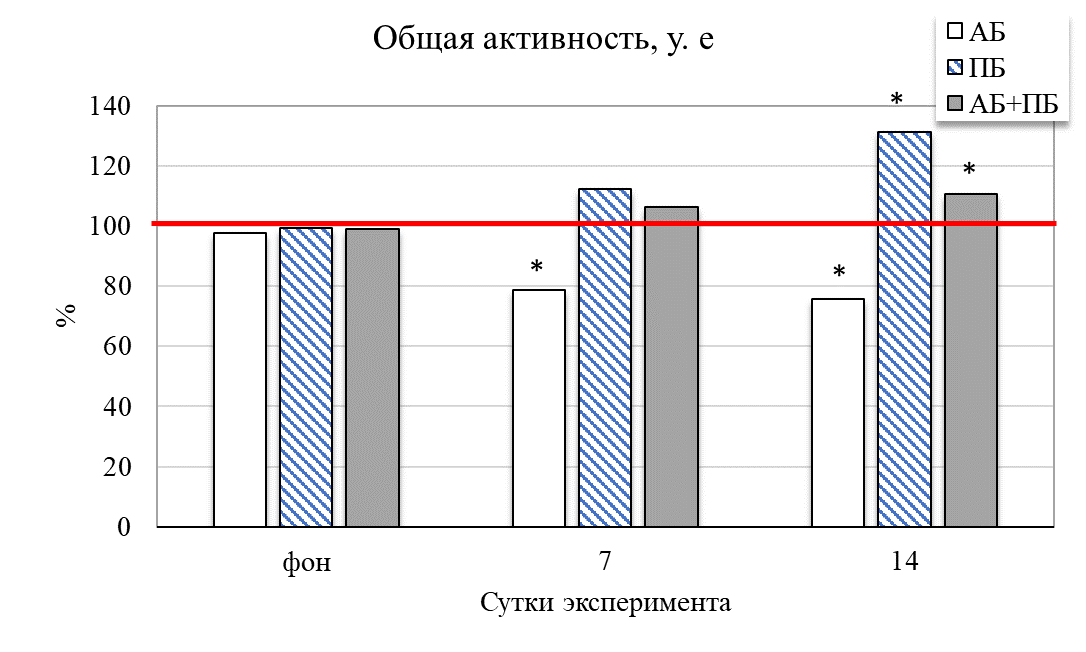
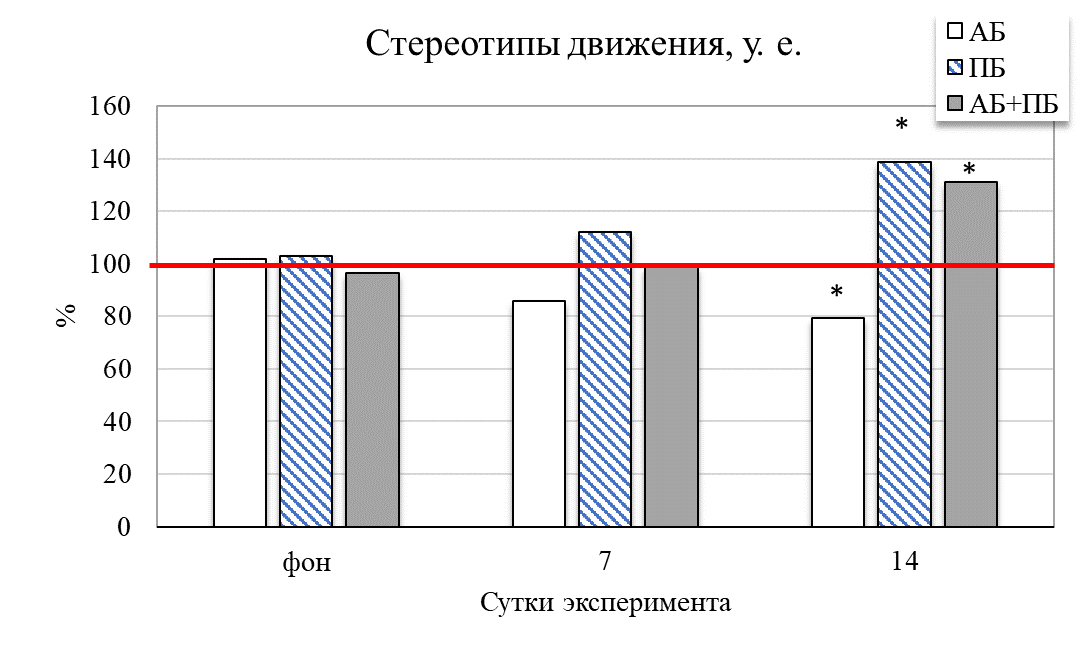
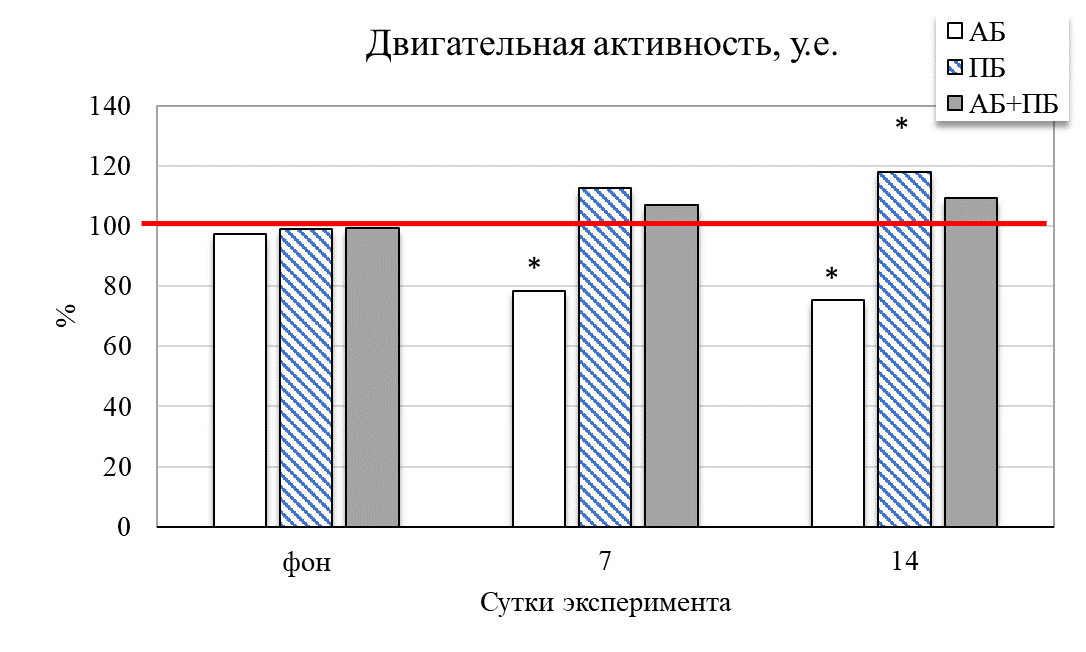
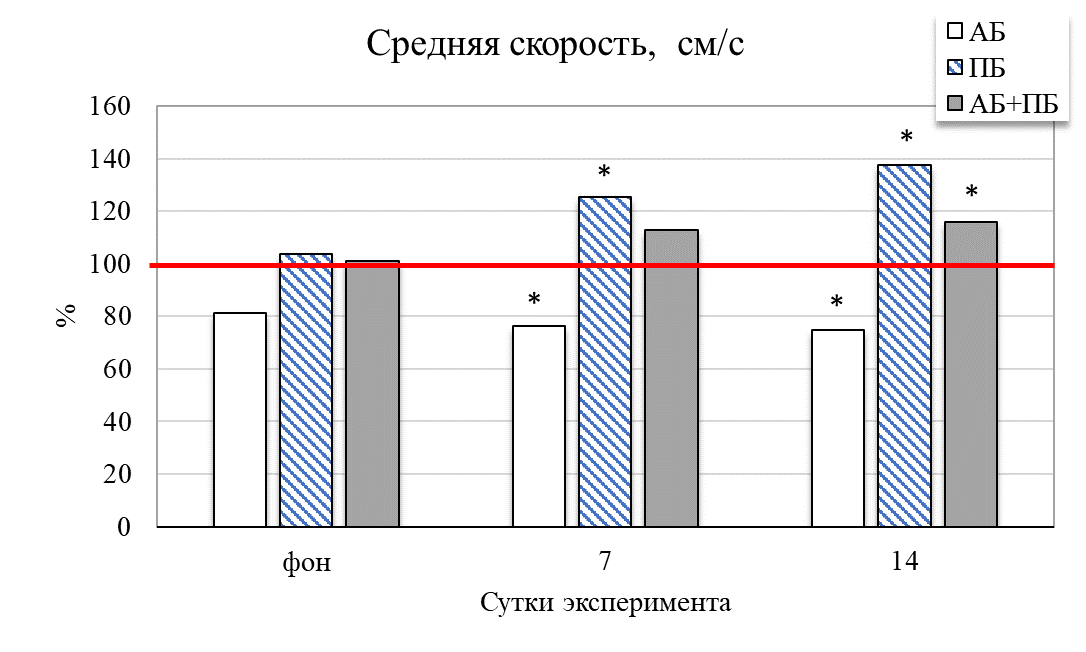
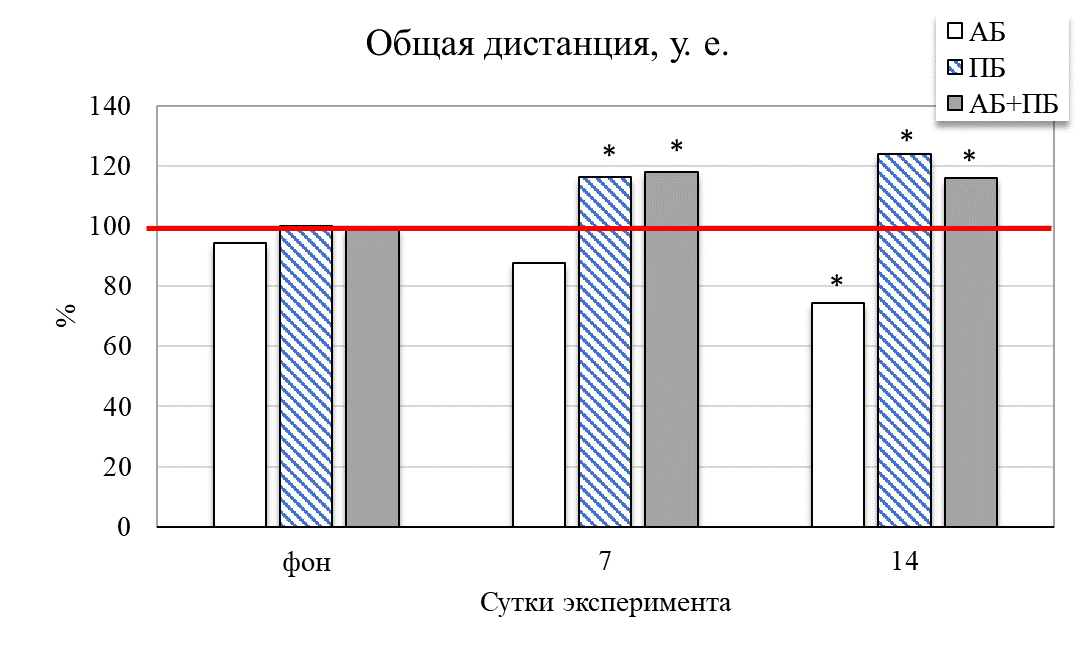
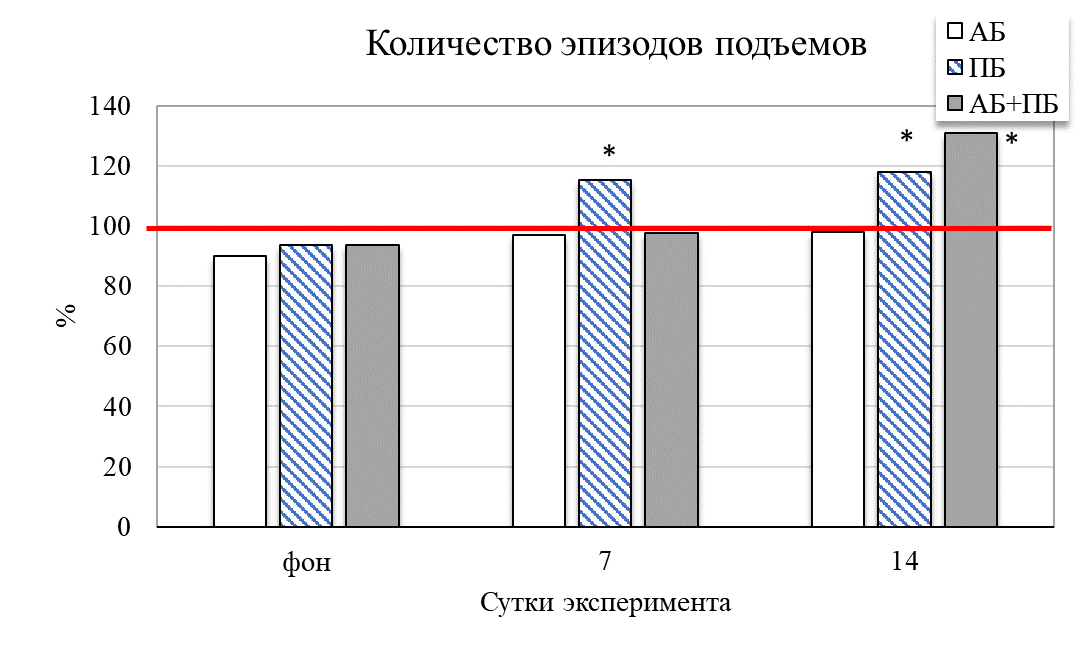
Рис. 2. Изменение поведенческих реакций в тесте «актиметр» у крыс при изолированном и комбинированном введении пробиотика и антибиотика (в % относительно контрольной группы) в разные сутки наблюдения.
Примечание: * – достоверность различий по сравнению со значениями контрольной группы животных по U-критерию Манна-Уитни.
У животных третьей группы (АБ) после введения антибиотика уменьшились общая активность на 14,63 % (р˂0,05), средняя скорость на 13,33 % (р˂0,05) относительно значений у животных контрольной группы (см. рис. 2). Изменилось время общей активности в центральных и периферических зонах поля. Так, на четырнадцатый день введения антибиотика данное соотношение составило 1 : 16 (в контрольной группе данный показатель был 1:14), то есть отмечалось больше предпочтительности животными периферических зон поля и меньше пересечений через центральную зону теста по сравнению с показателями контрольной группы (см. рис. 3).
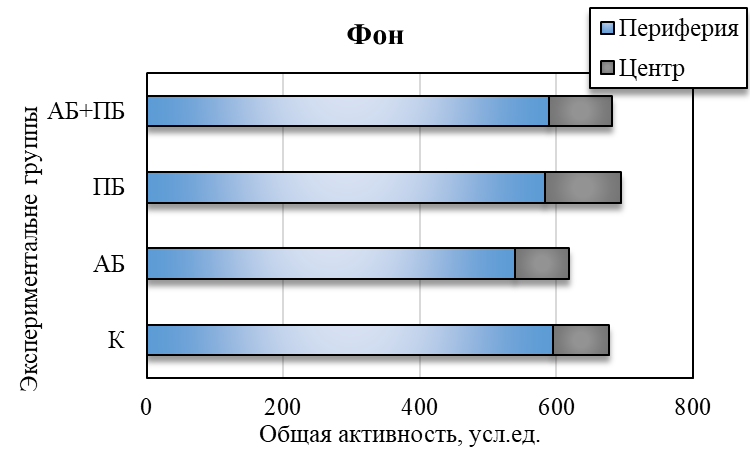

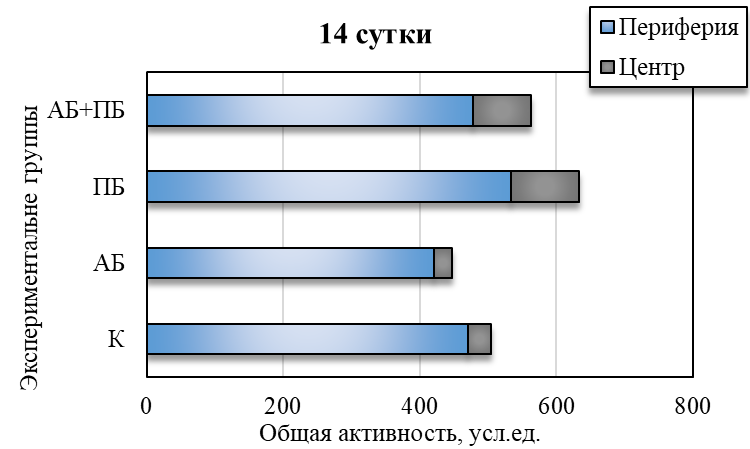
Рис. 3. Общая активность в центральной и периферической зоне теста «инфракрасный актиметр» у крыс в контроле (К), при изолированном и комбинированном введении пробиотика (ПБ) и антибиотика (АБ) в фоновый день, на седьмые и четырнадцатые сутки наблюдения.
Таким образом, введение антибиотика способствовало уменьшению двигательной активности (общей активности и стереотипов движения), увеличению периодов покоя крыс в актиметре. Это проявлялось в большей предпочтительности животными периферических зон поля, уменьшении средней скорости перемещения. У группы АБ наблюдались уменьшение активности на фоне контроля, меньший исследовательский интерес и ухудшение общего состояния.
При комбинированном введение пробиотика и антибиотика у животных четвертой группы (АБ+ПБ) наблюдается увеличение общей активности на 7 и 14 день на 8,69 % и 10,79 % соответсвенно относительно группы контроля. Наблюдается резкое увеличение стереотипных движений (на 31,22 %; р˂0,05), двигательной активности (на 16,99 %; р˂0,05) относительно значений в контроле. Также наблюдалось уменьшение количества вертикальных стоек на 14 день на 31,21 % (р˂0,05) относительно контрольной группы (см. рис. 2). Изменилось время общей активности в центральных и периферических зонах поля. Так, на четырнадцатый день комбинированного введения пробиотика и антибиотика данное соотношение составило 1 : 5, то есть отмечалось больше предпочтительности животными центральных зон поля и увеличение числа пересечений через центральную зону теста по сравнению с показателями контрольной группы (см. рис. 3). Пробиотик нейтрализовал действие антибиотика и положительно влиял на общее состояние у крыс.
Таким образом, комбинированное воздействие пробиотиков и антибиотика способствовало увеличению двигательной активности, уменьшению периодов покоя, значения показателей были выше чем в группе АБ, но ниже чем в группе ПБ. Отмечается большая предпочтительность животными центральных зон поля по сравнению с показателями контрольной группы, что свидетельствует о синергетическом эффекте – уменьшение негативных побочных эффектов антибиотиков при сочетанном применении пробиотиков и антибиотиков.
В ходе проведённого исследования выявлено, что применение пробиотика «Пробиовит» при комбинированном и последовательном воздействии с моделью дисбиоза при антибиотико-индуцированном стрессе оказывает положительное влияние на двигательную активность и общее состояние животных. При этом эти изменения могут выражаться как в увеличении общей активности животных, так и в увеличении скоростных показателей, общей пройденной дистанции, а также вертикальной двигательной активности.
Известно, что пробиотики могут воздействовать на КМО, влияя на коммуникацию между кишечником и мозгом, эта ось играет ключевую роль в регуляции различных аспектов здоровья, включая поведение, настроение и функции иммунной системы [15]. Они могут воздействовать на производство нейромедиаторов в кишечнике, таких как серотонин и ГАМК, которые могут влиять на настроение и функцию мозга [16]. Исследования также показывают, что пробиотики могут снижать уровень стресса и симптомы анксиозности, что может отразиться на поведении. В опытах с лабораторными животными установлено, что биотический штамм Lactobacillus rhamnosus, действуя через ГАМК-зависимую систему в мозге, подавлял тревожное поведение животных в сложном лабиринте и в опытах на открытом освещенном поле, а также депрессивное состояние в опытах с форсированным плаванием мышей [6]; ваготомия (перерезание блуждающего нерва, связывающего энтерическую нервную систему с мозгом) прекращала воздействие психобиотика [17].
Научные исследования продолжают раскрывать множество аспектов влияния пробиотиков на организм, и есть некоторые данные, указывающие на их потенциальное воздействие на двигательную активность. Эти механизмы все еще являются предметом активного исследования, и необходимо провести дополнительные исследования для более полного понимания влияния пробиотиков на энергетический обмен и физическую активность.
В целом, исследования в этой области важны для понимания сложных взаимосвязей между кишечником и мозгом, а также для поиска новых стратегий лечения, основанных на воздействии на состав и функции микробиома.
ЗАКЛЮЧЕНИЕ
- Двухнедельное введение пробиотика «Пробиовит» способствовало увеличению двигательной активности и исследовательского поведения крыс. Это проявлялось в большей предпочтительности животными открытых зон поля, увеличении скорости перемещения и большем числе пересечений через центральную зону теста по сравнению с показателями контрольной группы. Отмечены улучшение ориентации в пространстве и увеличение стереотипного поведения. Это может свидетельствовать об анксиолитическом эффекте пробиотиков, то есть снижении уровня тревожности и страха крыс данной группы, что проявляется в большей предпочтительности открытых зон и уменьшении времени проведения в защищенных участках.
- Введение антибиотика вызывало уменьшение двигательной активности (общей активности и стереотипов движения), увеличение периода покоя крыс в актиметре, меньший исследовательский интерес и ухудшение общего состояния.
- При комбинированном введении пробиотика и антибиотика у животных наблюдается тенденция к увеличению общей активности относительно группы контроля, уменьшению периодов покоя, значения показателей были выше, чем в группе животных, которым вводился антибиотик, но ниже, чем в группе пробиотик. Отмечается большая предпочтительность животными центральных зон поля по сравнению с показателями контрольной группы. Пробиотик нейтрализовал действие антибиотика и положительно влиял на общее состояние у крыс.
Работа выполнена на базе ЦКП «Экспериментальная физиология и биофизика» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского»
- Kudelka M. R., Hinrichs B. H., Darby T. [et al.] Cosmc is an X-linked inflammatory bowel disease risk gene that spatially regulates gut microbiota and contributes to sex-specific risk, Proc. Nat. Acad. Sci USA, 113, 14787 (2016).
- Schmidt K., Cowen P. J., Harmer C. J., Tzortzis G. [et al.] Prebiotic intake reduces the waking cortisol response and alters emotional bias in healthy volunteers, Psychopharmacology (Berl), 232, 793 (2015).
- Herndon C. C., Wang Y. P., Kaohsiung C. L. Targeting the gut microbiota for the treatment of irritable bowel syndrome, Med. Sci., 36, 160 (2019).
- Johnson C. C., Res D. R. The infant gut bacterial microbiota and risk of pediatric asthma and allergic diseases, Transl., 179, 60 (2017).
- Cerdo T., Dieguez E., Campoy C. [et al.] Impact of gut microbiota on neurogenesis and neurological diseases during infancy, Curr. Opin. Pharmacol., 50, 33 (2020).
- Boulange C. L., Neves A. L., Chilloux J. [et al.] Impact of the gut microbiota on inflammation, obesity, and metabolic disease, Genome Med., 8, 42 (2016).
- Zakharova I. N., Dmitrieva D. K., Berezhnaya I. V., Serikova L. S. [et al.] Clinical effects of probiotics influence on the functioning of the “intestine – brain axis” in children, Medical Council., 16 (12), 152 (2022) https://doi.org/10.21518/2079-701X-2022-16-12-152-159.
- Oleskin A. V., Shenderov B. A. Biopolitical approach to rehabilitation medicine: the potential role of microbial neurochemistry, Vestnik of Rehabilitation Medicine, 2 (33), 60 (2013).
- Shenderov B. A., Sinitsa A. V., Zakharchenko M. M. Metabiotics: yesterday, today, tomorrow, 222 p. (Spb. Kraft, 2017).
- Oleskin A. V., Shenderov B. A. Probiotics, psychobiotics and metabiotics: problems and prospects. Physical and rehabilitation medicine, medical rehabilitation, 2(3), 233 (2020). doi: //doi.org/10.36425/rehab25811.
- Ivashkin V. T., Ivashkin K. V. Psychobiotic effects of probiotics and prebiotics, Ros. zhurn. gastroenterol., hepatol., koloproktol., 28 (1), 4 (2018). doi: 10.22416/1382-4376-2018-28-1-4-12.
- Parfenov A. I., Ruchkina I. N., Osipov G. A. Antibiotic-associated diarrhea, Expert. and Clin. Gastroenterol, 5, 92 (2002).
- Ugolev A. M. Theory of adequate nutrition and trophology, 271 р. (SPb., 1991).
- Lobzin Yu. V., Makarova V. G., Krovyakova E. R. Intestinal dysbacteriosis (clinic, diagnosis, treatment): A guide for doctors, 256 р. (St. Petersburg, 2003).
- Kennedy L., Cryan J. F., Dinan T. G., Clarke G. Pathway metabolism and the microbiota-gut-brain axis, Kynurenine Neuropharmacology, 112, 399 (2017).
- Friedland R. P., Alzheimer’s J. Mechanisms of molecular mimicry involving the microbiota in neurodegeneration, Dis., 45, 349 (2015).
- Rohrscheib C. E. Microorganisms that manipulate complex animal behaviours by affecting the host’s nervous system, Sci. Rev. Springer, 1, 133 (2013). doi: 10.1007/s40362-013-0013-8.



