CHANGES IN MORPHOMETRIC PARAMETERS OF RAT SPLEEN UPON ADMINISTRATION OF PROBIOTIC «PROBIVIT» UNDER DYSBIOSIS CONDITIONS
ИЗМЕНЕНИЕ МОРФОМЕТРИЧЕСКИХ ПОКАЗАТЕЛЕЙ СЕЛЕЗЕНКИ КРЫС ПРИ ВВЕДЕНИИ ПРОБИОТИКА «ПРОБИОВИТ» В МОДЕЛИ ДИСБИОЗА
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №4, 2024
Publication text (PDF):Download
UDK 612.335.2:663.18
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Yarmolyuk N. S., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
Dzheldubaeva E. R., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
Rzhevskaya V. S., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
Tumanyants K. N., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
Aedinova D. Z., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
Kovalchuk I. O., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-4-239-250
PAGES:from 239 to 250
STATUS:Published
LANGUAGE:Russian
KEYWORDS: probiotic “Probiovit”, dysbiosis model, antibiotic, spleen.
ABSTRACT (ENGLISH):
Most of the currently available research focuses on the metabolic properties of probiotics, while their immunomodulatory effects are still relatively poorly understood. In addition, one of the most frequent causes of disorders is exposure to antibacterial drugs. The aim of the work was to reveal changes in hematologic blood parameters and morphometric indices of the spleen in rats upon administration of probiotic “Probiovit” in the model of dysbiosis.
The experiments were performed on white sexually mature female rats of the Wistar line (n = 40), weighing 220–240 g with average motor activity and low emotionality, determined in the “open field” test. Four experimental groups were allocated, which were intragastrically administered 1 % probiotic solution (3 ml each) and broad-spectrum antibiotic doxycycline at a dose of 5 mg/kg for 14 days. The reliable level of differences between the experimental groups was assessed using Mann’s U-criterion.
The results of the study showed that when probiotic was administered against the background of dysbiosis, there was an increase in the number of leukocytes due to the fact that antibiotics can disrupt the balance of intestinal microbiota, which can “weaken” the immune system. Whereas probiotics help restore a healthy microbiota, which in turn can strengthen the immune system by increasing its activation, leading to increased production of white blood cells including lymphocytes, monocytes and granulocytes.
Probiotics may help reduce the negative effects of antibiotics on the immune system and microbiota. Which may be reflected in the structure of the spleen, including improvement in the ratio of red to white pulp, indicating restoration of overall health and immune function.
The study of the effect of probiotics on the immune system in conditions of dysbiosis is an urgent and promising area of research. This area has the potential not only to expand fundamental knowledge about the interaction between the microbiota and the immune system, but also to develop new therapeutic strategies and improve clinical practice. Understanding the effects of probiotics on the immune system may lead to the development of novel therapies for the treatment and prevention of diseases associated with immune system dysfunction. The results of such studies can be used to improve therapeutic regimens for infectious diseases, inflammatory conditions and immune disorders.
ВВЕДЕНИЕ
Использование пробиотиков является эффективным терапевтическим методом, который уменьшает негативные последствия для микробиоты макроорганизма в целом. Пробиотики – это живые микроорганизмы, которые могут быть полезными для здоровья человека, особенно для кишечника [1]. Показано, что пробиотические бактерии могут взаимодействовать и стимулировать иммунные клетки кишечника и комменсальную микрофлору, модулируя специфические иммунные функции и иммунный гомеостаз [2, 3]. Все больше данных показывает, что пробиотические бактерии обладают и иммуномодулирующими свойствами [4].
Одним из самых крупных органов лимфоидной системы, выполняющего функции лимфопоэза, накопления тромбоцитов, а также иммунную функцию, является селезенка [5–7]. На ее функционирование оказывают влияние различные факторы. Поэтому изучение влияния иммуностимуляторов на анатомо-гистологические особенности органов является актуальным. Исследования на животных моделях по воздействию пробиотиков при некоторых заболеваниях показали многообещающие результаты [8]. Введение состава из четырех различных пробиотических штаммов, т.е. Lactobacillus acidophilus, Lactobacillus Casei, Lactobacillus Reuteri, Streptococcus thermophilus и Bifidobacterium bifidum, может способствовать подавлению иммунных нарушений, таких как воспалительное заболевание кишечника, атопический дерматит и ревматоидный артрит.
При этом механизмы взаимодействия между иммунными клетками хозяина и пробиотиками описаны лишь частично. Примечательно, что большинство доступных в настоящее время исследований сосредоточено на метаболических свойствах пробиотиков, в то время как их иммуномодулирующее действие изучено еще относительно мало. Более того, также необходима идентификация новых и появляющихся штаммов пробиотиков с данными свойствами [9].
Кроме того, одной из наиболее частых причин нарушений является воздействие на нее антибактериальными препаратами. С целью создания модели дисбиоза, антибиотико-обусловленного стресса у животных в экспериментах используют комбинированное применение пробиотика с антибиотиком широкого спектра.
В связи с этим, целью данного исследования было выявить изменения морфометрических показателей селезенки у крыс при введении пробиотика «Пробиовит» в модели дисбиоза.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнялась в Центре коллективного пользования научным оборудованием «Экспериментальная физиология и биофизика» на кафедре физиологии человека и животных и биофизики в рамках программы исследований № АААА-А21-121011990099-6 «Физиологические механизмы биологического действия факторов разной природы и интенсивности» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского». Эксперименты выполнены на белых половозрелых крысах-самках линии Wistar, которые были специально выведены для лабораторных исследований. Общая выборка животных составила 40 здоровых крыс-самок массой 220–240 г. со средней двигательной активностью, которые, согласно литературным данным, составляют большинство в популяции и, соответственно, у них развивается наиболее типичная реакция на любое воздействие.
Исследуемые животные были разделены на 4 равноценные группы по 10 особей в каждой. Крысы первой группы «контроль» (К) содержались в стандартных условиях вивария, которым вводили эквивалентный объем питьевой воды. Второй группе «Антибиотик» (АБ) давали антибиотик широкого спектра действия доксициклин в дозе 5 мг/кг. Животным третьей группы «Пробиотик» (ПБ) давали 1 % раствор пробиотика «ПРОБИОВИТ®». Крысам четвертой группы «Комбинация» (АБ+ПБ) на протяжении всего эксперимента комбинированно давали антибиотик и пробиотик. Исследуемые вещества вводились животным внутрижелудочно путем использования желудочного орального зонда для кормления мышей и крыс, в соответствии с дозой 3 мл для каждого препарата. Кратность введения исследуемого препарата составляла 1 раз в сутки на протяжении 14 дней.
Все манипуляции с крысами, в рамках эксперимента, реализовывались с соблюдением требований разработки и реализации этапов доклинических исследований, каждый из которых проводился в соответствии с необходимыми условиями гуманного обращения с лабораторными животными.
Пробиотик готовился в виде молочнокислых заквасок и вводился в виде 1 % раствора в дозе 81gКОЕ/мл, которая в пересчёте на массу тела крысы соответствует максимальной дозе 3 мл [10].
Синтез тестируемого пробиотика проводился на кафедре ботаники и физиологии растений и биотехнологий ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского» под руководством Ржевской В. С. Микробный консорциум включал штаммы пробиотических микроорганизмов: Lactobacillus parabuchneri ВКМ В-3553D, Lactobacillus plantarum ВКМ В-3552D, Lactobacillus acidophilus ВКМ В-3563D, Enterococcus faecium ВКМ В-3551D, Brettanomyces bruxellensis ВКМ Y-3064D. Все штаммы микроорганизмов депонированы в Всероссийской коллекции микроорганизмов. Микробный консорциум получали путем совместного культивирования молочнокислых бактерий, энтерококка и дрожжей в жидкой питательной среде MRS следующего состава (г/л): пептон ферментативный – 10,0; экстракт пекарных дрожжей – 4,0; твин-80 – 1,0 мл; мясной экстракт – 8,0; глюкоза – 20,0; калий фосфорнокислый однозамещенный – 2,0; натрий уксуснокислый 3-водный – 5,0; аммоний лимоннокислый однозамещенный – 2,0; магний сернокислый 7-водный – 0,1; марганец хлористый 4-водный – 0,05; рН среды – 6,3; режим стерилизации: 0,75 атм, 20 мин. Культивирование микроорганизмов проводили в биореакторе Minifors 2 объемом 4 л (Minifors 2 НТ, Швейцария) при температуре 32 °С и 50 об/ мин в течение 3-х суток. Учет численности микроорганизмов в консорциуме проводили методом предельных разведений. Биологическая концентрация бактерий микробного консорциума составила 1,3∙109 КОЕ.
Животных выводили из эксперимента путем декапитации. Подготовка гистологического материала осуществлена в ЦКП «Молекулярная биология» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского». Гистологические препараты готовили в соответствие со стандартными методиками.
Фиксировали поперечные тонкие срезы толщиной 4 мкм на уровне ворот селезенки в 10 %-м забуференном формалине (рН 7,2) в течение 24 часов. После этого осуществляли дегидратацию и пропитку парафином в микроволновом гистологическом процессоре LOGOS (Mielstone, Италия) с использованием программы, рекомендованной производителем. Пропитанные парафином кусочки органов заливали в блоки, из которых изготавливали гистологические срезы. Срезы окрашивали гематоксилином и эозином [11].
Гистопрепараты просматривали под микроскопом DM2000 с объективами Plan5х, 10х и 40х и фотографировали камерой DFC295 (Leica). Морфометрические измерения выполняли на микрофотографиях в программе ImageJ с использованием шкалы TS-M1 PW106011 (1div=0.01mm) stage micrometer, используя метод наложения точечных морфометрических сеток.
Процентное соотношение белой/красной пульпы селезенки считали на увеличении 5х методом точек, обводя заданные области, и затем вычисляли процентное соотношение.
Анализ структур лимфатического узла (ЛУ) на гистопрепаратах проводили при увеличении 10х методом точек, обводя заданные области, и затем вычисляя процентное соотношение зон лимфоузла: герминативный центр (ГЦ), периартериальная, мантийная, маргинальная зоны.
Статистическая обработка полученных данных выполнялась с использованием прикладного программного документа «STATISTICA – 10.0» (StatSoft, США) с помощью непараметрических методов, оценка достоверного уровня различий между экспериментальными группами по U-критерию Манна-Уитни. Достоверными показателями считаются показатели меньше р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изменение процентного соотношения белая/красная пульпа у крыс при введении пробиотика на фоне дисбиоза
При анализе процентного соотношения белой и красной пульпы в селезенке крыс были выявлены некоторые изменения. Так на гистологических срезах селезенки крыс второй группы, подвергнутых введению пробиотика (ПБ) наблюдается увеличение белой пульпы до 69 % (р˂0,05), и уменьшение объема красной пульпы до 31 % (р˂0,05), что на 19 % отклоняется от данных контрольной группы (рис. 1, 2). Известно, что пробиотики обладают иммуностимулирующими свойствами и могут активировать иммунные клетки, такие как макрофаги и дендритные клетки, в селезенке. Это приводит к пролиферации лимфоцитов и увеличению белой пульпы [12]. Кроме того, пробиотики могут модулировать иммунный ответ, способствуя развитию толерантности и подавляя воспалительные реакции [13]. Это может привести к уменьшению относительного объема красной пульпы, которая в основном состоит из макрофагов, участвующих в фагоцитозе и воспалении (рис. 1).
У крыс третьей группы (АБ) также отмечается увеличение объема белой пульпы до 63 % (р˂0,05), и соответственно уменьшение объема красной пульпы до 37 % (р˂0,05), что на 13 % отклоняется от значений в контрольной группе животных (рис. 1, 2).
Как правило антибиотики ингибируют рост и размножение бактерий, что приводит к уменьшению лимфоцитарной реакции и, следовательно, к уменьшению белой пульпы в селезенке, но в наших исследованиях отмечено увеличение ее объема относительно красной пульпы, что может свидетельствовать о воспалительной реакции или иммунном ответе на инфекцию или повреждение, вызванные антибиотиками. Это может быть связано с активацией иммунных клеток в ответ на изменения в микробиоте или прямое токсическое действие антибиотиков.
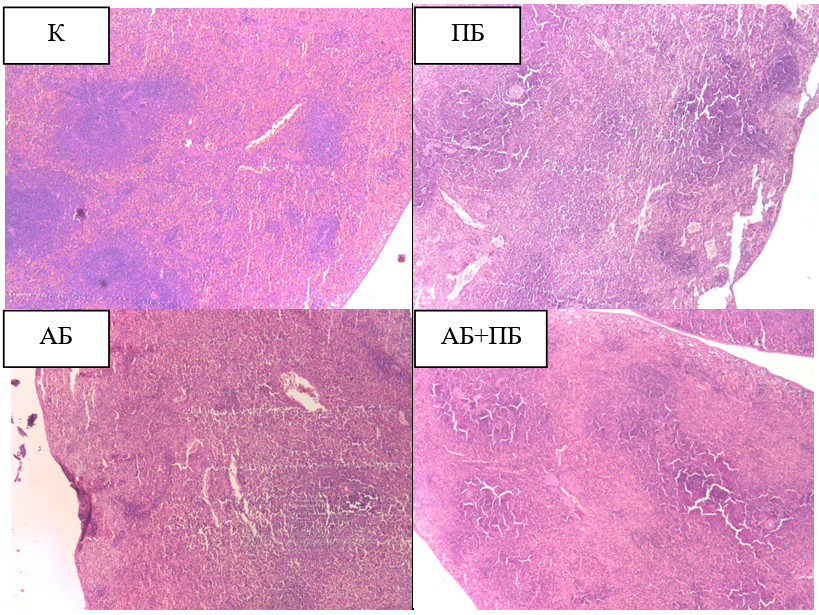
Рис. 1. Гистологические срезы селезенки крыс в контроле (К), при изолированном и комбинированном введении пробиотика (ПБ) и антибиотика (АБ) (ув. х5).
Рис. 2. Процентные соотношения белой и красной пульпы селезенки в исследуемых группах животных.
Примечание: достоверность различий относительно контрольной группы * – р˂0,05
У крыс четвертой группы (ПБ+АБ) на гистосрезах селезенки достоверно значимых изменений не обнаружено, данные процентного соотношения белой и красной пульпы практически совпадают со значениями контрольной группы (рис. 1, 2).
Таким образом, стабилизация объема белой пульпы при введении пробиотиков на фоне дисбиоза может свидетельствовать о нескольких важных аспектах. Пробиотики могут помогать уменьшать отрицательные эффекты антибиотиков на иммунную систему и микробиоту. Это проявляется в стабилизации или увеличении объема белой пульпы, что указывает на восстановление или поддержание нормальной иммунной функции. Кроме того, пробиотики могут способствовать восстановлению нормального состава кишечной микробиоты после антибиотикотерапии. Это может отражаться на структуре селезенки, включая улучшение соотношения красной и белой пульпы, и свидетельствует о восстановлении общего состояния здоровья и иммунной функции.
Комбинированное введение пробиотиков и антибиотиков может снижать воспалительные процессы, вызванные дисбиозом и прямым воздействием антибиотиков. Уменьшение воспаления может проявляться в уменьшении гиперплазии белой пульпы и стабилизации объема красной пульпы. Также можно предположить, что пробиотики способствуют поддержанию гомеостаза иммунной системы и предотвращению чрезмерных иммунных реакций, вызванных антибиотиками. Это может проявляться в нормализации соотношения красной и белой пульпы селезенки.
В целом, изменения соотношения красной и белой пульпы селезенки при комбинированном введении антибиотиков и пробиотиков могут свидетельствовать о восстановлении и поддержании иммунного и гематологического гомеостаза, уменьшении негативных эффектов дисбиоза и улучшении общего состояния организма.
Изменение структур лимфоузлов селезенки крыс при введении пробиотика на фоне дисбиоза
При анализе различных областей ЛУ селезенки крыс под воздействием пробиотика, антибиотика и их комбинации выявили значимые изменения в сравннии с показателями интактных животных.
У крыс второй группы ПБ отмечается увеличение площади маргинальной (на 66,7 %; р˂0,05), мантийной (на 29,4 %; р˂0,05) и периартериальной (на 120,8 %; р˂0,05) зон лимфоузлов селезенки по сравнению с данными контрольной группы. Это может свидетельствовать о стимуляции иммунной активности пробиотиком, усилении функции Т-лимфоцитов, которые концентрируются в периартериальной зоне (рис. 3, 4). Увеличение площади герминативного цента на 17,9 % указывает на активацию В-лимфоцитов и улучшение гуморального иммунитета.
У животных третьей группы (АБ) на фоне дисбиоза отмечается незначительное увеличение площадей маргинальной (на 11,1 %) и мантийной (на 11,8 %) зон, снижение площади герминативного цента на 45,1 % (р˂0,05) в сравнении с контролем, что отражает угнетение иммунной функции Площадь периартериальной зоны лифоузлов селезенки увеличивается на 66,7 % (р˂0,05) по сравнению с показателями крыс первой группы (К), что является компенсаторной реакцией на иммунный стресс (рис. 3, 4).
Рис. 3. Изменение площади различных областей ЛУ селезенки у крыс при введении пробиотика, антибиотика и их комбинации относительно данных контрольной группы.
Примечание: достоверность различий относительно контрольной группы * – р˂0,05; ** – р˂0,01.
У крыс четвертой группы (ПБ+АБ) площадь маргинальной зоны существенно не изменилась по сравнению с таковым показателей в контроле, что указывает на ослабленный эффект пробиотика в присутствии антибиотика. Вместе с тем, уменьшение на 39,1 % по сравнению с контролем площади мантийной зоны свидетельствует о компенсирующем разрушительном воздействии антибиотика на эту зону. Площадь периартериальной зоны уменьшается на 24,1 % относительно данных интактных животных (рис. 3, 4), вследствие подавлений иммунных процессов при комбинированном воздействии антибиотика и пробиотика. Площадь герминативного центра лимфоузлов селезенки снижается ещё сильнее (на 66,8 % (р˂0,01)), что указывает на серьёзное подавление активности В-лимфоцитов, несмотря на наличие пробиотика.
Таким образом, введение пробиотика вызывало у крыс увеличение площади всех зон лимфоузлов селезенки, что свидетельствует о его иммуностимулирующем эффекте. Наиболее заметное влияние наблюдается в периартериальной и маргинальной зонах. Введение антибиотика оказывало угнетающее воздействие на мантийную зону и герминативный центр, что указывает на снижение В-клеточной и общей иммунной активности. При этом в периартериальной зоне наблюдается относительное увеличение площади как компенсаторный механизм. При введении пробиотика на фоне дисбиоза показано, что пробиотик не компенсирует полностью негативное влияние антибиотика, особенно в мантийной зоне и герминативном центре, что указывает на ограниченную способность пробиотиков защищать иммунную систему в условиях дисбиоза.
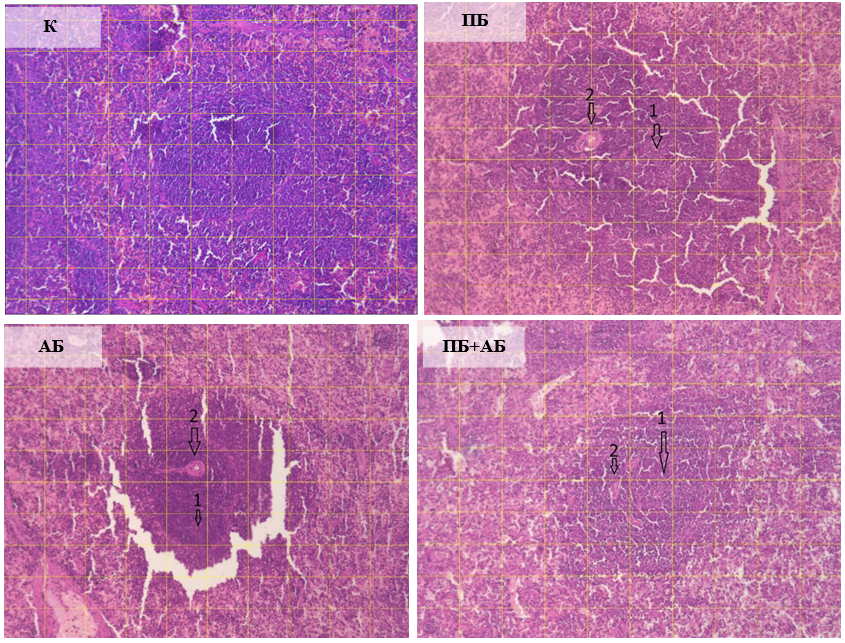
Рис. 4. Гистологические срезы селезенки крыс в контроле (К), при изолированном и комбинированном введении пробиотика (ПБ) и антибиотика (АБ) (ув. х10).
Эти данные подчёркивают как стимулирующий эффект пробиотиков на иммунную систему, так и разрушительное воздействие антибиотиков, особенно на гуморальный иммунитет.
Известно, что пробиотики стимулируют активацию и пролиферацию лимфоцитов, включая Т-клетки, В-клетки и естественные клетки-киллеры, что приводит к увеличению их популяции в лимфоузлах селезенки [14]. Кроме того, пробиотики модулируют иммунную систему, индуцируя выработку лимфокинов, таких как интерлейкины и интерфероны, которые способствуют дифференцировке и активации лимфоцитов в лимфоузлах селезенки. Также пробиотики могут снижать апоптоз лимфоцитов в лимфоузлах селезенки, что и приводит к увеличению популяции лимфоцитов и усилению иммунного ответа [15]. В некоторых случаях пробиотики могут стимулировать образование новых лимофузлов в селезенке, что приводит к увеличению общей площади лимфоидной ткани.
Тогда как введение антибиотика приводит к подавлению роста бактерий, соответственно стимуляция В-клеток в герминативных центрах снижается [16]. В отсутствие антигенной стимуляции В-клетки в герминативных центрах подвергаются апоптозу, что и приводит к сокращению площади герминативного центра. В ответ на уменьшение герминативных центров ткань селезенки перестраивается, это включает увеличение площади лимфоцитарных зон и уменьшение площади герминативных центров.
Изучение влияния пробиотиков на иммунную систему в условиях дисбиоза является актуальной и перспективной областью исследований. Это направление имеет потенциал не только для расширения фундаментальных знаний о взаимодействии микробиоты и иммунной системы, но и для разработки новых терапевтических стратегий и улучшения клинической практики. Понимание влияния пробиотиков на иммунную систему может привести к разработке новых методов лечения и профилактики заболеваний, связанных с дисфункцией иммунной системы. Результаты таких исследований могут быть использованы для улучшения схем терапии при инфекционных заболеваниях, воспалительных состояниях и иммунных нарушениях.
ЗАКЛЮЧЕНИЕ
- Проведен анализ морфометрических показателей селезенки крыс при введении пробиотика «Пробиовит» в условиях моделирования дисбиоза.
- При анализе процентного соотношения белой и красной пульпы в селезенке крыс были выявлены некоторые изменения. На гистосрезах селезенки крыс группы пробиотик наблюдается увеличение белой пульпы до 69 % (р˂0,05), и уменьшение объема красной пульпы до 31 % (р˂0,05), что на 19% отклоняется от данных контрольной группы. У крыс группы антибиотик также отмечается увеличение объема белой пульпы до 63 % (р˂0,05) и уменьшение объема красной пульпы до 37 % (р˂0,05), что на 13 % отклоняется от значений в контрольной группе животных. В группе комбинация достоверных изменений не обнаружено.
- При изучении на гистологических препаратах различных областей лимфатических узлов селезенки выявлено, что в группе пробиотик достоверно увеличиваются площади маргинальной зоны на 66 % (р˂0,05), мантийной зоны на 30 % (р˂0,05) и периартериальной зоны на 120,8 % (р˂0,01) относительно данных контрольной группы животных. В группе животных антибиотик отмечено увеличение площади периартериальной зоны на 67 % (р˂0,05) и уменьшение площади герминативного центра лимфатического узла селезенки на 45,1 % (р˂0,05). В группе животных комбинация отмечено уменьшение площади мантийной зоны на 39,1 % (р˂0,05) и герминативного центра лимфатического узла селезенки на 66,8 % (р˂0,01) относительно данных контрольной группы.
- Borovkova E. A., Alieva E. V., Frolova T. V. Study of biological properties and probiotic potential of intestinal lactobacilli, Acta Biomedica Scientifica, 1, 124 (2019).
- Yarullina D. R., Fakhrullin R. F. Bacteria of the genus Lactobacillus: general characterization and methods of work with them: Educational and methodological manual, 51 (Kazan University, 2014).
- Kihl P. [et al.] Effect of gluten-free diet and antibiotics on murine gut microbiota and immune response to tetanus vaccination, Public Library of Science One, 17(4), 1 (2022).
- Nyangahu D. D. [et al.] Antibiotic Treatment during Gestation Enhances Susceptibility to Mycobacterium tuberculosis in Offspring, Microbiology Spectrum, 10(6), 1 (2022).
- Zaslavskaya M. I. et al. Prospects for the use of bacteriocins of normal microbiota in antibacterial therapy (review), Modern Technologies of Medicine, 3, 136 (2019).
- Kozlov R. S., Golub A. V. Place doxycycline in modern clinical practice, Journal of MS, 9, 118 (2014).
- Kostyukevich O. I. Modern ideas about the intestinal microbiocenosis. Dysbacteriosis and its correction, Russian Medical Journal, 28, 2176, 1 (2007).
- Ouwehand A. [et al.] In vitro adhesion of propionic acid bacteria to human intestinal mucus. / A. Ouwehand, Dairy Science & Technology, 82 (1), 123 (2002).
- Aniagyei W. [et al.]Doxycycline Treatment of Mansonella perstans-infected Individuals Affects Immune Cell Activation and Causes Long-term T-cell Polarization, Clinical Infectional Disorders., 76 (3), 1399 (2023).
- Manual on experimental (preclinical) study of new pharmacological substances, Under the general editorship of Corresponding Member of RAMS, Professor R.U. Khabriev. – 2nd edition, revised and supplemented, 832 (Moscow: JSC “Izdatelstvo ‘Medicine’, 2005).
- Mustafina L. R., Gerasimov A. V., Potapov A. V. [et al]. Private course of histology: textbook: in 2 parts, 169 p. (Tomsk: SibGMU, 2022).
- Ermolenko E. I. Immunomodulatory effect of probiotic bacteria in diseases of the gastrointestinal tract // Bulletin of St. Petersburg University, 11, 4, 5 (2014).
- de Kivit S., Tobin M. C., Forsyth C. B., Keshavarzian A., Landay A. L. Regulation of intestinal immune responses through TLR activation: implications for pro- and prebiotics. Front Immunol., 5, 60 (2014).
- Topol I. A., Polyakova I. S., Elykova A. V. Role of intestinal microbiota in the regulation of immune reactions in the intestinal immune system under stress conditions and at modulation of its composition by introduction of antibiotics and probiotics. Journal of Microbiology, Epidemiology and Immunobiology, 99(6), 722 (2022) DOI: https://doi.org/10.36233/0372-9311-270_
- Wagner R. D., Johnson S. J. Probiotic bacteria prevent – induced suppression of lymphoproliferation in mice by an immunomodulatory mechanism, BMC Microbiol., 17(1), 77 (2017) doi: 10.1186/s12866-017-0990-x
- Ali M. S., Lee E. B., Quah Y., Sayem S. A. J, Abbas M. A., Suk K., Lee S. J., Park S. C., Vet Q. Modulating effects of heat-killed and live Limosilactobacillus reuteri PSC102 on the immune response and gut microbiota of cyclophosphamide-treated rats, 44(1), 1 (2024) doi: 10.1080/01652176.2024.2344765

