CHANGES IN THE PARAMETERS OF THE SKIN MICROCIRCULATION OF RATS UNDER THE INFLUENCE OF COORDINATION COMPOUNDS OF ACETYLSALICYLIC ACID WITH LITHIUM, POTASSIUM, CALCIUM AND MAGNESIUM IN A CHRONIC EXPERIMENT
ИЗМЕНЕНИЕ ПОКАЗАТЕЛЕЙ КОЖНОЙ МИКРОЦИРКУЛЯЦИИ КРЫС ПОД ВЛИЯНИЕМ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ С ЛИТИЕМ, КАЛИЕМ, КАЛЬЦИЕМ И МАГНИЕМ В ХРОНИЧЕСКОМ ЭКСПЕРИМЕНТЕ
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №2, 2024
Publication text (PDF):Download
UDK: 57.084: 547.19
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Chuyan E. N., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia
Mironyuk I. S., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia
Ravaeva M. Yu., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia
Cheretaev I. V., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia
Abdulkhairova Z. I. V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-2-232-253
PAGES:from 232 to 253
STATUS:Published
LANGUAGE:Russian
KEYWORDS: coordination compounds acetylsalicylic acid with metals, vasotropic activity; skin microcirculation., skin microhemodynamics
ABSTRACT (ENGLISH):
The effect of acetylsalicylic acid and its complexes with lithium, potassium, calcium, and magnesium at a dosage of 10 mg/kg was studied in a chronic experiment on parameters of skin microcirculation in rats. The study was conducted at the Center for Collective Use of Scientific Equipment “Experimental Physiology and Biophysics”, Department of Human and Animal Physiology, V. I. Vernadsky Crimean Federal University. Biological effects of acetyl salicylic acid, its complexes, lithium, potassium and calcium were investigated by intraperitoneal injection of rats at a dosage 10mg/kg. Skin microcirculatory parameters were measured using laser Doppler flowmetry on the Lazma-MC (RPE Lazma, Russia) device. Vasotropic reactions related to vasodilation persisted for 1–15 days after administration of acetylsalycylic acid. However, a longer administration of acetylsalicylic acid (15–20 days) leveled the differences with the control group of rats, indicating a decrease in vascular hyperemia. Repeated administration of an acetylsalicyclic acid complex with lithium did not produce statistically significant changes in microcirculatory parameters compared to the values in the control group, indicating the absence of vasodilation typical for acetylsalicylic acid. Repeated administrations of acetylsalycilic acid complexes with potassium, magnesium, and calcium resulted in vasodilation, with more pronounced effects than those observed during administration of pure acetylsalicylate, while vascular hyperaemia persisted for up to 20 days. The vasotropic effects of acetylsalycilate complexes with lithium, potassium and magnesium were modified by the metal component of the complex in a chronic study.
ВВЕДЕНИЕ
Ацетилсалициловая кислота (АСК) давно и повсеместно используется для лечения заболеваний сердечно-сосудистой системы [1, 2], однако имеет ряд побочных эффектов [3], что существенно ограничивает её применение. С целью снижения нежелательных осложнений и увеличения терапевтической эффективности и биодоступности проводятся исследования различных соединений АСК, в том числе с металлами [4–7], которые демонстрируют перспективность создания комплексов металл-АСК для получения эффективных лекарственных препаратов нового поколения.
В наших предыдущих исследованиях показаны вазо-, кардиотропные, противовоспалительные и анальгетические эффекты новосинтезированных координационных соединений АСК с металлами кобальта, цинка, никеля и марганца в дозах 5, 10 и 20 мг/кг при однократном и многократном применении
(20-кратное введение) [8–12], получены данные о влиянии на показатели электрокардиограммы сердца, артериальное давление (АД), частоту сердечных сокращений, кожной микроциркуляции (МЦ) крыс координационных соединений АСК с литием (Li+), калием (К+), кальцием (Ca2+) и магнием (Mg2+) при однократном введении в дозах 5, 10 и 20 мг/кг [13, 14]. Установлено, что выраженность развивающегося эффекта зависит не столько от действующей дозы тестируемых соединений, сколько от входящего в комплексное соединение с АСК металла. Поскольку в клинической практике показано применение АСК длительно (14 дней и более), а нашими экспериментальными исследованиями выявлена зависимость выраженности вазо- и кардиотропных эффектов координационных соединений АСК с металлами от продолжительности их введения, то актуальным является исследование динамики показателей кожной МЦ у крыс в течение 20-кратного введения АСК и её координационных соединений с литием (СLi+), калием (СК+), магнием (СMg2+) и кальцием (СCa2+) в дозе 10 мг/кг, что и явилось целью данного исследования.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальная часть работы выполнена в Центре коллективного пользования научным оборудованием «Экспериментальная физиология и биофизика» кафедры физиологии человека и животных и биофизики ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского».
Все процедуры, выполненные с участием экспериментальных животных, соответствовали ГОСТ 33044-2014 [15], этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям этического комитета ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского» (протокол № 10 от 06. 12. 2022 г.) и проводили согласно правилам лабораторной практики при проведении доклинических исследований [16]. План эксперимента составлен таким образом, чтобы сократить количество животных, используемых в исследованиях и ограничить вред, причиняемый животным во время экспериментов до минимума в соответствии с концепцией «3Rs» (reduction, refinement and replacement: замена, сокращение и усовершенствование), представленной в «The Principles of Human Experimental Technique» W.M.S. [17]. Данный подход исключает серьезную этическую проблему, связанную с физическими и/или психологическими страданиями животных.
Крысы («ФГУП «Питомник лабораторных животных «Рапполово») содержались в условиях вивария с естественным свето-темновым циклом при температуре 18–22°С на подстиле на основе початков кукурузы (ООО «Зилубаг», Россия) со свободным доступом к воде и полноценному гранулированному корму ЛБК-120 (ЗАО «Тосненский комбикормовый завод», Россия).
Тестируемые вещества синтезированы на кафедре общей химии под руководством профессора А. Н. Гусева. Комплексы получены в водной среде при взаимодействии эквимолярных количеств ацетилсалициловой кислоты ацетата или гидроксида соответствующего металла при температуре 36–40 оС. После изотермического упаривания получали комплексы с выходом 43–68 %, устойчивые на воздухе и хорошо растворимые в воде. По данным элементного анализа комплексы характеризуются соотношением металл-лиганд 1 : 2 (для двухвлентныъ металлов) и 1 : 1 для одновалентных. Учитывая, что для биологических исследований ключевым фактором является чистота объектов, с помощью рентгенофлуоресцентного анализа, проведенного в Ресурсном центре «Рентгенодифракционные методы исследования» ФГБОУ ВО «Санкт-Петербургский государственный университет», показано отсутствие примесей в полученных кристаллических образцах (химическая чистота составляла не менее 98,0 %).
Исследование острой токсичности координационных соединений АСК проводили на 100 крысах при однократном внутрибрюшинном введении тестируемых соединений в диапазоне доз от 5 до 500 мг/кг для координационных соединений и от 100 до 1000 мг/кг – для АСК. Координационные соединения АСК растворяли в физиологическом растворе и готовили фиксированные дозы (5, 20, 40, 80, 160, 300, 450, 600 мг/кг), которые вводили внутрибрюшинно однократно каждой группе экспериментальных животных в одной из заданных доз в объеме 0,2 мл. Перед введением тестируемых веществ, животных лишали ночью пищи, но не воды. Наблюдение за животными после введения фиксированных доз тестируемых веществ осуществляли не реже одного раза в течение первых 30 минут после введения дозы тестируемых соединений и в течение последующих 24 часов. В период наблюдений оценивали выживаемость животных, отмечая количество погибших в группах. На основании полученных данных оценивали острую токсичность соединений экспериментальным путем по параметрам ЛД20, ЛД50 согласно ГОСТ 12.1.007-76, ЛД100 – с помощью пробит-анализа [18].
Экспериментальным путём и с помощью пробит-анализа в исследованиях острой токсичности ацетилсалициловой кислоты (АСК) и её координационных соединений с литием (СLi+), калием (СK+) магнием (СMg2+) и кальцием (ССa2+) установлено, что ЛД20, при которой наблюдалась первая смертность животных, для АСК составила 500 мг/кг, для СLi+ – 165 мг/кг, для СК+ – 170 мг/кг, для СMg2+ – 240 мг/кг, для ССа2+ – 200 мг/кг. ЛД50, при которой наблюдалась смертность 50 % животных, для АСК составила 910 мг/кг, для СLi+ – 565 мг/кг, СК+ – 620 мг/кг, для СMg2+ – 500 мг/кг, для ССа2+ – 440 мг/кг. Абсолютная летальная доза LD100 для АСК составила 1530 мг/кг, для СLi+ – 1015 мг/кг, для СК+ – 1303 мг/кг, для СMg2+ – 900 мг/кг, для ССа2+ – 780 мг/кг. Полученные результаты позволили отнести АСК, СLi+, СK+, СMg2+ и СCa2+ к 3 классу опасности, т.е. умеренно токсичным веществам.
Исследование вазотропной активности координационных соединений АСК с металлами СLi+, СK+, СCa2+ и СMg2+ проводили на 50 половозрелых крысах-самцах линии Wistar массой 180–200 г., характеризующихся средней двигательной активностью в тесте «открытого поля», регистрируемой с помощью актиметра с двумя инфракрасными рамками, выполняющими роль датчиков движений и программным обеспечением Actitrack 2.0 (Pan Lab Harvard Apparatus», Испания), у которых, как показали наши исследования [19], развивается типичная реакция на действие факторов разной природы, в том числе химической, что позволяет минимизировать количество животных в экспериментальной группе.
Дизайн эксперимента (рис. 1). Животных после предварительного отбора разделили на 6 групп по 10 крыс в каждой. К первой группе (контрольной) относились животные, которым проводились внутрибрюшинные инъекции физиологического раствора (NaCl, 0,9 %) 0,2 мл. Животным 2 – 6-ой групп осуществляли внутрибрюшинные инъекции АСК, СLi+, СK+, СMg2+ и СCa2+ соответственно в дозе 10 мг/кг, которая соответствует терапевтической для человека [20], по 0,2 мл ежедневно в течение 20-ти дней в одно и то же время суток (с 8.00 до 11.00 часов).

Рис. 1. Дизайн экспериментального исследования.
Регистрацию показателей МЦ кожи крыс осуществляли с помощью метода лазерной допплеровской флоуметрии (ЛДФ), которая в настоящее время считается золотым стандартом неинвазивной оценки функции микрососудов кожи [21–23], прибором «Лазма-МЦ» (производство НПП «Лазма», Россия) на 1, 5, 10, 15, 20-е сутки наблюдения через 20 минут после введения соединений. Сигналы МЦ кожи демонстрируют нелинейный, периодический, колебательный характер, возникающий в результате различных физиологических воздействий.
В ходе исследования оценивали неосцилляторные (показатель перфузии (ПМ, перф. ед.); среднее квадратическое отклонение (СКО, перф. ед.); коэффициент вариации (Кв, %)) и осцилляторные показатели МЦ (нормированные амплитуды эндотелиального NO-зависимого (Аэ), миогенного (Ам), нейрогенного (Ан), дыхательного (Ад) и сердечного (Ас) ритмов), значения которых рассчитывали с помощью компьютерной программы обработки ЛДФ-граммы LDF 2.20.0.507WL. Нейрогенный (НТ) и миогенный (МТ) тонусы рассчитывали согласно [23, 24].
Для анализа эффективности биологического действия координационных соединений АСК с металлами по сравнению с молекулой-предшественницей АСК проводился расчет коэффициента эффективности (КЭ) по формуле:
КЭ = (Смет. – АСК)/АСК,
где Смет. – значения показателей, зарегистрированные у животных при введении CLi+, СK+, СMg2+ и СCa2+ (средние значения измерений в каждой экспериментальной группе); АСК – значения исследуемых показателей, зарегистрированные у животных при введении АСК.
Статистическую и графическую обработку экспериментальных данных осуществляли с помощью программ «Statistica 8.0» (StatSoft, США), «Microsoft Excel 2007». Применялись непараметрические методы статистики, поскольку распределение значений переменных отличалось от нормального. Достоверность статистических различий между контрольной и экспериментальными группами определяли с помощью критерия Манна-Уитни. Различия считались достоверными при p<0,05. С целью визуализации динамики вазотропных эффектов тестируемых соединений, значения показателей МЦ рассчитывали в % относительно значений контрольной группы, принятых за 100 %.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как показали результаты исследования, у животных контрольной группы на протяжении 20-дневного наблюдения значения исследуемых показателей МЦ были в пределах физиологической нормы и согласуются с результатами наших предыдущих исследований [9, 13].
Реакция микрососудов кожи крыс на введение АСК заключалась в достоверном изменении активности практически всех компонентов регуляции МЦ (рис. 2 А, Б, В). Так, в течение 1 – 15 суток наблюдения происходило статистически значимое увеличение амплитуд эндотелиальных колебаний (Аэ), наиболее выраженное на 82,18 % (р<0,05) после 10-кратного введения. Известно, что медленные колебания эндотелиального ритма ЛДФ-граммы обусловлены секреторной активностью эндотелия и синхронизированы с периодическим релизингом оксида азота (NO) эндотелием сосудов [22–24], который играет важную вазодилатирующую роль и обеспечивает физиологическую регуляцию тонуса гладких мышц сосудов. Поэтому наблюдаемое увеличение амплитуды Аэ отражает увеличение базального уровня секреции NO, способствующего вазодилатации микрососудов.
Подтверждением этому является и повышение в ЛДФ-граммах крыс 2 группы амплитуд колебаний эндотелиально-независимого происхождения, а именно нейрогенных осцилляций (Ан), наиболее выраженное после 10-кратного введения АСК (на 105,40 %; р<0,05) (см. рис. 2-Б). Нейрогенные колебания отражают активность со стороны симпатических адренергических нервных волокон на гладкомышечные стенки микрососудов и характеризуют уровень нутритивного кровотока [22–24]. Поэтому зарегистрированные в наших исследованиях повышение Ан свидетельствует об ограничении вазоконстрикторного контроля артериолярного тонуса симпатическими нервами и развитии вазодилатации, что подтверждаются снижением НТ прекапиллярных резистивных микрососудов, наиболее выраженное также после 10-кратного введения АСК (на 55,22 %; р<0,05) относительно контроля (рис. 3).
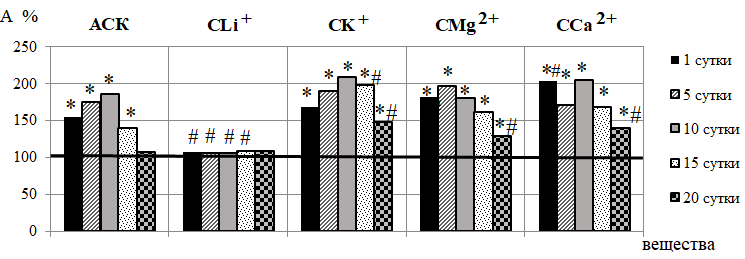
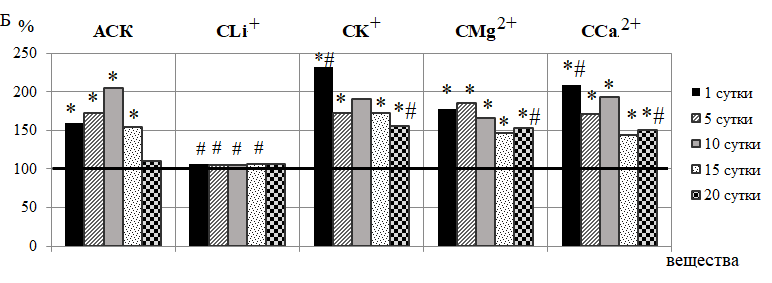
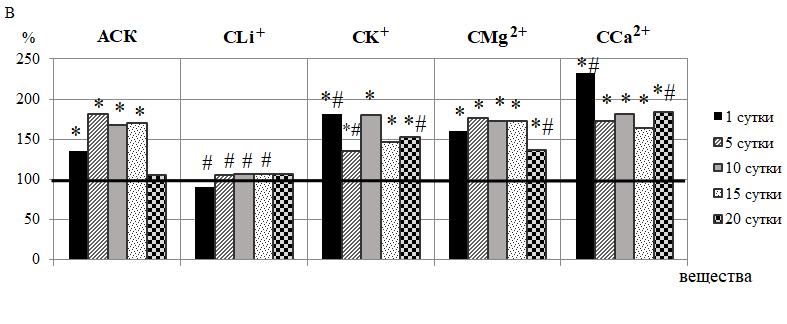
Рис. 2. Динамика амплитуд эндотелиальных (А), нейрогенных (Б) и миогенных (В) ритмов у животных в течение 20-кратного введения ацетилсалициловой кислоты (АСК) и ее координационных соединений с литием (СLi+), калием (СК+), магнием (СMg2+) и кальцием (СCa2+) (в % относительно значений в контрольной группе животных, принятых за 100 %, обозначенных на графиках горизонтальной линией).
Примечания: * – уровень достоверности различий по критерию Манна-Уитни относительно значений показателей в контрольной группе животных; # – уровень достоверности различий по критерию Манна-Уитни относительно значений показателей в группе животных, которым вводили ацетилсалициловую кислоту (АСК).
После введения АСК в течение 15 суток происходило также увеличение амплитуд миогенных ритмов (Ам) во все сроки наблюдения, особенно выраженное (на 81,60 %; р<0,05 относительно значений в контрольной группе крыс) на 5 день наблюдения (см. рис. 2-В), что сопровождается снижением МТ на 58,81 % (р<0,05) после 5-кратного введения (см. рис. 3).
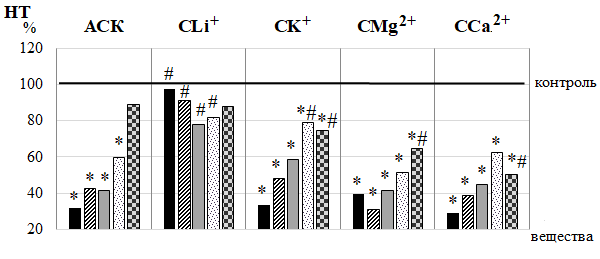
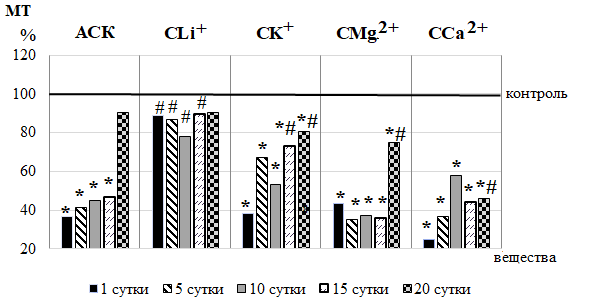
Рис. 3. Динамика нейрогенного (НТ) и миогенного (МТ) тонусов у животных в течение 20-кратного введения ацетилсалициловой кислоты (АСК) и ее координационных соединений с литием (СLi+), калием (СК+), магнием (СMg2+) и кальцием (СCa2+) (в % относительно значений в контрольной группе животных, принятых за 100 % и обозначенных на графиках горизонтальной линией).
Примечания те же, что на рис. 2.
Известно, что миогенные осцилляции, обусловленные периодической активностью гладкомышечных волокон артериол, приводящих к изменению диаметра их просвета (вазомоции), регулируют внутренний диаметр артерий и артериол независимо от других влияний. Они могут вызывать либо расширение сосудов, снижающее сосудистое сопротивление и увеличивающее кровоток, либо сужение сосудов, оказывающее противоположный эффект [25]. Эти колебания регистрируются не только на уровне прекапиллярных сфинктеров [26], но и на более проксимальных артериолах, что является приспособительным нейротрофическим механизмом, достоверно увеличивающим число функционирующих капилляров и направленность потока крови из артериол в капиллярное русло [23, 24]. Таким образом, существенное увеличение Ам при введении животным АСК свидетельствует об увеличении активности миоцитов прекапиллярных сфинктеров и прекапиллярных метартериол, увеличении количества функционирующих капилляров, дилатации прекапилляров и, как следствие, приводит к приоритетному току крови в нутритивное русло.
Наряду с повышением амплитуд внутрисосудистых тонусформирующих ритмов ЛДФ-граммы, произошло увеличение амплитуд ритмов, отражающих активность внесосудистых механизмов регуляции, а именно сердечных (пульсовая волна со стороны артерий) и дыхательных (присасывающие действие «дыхательного насоса» со стороны вен [22, 25, 26] колебаний в течение 1–15 суток наблюдения, особенно выраженное после 10-кратного введения АСК на 89,65 % (р<0,05) и 96,94 % (р<0,05) соответственно относительно контроля (рис. 4-А, Б).
Выявленные изменения со стороны регуляторных механизмов МЦ при введении АСК привели и к изменению показателя ПМ, отражающего усредненную величину перфузии в капиллярах, артериолах и венулах [23, 24], наиболее выраженному уже после однократного введения (на 79,11 %; р<0,05 относительно контроля; рис. 5), что явилось следствием усиления выработки эндотелием NO, снижения активности симпатических эфферентов, дилатации гладкомышечных прекапилляров, увеличения тока крови в нутритивном русле.
Регуляция кровотока в системе МЦ обусловлена тесным взаимодействием низкочастотных и высокочастотных компонентов спектра ЛДФ-граммы. По мнению [23], при ЛДФ–диагностике нарушений МЦ основное значение имеет комплексный анализ величины ПМ и состояния колебательных процессов, связанных, в том числе с артериальным притоком (Ас) и дыхательной модуляцией венулярного оттока (Ад). Увеличение амплитуды пульсовой волны при повышенных значениях ПМ, наряду со снижением вазомоторного тонуса и периферического сопротивления, свидетельствует об увеличении притока в микроциркуляторное русло артериальной крови со стороны артериол. Увеличение Ад указывает на снижение микроциркуляторного давления и/или ухудшение венозного оттока. Диагностическое значение имеет и величина Ас / Ад: если она больше 1, то в этих случаях при увеличении величины ПМ диагностируют артериальную гиперемию.
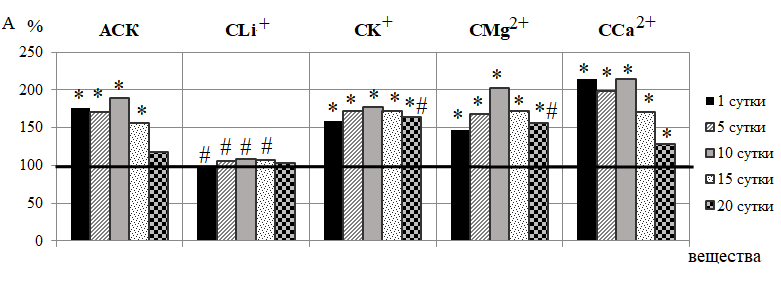
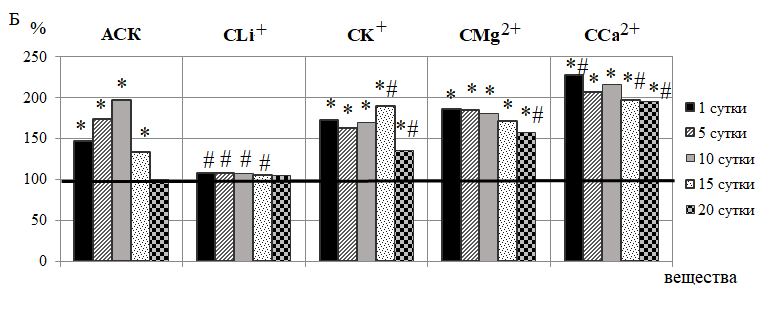
Рис. 4. Динамика амплитуд дыхательных (А) и пульсовых (Б) ритмов у животных в течение 20-кратного введения ацетилсалициловой кислоты (АСК) и ее координационных соединений с литием (СLi+), калием (СК+), магнием (СMg2+) и кальцием (СCa2+) (в % относительно значений в контрольной группе животных, принятых за 100 %, обозначенных на графиках горизонтальной линией).
Примечания те же, что на рис. 2.
Анализ полученных данных показал, что в течение 5–10 суток эксперимента после введения АСК отношение Ас / Ад было больше 1, а, следовательно, наблюдалась артериальная гиперемия. Однако более длительное введение АСК
(15–20 сутки) привело к снижению ПМ и амплитуд регистрируемых ритмов ЛДФ-граммы до уровня значений показателей в контрольной группе (рис. 2-А, Б, В), что свидетельствует о снижении гиперемии микрососудов. При этом величина Ас / Ад стала меньше единицы, что на фоне отсутствия снижения величины ПМ ниже контрольных значений и нормальных величинах Ас свидетельствует о венозном застое, что, вероятно, и наблюдалось при длительном введении АСК.
Таким образом, многократное введение АСК вызвало изменения кожной МЦ, которые зависели от длительности ее введения: в течение 1–15 суток наблюдения развивалась гиперемия микрососудов, однако более длительное введение
(15–20 сутки) привело к снижению гиперемии и развитию венозного застоя.
Под влиянием исследуемых координационных соединений наблюдались определенные изменения показателей тканевой МЦ, которые зависели от металла, входящего в состав соединений АСК-металл.
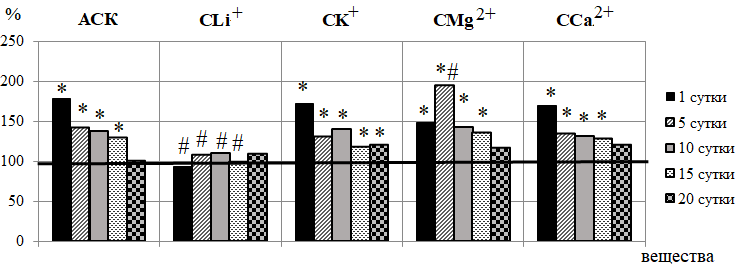
Рис. 5. Динамика показателя перфузии у животных в течение 20-кратного введения ацетилсалициловой кислоты (АСК) и ее координационных соединений с литием (СLi+), калием (СК+), магнием (СMg2+) и кальцием (СCa2+) (в % относительно значений в контрольной группе животных, принятых за 100 %, обозначенных на графиках горизонтальной линией).
Примечания те же, что на рис. 2.
Многократное введение координационного соединения АСК с литием не вызвало статистически значимых изменений относительно значений показателей ЛДФ-граммы контроля, что свидетельствует об отсутствии вазодилатации сосудов, характерной для АСК (см. рис. 2–5). Действительно, ПМ и амплитуды как внутрисосудистых, так и внесосудистых компонентов регуляции микрососудистого тонуса были ниже таковых у животных, которым вводили АСК, о чём свидетельствует отрицательный КЭ (рис. 6-А).
Многократное введение координационных соединений АСК с калием, магнием и кальцием привело к вазодилатации сосудов, причем выраженной в большей степени, чем у крыс при хроническом введении АСК, о чем свидетельствует рост регистрируемых показателей ЛДФ-граммы, как относительно значений этих показателей в контроле (см. рис. 2–5), так и относительно таковых у крыс 2 группы, которым вводили АСК (рис. 6-Б, В, Г). Необходимо отметить, что, в отличие от АСК, под влиянием СК+, СMg2+ и ССа2+ у животных на 20-е сутки исследования наблюдалась выраженная вазодилатация микрососудов, о чем свидетельствует рост ПМ и амплитуд регистрируемых ритмов (см. рис. 2–5) и отражает положительный КЭ (см. рис. 6). При этом выраженная артериальная гиперемия (Ас / Ад > 1) наблюдалась в течение 1–15 суток наблюдения после введения животным координационных соединений АСК с калием и магнием и в течение 1–20 суток после инъекций координационного соединения АСК с кальцием. На 20-е сутки наблюдения введение животным СК+, СMg2+ привело к снижению величины (Ас / Ад ≤ 1), однако, в отличие от АСК, это происходило на фоне высоких значений ПМ (см. рис. 5), Ас (см. рис. 4), которая прямо пропорциональна увеличению притока крови в системе МЦ за счет пульсового кровенаполнения [24] и Ад (см. рис. 4), которая свидетельствует о венозном полнокровии, что, по мнению [23], указывает на застойно-гиперемическую форму нарушения периферического кровообращения.
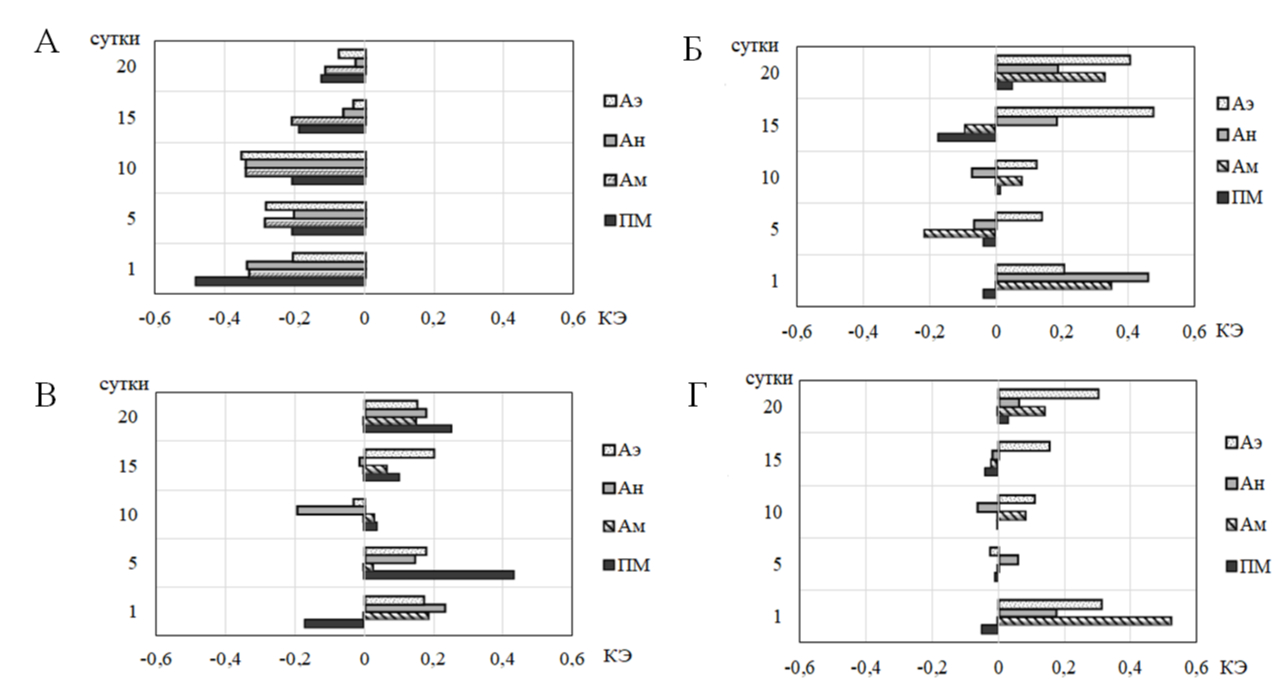
Рис. 6. Коэффициент эффективности (КЭ) показателей микроциркуляции, зарегистрированных у животных при многократном введении координационного соединения АСК с литием (Li+) (А), калием (СK+) (Б), магнием (CMg2+) (В), кальцием (CCa2+) (Г) относительно значений в группе АСК, принятых за 100 %.
Примечание: Аэ – амплитуда эндотелиальных ритмов; Ан – амплитуда нейрогенных ритмов; Ам – амплитуда миогенных ритмов; ПМ – показатель перфузии.
Таким образом, АСК и ее соединения с калием, магнием и кальцием в хроническом эксперименте вызывают увеличение перфузии, диаметра прекапилляров и количества функционирующих капилляров, снижение периферического сопротивления, а, следовательно, вазодилатацию микрососудов, увеличение притока крови в нутритивное микрососудистое русла на фоне уменьшения венозного оттока. Возможно, это связано со способностью АСК и данных координационных соединений, синтезированных на ее основе, блокировать циклооксигеназу тромбоцитов с последующим ингибированием синтеза из арахидоновой кислоты простагландинов (PGF2 и PGE2) клетками гладкой мускулатуры кровеносных сосудов, что приводит к угнетению функции тромбоксан-синтетазы и, в результате, уменьшению образования активного проагреганта тромбоксана А2, который является одним из основных индукторов агрегации тромбоцитов и мощным вазоконстриктором. При этом уровень простациклина (PGI2), мощного естественного вазодилататора и ингибитора адгезии тромбоцитов к эндотелию, действующему аналогично эндотелиальному оксиду азота, сохраняется достаточно высоким [2, 26], что и отражается в развитии вазодилатации и даже гиперемии. Однако эффекты координационных соединений АСК с литием, калием, кальцием и магнием на тканевую МЦ имеют определенные отличия и, по всей видимости, модифицированы металлом, входящим в состав соединения.
В
А
Соли лития (в основном в виде карбоната, цитрата, оксибутирата, сукцината, оротата, хлорида и сульфата) уже более 70 лет используются в психиатрической практике для лечения маниакальных и гипоманиакальных состояний различного происхождения (особенно при частых приступах), аффективных психозов, биполярных расстройств, в профилактике и лечении тяжёлых и резистентных депрессий [27–30]. Накопленный массив экспериментальных и клинических данных указывает на несомненные нейропротекторные и нейротрофические эффекты лития, проявляющиеся при ишемии головного мозга, инсульте, боковом амиотрофическом склерозе [31, 32]. В экспериментах показано, что литий уменьшает поведенческие и когнитивные нарушения у животных в моделях нейродегенеративных заболеваний (болезни Хантингтона, Альцгеймера, Паркинсона) [33].
Влияние лития и его солей на сердечно-сосудистую систему мало изучено. Показано, что приём препаратов лития способствует защите сосудов и мезенхимы печени при хронической ишемии печени и снижает повышенное АД в модели гипертонии [34], что связано с регуляцией биологической активности ренина, ангиотензина, норадреналина, альдостерона и натрийуретического пептида предсердий. Ионы лития оказывают также влияние на ацетилхолин-опосредованную вазодилатацию посредством воздействия на синтез оксида азота и поддержания баланса вазодилататорных и вазоконстрикторных простагландинов [35]. Установлено, что соли лития через мускариновые рецепторы ацетилхолина влияют на протеинкиназу С, ингибируя её активность [36]. Применение лития увеличивает уровень фактора роста эндотелия сосудов in vitro и in vivo [37].
Таким образом, имеющиеся немногочисленные клинические и экспериментальные данные свидетельствуют о способности лития вызывать снижение тонуса и вазодилатацию кровеносных сосудов. Однако наши исследования продемонстрировали отсутствие вазодилатации сосудов под влиянием координационного соединения АСК с литием. Более того, введение ионов лития в молекулу АСК снижало вазодилатирующие свойства молекулы предшественницы (АСК). Полученные данные, по-видимому, связаны с тем, что ионы лития обладают «пороговым» эффектом воздействия, терапевтический индекс препаратов лития весьма низок, а фармакологическая эффективность препаратов лития определяется их способностью вызывать стабильное повышение концентрации ионов лития в плазме крови и в эритроцитах. Это подтверждается экспериментами A.R. Dehpour с соавт. [38], в которых продемонстрировано два противоположных действия лития на эндотелиальную релаксацию брыжеечного ложа крысы: дозы 0,5 и 1 мМ ингибировали, а дозы 2 и 2,5 мМ, напротив, потенцировали релаксацию эндотелия. Поэтому имеющиеся в литературе данные по биологической и терапевтической эффективности лития в существенной мере зависят от дозы препарата. Следовательно, можно предположить, что отсутствие вазотропного эффекта координационного соединения АСК с литием связано с низким содержанием иона в молекуле.
В отличие от координационного соединения АСК с литием, многократное введение соединений АСК с калием, магнием и кальцием привело к вазодилатации сосудов, выраженной даже в большей степени, чем у крыс при хроническом введении АСК. Полученные данные согласуются с нашими исследованиями, в которых показано, что у крыс после однократного введения салицилатов калия, магния и кальция в дозах 5, 10 и 20 мг/кг происходили статистически значимые снижение АД [14] и гиперемия микрососудов кожи [13], и литературными данными.
Действительно, кальций, магний и калий занимают очень важное место в регуляции ритма сердца и тонуса сосудов, оказывая синергический эффект. Например, клиническими и экспериментальными исследованиями показана взаимосвязь между обеспеченностью натрием, калием, кальцием, магнием и уровнями АД. Пациенты с артериальной гипертензией имеют значительно более высокий уровень натрия и более низкие уровни кальция, магния и калия в крови и волосах [39, 40].
Известны некоторые механизмы, объясняющие влияние кальция на уровень АД, связанные с изменением секреции кальций-регулирующих гормонов, включая паратгормон и паратиреоидный гипертензивный фактор. Кальций-зависимые рецепторы, которые выделены в паращитовидных железах, гладкомышечных и эндотелиальных клетках сосудов, кардиомиоцитах и других органах, играют важную роль в регуляции тонуса сосудов и АД, стимуляция данных рецепторов приводит к увеличению продукции оксида азота, мощного вазодилататора. Ионы кальция оптимизируют натрий-калиевый баланс в организме, что может быть потенциальным механизмом снижения АД и, как следствие – расширения сосудов [41]. Следует отметить, что уменьшение потребления кальция с пищей приводит к увеличению концентрации внутриклеточного ионизированного кальция, что увеличивает тонус гладкомышечных клеток сосудов, периферическое сосудистое сопротивление и АД, и, наоборот, увеличение потребления кальция вызывает обратный эффект. Этот эффект проявляется благодаря тому, что витамин D взаимодействует со специфическими рецепторами, расположенными на клеточных мембранах, вызывает прессорный эффект, способствуя повышению вазоконстрикции и периферического сосудистого сопротивления [42, 43]. Следовательно, низкий уровень кальция в диете стимулирует синтез витамина D3, что сопровождается повышением АД и, наоборот, повышение потребления кальция снижает содержание витамина D3 и, тем самым, уменьшает сосудистое сопротивление и АД.
В экспериментальном исследовании артериол крыс в культуре установлено, что низкие уровни калия и магния в питательной среде нарушают регуляцию сосудистого тонуса, приводя к резким изменениям диаметра сосуда, причем сначала просвет сосуда сужался, затем избыточно расширялся. При этом дефицит магния дозозависимо усиливал вазоконстрикцию [44]. В экспериментальных исследованиях Shechter M. с соавторами [45] показано, что применение пероральных лекарственных средств Mg2+ и К+ пациентами с ишемической болезнью сердца способствовало увеличению эндотелий-зависимой вазодилатации плечевой артерии и найдена линейная корреляционная связь между внутриклеточной концентрацией магния и степенью вазодилатации.
Ионы калия обладают вазоактивностью, оказывая влияние на гладкую мускулатуру сосудов, что в свою очередь влияет на кровоток и АД. Установлено, что вызываемая, ионами К+ вазодилатация возникает в результате гиперполяризации эндотелиальных и гладкомышечных клеток вследствие активации натрий-калиевого насоса [46, 47] В рандомизированном контролируемом исследовании G. Wu и соавторами [48] показано, что дополнительный прием калия способствует усилению натрийуреза при отсутствии изменений активности ренина в плазме крови, снижению симпатической активности, улучшению эндотелий-зависимой вазодилатации, активации Na+/K+-АТФ-азы в адренергических нервных окончаниях и гладкой мускулатуры сосудов, усилению синтеза простациклинов и повышения эластичности стенки сосудов.
Исследования с магнием продемонстрировали его периферический (преимущественно артериолярный) сосудорасширяющий эффект при сохранении сердечной функции, не только косвенно за счет эндотелий-зависимого высвобождения оксида азота [49, 50], но и за счет его способности вызывать эндотелий-независимую вазодилатацию в результате прямого воздействия на гладкую мускулатура сосудов. Ионы Mg2+, являясь антагонистом кальция, блокируют кальциевые каналы, способствуют ингибированию поступления ионов кальция в клетки гладкой мускулатуры сосудов и приводят к кальций-зависимой вазодилатации [51–53]. Причем предполагают, что эндотелий-независимая вазодилатация зависит от концентрации Mg2+ в сосудах, а эндотелий-опосредованный сосудорасширяющий путь Mg2+, по-видимому, активируется независимо от его уровня в плазме [50]. Есть данные и о большой роли магния в поддержании оптимального тонуса сосудов за счет воздействия на активность эндотелина-1, обладающего мощными вазоконтрикторным и митогенным свойствами в отношении гладкомышечных клеток [54, 55]. Сосудорасширяющие эффекты магния связаны также и с другими механизмами, такими как увеличение деформируемости эритроцитов, снижение агрегации тромбоцитов, противовоспалительные эффекты и поддержание целостности эндотелия [56, 57]. Дополнительный прием препаратов магния способствует существенному улучшению функции эндотелия, а увеличение внеклеточного содержания ионов магния потенцирует действие некоторых эндогенных (аденозин, ряд простагландинов) и экзогенных (изопротеренол и нитропруссид) вазодилататоров [48].
Таким образом, вазотропные реакции координационных соединений АСК с литием, калием, кальцием и магнием в хроническом эксперименте связаны со способностью АСК к вазодилатации, однако модифицированы металлом, входящим в состав соединения. Можно предположить, что способность АСК к уменьшению тонуса кровеносных сосудов еще больше усиливается аналогичным действием ионов магния, калия и кальция, приводя к усилению вазодилатации и, напротив, снижается противоположным действием ионов лития.
Результаты этих экспериментов открывают перспективы дальнейших исследований, связанных с выявлением терапевтического потенциала координационных соединений, созданных на основе АСК.
ЗАКЛЮЧЕНИЕ
- Вазотропные реакции координационных соединений ацетилсалициловой кислоты с литием, калием, кальцием и магнием в хроническом эксперименте связаны со способностью АСК к вазодилатации, однако модифицированы металлом, входящим в состав соединения.
- Многократное введение ацетилсалициловой кислоты (10 мг/кг) вызвало изменения кожной микроциркуляции, которые зависели от длительности её введения: в течение 1–15 суток наблюдения развивалась гиперемия микрососудов, однако более длительное введение (15–20 сутки) привело к снижению гиперемии и развитию венозного застоя.
- Введение ионов лития в молекулу ацетилсалициловой кислоты снижает вазодилатирующие свойства молекулы предшественницы.
- Введение крысам координационного соединения ацетилсалициловой кислоты с кальцием привело к артериальной гиперемии, выраженной в большей степени, чем при введении молекулы-предшественницы (ацетилсалициловой кислоты), которая сохранялась на протяжении 1–20 суток наблюдения.
- Введение координационных соединений ацетилсалициловой кислоты с калием и магнием на протяжении 1–15 суток наблюдения привело к развитию гиперемии, выраженной в большей степени, чем на фоне введения ацетилсалициловой кислоты, однако на 20-е сутки развивалась застойно-гиперемическая форма нарушения периферического кровообращения.
- Wein T., Canadian Stroke Best Practice Recommendations: acetylsalicylic acid for prevention of vascular events, Cmaj. 192 (12), E302 (2020).
- Chuyan E. N., Mironyuk I. S., Cheretaev I. V., Ravaeva M. Yu., Grishina T. V., Physiological Mechanisms of Salicilates Action on the Cardiovascular System, I.M. Sechenov Russian Journal of Physiology,107 (3), 288 (2021).
- Mortensen B., Bifidobacterium breve Bif195 protects against small-intestinal damage caused by acetylsalicylic acid in healthy volunteers, Gastroenterology, 157, 3, 637 (2019).
- Obermoser V., Chlorinated cobalt alkyne complexes derived from acetylsalicylic acid as new specific antitumor agents, Dalton Transactions. 47, 12, 4341 (2018).
- Kowalski K., Insight into the biological activity of organometallic acetylsalicylic acid (aspirin) derivatives, Chem Plus Chem, 84, 4, 403 (2019).
- Fijałkowski Ł., Acetylsalicylic acid – primus inter pares in Pharmacology, Molecules, 27, 23, 8412 (2022).
- Bica K., Rijksen C., Nieuwenhuyzena M., In search of pure liquid salt forms of aspirin: ionic liquid approaches with acetylsalicylic acid and salicylic acid, Phys. Chem. 12, 2011 (2010).
- Chuyan E. N., Mironyuk I. S., Ravaeva M. Yu., Grishina T. V., Cheretaev I. V., Chernobai S. E., Changes in micro- and central hemodynamic parameters in rats under the action of acetylsalicylic acid and its coordination compounds with metals, Regional blood circulation and microcirculation, 20 (4), 75 (2021). https://doi.org/10.24884/1682-6655-2021-20-4-75-86.
- Ravaeva M. Yu., Chuyan E. N., Mironyuk I. S., Cheretaev I. V., Grishina T. V., Indicators of tissue microhemodynamics in rats exposed to acetylsalicylic acid and metal salicylates, J. Evol. Biohim. Phys., 57 (1), 71, (2021). https://doi.org/10.31857/S0044452921010083.
- Gusev A., Baluda Y., Braga E., Kryukova M., Kiskin M., Chuyan E., Ravaeva M., Cheretaev I., Linert W., Mn (II), Co (II), Ni (II) and Zn (II) salicylates: Synthesis, structure and biological properties studies, Inorganica Chimica Acta. 528, (2021). https://doi.org/10.1016/j.ica.2021.120606 .
- Mironyuk I. S., Biryukova E. A., Chuyan E. N., Asanova А.R., Сhanges in electrocardiogram parameters rats under the influence of acetylsalicylic acid and its complex compounds with metals, Scientific notes of the Crimean Federal University named after V. I. Vernadsky. Biology. Chemistry, 11(3), 25 (2021). https://doi.org/10.37279/2224-6444-2021-11-3-25-33.
- Ravaeva M. Yu., Cheretaev I. V., Chuyan E. N., Shekhmambetov N. R., Styagina D. V., Gruzinov E. N., Kuznetsova A. A., Kashirina A. V., Effect of salicylates Co2+, Ni2+, Zn2+, Mn2+, Li+ and Mg2+ on the pain sensitivity of male rats, Scientific notes of the Crimean Federal University named after V. I. Vernadsky. Biology. Chemistry, 7(73), 134, (2021).
- Chuyan E. N., Mironyuk I. S., Ravaeva M. Yu., Fahridinova Z. I., Martynjuk V. I., Gordienko A. S., Cheretaev I. V., Vasotropic effects of acetylsalicylic acid coordination compounds with metals of lithium, potassium, magnesium and calcium, Scientific notes of the Crimean Federal University named after V. I. Vernadsky. Biology. Chemistry, 8 (74), (2022).
- Chuyan E. N., Mironyuk I. S., Biryukova E. A., Pridatkо A. I., Ravaeva M. Yu., Grishina T. V., Asanova E. R., Asanova A.R., Indicators of the cardiovascular system of rats under the action of acetylsalicylic acid and its complex compounds with metals, Scientific notes of the Crimean Federal University named after V. I. Vernadsky. Biology. Chemistry, 7(73) , 271, (2021).
- GOST 33044-2014 Principles of good laboratory practice, Moscow: Standartinform, p. 12 (2019).
- Khabriev R. U., Guidelines for experimental (preclinical) study of new pharmacological substances, 832 p. (M.: Medicine, 2005).
- Expert Consensus Document on the use of antiplatelet agents. The Task Force on the use of antiplatelet agents in patients with atherosclerotic cardiovascular disease of the European Society of Cardiology, Eur. Heart J. (2004).
- Ardashev V. N., Kaljonova I. E., Ljapkova N. B., Dokazatel’naja medicina: obzor sovremennyh matematicheskih metodov analiza, 224 р. (M.: AVN UNMD Prezidenta RF, 2013).
- Nizkointensivnoe millimetrovoe izluchenie: nejroimmunojendokrinnye mehanizmy adaptacionnyh reakcij : monografija / E. N. Chujan, Je. R. Dzheldubaeva ; Ros. fond fundamental. Issled, 621 (Simferopol’ : Arial, 2020).
- Chuyan E. N., Mironyuk I. S., Ravaeva M. Yu., Cheretaev I. V., Grishina T. V., Ablaeva R. N., Dosedependent cardiotropic effects of acetylsalicylates, Scientific notes of the Crimean Federal University named after V. I. Vernadsky. Biology. Chemistry, 6(72), 4, 175 (2020). https://doi.org/ 10.37279/2413-1725-2020-6-4-175-196.
- Kralj L., Lenasi H. Wavelet analysis of laser Doppler microcirculatory signals: Current applications and limitations. Frontiers in Physiology. (2022).
- Silva H., Šorli J., Lenasi H., Oral glucose load and human cutaneous microcirculation: An insight into flowmotion assessed by wavelet transform, Biology, 10 (10) (2021).
- Krupatkin A. I., Sidorov V. V., Laser Doppler flowmetry of blood microcirculation, p. 254 (M.: Medicine, 2005).
- Kozlov V. I., Laser Doppler flowmetry in the assessment of the state and disorders of blood microcirculation (Moscow: RUDN, 2012).
- Jackson W.F. Myogenic tone in peripheral resistance arteries and arterioles: the pressure is on. Front. Physiology. 12, 699517 (2021).
- Mizeva I., Zharkikh E., Dremin V., Zherebtsov E., Makovik I., Potapova E., Spectral analysis of the blood low in the foot microvascular bedduring thermal testing in patients with diabetes mellitus, Res. 120, 13 (2018).
- Gin S. Malhi, Michelle Tanious, Optimal Frequency of Lithium Administration in the Treatment of Bipolar Disorder (англ.), Drugs journal. 25(4), 289 (2011). https://doi.org/ 10.2165/11586970-000000000-00000.
- Pronin A.V., Gogoleva I. V., Torshin I. Ju., Gromova O. A., Nejrotroficheskie jeffekty litija, aktual’nye dlja snizhenija ishemicheskih i nejrodegenerativnyh porazhenij mozga, Molodoj uchenyj, 2 (106), 365 (2016).
- Tondo L., Baldessarini R. J., Long-term lithium treatment in the prevention of suicidal behavior in bipolar disorder patients, Epidemiol.Psichiatr.Soc, 18, 179 (2009).
- Edwards S. J., Lithium or an atypical antipsychotic drug in the management of treatment-resistant depression: a systematic review and economic evaluation (англ.), Health Technol. Assess.: journal, 17(54), 1(2013). https://doi.org/ 10.3310/hta17540
- Xu J., Culman J., Blume A., Chronic treatment with a low dose of lithium protects the brain against ischemic injury by reducing apoptotic death, J. Stroke. 34 (5), 1287, (2003). https://doi.org/ 10.1161/01.STR.0000066308.25088.64.
- Xie C., Zhou K., Wang X., Blomgren K., Zhu C., Therapeutic benefits of delayed lithium administration in the neonatal rat after cerebral hypoxia-ischemia, PLoS One. 11 (9). (2014). https://doi.org/ 10.1371/journal.pone.0107192
- Forlenza O. V., De-Paula V. J., Diniz B. S., Neuroprotective Effects of Lithium: Implications for the Treatment of Alzheimer’s Disease and Related Neurodegenerative Disorders, ACS Chem Neurosci, 5(6), 443 (2014). https://doi.org/10.1021/cn5000309
- Bisogni V., Rossitto G., Reghin F., Padrini R., Rossi G. P., Antihypertensive therapy in patients on chronic lithium treatment for bipolar disorders, J. Hypertens, 34 (1), 20 (2016).
- Ostrenko K. S., Galochkinа V. Р., Koloskova E. M., Galochkin V. A., Organic lithium salt are effective anti-stress preparations of a new generation, Problems of biology of productive animal, 2, 5 (2017).
- Hillert M. H., Imran I., Zimmermann M., Lau H., Weinfurter S., Klein J., Hillert M. H., Dynamics of hippocampal acetylcholine release during lithium-pilocarpine-induced status epilepticus in rats, J. Neurochem, 131 (1), 42 (2014).
- Guo S., Arai K., Stins M. F., Chuang D. M., Lo E. H., Lithium upregulates vascular endothelial growth factor in brain endothelial cells and astrocytes, Stroke, 40 (2), 652. (2009). https://doi.org/ 10.1161/STROKEAHA.108.524504
- Dehpour A. R., Dehpour P. Ghafourifar J., Samenian A. R., The effect of lithium on endothelial-dependent relaxation in rat isolated aorta, Gen Pharmacol, 26 (1995).
- Panhwar A. H., Kazi T. G., Afridi H. I., Distribution of potassium, calcium, magnesium, and sodium levels in biological samples of Pakistani hypertensive patients and control subjects, Clin Lab, 60(3). 463 (2014).
- Kass L., Weekes J., Carpenter L., Effect of magnesium supplementation on blood pressure: a metaanalysis, Eur J Clin Nutr, 66(4), 411 (2012). https://doi.org/ 10.1038/ejcn.2012.4
- Kolomiec V. V., Simbirceva K. Ju., Scecevich D. U., Ocenka sostojanija obmena kal’cija i sinteza oksida azota u bol’nyh arterial’noj gipertenziej v sochetanii s osteoartrozom, Ukrainskij revmatologicheskij zhurnal, 25, 26 (2006).
- Peterlink M., Cross H.S. Vitamin D and calcium deficits predispose for multiple chronic diseases Eur. J Clin. Invest, 35(5). 290 (2005).
- Li Y. C., Kong J., Wei M., 1,25-Dihydroxyvitamin D3 is a negative endocrine regulator of the renin-angiotensin system, J Clin Invest, 1101, 229 (2002).
- Murata T., Horiuchi T., Goto T., Vasomotor response induced by change of extracellular potassium and magnesium in cerebral penetrating arterioles, Neurosci Res, 70(1). 30 (2011). https://doi.org/ 10.1016/j.neures.2011.01.01
- Shechter M., Oral magnesium therapy improves endothelial function in patients with coronary artery diseases, Circulation, 102(19), 2553 (2000).
- Francis J. H., Vanhoutte P. M., Feletou M., Role of potassium in regulating blood flow and blood pressure Am J Physiol Regul Integr Comp Physiol, 290(3). R546 (2005). https://doi.org/10.1152/ajpregu.00491.2005
- Kim M. Y., Contribution of Na+-K+ pump and Kir current to extracellular pH-dependent changes of contractility in rat superior mesenteric artery, Am. J. Physiol. Heart Circ. Physiol, 289, 792 (2005).
- Wu G., Tian H., Han K., Potassium magnesium supplementation for four weeks improves small distal artery compliance and reduces blood pressure in patients with essential hypertension, Clin ExpHypertens, 28(5). 489 (2006). https://doi.org/10.1080/10641960600798705.
- Wang D., Zong-Xiang L., Dong-Mou J., Yan-Zhong L., Xin Wang L.,Yi-Ping, Magnesium ions improve vasomotor function in exhausted rats, PLOS ONE, 18(2) (2023) https://doi.org/10.1371/journal.pone.0279318
- Haenni A., Johansson K., Lind L., Lithell H., Magnesium infusion improves endothelium-dependent vasodilation in the human forearm, Am J Hypertens, 15, 10 (2002). https://doi.org/10.1016/S0895-7061(01)02225-7.
- Pranskunas A., Vellinga N. A., Pilvinis V., Microcirculatory changes during open label magnesium sulphate infusion in patients with severe sepsis and septic shock, BMC Anesthesiol. 11 (1), 12 (2011). https://doi.org/10.1186/1471-2253-11-12
- Quelly J., Qiu Y., K+-induced vasodilation in the rat dependent on the endothelium and activation of K+channels, Eur. J. Pharmacal, 508, 193(2005).
- Akarachkova E. S., Magnesium in the treatment and prevention of cerebrovascular diseases, Russian medical journal, 8, 8 (2020).
- Berthon N., Laurant P, Hayoz D., Magnesium supplementation and deoxycorticosterone acetate-salt hypertension: effect on arterial mechanical properties and on activity of endothelin-1, Can J Physiol Pharmacol, 80 (6), 553 (2002).
- Whitworth J. A., Effect of oral magnesium supplementation on blood pressure in deoxycorticosterone acetate-induced hypertension in rats, J. Hypertens, 18(12), 1877 (2000).
- Mazur A., Maier J. A., Rock E., Gueux E., Nowacki W., Rayssiguier Y., Magnesium and the inflammatory response: potential physiopathological implications, Arch Biochem Biophys, 458 (1), 48 (2007). https://doi.org/10.1016/j.abb.2006.03.031.
- Dong J. F., Cruz M. A., Aboulfatova K., Martin C., Choi H., Bergeron A. L., Martini S. R., Kroll M. H., Kent T. A., Magnesium maintains endothelial integrity, up-regulates proteolysis of ultra-large von Willebrand factor, and reduces platelet aggregation under flow conditions, Thromb Haemost, 99(3), 586 (2008).



