MALL MAMMALS OF THE CRIMEA: ECOLOGICAL AND EPIZOOTOLOGICAL ASPECTS IN THE DYNAMICS OF DIFFERENT YEARS
МЕЛКИЕ МЛЕКОПИТАЮЩИЕ КРЫМА: ЭКОЛОГИЧЕСКИЕ
И ЭПИЗООТОЛОГИЧЕСКИЕ АСПЕКТЫ В РАЗНОГОДИЧНОЙ ДИНАМИКЕ
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №4, 2024
Publication text (PDF):Download
UDK: 599.32/35:614.449
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Vladychak V. V., FGKUZ “Anti-plague Station of the Republic of Crimea” of Rospotrebnadzor, Simferopol, Republic of Crimea, Russia
Kobechinskaya V. G., Institute of Biochemical Technologies, Ecology and Pharmacy (SP) Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
Yakunin S. N., FGKUZ “Anti-plague Station of the Republic of Crimea” of Rospotrebnadzor, Simferopol, Republic of Crimea, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-4-40-57
PAGES:from 40 to 57
STATUS:Published
LANGUAGE:Russian
KEYWORDS: small mammals, landscape zones, zoonotic infections, distribution dynamics, Crimea.
ABSTRACT (ENGLISH):
The results of almost 240 years of research on the fauna of the Crimea are of great scientific and historical interest in studying the modern and historical theriofauna of the peninsula, especially when comparing these data with modern works in this field. Most small rodents contribute to the circulation of pathogens of many zoonotic infections, being the main feeders of a variety of blood-sucking arthropods. That is why the number of publications both in the Russian Federation and abroad in this field is so significant.
Our research was devoted to the study of the multiyear dynamics of the distribution of these species over the period 2015–2023 in the Crimea. A total of 4142 rodent specimens were captured and 3568 laboratory studies were conducted, which allowed us to obtain representative data on both the faunal prevalence of species and their epidemiological role as carriers and vectors of diseases. The dominant species among this group in the mountainous landscape-geographical zone are: steppe mouse (S.witherbyi) – ID 53.9 %, common (аltai) vole (M. arvalis (obscurus) – ID 21.6 %, yellow-throated mouse (S. flavicollis (tauricus) – ID 12.5 %, public vole (M. socialis) – ID 8.8 %, house mouse (M. musculus) – ID 2.1 %, small forest mouse (S. uralensis) – ID 0.3 %, barrow mouse (M. spicilegus) – ID 0.2 %, gray hamster (Cricetulus migratorius) – ID 0.2 %, other species were isolated.
The most common species of theriofauna in the foothill zone are the following animals: steppe mouse (S. witherbyi) – ID 37.5 %, public vole (M. socialis) – ID 27.1 % and common (аltai) vole (M. arvalis (obscurus) – ID 10.3 %, house mouse (M. musculus) – ID 10.1 %, small white tooth (C. suaveolens) – ID 3.85 %, small forest mouse (S. uralensis) – ID 3.1 %, barrow mouse (M. spicilegus) – ID 2.9 %, yellow-throated mouse (S. flavicollis (tauricus) – ID 2.9 %, gray rat (R. norvegicus) – ID 2.63 %, gray hamster (Cricetulus migratorius) – ID 0.23 %, other species are isolated.
The most common species of the steppe zone of Crimea: steppe mouse (S. witherbyi) – ID 30.7 %, house mouse (M. musculus) – ID 24.4 %, public vole (M. socialis) – ID 21.9 %, small white tooth (C.suaveolens) – ID 14.5 %, gray rat (R. norvegicus) – ID 12.8 %, кurgan mouse (M. spicilegus) – ID 3.6 %, gray hamster (Cricetulus migratorius) – ID 1.3 %, common (аltai) vole (M. arvalis (obscurus) – ID 1.1 %, white-bellied whitethroat (C. leucodon) – ID 0.72 %. common hamster (Cricetus cricetus) – ID 0.3 %, yellow-throated mouse (S. flavicollis (tauricus) – ID 0.1 %, southern mouse (S. lorigera) – ID 0.1 %.
According to our research, carriers of zoonotic leptospirosis infections are: common (аltai) vole (M. arvalis (obscurus), yellow-throated mouse (S. flavicollis (tauricus), steppe mouse (S. witherbyi). the social vole (M. socialis). Only in the foothill and steppe zones, the following were identified as carriers of this disease: kurgan mouse (M. spicilegus), small white tooth (C.suaveolens), house mouse (M. musculus), gray rat (R. norvegicus), common hamster (Cricetus cricetus). Species that support the circulation of tularemia pathogens: lesser whitethroat (C. suaveolens), social vole (M. socialis), steppe mouse (S. witherbyi), house mouse (M. musculus), barrow mouse (M. spicilegus), gray rat (R. norvegicus). The main reservoirs of the causative agent of hemorrhagic fever with renal syndrome, called hantavirus infection, are: common (аltai) vole (Microtus arvalis (obscurus), public vole (M. socialis), brownie (M. musculus) and steppe (S. witherbyi) mice. Leading the transfer whitethroat (C. suaveolens), social vole (M. socialis), steppe mouse (S. witherbyi), house mouse (M. musculus), barrow mouse (M. spicilegus), gray rat (R. norvegicus). The main reservoirs of the causative agent of hemorrhagic fever with renal syndrome, called hantavirus infection, are:common (аltai) vole (Microtus arvalis (obscurus), public vole (M. socialis), brownie (M. musculus) and steppe (S. witherbyi) mice. The leading carriers of ixodic tick-borne borreliosis (ICB) are: yellow-throated mouse (S. flavicollis (tauricus), house mouse (M. musculus), gray rat (R. norvegicus), common hamster (Crickets cricetus), etc.
The noted changes in the landscapes of the peninsula, both natural and anthropogenic (climate warming, the growth of cities and towns, agricultural and recreational development of territories, etc.) contribute to their significant transformation, which leads to a change in the natural habitats of small mammals and the territorial occurrence of various zoonotic infections, respectively. Conducting annual studies on the number of theriofauna populations in the physico-geographical regions of the Crimea, taking into account their zoonosis, makes it possible to counteract the deterioration of the epidemiological situation on the peninsula with an annual increase in the tourist flow of vacationers.
ВВЕДЕНИЕ
Основоположником изучения териофауны полуострова можно считать первого вице-губернатора Крыма К. И. Габлица, который в 1783 году составил список млекопитающих из четырнадцати видов, обитающих на этой территории [1]. К. Ф Кеслер неоднократно посещал Крым в течении 1858–1880 гг. для изучения крымской фауны, он инициировал учреждение комитета по детальному изучению природы полуострова при Санкт-Петербургском обществе естествоиспытателей. С этой целью в Таврическую губернию был направлен для исследования фауны зоолог А. М. Никольский. Его сводка «Позвоночные животные Крыма» (1891) содержала систематический обзор всех видов этой обширной группы, обитающих в Крыму, поэтому её можно рассматривать как итог более чем столетнему периоду в изучения фауны полуострова [2]. В 1885 году вышла работа Ф. П. Кеппена, в которой он выдвинул гипотезу о близости фауны Кавказа и горного Крыма, которая оказала влияние на зоогеографические взгляды зоологов, работавших здесь впоследствии [3]. В 1893 году на должность губернского энтомолога был назначен С. А. Мокржецкий, который инициировал учреждение Симферопольского естественно-исторического музея с созданием коллекционных фондов местной фауны. Фрагменты териологической части этой коллекции в настоящее время хранятся в Зоологическом институте РАН г. Санкт-Петербург. В дореволюционный период, благодаря исследователям С. И. Огневу и супругам В. и Э. Мартино, были собраны серийные коллекционные материалы, позволившие провести в последствии систематизацию крымских млекопитающих [4, 5].
Известный исследователь фауны Крыма И. И. Пузанов в своих публикациях упоминает многих ученых, работавших в области систематики, экологии, болезней и паразитов млекопитающих (Б. И. Волянский, А. К. Даль, А. Р. Штамм, Э. И. Шерешевский, М. И. Котовщикова, И. Я. Поляков, Д. И. Рухлядев, С. К. Алгульян, В. Г. Гептнер, М. И. Саввина, А. А Бируля, В. И. Громов, Б. С. Виноградов и дp.) [6, 7].
В послевоенный период зоологические исследования териофауны юга Украины и Крыма проводились С. А. Афанасьевым и Г. И. Билык, Ю. В. Авериным, С. Л. Делямуре, Ф. Н. Вшивковым, А. Н. Киселевым [8, 9]. В 60-е годы проводилось детальное изучение экологии грызунов в Крымском заповеднике и других ландшафтно-климатических зонах полуострова (А. А. Кормилицин, В. В. Кормилицина, З. С. Ходыкина, Д. Д. Завалеева, А. И. Константинов, В. П. Дмитриева, К. К. Панютин и др.) [10].
Таким образом, результаты почти 240-летних исследований фауны Крыма представляют большой научный и исторический интерес при изучении современной и исторической териофауны полуострова, особенно при сравнении этих данных с современными работами в этой сфере.
Большинство мелких грызунов способствуют циркуляции возбудителей многих зоонозных инфекций, являясь главными прокормителями разнообразных кровососущих членистоногих [11–16]. Поэтому так значителен удельный вес исследований по морфо-экологической группе Micromammalia в общем объеме зоологических и экологических исследований, посвященных фауне наземных экосистем как в Российской Федерации [17–20 и др.], так и за рубежом [21–26 и др.]
Для анализа современного состояния фауны мелких млекопитающих и динамики этих сообществ в Крыму необходимо учитывать интенсивность антропогенного влияния на очаги их природных местообитаний. В 60–70-е годы ХХ века насаждение в степном регионе значительного количества лесополос, распашка русел малых рек и балок, введение в строй мощной оросительной системы и создание на больших площадях орошаемого земледелия привели к серьезным биотопическим изменениям ранее засушливых экосистем. Введение в культуру риса и строительство рисовой системы, резкое расширение сельхозугодий привели к смене доминирующих видов в степной части полуострова [13]. Увеличение площади антропогенного воздействия на природу при повышении среднегодовых температур за последние 30 лет на 1,3 0С выше среднемноголетних данных в Крыму в рамках глобального потепления климата планеты [27] вынуждает виды, ранее занимаемые этот ареал обитания, перемещаться на новые территории либо приспосабливаться к сложившимся условиям обитания, т.е. возрастает вероятность частоты возможного контакта их с человеком [14].
Вопросы приуроченности обитаний различных видов мелких млекопитающих по природно-климатическим зонам полуострова с учетом возрастающего с каждым годом антропогенного воздействия на ландшафты Крыма важны, т.к. меняется под влиянием комплекса факторов их территориальная приуроченность. Поэтому так необходимы регулярные ежегодные исследования за динамикой численности популяций этих видов для выявления изменения границ их существования, а, следовательно, и смещений зон природных очагов инфекций, что обусловило выбор темы исследования и её актуальность.
МАТЕРИАЛЫ И МЕТОДЫ
Отбор материала из природных мест обитания мелких млекопитающих проводился по всей территории Крымского полуострова в период с 2015 г. по 2023 годы. Исследования осуществлялись на базе Федерального государственного казенного учреждения здравоохранения «Противочумная станция Республики Крым» Роспотребнадзора, согласно методическим рекомендациям «Отлов, учет и прогноз численности мелких млекопитающих и птиц в природных очагах инфекционных болезней». МР 3.1. 0211-20 [28]; «Сбор, учет и подготовка к лабораторному исследованию кровососущих членистоногих в природных очагах опасных инфекционных болезней». МУ 3.1.3012-12 [30]; Санитарно-эпидемиологических правил при работе с микроорганизмами I-II групп патогенности, СП 1.3.3118-13 [31] и с соблюдением требований СанПин 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней» [29]. Все работы выполнялись в соответствии с законами и иными нормативными правовыми актами Российской Федерации, действующими в сфере эпидемиологии и экологии, основ трудового законодательства.
Латинские наименования животных приводятся по сводке А. А. Лисовского и др. [32].
Отлов мелких млекопитающих (грызунов, насекомоядных) осуществлялся мышеловками, плашками (давилками Геро) с трапом или без него [33]. Млекопитающих средней величины (крыс) отлавливали дуговыми капканами. Для вылова мелких млекопитающих живыми применяли разного вида живоловки: сетчатого или ящичного типа [34, 35].
Минимальной учетной единицей для каждой стации обитания видов считали 100 ловушко/суток. Учитывалось число зверьков (общее и по видам), попавших в такое количество ловушек. Для каждого вида вычислялся индекс доминирования (далее ИД), отображающий отношение числа особей какого-либо вида к их общему числу в биоценозе по годам и по средним показателям, согласно МУ 3.1.3012 [30]:
Di = ni / N*100,
где Di – индекс доминирования, ni – число особей вида, N – число отловленных экземпляров.
Собранный в экспедиционных условиях материал снабжался этикеткой с детальным описание мест отлова, даты, общего числа пойманных животных и по их видовому составу. Все сборы помещали в контейнеры и отправляли в лабораторию учреждения. В ней специалистами проводился детальный анализ с выявлением спектра заболеваний этих животных согласно существующим методическим рекомендациям [30].
Все млекопитающие в лаборатории исследовались на наличие возбудителей при помощи полимеразной цепной реакции (ПЦР), иммуноферментного анализа (ИФА) и реакции прямой гемагглютинации (РПГА) [28–31]. Данные методы позволяют выявлять у мышевидных грызунов возбудителей туляремии, лептоспироза, иксодовых клещевых боррелиозов (ИКБ), вирусов Крымской-Конго геморрагической лихорадки и клещевого энцефалита (КВЭ). Для выявления антигена вируса геморрагической лихорадки с почечным синдромом образцы исследовались методом ИФА. Выявление туляремийных антител проводились серологическим методом в реакции непрямой гемагглютинации (РНГА). Полученные результаты обрабатывались стандартными статистическими методами с ошибкой средней ± 7–10 % [33].
Полученные данные были обобщены с использованием ГИС технологий и создания карт [37]. Это эффективный инструмент сбора, хранения, анализа, графической визуализации географических данных и связанной с ними полученной информации об исследуемых объектах. Современный анализ непространственных данных дает возможность совмещать геоинформационную систему с эпизоотологическим мониторингом, что позволяет решать ряд проблем и приводит к качественному и быстрому принятию решений при возникновении заболеваний зоонозного характера. Данные технологии применяются в ФГКУЗ «Противочумная станция Республики Крым» Роспотребнадзора для изучения пространственно-временного распределения стационарно неблагополучных участков Крымского полуострова по таким опасным болезням: сибирская язва, чума, холера, туляремия, борреллиоз, хантавирусная инфекция и др.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Во всех природно-климатических зонах Крыма мелкие млекопитающие являются наиболее многочисленными животными. Именно их фоновые виды являются ведущими прокормителями разнообразных кровососущих членистоногих, которые переносят опасные заболевания, поддерживая их природную очаговость на полуострове.
За период 2015 по 2023 гг. на данной территории было отработано 34336 ловушко/суток, отловлено 4142 экземпляра мелких млекопитающих в степной, предгорной и горной части Крыма, что позволило получить репрезентативные данные как по фаунистической распространенности видов, так и по их эпидемиологической роли носителей и переносчиков болезней.
Фауна мелких млекопитающих Крымского полуострова – немногочисленна и представлена 21 видом, относящихся к двум отрядам: Насекомоядные (Insectivora) и Грызуны (Rodentia) и восьми родам. 16 видов встречаются часто, остальные представлены единичными находками [17].
Мы обобщили многочисленные литературные данные [10–23] и собственные исследования [38, 39], сделав обобщенную сводку по мелким млекопитающим, которые являются носителями или переносчиками зоонозных заболеваний (табл. 1).
Таблица 1
Ведущие переносчики инфекций из мелких млекопитающих
| Название вида | Переносчик болезней |
| 1 | 2 |
| Малая белозубка | восприимчива к туляремии и её переносчик |
| Серый хомячок | выделяли возбудителей Ку-лихорадки, чумы, туляремии, эризипилоида |
| Обыкновенная слепушонка
(мышь) |
переносчик клещевого риккетсиоза, чумы, туляремии, альвеококоза, токсоплозмоза |
| Общественная полевка | восприимчива к бруцеллезу, иерсинеозу, эхинекокозу; переносчик: Ку-лихорадки, чумы, туляремии, эризипелоида, лептоспироза гебдомадис, альвеококкоза, токсоплазмоза |
| Обыкновенная (алтайская) полевка | восприимчива к бруцеллезу, переносчик: лептоспироза, энцефалита, лимфоцитарного хориомененгита, сальмонеллёза, сибирской язвы, чумы, псевдотуберкулеза, туляремии, листериоза, эризипелоида, токсоплазмоза, альвеококоза, гименолепидоза, риккетсиоза, Ку-лихорадки. На ней обитает 40 видов блох, 15 в. – иксодовых, 17 в. – гамазовых и 17 в. – краснотелковых клещей |
| Восточноевропейская полевка | восприимчива к бруцеллезу; переносчик: лептоспироза, энцефалита, лимфоцитарного хориоменингита, сальмонеллёза, сибирской язвы, чумы, псевдотуберкулеза, туляремии, листериоза, эризипелоида, токсоплазмоза, альвеококоза, гименолепидоза, риккетсиоза, Ку-лихорадки. На ней обитает 40 видов блох, 15 в. – иксодовых, 17 в. – гамазовых и 17 в. – краснотелковых клещей |
| Малая лесная мышь | носитель геморрагической лихорадки с почечным синдромом |
| Степная мышь | переносчик: геморрагической лихорадки с почечным синдромом, туляремии, эризипелоида, дикроцелиоза, альвеококоза, лептоспироза, Ку-лихорадки, токсоплазмоза, бешенства |
| Желтогорлая мышь | носитель: иктерогеморрагического лептоспироза, клещевого энцефалита, лимфоцитарного хориоменингита, гименолепидоза, туляремии, геморрагической лихорадки с почечным синдромом |
| Домовая мышь | носитель: лимфоцитарного хориоменингита, блошиного риккетсиоза, цуцугамуши, клещевого риккетсиоза, везикулярного риккетсиоза, Ку-лихорадки, сальмонеллёза, бруцеллёза, чумы, сибирской язвы, кожного лейшманиоза, гименолепидоза, трихинеллёза, клещевого энцефалита, западного энцефаломиелита лошадей, аргентинской геморрагической лихорадки, болезни Чагоса. Также является носителями и прокормителями иксодовых, гамазовых и краснотелковых клещей |
| Черная крыса | переносчик: Ку-лихорадки, сальмонеллёза, псевдотуберкулёза, туляремии, лептоспироза, листероза, эризипелоида, чумы, лихорадки цуцугамуши и марсельской, бруцеллёза, содоку, клещевого спирохетоза, висцерального лейшманиоза, токсоплазмоза, трихинеллёза, блошиного риккетсиоза |
| Серая крыса | носитель: блошиного риккетсиоза, лихорадки цуцугамуши, клещевого риккетсиоза, везикулярного риккетсиоза, Ку-лихорадки, сальмонеллёза, бруцеллёза, сибирской язвы, чумы, туляремии, листероза, эризипелоида, содоку, токсоплазмоза, трихинеллёза, клещевого энцефалита, бешенства, болезни Чагоса и др. В Крыму на крысе обнаружены 21 вид экто- и 16 видов эндопаразитов |
| Обыкновенный хомяк | носитель: Ку-лихорадки, чумы, туляремии, лептоспироза, гриппотифоза, альвеококоза, токсоплазмоза, клещевого энцефалита. На хомяке было обнаружено 13 видов блох, 10 в. – иксодовых, 4 в. – гамазовых и 5 в. – краснотелковых клещей |
| Обыкновенная белка | переносчик: клещевого энцефалита, туляремии, эризипелоида, дикроцелиоза, альвеококоза, лептоспироза, Ку-лихорадки, токсоплазмоза, бешенства |
| Малый суслик | носитель: сибирской язвы, бруцеллеза, туляремии, Ку-риккетсиоза, лептоспироза, псевдотуберкулеза |
| Большой тушканчик | носитель: Ку-лихорадки, туляремии, чумы, омской геморрагической лихорадки |
Имеющиеся современные эпидемиологические данные свидетельствуют о наличии на территории Крыма природных очагов следующих инфекционных заболеваний: туляремии, лептоспироза, сибирской язвы, клещевого энцефалита (КВЭ), Крымской геморрагической лихорадки (КГЛ), инфекции, вызываемой хантавирусами (геморрагическая лихорадка с почечным синдромом), Ку-лихорадки, бешенства, марсельской лихорадки (МЛ), иксодовых клещевых боррелиозов (ИКБ), иерсиниозов, моноцитарного эрлихиоза человека (МЭЧ) и гранулоцитарного анаплазмоза человека (ГАЧ) [11, 14, 15 ].
В данной работе мы приводим сводку наиболее часто встречавшихся в отловах мелких млекопитающих за 8-летний период исследований (табл. 2).
Таблица 2
Виды мелких млекопитающих, встречавшихся наиболее часто в отловах за период 2015-2023 гг. по территории Крыма *
| Отряд | Вид | Русское название |
| Rodentia | Sylvaemus witherbyi, Thomas, 1902 | Степная мышь |
| Sylvaemus flavicollis (tauricus), Melchior, 1834 | Желтогорлая мышь | |
| Sylvaemus uralensis, Pallas, 1811 | Малая лесная мышь | |
| Mus musculus, Linnaeus, 1758 | Домовая мышь | |
| Mus spicilegus, Petenyi, 1882 | Курганчиковая мышь | |
| Microtus socialis, Pallas, 1773 | Общественная полевка | |
| Microtus arvalis (obscurus), Pallas, 1778 | Обыкновенная (алтайская) полевка | |
| Cricetus cricetus, Linnaeus, 1758 | Хомяк обыкновенный | |
| Cricetulus migratorius, Pallas, 1773 | Серый хомячок | |
| Rattus norvegicus, Berkenhout, 1769 | Серая крыса | |
| Sicista lorigera, Nathusius, 1840 | Южная мышовка | |
| Insectivora | Crocidura suaveolens, Pallas, 1811 | Малая белозубка |
| Crocidura leucodon, Hermann, 1780 | Белобрюхая белозубка |
Примечание: *Источник: Владычак В. В. и др. [38, 39].
Анализ по приуроченности видов к физико-географическим зонам Крыма выявил следующее. Наибольшая плотность и наиболее высокая встречаемость по видовому составу отмечена в степном Крыму, что подтверждает и численность – 2960 отловленных здесь особей (в среднем – 13,0 экз. на 100 ловушко/суток). В убывающем порядке на втором месте по плотности и видовому разнообразию предгорная зона – выловлено 854 особи грызунов (в среднем – 11,1 экз. на 100 ловушко/суток) и наименьшее количество их было поймано в горной зоне – 328 особей (в среднем – 8,5 экз. на 100 ловушко/суток). Ведущая причина такого распределения – кормовая база и контрастные климатические факторы (наличие устойчивого снежного покрова в горах до 100–120 суток, в степной зоне – 10–20 суток).
Рассмотрим динамику популяций, наиболее часто встречающихся в отловах видов с учетом их индекса доминирования (ИД) по физико-географическим зонам Крыма за 8 лет исследований.
В горной зоне к ним можно отнести следующие виды: степная мышь (S.witherbyi) – ИД 53,9 %, обыкновенная (алтайская) полевка (M. arvalis (obscurus) – ИД 21,6 %, желтогорлая мышь (S. flavicollis (tauricus) – ИД 12,5 %, общественная полевка (M. socialis) – ИД 8,8 %, домовая мышь (M. musculus) – ИД 2,1 %, малая лесная мышь (Sylvaemus uralensis) – ИД 0,3 %, курганчиковая мышь (M. spicilegus) – ИД 0,2 %, серый хомячок (Cricetulus migratorius) – ИД 0,2 %, остальные виды в наших отловах представлены единичными экземплярами.
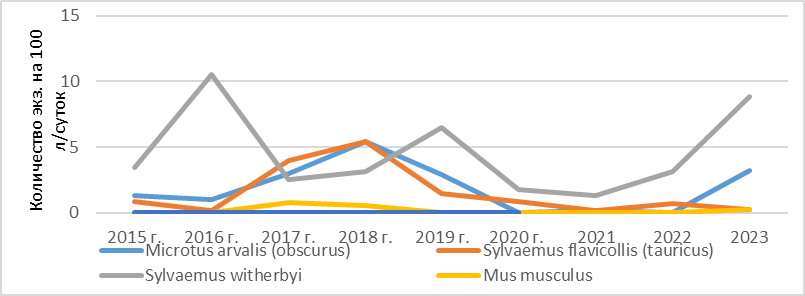
Рис. 1. Разногодичная численность фоновых видов мелких млекопитающих в горной зоне Крыма (2015–2023 гг.).
С учетом разногодичной динамики (рисунок 1) для степной мыши (S. witherbyi) 2016 и 2019 года являлись самыми благоприятными, поэтому график имеет четко выраженные пики подъема численности, а с 2020 года наблюдается видимое снижение встречаемости этого вида с подъемом в 2023 г. Для желтогорлой мыши (S. flavicollis (tauricus), начиная с 2015 года по 2018 год, прослеживается неуклонный рост встречаемости этого вида в отловах, а с 2019 года наступает спад популяции данного вида. Для общественной полевки (M. socialis) пик численности приходится на 2018 год, с дальнейшим снижением этого показателя в последующие периоды наблюдений. Для остальных видов численность их популяций относительно стабильна без резких колебаний по годам.
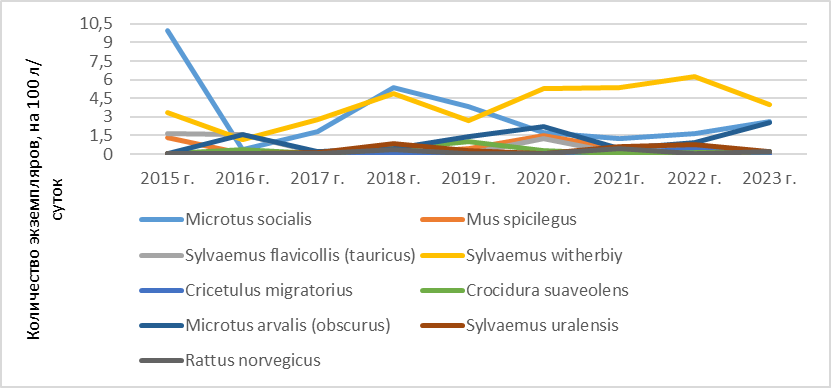
Рис. 2. Разногодичная численность фоновых видов мелких млекопитающих в предгорной зоне Крыма (2015–2023 гг.).
Наиболее часто встречающимися в предгорной зоне являются следующие виды: степная мышь (S. witherbyi) – ИД 37,5 %, общественная полевка (M. socialis) – ИД 27,1 % и обыкновенная (алтайская) полевка (M. arvalis (obscurus)) – ИД 10,3 %, домовая мышь (M. musculus) – ИД 10,1 %, малая белозубка (C. suaveolens) – ИД 3,85 %, малая лесная мышь (Sylvaemus uralensis) – ИД 3,1 %, курганчиковая мышь (M. spicilegus) – ИД 2,9 %, желтогорлая мышь (S. flavicollis (tauricus) – ИД 2,9 %, серая крыса (R. norvegicus) – ИД 2,63 %, серый хомячок (Cricetulus migratorius) – ИД 0,23 %, остальные грызуны встречались единично.
Прежде всего на рисунке 2 следует обратить внимание на более широкий спектр видов доминантов в предгорье, имеющих значительную численность популяций – 10 видов, по сравнению с 8 видами в горной зоне. Для общественной полевки (M. socialis) пиками численности являлись 2018–2019 гг., для обыкновенной (алтайской) полевки (М. arvalis (obscurus) благоприятными годами можно считать 2016 год и 2020 год, после чего наступил выраженный спад этого показателя, а в 2023 году видимый рост. Для остальных видов не выражены резкие колебания популяционных волн за годы исследований, за исключением 2020 года, когда было заметно возрастание числа в отловах малой белозубки (C. suaveolens) и желтогорлой мыши (S. flavicollis (tauricus).
Наиболее контрастны пики повышения численности и снижения плотности популяций в степной зоне полуострова (рисунок 3).
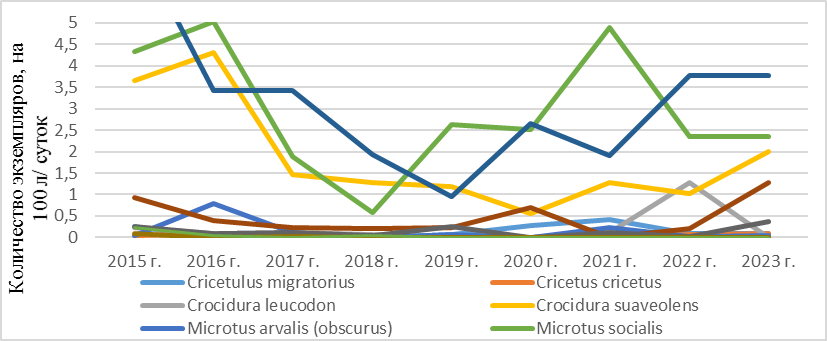
Рис. 3. Разногодичная численность фоновых видов мелких млекопитающих в степной зоне Крыма (2015–2023 гг.).
Самыми распространенными 12 видами в степной зоне Крыма являются: степная мышь (S. witherbyi) – ИД 30,7 %, домовая мышь (M. musculus) – ИД 24,4 %, общественная полевка (M. socialis) – ИД 21,9 %, малая белозубка (C.suaveolens) – ИД 14,5 %, серая крыса (R. norvegicus) – ИД 12,8 %, курганчиковая мышь (M. spicilegus) – ИД 3,6 %, серый хомячок (Cricetulus migratorius) – ИД 1,3 %, обыкновенная (алтайская) полевка (М. arvalis (obscurus) – ИД 1,1 %, белобрюхая белозубка (C. leucodon) – ИД 0,72 %, хомяк обыкновенный (Cricetus cricetus) – ИД 0,3 %, желтогорлая мышь (S. flavicollis (tauricus) – ИД 0,1 %, южная мышовка (S. lorigera) ИД – 0,1 %.
У общественной полевки (M. socialis) максимум численности приходился на 2016 год с последующей депрессией с 2018 год по 2021 г., далее происходит выравнивание этого показателя в 2022–2023 гг. Для малой белозубки (C. suaveolens) наибольшая численность отмечена в 2016 году, начиная с середины 2017 года идет резкий спад. Наступает катастрофическое снижение популяции данного вида и только с 2020 года он начинает выходить из депрессии и наращивать число, что подтвердили сезонные отловы в степи. Для степной мыши (S. witherbyi) пики численности выявлены в 2015–2016 и 2019 гг. Депрессия в популяциях наблюдалась в период 2017-2018 гг. и с 2020 г по 2023 год этот показатель слабо изменялся. Для домовой мыши (M. musculus) 2015–2017 гг. являлись самыми благоприятными, число особей при отлове в среднем мало менялось. С 2018 года численность этого вида сильно сократилась, а с 2019 года этот показатель постепенно увеличивался до 2023 г. Для остальных отлавливаемых видов грызунов в степной зоне популяционные волны по годам отловов не выражены.
Таким образом, анализ отлова мелких млекопитающих в основных зонах полуострова показал, что наибольшее фаунистическое разнообразие мелких млекопитающих в степи. Доминирующими видами в степной зоне являются степная мышь (S. witherbyi) (с колебаниями в разные годы ИД от 17,8 % до 46,9 %) и домовая мышь (M. musculus) (ИД от 9,38 % до 37,8 %); в предгорной – общественная полевка (M. socialis) (ИД от 5,8% до 61,1 %) и степная мышь (S. witherbyi) (ИД от 17,6 % до 57,7 %); в горной – степная мышь (S. witherbyi) ( ИД от 12,5 % до 77,7 %) и обыкновенная (алтайская) полевка (М. arvalis (obscurus) (ИД от 11,1 до 54,2 %), т.е. индексы доминирования также свидетельствуют о значительных колебаниях изученных параметров по годам.
Полагаем, что к ведущим причинам установленной нами разногодичной динамики колебаний численности популяций мелких млекопитающих в Крыму можно отнести прежде всего природно-климатические условия: благоприятные, которые способствуют увеличению размеров популяций некоторых видов, неблагоприятные – соответственно сокращение плотности видов (холодная зима, засушливое лето, антропогенный пресс и т.д.). Закономерное: увеличение численности хищников и эктопаразитов в ответ на рост количества природных прокормителей. При возникновении благоприятных условий для размножения и увеличения плотности численности изученных видов, складываются условия для возникновения эпизоотий, которые приводят к массовой гибели большого числа особей того или иного вида. Сюда же можно отнести и возможное изменение кормовой базы по годам с учетом климатических факторов, сокращение мест обитания из-за расширения освоенности как сельскохозяйственных, так и рекреационных территорий и пр.
На рисунке 4 приводятся данные по циркуляции наиболее распространённых инфекций с учетом природно-климатических зон полуострова Крыма за 8 лет (в %).
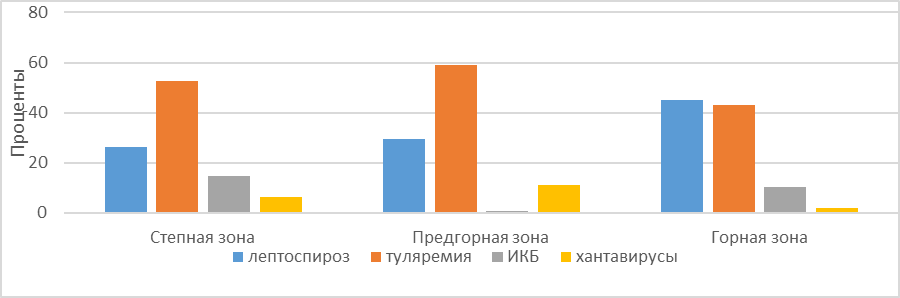
Рис. 4. Циркуляция ведущих зоонозных инфекций на территории Крыма за 2015–2023 гг.
Носители лептоспироза встречаются во всех ландшафтно- климатических зонах Крыма, но особенно высоки эти показатели у видов, обитающих в горной зоне (до 42,1 %). К ним относят: обыкновенную (алтайскую) полевку (М. arvalis (obscurus), желтогорлую мышь (S. flavicollis (tauricus), степную мышь (S. witherbyi). общественную полевку (M. socialis). Только в предгорной и степной зонах переносчиками этого заболевания были выявлены: курганчиковая мышь (M. spicilegus), малая белозубка (C.suaveolens), домовая мышь (M. musculus), серая крыса (R. norvegicus), хомяк обыкновенный (Cricetus cricetus).
Ведущими видами мелких млекопитающих, поддерживающих циркуляцию возбудителей туляремии по данным наших исследований, являются: малая белозубка (C. suaveolens), общественная полевка (M. socialis), степная мышь (S. witherbyi), домовая мышь (M. musculus), курганчиковая мышь (M. spicilegus), серая крыса (R. norvegicus) встречающихся по всему Крыму, но чаще всего инфицированы особи, отловленные в предгорье (до 58,9 %).
Основными резервуарами возбудителя геморрагической лихорадки с почечным синдромом, вызываемой хантавирусами, являются: обыкновенная (алтайская) полевка (Microtus arvalis (obscurus), общественная полевка (M. socialis), домовая (M. musculus) и степная (S. witherbyi) мыши, уровень инфицированности этих видов в предгорной зоне достигает 10,9 %.
В 2023 г возбудители иксодовых клещевых боррелиозов (ИКБ) зарегистрированы в степной зоне с самыми высокими показателями (до 14,6 % от всех исследованных животных), в горной зоне они составили – 10,4 % и в предгорьях – 0,6 % соответственно. Их основными переносчиками являются: желтогорлая мышь (S. flavicollis (tauricus), домовая мышь (M. мusculus), серая крыса (R. norvegicus), хомяк обыкновенный (Cricetus cricetus) и др. Необходимо отметить, что в горной и предгорной зонах полуострова положительные результаты на иксодовые клещевые боррелиозы (ИКБ) в мелких млекопитающих в период с 2015 по 2019 годы не обнаруживали, а регистрировались только среди иксодовых клещей. Поэтому выявленная динамика в 2023 г. отмечена впервые за 8 лет исследований.
ЗАКЛЮЧЕНИЕ
- Мелкие млекопитающие занимают ведущее положение в циркуляции возбудителей многих зоонозных инфекций в Крыму. Определена разногодичная динамика распространения этих видов за период 2015–2023 гг. Всего было отловлено 4142 экземпляра грызунов и проведено 3568 лабораторных исследований, что позволило получить репрезентативные данные как по фаунистической распространенности видов, так и по их эпидемиологической роли носителей и переносчиков болезней.
- Доминирующими видами среди этой группы в горной ландшафтно-географической зоне являются: степная мышь (S.witherbyi) – ИД 53,9 %, обыкновенная (алтайская) полевка (M. arvalis (obscurus) – ИД 21,6 %, желтогорлая мышь (S. flavicollis (tauricus) – ИД 12,5 %, общественная полевка (M. socialis) – ИД 8,8 %, домовая мышь (M. musculus) – ИД 2,1 %, малая лесная мышь (S. uralensis) – ИД 0,3 % , курганчиковая мышь (M. spicilegus) – ИД 0,2 %, серый хомячок (Cricetulus migratorius) – ИД 0,2 % , остальные виды отмечены единично.
- Наиболее часто встречающимися видами териофауны в предгорной зоне являются следующие животные: степная мышь (S. witherbyi) – ИД 37,5 %, общественная (M. socialis) – ИД 27,1 % и обыкновенная (алтайская) (M. arvalis (obscurus) полевки – ИД 10,3 %, домовая мышь (M. musculus) – ИД 10,1 %, малая белозубка (C. suaveolens) – ИД 3,85 %, малая лесная мышь (S. uralensis) – ИД 3,1 %, курганчиковая мышь (M. spicilegus) – ИД 2,9 %, желтогорлая мышь (S. flavicollis (tauricus) – ИД 2,9 %, серая крыса (R. norvegicus) – ИД 2,63 %, серый хомячок (Cricetulus migratorius) – ИД 0,23 %, остальные встречались редко.
- Самые распространенные виды степной зоны Крыма: степная мышь (S. witherbyi) – ИД 30,7 %, домовая мышь (M. musculus) – ИД 24,4 %, общественная полевка (M. socialis) – ИД 21,9 %, малая белозубка (C. suaveolens) – ИД 14,5 %, серая крыса (R. norvegicus) – ИД 12,8 %, курганчиковая мышь (M. spicilegus) – ИД 3,6 %, серый хомячок (Cricetulus migratorius) – ИД 1,3 %, обыкновенная (алтайская полевка) (М. arvalis (obscurus) – ИД 1,1 %, белобрюхая белозубка (C. leucodon) – ИД 0,72 %. хомяк обыкновенный (Cricetus cricetus) – ИД 0,3 %, желтогорлая мышь (S. flavicollis (tauricus) – ИД 0,1 %, южная мышовка ( S. lorigera) – ИД 0,1 %.
- По данным наших исследований носители зоонозных инфекций по лептоспирозу: обыкновенная (алтайская) полевка (М. arvalis (obscurus), желтогорлая мышь (S. flavicollis (tauricus), степная мышь (S. witherbyi). общественная полевка (M. socialis). Только в предгорной и степной зонах переносчиками этого заболевания были выявлены: курганчиковая мышь (M. spicilegus), малая белозубка (C.suaveolens), домовая мышь (M. musculus), серая крыса (R. norvegicus), хомяк обыкновенный (Cricetus cricetus). Виды, поддерживающие циркуляцию возбудителя туляремии: малая белозубка (C. suaveolens), общественная полевка (M. socialis), степная мышь (S. witherbyi), домовая мышь (M. musculus), курганчиковая мышь (M. spicilegus), серая крыса (R. norvegicus). Основными резервуарами возбудителя геморрагической лихорадки с почечным синдромом, вызываемой хантавирусами, являются: обыкновенная (алтайская) полевка (Microtus arvalis (obscurus), общественная полевка (M. socialis), домовая (M. musculus) и степная (S. witherbyi) мыши. Ведущими переносчиками иксодовых клещевых боррелиозов (ИКБ) являются: желтогорлая мышь (S. flavicollis (tauricus), домовая мышь (M. мusculus), серая крыса (R. norvegicus), хомяк обыкновенный (Cricetus cricetus) и др.
- Отмеченные изменения в ландшафтах полуострова как природные, так и антропогенные (потепление климата, рост площадей городов и поселков, сельскохозяйственного и рекреационного освоения территорий и пр.) способствуют их значительной трансформации, что ведёт к изменению ареалов обитания мелких млекопитающих и территориальной приуроченности различных зоонозных инфекций соответственно.
- Ведение ежегодных исследований по численности популяций териофауны в физико-географических районах Крыма с учетом их эпизоотологического значения позволяет противодействовать ухудшению эпидемиологической ситуации на полуострове при ежегодном росте туристического потока отдыхающих.
- Gablitz K. I. Physical description of the Tauride region by its location and all three kingdoms of nature (1781). Access mode: http://prometeus.nsc.ru/ (Access date: 22/09/2024).
- Nikolsky A. M. Vertebrate animals of the Crimea (1891). Access mode: http://prometeus.nsc.ru. (Access date: 19/09/2024).
- Köppen F. P. Scientific works of P. S. Pallas. Access mode: http: //search.rsl.ru/ru/record/01003670558ysclidlvqffiuiic37162437. (Access date: 23/09/2024).
- Ognev S. I. Mammals of the Tauride province/ Access mode: http://www.biblioclub.ru (Access date: 23/09/2024).
- Martino V. and E. New data on mammals of the mountainous Crimea, Access mode: http://www.biblioclub.ru. (Access date: 23/09/2024).
- Puzanov I. I. The originality of the fauna of the Crimea and its origin, Scientists Notes of Gorky University (1949). Access mode: http://prometeus.nsc.ru. (Access date: 23/09/2024).
- Puzanov I. I. The stay of P. S. Pallas in the Crimea (1972), Access mode: http://www.biblioclub.ru. (Access date: 23/09/2024).
- Averin Yu. V., Delamure S. L. Animal world: a guide to the Crimea, 114 p. (Simferopol: Krymizdat, 1956).
- Vshivkov F. N. The Beasts of the Crimea. 86 p. (Simferopol: Crimea, 1964).
- Kormilitsyna V. V. On the fluctuation in the number of mouse-like species of the genus Apodemus in protected beech forest, 117 «Protected forests of the mountainous Crimea» (Simferopol, 1969).
- Tovpinets N. N., Ovdienko N. S., Bykova T. I. Features of the natural foci of some zoonotic infections in the Crimea in conditions of anthropogenic landscapes. Mater. the All-Union. сonf. “Epizootology, epidemiology, diagnostic tools, therapy and specific prevention of infectious diseases common to humans and animals,” 47 (Lviv, 1988).
- Markeshin S. Ya. The study of foci of tick-borne encephalitis, hemorrhagic fever with renal syndrome and Crimean–Congo hemorrhagic fever in Crimea,160 p. (M., 1994).
- Kostin Yu. V., Dulitsky A. I., Kostin S. Yu. Ecological and geographical characteristics of zonal biotopic secretions and the composition of their fauna, Issues of development of the Crimea: Scientific and practical. discussion and analytical collection “Biological and landscape diversity of Crimea: problems and prospects», 11, 35 (Simferopol, 1999).
- Kucheruk V. V., Karaseva E. V. Synanthropy of rodents and limitation of their numbe, 4 (M., 1992).
- Kucheruk V. V. Selected works on natural foci of diseases. GU Nauch.- research. Institute of Epidemiology and Microbiology named after honor. Academician N. F. Gamalei of the Russian Academy of Sciences, Institute of Problems of Ecology and Evolution named after A. N. Severtsov of the Russian Academy of Sciences, Problems. The Commission of the Russian Academy of Medical Sciences “Natural focal human infections”,306 p. (M.,2006).
- Tarasov M. A. Ecological and epizootological monitoring in the foci of dangerous zoonotic infectious diseases, 356 p. (Saratov, 2016).
- Alekseev A. F., Cherniy N. N., Tovpinets V. I. Distribution and abundance of rodents of the Crimea. All-Union meeting on the problem of cadastre and accounting of the animal world: abstracts of the reports, 175 (Ufa, 1989).
- Dulitsky A. I. Mammals of the Crimea, 224 p. (Simferopol, 2001).
- Bondarenko Е. О., Utenkova A. L. Natural focal infections, 268 p. (Kirov, 2009).
- Lehman A. M. Features of the manifestation of natural focal zoonotic infections. Our agriculture. 18 (242), 64 (2020).
- Alymkulova A. A., Meka-Mechenko T. V., Burdelov L. A., Nekrasova L. E., Mecha-Mechenko V. G., Belyak L. G. Infection with zoonotic infections of rodents of Kyrgyzstan. Scientific life. 14, 3 (91), 391 (2019).
- Schmaljohn C., Hjelle B. Hantaviruses: a global disease problem. Emerg. Infect Dis. 3, 95 (1997). DOI:10.3201/eid0302.970202.
- Adler H., Vonstein S., Deplazes P., Stieger C., Frei R. Prevalence of Leptospira spp. in various species of small mammals caught in an inner-city area, Switzerland. Epidemiol. Infect. 128 (1), 107 (2002). DOI:10.1017/s0950268801006380.
- Ellis J., Ellis P., Oyston C., Green M., Titball R. W. Tularemia, Clin. Microbiol. Rev., 15, 631 (2002). DOI.org/10.1128 /CMR.15.4.631- 646.2002.
- Foley J., Piovia-Scott J. Vector biodiversity did not associate with tick-borne pathogen prevalence in small mammal communities in northern and central California, Ticks Tick Borne Dis., 5, 299 (2014). DOI.org/10.1016/j.ttbdis.2013.12.003.
- Combs M. A. Socio-ecological drivers of multiple zoonotic hazards in highly urbanized cities, Global Change Biology, 28, 5, 1705 (2022).
- Scientific and applied reference book “Climate of Russia”. Access mode: http://aisori.meteo.ru/ClspR. (Access date: 23/09/2024).
- Methodological recommendations “Trapping, accounting and forecasting the number of small mammals and birds in natural foci of infectious diseases. MP 3.1. 0211-20,” 45 p. (M., 2020). Access mode: https://medilis.ru/file. (Access date: 23/09/2024).
- Sanitary and epidemiological rules “Sanitary and epidemiological requirements for the prevention of infectious diseases SANPIN 3.3686-21″, 109 p. (M. 2021).
- Methodological guidelines “Collection, accounting and preparation for laboratory examination of blood-sucking arthropods in natural foci of dangerous infectious diseases.” MU 3.1.3012-12. Approved by Rospotrebnadzor 04.04.2012, 58 p. (M., 2012).
- Sanitary and epidemiological rules “Safety of work with microorganisms of groups I-II of pathogenicity (danger)”. SP 1.3118-13 M.: Federal Center for Hygiene and Epidemiology of Rospotrebnadzor, 195 p. (М., 2014).
- Lisovsky A. A., Shtefel B. I., Savelyev A. P., Ermakov Yu. A., Kozlov O. A., Smirnov D. G., Stakheev V. V., Glazov D. M. Mammals of Russia: list of species and applied aspects. Proceedings of the Zoological Museum of Moscow State University, 56, 19. (M., 2019).
- Karaseva E. V., Telitsyna A. Yu., Zhigalsky O. A. Methods of studying rodents in the field. 416 p. (M., 2008).
- Popov I. Y. Distribution of small mammals on stationary sites depending on the dynamics of vegetation cover, Ecological ordination and communities, 15 ( M., 1990).
- Oleinichenko V. Yu. Reactions of small mammals to the smell of a precursor in contact with traps, Zoological Journal, 94, 8, 923 (2015).
- Shmoylova R. A. General theory of statistic, 480 p. (M., 2002).
- Karpik A. P. Methodological and technological foundations of geoinformation support of territories, 260 p. (Novosibirsk, 2004).
- Vladychak V. V., Kobechinskaya V. G., Kovalenko I. S., Abibulaev D. E., Yakunin S. N., Tikhonov S. N. Ecological and topological monitoring of small mammals of the Crimea, taking into account their natural focal zoonosis, Ecosystems, 29, 70 (2022).
- Vladychak V. V., Kobechinskaya V. G. Biological diversity of small mammals of the Crimean Peninsula. Collection of scientific works of the II conf. of the faculty, graduate students, students and young scientists named after A.G. Gurvich, 15 (Simferopol, 2024).
