MORPHOMETRIC PARAMETERS OF THE INTESTINE IN RATS AFTER PROBIOTIC ADMINISTRATION IN A DYSBIOSIS MODEL
МОРФОМЕТРИЧЕСКИЕ ПОКАЗАТЕЛИ КИШЕЧНИКА У КРЫС
ПРИ ВВЕДЕНИИ ПРОБИОТИКА В МОДЕЛИ ДИСБИОЗА
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №4, 2024
Publication text (PDF):Download
UDK 612.335.2:663.18
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Dzheldubaeva E. R., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
Yarmolyuk N. S., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
Rzhevskaya V. S., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
Tumanyants K. N., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
Nazyrova L. E., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
Borisenko D. A., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-4-65-77
PAGES:from 65 to 77
STATUS:Published
LANGUAGE:Russian
KEYWORDS: probiotic, dysbiosis, rats, morphometric parameter, intestine.
ABSTRACT (ENGLISH):
The aim of this study was to identify changes in the morphometric parameters of the intestine in rats after administration of a tested probiotic in a dysbiosis model.
The experiments were performed on 40 sexually mature female Wistar rats, weighing 220–240 g, with average motor activity and low emotional reactivity. The rats were divided into four experimental groups of 10 individuals each. They were administered an equivalent volume of drinking water (control), either alone or in combination, over 14 days. The treatment consisted of 3 mL of a 1 % probiotic solution and 5 mg/kg of the broad-spectrum antibiotic doxycycline. The microbial consortium included probiotic strains: Lactobacillus parabuchneri, Lactobacillus plantarum, Lactobacillus acidophilus, Enterococcus faecium, and Brettanomyces bruxellensis.
Morphometric analysis of the middle section of the small intestine mucosa included an assessment of its architecture, the thickness of the entire mucosa, the height and thickness of the villi, and the height of glandular cells.
Statistical analysis of the data was carried out using nonparametric methods, specifically the Mann-Whitney U-test. Results were considered statistically significant at p < 0.05.
Administration of probiotics resulted in a significant 51.32 % (p < 0.05) increase in the number of goblet cells compared to control values. This indicates a positive effect of probiotics on the intestinal barrier function and improved morphofunctional condition.
Animals receiving antibiotics showed a statistically significant decrease in the thickness of the mucosa, the height, and thickness of the small intestine villi by 37.28 % (p < 0.05), 43.01 % (p < 0.05), and 18.64 % (p < 0.05), respectively. Additionally, there was a 6.74 % reduction in epithelial thickness and a 39.52 % (p < 0.05) decrease in goblet cell counts compared to control animals. These findings highlight structural and functional damage to the intestinal mucosa caused by dysbiosis modeling.
Combined probiotic and antibiotic group: In the fourth group, which received both the probiotic and antibiotic, a reduction in mucosal thickness by 22.05 % (p < 0.05) and villi height by 21.20 % (p < 0.05) was observed compared to control values. However, there was a 40.87 % (p < 0.05) increase in goblet cell numbers relative to control. While antibiotics caused damage, probiotics partially mitigated this effect, accelerating recovery. The moderate decrease in villi height allowed for the preservation of some absorptive function.
The introduction of probiotics in the context of dysbiosis reduces the negative impact of antibiotics on the intestine and accelerates the restoration of its morphofunctional state. A synergistic effect was observed: reduced adverse side effects of antibiotics, preservation of normal mucosal structure, and function when probiotics and antibiotics were combined. This emphasizes the importance of using probiotics as an adjuvant in antibiotic therapy.
ВВЕДЕНИЕ
Известно, что кишечник животных и человека колонизирован сложным микробным сообществом, известным как микробиота, которое состоит по меньшей мере из 1000 видов бактерий [1, 2]. Эта микробиота играет ключевую роль в физиологии кишечника и здоровье хозяина, выполняя большое количество функций, таких как переваривание необработанных пищевых веществ, синтез витаминов и короткоцепочечных жирных кислот, модуляция иммунной системы и ингибирование колонизации патогенов [3]. Бактерии могут быть вовлечены через механизмы дисбиоза, воспаления и повреждения кишечного барьера в патогенез и патофизиологию многочисленных кишечных заболеваний, включая синдром раздраженного кишечника [4], болезнь Крона и язвенный колит [5], антибиотик-ассоциированная диарея [6], синдром повышенной кишечной проницаемости [7], аллергические и аутоиммунные заболевания [8] и пр.
Разработка мультиштаммовых и персонализированных пробиотических консорциумов открывает широкие перспективы для профилактики и лечения разных заболеваний, а также для улучшения общего состояния здоровья [9, 10]. Показано, что отдельные пробиотики (ПБ) оказывают комплексное влияние на слизистую кишечника через механизмы, связанные с улучшением микробного баланса, модуляцией иммунных ответов и укреплением кишечного барьера [11]. Пробиотики могут снижать выработку провоспалительных цитокинов (например, TNF-α, IL-6) и стимулировать продукцию противовоспалительных молекул (например, IL-10) [12]. Они стимулируют клетки врожденного и адаптивного иммунитета, включая дендритные клетки, макрофаги и регуляторные Т-клетки. Они стимулируют выработку антител (например, IgA), усиливая местный иммунитет слизистой [13]. В последнее время появляются сообщения об обнаружении у некоторых штаммов антиоксидантных свойств [14]. Таким образом, показано, что пробиотики оказывают многоуровневое положительное влияние на слизистую кишечника, способствуя её защите, восстановлению и поддержанию здоровья.
Cтановится все более актуальным использование пробиотиков в качестве профилактики или терапии последствий приема антибиотиков, включая дисбиоз и повреждение слизистой. Показано, что сбалансированность микробиоты может нарушаться «при превышении интенсивности негативных внешних воздействий над пороговыми значениями адаптационной системы организма» [15] и при сдвигах в метаболической активности самой микрофлоры желудка [16]. Одной из наиболее частых причин нарушений является воздействие на нее антибактериальными препаратами. С целью создания модели дисбиоза, антибиотико-индуцированного стресса у животных в экспериментах используют комбинированное применение пробиотика с антибиотиком широкого спектра, что позволяет оценить физиологические показатели при антибиотикотерапии.
Создание новых пробиотиков с улучшенными свойствами требует изучения их эффективности и безопасности. Модели на животных, таких как крысы, позволяют оценить влияние пробиотиков на микрофлору и слизистую кишечника до проведения клинических исследований. В доступной научной литературе недостаточно показано изменение морфометрических гистологических показателей кишечника при введении пробиотиков. При этом изучение слизистой кишечника позволит лучше понять механизмы воздействия пробиотиков на микробиоту кишечника, иммунную систему и барьерные функции слизистой.
В связи с вышеизложенным целью данной работы явилось изучение изменения морфометрических показателей кишечника у крыс при введении тестируемого пробиотика в модели дисбиоза.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнялась в Центре коллективного пользования научным оборудованием «Экспериментальная физиология и биофизика» при кафедре физиологии человека и животных и биофизики в рамках программы исследований № АААА-А21-121011990099-6 «Физиологические механизмы биологического действия факторов разной природы и интенсивности» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского».
Эксперименты выполнены на белых половозрелых крысах-самках линии Wistar, которые были специально выведены для лабораторных исследований. Общая выборка животных составила 40 здоровых крыс, массой 220-240 г, со средней двигательной активностью и низкой эмоциональностью определяемых в тесте «открытое поле», которых наблюдалось большинство в популяции, вследствие чего у животных развивается типичная среднестатистическая реакция на действие различных раздражающих факторов, включая тестируемые химические соединения. Из общего количества отобранных крыс было выделено четыре экспериментальные группы. Первой группе «Контроль» (К) в течение 14 дней путем зондирования вводили эквивалентный раствор физраствора. Второй группе «Пробиотик» (ПБ) интрагастрально вводили по 3 мл 1 % раствор пробиотика путём зондирования в течение 14 дней. Третьей группе «Антибиотик» (АБ) вводили антибиотик доксициклин в дозе по 5 мг/кг в течение 14 дней при моделировании дисбиоза. Четвертой группе животных (АБ+ПБ) – комбинированно вводили антибиотик и пробиотик в течение 14 дней.
Синтез тестируемого пробиотика проводился на кафедре ботаники и физиологии растений и биотехнологий ФГАОУ ВО «Крымский федеральный университет имени В.И. Вернадского» под руководством Ржевской В. С. Микробный консорциум включал штаммы пробиотических микроорганизмов: Lactobacillus parabuchneri ВКМ В-3553D, Lactobacillus plantarum ВКМ В-3552D, Lactobacillus acidophilus ВКМ В-3563D, Enterococcus faecium ВКМ В-3551D, Brettanomyces bruxellensis ВКМ Y-3064D. Все штаммы микроорганизмов депонированы в Всероссийской коллекции микроорганизмов. Микробный консорциум получали путем совместного культивирования молочнокислых бактерий, энтерококка и дрожжей в жидкой питательной среде MRS следующего состава (г/л): пептон ферментативный – 10,0; экстракт пекарных дрожжей – 4,0; твин-80 – 1,0 мл; мясной экстракт – 8,0; глюкоза – 20,0; калий фосфорнокислый однозамещенный – 2,0; натрий уксуснокислый 3-водный – 5,0; аммоний лимоннокислый однозамещенный – 2,0; магний сернокислый 7-водный – 0,1; марганец хлористый 4-водный – 0,05; рН среды – 6,3; режим стерилизации: 0,75 атм, 20 мин. Культивирование микроорганизмов проводили в биореакторе Minifors 2 объемом 4 л (Minifors 2 НТ, Швейцария) при температуре 32 °С и 50 об/ мин в течение 3-х суток. Учет численности микроорганизмов в консорциуме проводили методом предельных разведений. Биологическая концентрация бактерий микробного консорциума составила 1,3∙109 КОЕ.
Животных выводили из эксперимента путем декапитации. Подготовка гистологического материала осуществлена в ЦКП «Молекулярная биология» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского». Гистологические препараты средней части тонкого кишечника крыс готовили в соответствие со стандартными методиками. Срезы окрашивали гематоксилином и эозином [17].
Гистопрепараты просматривали под микроскопом DM2000 с объективами Plan5х, 10х и 40х и фотографировали камерой DFC295 (Leica). Морфометрические измерения выполняли на микрофотографиях в программе ImageJ с использованием шкалы TS-M1 PW106011 (1div=0.01mm) stage micrometer [18].
Выбор методов и приемов микроскопирования осуществлялся согласно рекомендациям, изложенным в учебном пособии Л. Д. Тимченко, В. Н. Вакулина [19]. Морфометрический анализ на светооптическом уровне включал оценку архитектоники средней части тонкого кишечника, толщину всей слизистой оболочки, высоту и толщину ворсин, высоту железистых клеток и количество эозинофилов.
Согласно государственному стандарту РФ «ГОСТ 33216-2014, Руководство по содержанию и уходу за лабораторными животными, Правила содержания и ухода за лабораторными грызунами и кроликами, Правила оборудования помещений и организации процедур» – испытуемые животные содержались в адекватных условиях, в соответствии с тезисами вышеприведённого государственного норматива.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям этического комитета по биоэтике ФГАОУ ВО «Крымский федеральный университет им. В. И. Вернадского» (протокол № 5 от 2022 г.).
Статистическую обработку и анализ материала проводили с помощью непараметрических методов, применение которых позволила проверка полученных данных на закон нормального распределения. Вычисляли среднее значение исследуемых величин, ошибку средней. Проводилась оценка достоверного уровня различий между экспериментальными группами с использованием непараметрического U-критерия Манна-Уитни. Достоверными показателями считаются показатели меньше р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При проведении морфологического исследования стенки кишечника интактных крыс контрольной группы установлено, что ее строение соответствовало нормальному, с учетом особенностей данного вида.
У животных второй группы (ПБ), подвергнутых введению пробиотиков в течение 14 дней, изменения слизистой кишечника значимо не отличались от таковых у крыс в контрольной группе (рис. 1, 2). Кишечные ворсинки правильной пальцевидной формы, с поверхности выстланы однослойным призматическим эпителием с хорошо выраженной исчерченной каемкой.
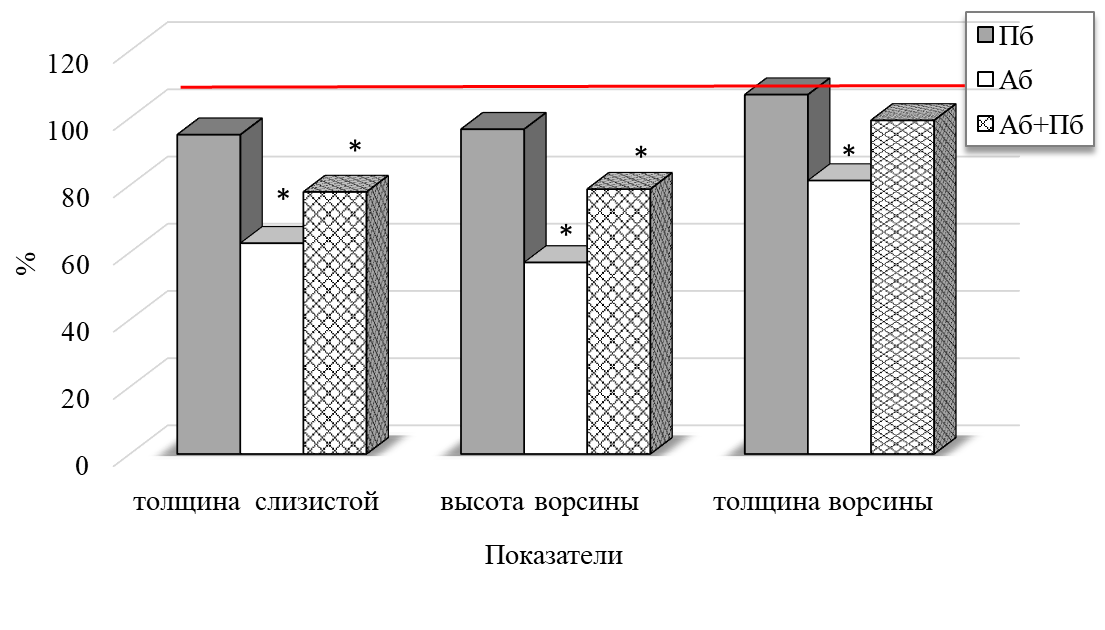
Рис. 1. Изменение показателей слизистой оболочки тонкого кишечника крыс при изолированном и комбинированном введении пробиотика (ПБ) и антибиотика (АБ) (по сравнению с показателями крыс контрольной группы, принятых за 100 %).
Примечание: * – достоверность различий по сравнению со значениями контрольной группы животных по U-критерию Манна-Уитни.
Аб+Пб
Аб
К
Пб
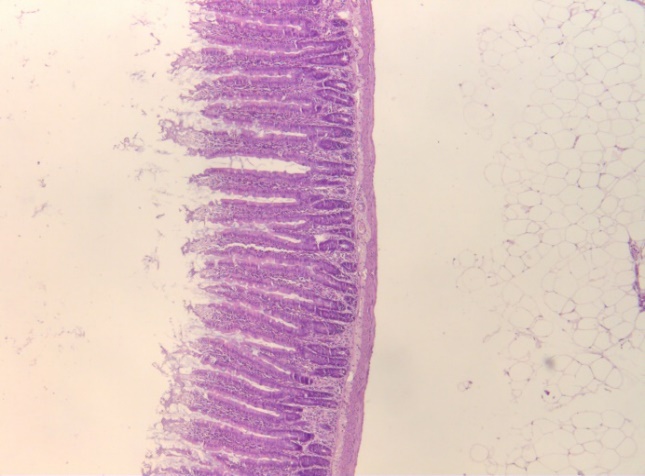
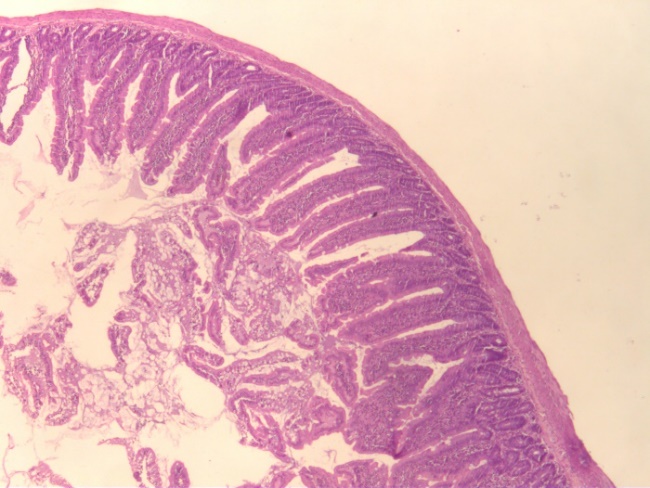
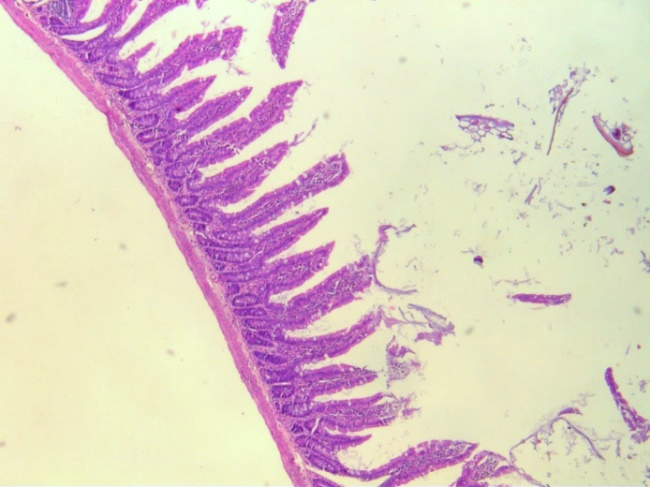
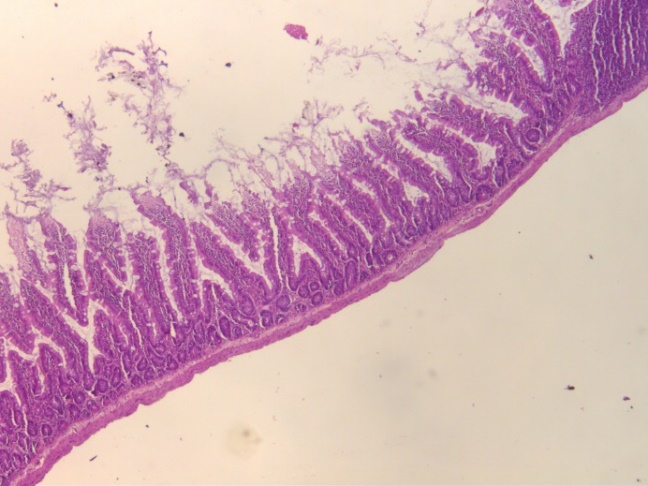
Рис. 2. Гистологические срезы стенки средней части тонкого кишечника крыс в контроле (К), при изолированном и комбинированном введении пробиотика (ПБ) и антибиотика (АБ) (ув. х5).
При этом отмечается тенденция к увеличению толщины эпителиоцитов в ворсинках на 8,34 %, а также выраженное увеличение количества железистых бокаловидных клеток на 51,32 % (p<0.05) относительно соответствующих значений у крыс контрольной группы (рис. 3).
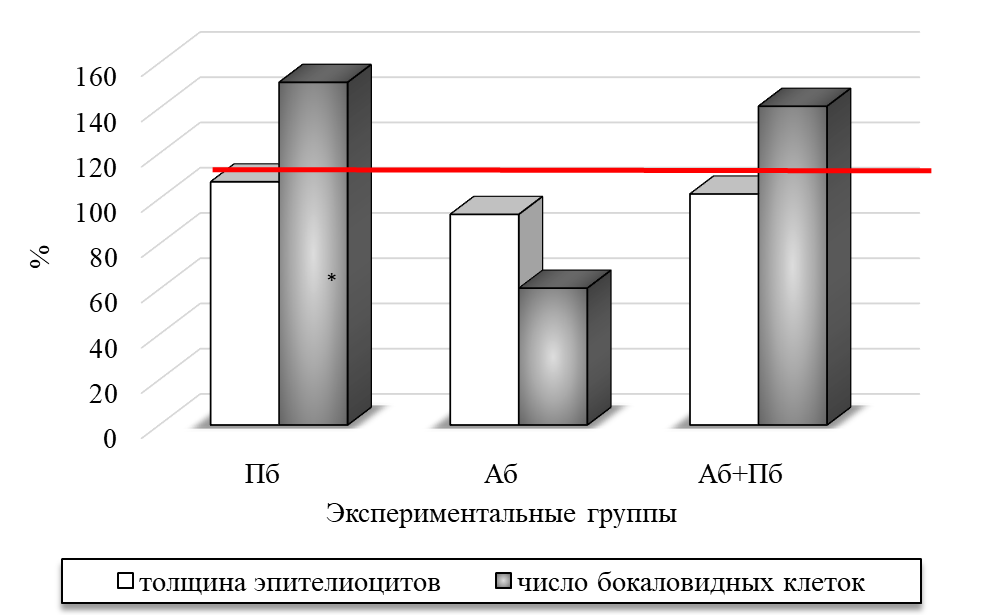
Рис. 3. Изменение толщины эпителиоцитов и количества бокаловидных клеток в ворсинках тонкого кишечника при изолированном и комбинированном введении пробиотика (ПБ) и антибиотика (АБ) (по сравнению с показателями крыс контрольной группы, принятых за 100 %).
Примечание: * – достоверность различий по сравнению со значениями контрольной группы животных по U-критерию Манна-Уитни.
На гистопрепаратах отмечается увеличение содержания гликопротеинов в поверхностной слизи и наполненности бокаловидных клеток крипт и ворсин (рис. 4). Увеличение содержания поверхностной слизи и количества бокаловидных клеток в ворсинках тонкого кишечника при введении пробиотиков свидетельствует о положительном воздействии пробиотиков на барьерную функцию кишечника и улучшении его морфофункционального состояния. Увеличение количества бокаловидных клеток, сопровождающееся усилением слизеобразования эпителием тонкой кишки, связано с активацией механизмов восстановления слизистой кишечника, улучшением структуры ворсинок и поддержанием их функции.
Пб
К
Аб
Аб+Пб
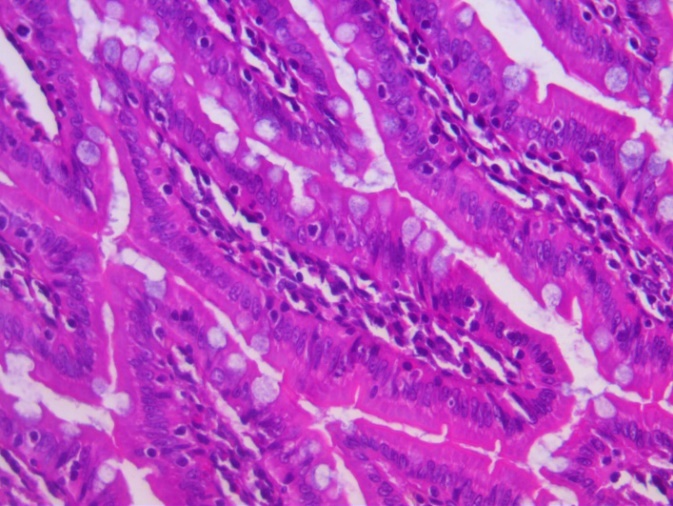

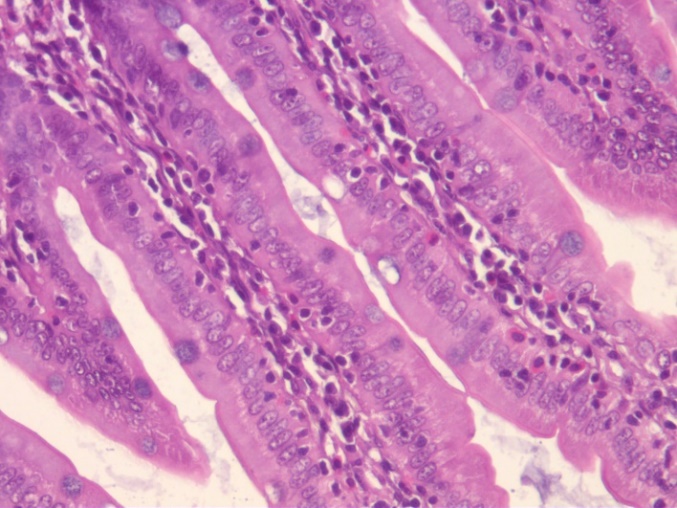
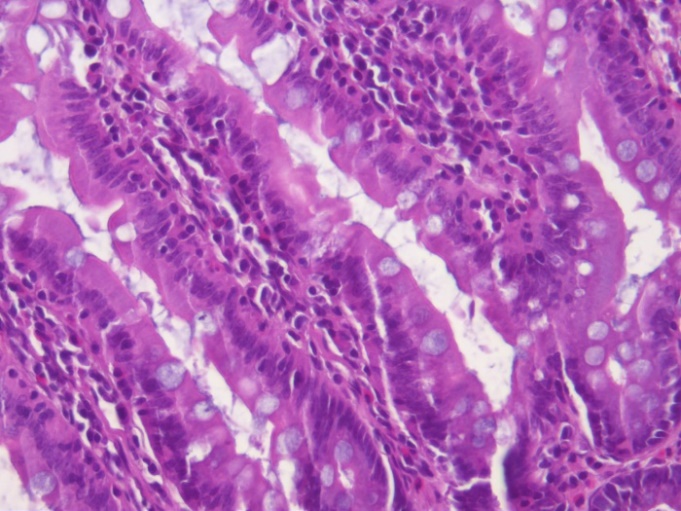
Рис. 4. Гистологические срезы ворсинок тонкого кишечника крыс в контроле (К), при изолированном и комбинированном введении пробиотика (ПБ) и антибиотика (АБ) (ув. х10)
При моделировании дисбиоза у крыс третьей группы (АБ) отмечается статистически значимое уменьшение толщины слизистой оболочки, высоты и толщины ворсинок тонкого кишечника на 37,28 % (p<0.05), 43.01 % (p<0.05) и 18.64 % (p<0.05) соответственно по сравнению со значениями животных контрольной группы (К) (рис. 1, 2).
Зарегистрировано незначительное уменьшение толщины эпителиоцитов на 6,74 % и уменьшение количества бокаловидных клеток (на 39,52 %; p<0.05) по сравнении с контролем (рис. 3). При этом верхушки отдельных кишечных ворсинок были полностью или частично лишены эпителия, с обнажением подслизистого слоя. Отмечается формирование в строме слизистой оболочки и подслизистого слоя полиморфных клеточных инфильтратов с примесью значительной доли эозинофилов. Данные изменения отражают дегенеративные изменения в слизистой оболочке, которые могут быть связаны с нарушением процессов регенерации эпителия, повреждение их структуры приводит к уменьшению площади поверхности кишечника, что снижает эффективность всасывания питательных веществ. Это свидетельствует о том, что антибиотики вызвали структурные и функциональные повреждения кишечной слизистой у крыс при моделировании дисбиоза.
При комбинированном введении антибиотика и пробиотика у животных четвёртой группы (АБ+ПБ) отмечается значимое уменьшение толщины слизистой оболочки на 22.05 % (p<0.05), высоты ворсинок на 21.20 % (p<0.05) относительно значений у животных контрольной группы. При этом толщина ворсинок и эпителиоцитов была сопоставима с таковой интактных крыс. Количество бокаловидных клеток увеличилось на 40,87 % (p<0.05) по сравнению со значениями группы К.
Снижение толщины слизистой оболочки у крыс четвертой группы отражает повреждение тканей вследствие влияния антибиотиков. Это может быть результатом разрушения микробиоты, воспаления и снижения регенеративных способностей эпителия. Увеличение количества бокаловидных клеток свидетельствует о защитной и восстановительной активности пробиотиков. Пробиотики стимулируют выработку муцина и поддерживают эпителиальные клетки, что компенсирует повреждения, вызванные антибиотиками. Комбинирование антибиотиков и пробиотиков вызвало баланс между повреждающими и восстанавливающими процессами. Уменьшение толщины слизистой указывает на наличие повреждения, но увеличение количества бокаловидных клеток говорит о начале процессов регенерации и усилении барьерной функции. Такое состояние отражает переходный этап адаптации кишечной слизистой к комбинированной терапии. Это подтверждает необходимость включения пробиотиков в схемы антибиотикотерапии для смягчения побочных эффектов антибиотиков и ускорения восстановления слизистой.
Таким образом, изменение морфометрических показателей кишечника при введении антибиотиков, пробиотиков и их комбинированном применении отражает различную степень влияния этих веществ на состояние слизистой оболочки. При моделировании дисбиоза антибиотиками отмечается уменьшение толщины слизистой оболочки, снижение высоты и толщины ворсинок. Нарушается структура ворсинок, что приводит к ухудшению абсорбционной функции кишечника. Повреждение эпителия вызывает снижение количества бокаловидных клеток, уменьшает секрецию муцина, что ослабляет барьерную функцию. Показано, что антибиотики могут оказывать либо прямое (в основном токсическое) действие на слизистую либо опосредованное за счет их влияния на микробиоту [20, 21]. Отмечается уменьшение размеров крипт и ворсинок в тонкой кишке, толщины ее стенки, а также происходило увеличение проницаемости слизистой оболочки [22].
При введении пробиотиков практически не изменяется состояние слизистой кишечника, увеличивается количество бокаловидных клеток. Секреция муцина усиливается, что способствует защите слизистой от патогенов и токсинов. При применении пробиотиков отмечается стимулирование процессов регенерации в слизистой кишечника, увеличение митотического индекса в эпителиоцитах [23].
Показано, что пробиотики могут способствовать экспрессии белков плотных контактов в эпителиальных клетках кишечника, муцине и эпителии кишечника, а также усиливать функцию барьера эпителиальных клеток кишечника [24], способствовать секреции слизи эпителиальными клетками для формирования защитного слоя между слизистой оболочкой и микробами, тем самым предотвращая транслокацию бактерий и токсинов и подавляя рост патогенов, а также адгезию и инвазию патогенных бактерий в эпителиальные клетки кишечника [23].
Комбинированное введение антибиотиков и пробиотиков вызывает уменьшение толщины слизистой оболочки (меньше, чем при введении только антибиотиков). Антибиотики вызывают повреждения, но пробиотики частично компенсируют это, ускоряя восстановление. Отмечается умеренное уменьшение высоты, сохраняя часть абсорбционной функции. То есть введение пробиотиков на фоне дисбиоза позволяет снизить негативное воздействие антибиотиков на кишечник и ускорить восстановление его морфофункционального состояния, т.е. отмечается синергетический эффект – уменьшение негативных побочных эффектов антибиотиков, поддержание нормальной структуры и функций слизистой оболочки при комбинированном применении пробиотиков и антибиотиков. Это подчеркивает важность использования пробиотиков как вспомогательного средства при антибиотикотерапии.
Таким образом, исследование эффективности новых микробиотных консорциумов пробиотиков имеет значительную практическую значимость, предоставляет данные для дальнейшего применения этих пробиотиков в медицине и ветеринарии, а также способствует пониманию их механизмов действия и потенциальной пользы. С учетом роста проблемы антибиотикорезистентности и нежелательных побочных эффектов при длительном приеме антибиотиков, поиск альтернативных методов лечения и профилактики, таких как пробиотики, становится все более важным.
ЗАКЛЮЧЕНИЕ
- Выявлены изменения морфометрических показателей слизистой тонкого кишечника у крыс при введении пробиотика как при изолированном введении, так и на фоне модели дисбиоза.
- При введении пробиотика у животных зарегистрировано значимое увеличение количества железистых бокаловидных клеток на 51,32 % (p<0.05) относительно значений у крыс в контроле, отмечено положительное воздействие пробиотиков на барьерную функцию кишечника и улучшение его морфофункционального состояния.
- При введении антибиотика у животных отмечается статистически значимое уменьшение толщины слизистой оболочки, высоты и толщины ворсинок тонкого кишечника на 37,28 % (p<0.05), 43.01 % (p<0.05) и 18.64 % (p<0.05) соответственно, а также уменьшение толщины эпителиоцитов на 6,74 % и уменьшение количества бокаловидных клеток на 39,52 % (p<0.05) по сравнению со значениями у животных в контрольной группе (К), что свидетельствует о структурных и функциональных повреждениях кишечной слизистой у крыс при моделировании дисбиоза.
- У животных четвёртой группы, подвергнутых комбинированному введению пробиотика и антибиотика, отмечается уменьшение толщины слизистой оболочки на 22.05 % (p<0.05), высоты ворсинок на 21.20 % (p<0.05) относительно значений у животных контрольной группы, а также увеличение количества бокаловидных клеток на 40,87 % (p<0.05) по сравнению с данными интактных крыс, что свидетельствует о способности пробиотиков на фоне дисбиоза снизить негативное воздействие антибиотиков на кишечник и ускорить восстановление его морфофункционального состояния.
Работа выполнена на базе ЦКП «Экспериментальная физиология и биофизика» и ЦКП «Молекулярная биология» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского»
- Lin L., Zhang J. Role of intestinal microbiota and metabolites on gut homeostasis and human diseases, BMC Immunology, 18, 2 (2017) doi: 10.1186/s12865-016-0187-3.
- Oganezova I. A. Intestinal microbiota and immunity: immunomodulatory effects of Lactobacillus rhamnosus GG, RMZh, 9, 39 (2018).
- Bäckhed F., Ley R. E., Sonnenburg J. L., Peterson D. A., Gordon J. I. Host-bacterial mutualism in the human intestine, Science, 307, 1915 (2005).
- Rajilić-Stojanović M., Shanahan F., Guarner F., de Vos W. M. Phylogenetic analysis of dysbiosis in ulcerative colitis during remission, Inflamm Bowel Dis., 19, 481 (2013).
- Tarasova G. N., Zubova A. D. Effect of therapy of ulcerative colitis on the bacterial profile of colonic microbiota, South-Russian Journal of Therapeutic Practice, 4(3), 22 (2023).
- Uspensky Yu. P., Fominikh Yu. A. Antibiotic-associated diarrhea – a new problem of civilization, Consilium Medicum, 14, 8, 51 (2012).
- Ukrainets R. V., Korneva Yu. S. Intestinal microbiocenosis, increased intestinal permeability syndrome (leaky gut syndrome) and a new look at the pathogenesis and possibilities of prevention of known diseases (literature review), Medicine, 8(1), 20 (2020).
- Maksimova O. V. Gervazieva V. B., Zverev V. V. Intestinal microbiota and allergic diseases, Journal of Microbiology, Epidemiology and Immunobiology, 91, 3, 49 (2014).
- Ardatskaya M. D. Probiotics, prebiotics and metabiotics in the correction of intestinal microecological disorders, 94 (Moscow: Medicine, 2015).
- Jiang He, Lemei Chang, Lange Zhang [et al.] Effect of probiotic supplementation on cognition and depressive symptoms in patients with depression: A systematic review and meta-analysis, Baltimore, 24, 47 (2023).
- Klyaritskaya I. L., Moshko Y. A., Maksimova E. V., Shelikhova E. O., Rabotyagova Y. S. Modern concepts of probiotics use in gastroenterology, Crimean Therapeutic Journal, 1, 9 (2021).
- Nagalingam N. A., Lynch S. V. Role of the microbiota in inflammatory bowel diseases, Inflamm Bowel Dis., 18 (5), 968 (2012).
- Looijer-van Langen M. A. C., Dieleman L. A. Prebiotics in chronic intestinal inflammation, Inflamm Bowel Dis., 15 (3), 454 (2009).
- Russo F., Linsalata M., Orlando A. Probiotics against neoplastic transformation of gastric mucosa: effects on cell proliferation and polyamine metabolism, World J Gastroenterol., 20 (37), 13258 (2014).
- Parfenov A. I. Antibiotic-associated diarrhea, Expert. and Clin. gastroenterol., 5, 92 (2002).
- Uspensky Yu. P., Baryshnikova N. V. World tendencies to the expansion of probiotics use sphere: relevance of Bacillus subtilis-based products application. Consilium Medicum, Gastroenterology, 4 (56), 75 (2012).
- Mustafina L. R., Gerasimov A. V., Potapov A. V. [et al]. Private course of histology: textbook: in 2 parts, 169 (Tomsk: SibGMU, 2022).
- Mytsik A. V. Using the ImageJ program for automatic morphometry in histological studies, Omsk scientific bulletin, 2, 187 (2011).
- Timchenko L. D., Vakulin V. N. Fundamentals of microscopic technique for biologist: textbook, 164 (Stavropol: Publishing house of SGU, 2005).
- Lobzin Yu. V., Makarova V. G., Krovyakova E.R. Intestinal dysbacteriosis (clinic, diagnostics, treatment): A guide for doctors, 256 (St. Petersburg, 2003).
- Belmer S. V. Antibiotic associated intestinal dysbacteriosis, RMZh, 12, 3, 148. (2004).
- Gut microflora: Digestive physiology and pathology / Ed. by J. C. Belmer. C. Rambaud, J. P. Buts, G. Corthier, B. Flourie, 247 (Paris, 2006).
- Zhang Y., Liu M., Zhao Y. [et al] Progress in probiotic and adjuvant therapy SMECTA studies in ulcerative colitis, Chin J Microecol., 25, 1356 (2013).
- Hering N. A., Fromm M., Schulzke J. D. Determinants of colonic barrier function in inflammatory bowel disease and potential therapy, J Physiol., 590, 1035 (2012).



