EVALUATION OF ANTIOXIDANT AND ANTIRADICAL ACTIVITY OF LIMONIUM GMELINII (WILLD.) KUNTZE ROOT EXTRACT
ОЦЕНКА АНТИОКСИДАНТНОЙ И АНТИРАДИКАЛЬНОЙ АКТИВНОСТИ ЭКСТРАКТА КОРНЕЙ LIMONIUM GMELINII (WILLD.) KUNTZE
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №1, 2024
Publication text (PDF): Download
UDK: 615.214
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Tsibizova A. A., Astrakhan State Medical University, Astrakhan, Russian Federation
Murtalieva V. Kh., Astrakhan State Medical University, Astrakhan, Russian Federation
Sergalieva M. U., Astrakhan State Medical University, Astrakhan, Russian Federation
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-1-253-261
PAGES:from 253 to 261
STATUS:Published
LANGUAGE:Russian
KEYWORDS: free-radical processes, Limonium gmelinii, extract, phenolic compounds, flavonoids, antioxidant activity.
ABSTRACT (ENGLISH):
Today it is known that free-radical oxidation, in particular, generation of reactive oxygen species initiating lipid peroxidation, belongs to normal biochemical processes necessary for the regulation of membrane permeability, vision mechanisms, nerve excitation, and others. Under physiological conditions, the processes of free-radical oxidation proceed with relatively low intensity, which excludes the accumulation of end products of lipid peroxidation in concentrations harmful to the body. Moreover, lipid peroxidation products in low concentrations are necessary for regulation of cell membrane permeability, stability of lipoprotein complexes and fulfilment of other functions.
When the redox balance between biochemical mechanisms of defence against the harmful effects of its highly reactive products of free-radical nature and repair of oxidative damage to cellular structures of biomolecules is disturbed, oxidative stress occurs. For this reason, the interest of researchers to search and study the means that exhibit antioxidant effects for the prevention and treatment of diseases that occur by strengthening the processes of free-radical oxidation is not weakening.
In this respect, medicinal plant sources containing a complex of biologically active compounds with antioxidant activity are promising. One of the promising groups of biologically active compounds with antioxidant properties are plant phenolic compounds.
The roots of L. gmelinii collected during the flowering phase in April 2023 in the vicinity of the Astrakhan region were used in this work. The content of phenolic compounds and flavonoids in the raw material was studied by spectrophotometric method.
Assessment of antiradical activity of phytoextract was carried out using spectrophotometric method of determining the degree of inhibition of superoxide radical in alkaline dimethyl sulfoxide solution. The antioxidant activity of L. gmelinii root extract was studied using spectrophotometric method of total antioxidant activity determination on the model of Fe+2-induced peroxidation of arachidonic acid.
In general, the obtained experimental data confirmed the presence of pronounced antioxidant and antiradical activity of the studied phytoextract. The study revealed that the degree of inhibition of superoxide radicals by L. gmelinii root extract was 31.25±1.12 %, the total antioxidant activity was 56.78±1.34 %.
High antioxidant and antiradical activity of the extract from the roots of L. gmelinii is due to the peculiarities of the chemical composition and quantitative content of various classes of polyphenolic compounds of this plant, which contribute to the «quenching» of free radicals, absorption of reactive oxygen species and have an inhibitory effect on the processes of lipid peroxidation.
The results of the study indicate that the phytoextract of L. gmelinii is an effective antioxidant agent capable of «quenching» chain free-radical processes, destroying the structures of reactive oxygen species. Thus, the obtained experimental data indicate that it is promising to develop a medicinal product based on the roots of L. gmelinii, growing in the Astrakhan region, to create phytopreparations with antioxidant properties and antiradical activity.
ВВЕДЕНИЕ
На сегодняшний день известно, что свободно-радикальное окисление (СРО), в частности, генерация активных форм кислорода (АФК), инициирующие перекисное окисление липидов (ПОЛ), относится к нормальным биохимическим процессам, необходимым для осуществления регуляции проницаемости мембран, механизмов зрения, нервного возбуждения и др. [1]. В физиологических условиях процессы СРО протекают с относительно низкой интенсивностью, что исключает накопление конечных продуктов ПОЛ в концентрациях, вредных для организма. Более того, продукты ПОЛ в низких концентрациях необходимы для регуляции проницаемости клеточных мембран, стабильности липопротеиновых комплексов и выполнения других функций [2].
При нарушении окислительно-восстановительного баланса между биохимическими механизмами защиты от вредного воздействия его высокореакционноспособных продуктов свободнорадикальной природы и восстановления окислительного повреждения клеточных структур биомолекул, возникает окисидативный стресс [3]. По этой причине не ослабевает интерес исследователей к поиску и изучению средств, проявляющих антиоксидантные эффекты в целях профилактики и лечения заболеваний, протекающих с усилением процессов СРО [4].
В этом отношении перспективными являются лекарственные растительные источники, содержащие комплекс биологически активных соединений (БАС), обладающих антиоксидантной активностью. Одной из перспективных групп БАС, обладающей антиоксидантными свойствами, являются растительные фенольные соединения (ФС) [5, 6] Научными исследованиями отмечено, что антиоксидантное действие ФС объясняется их способностью связывать ионы тяжелых металлов, образуя устойчивые комплексы, которые выступают в роли катализаторов окислительных процессов, а также вступать во взаимодействие с высокоактивными свободными радикалами, переводя последние в малоактивные. [7].
В этой связи, целью исследования явилась оценка антиоксидантной и антирадикальной активности экстрактов корней кермека Гмелина (Limonium gmelinii (Willd.) Kuntze) в эксперименте in vitro.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали собранные в апреле 2023 г. в окрестностях Астраханской области корни L. gmelinii. Пробоподготовка корней была осуществлена согласно требованиям нормативной документации: ОФС.1.5.3.0007.15, ОФС.1.5.0003.15, ОФС.1.5.3.0004.15. Корни L. gmelinii высушивали, измельчали до размера частиц 2-3 мм и подвергали экстракции 70 % этанолом в соотношении сырье – экстрагент 1:10 настаиванием на водяной бане при температуре 60 оС при периодическом перемешивании в течение 3 часов.
Содержание ФС и флавоноидов в подземной части L. gmelinii изучали спектрофотометрически. Общее содержание ФС в сырье определяли путем добавления к 0,5 мл полученного экстракта 1 мл фосфорномолибденово-вольфрамового реактива, 10 мл воды, 10,6 % раствора Na2CO3 и через 30 минут измеряли оптическую плотность исследуемого раствора при λ = 760 нм, используя в качестве раствора сравнения воду. Сумму ФС в пересчете на галловую кислоту (CAS № 149-91-7, чистота основного вещества более 98 %) рассчитывали по формуле:
Хмг/мл = Ах×mст×2500 / Аст×Vх,
где Ах – оптическая плотность исследуемого раствора; Аст – оптическая плотность стандартного раствора галловой кислоты; mст – масса навески галловой кислоты (г), Vx – объем исследуемого экстракта (мл) [8].
Содержание флавоноидов изучали, добавляя к 2 мл экстракта корней L. gmelinii 2 мл 1 % раствора AlCl3 в 95 % этаноле, 0,5 мл 33 % раствора CH3COOH. Оптическую плотность изучаемого экстракта измеряли через 20 минут при λ = 410 нм, применяя в качестве сравнения раствор, не содержащий AlCl3. Суммарное количество флавоноидов в исследуемом извлечении в пересчете на рутин (CAS № 5373-11-5, чистота основного вещества более 98,5 %) вычисляли по формуле:
Хмг/мл = Ах×Сст×5000 / Аст×Vх,
где Ах – оптическая плотность исследуемого раствора; Аст – оптическая плотность стандартного раствора рутина; Сст – концентрация стандартного раствора рутина (%), Vx – объем исследуемого экстракта (мл).
В целях повышения точности фитохимический анализ экстракта корней L. gmelinii проводили в пяти сериях. Полученные результаты обрабатывали статистически, определяли унифицированные метрологические характеристики и относительное стандартное отклонение полученных результатов (RSD, %).
Оценку антирадикальной активности фитоэкстракта проводили, используя спектрофотометрическую методику определения степени ингибирования супероксид-радикала в щелочном растворе диметилсульфоксида (ДМСО). К 50 мкл исследуемого фитоэкстракта прибавляли 3 мл щелочного раствора ДМСО (1 мл ДМСО содержит 0,1 мл 5 мМ раствора NaOH) и 0,2 мл 0,001 % раствора нитросинего тетразолия с последующей инкубацией течение 5 мин при комнатной температуре. Оптическую плотность раствора измеряли при λ = 560 нм. Антирадикальную активность экстракта рассчитывали по формуле:
% ингибирования = (Ах / Аст)×100 %,
где Ах – оптическая плотность исследуемого раствора, Аст – оптическая плотность стандартного образца.
Антиоксидантную активность извлечения из корней L. gmelinii изучали, применяя спектрофотометрический метод определения суммарной антиоксидантной активности на модели Fe+2-индуцированного перекисного окисления арахидоновой кислоты. К 50 мкл исследуемого фитоэкстракта прибавляли 1,0 мл водно-этанольного раствора арахидоновой кислоты и для активации перекисного окисления 50 мкл раствора FeSO4. Параллельно готовили эталонную пробу: в пробирки вместо опытной пробы добавляли 50 мкл изотонического раствора NaCl. Все пробы тщательно перемешивали и помещали на водяную баню (при Т = 37 °С) на 20 минут, с последующим центрифугированием при 3000 об/мин в течение 10 минут. После чего к 1,0 мл центрифугата добавляли 0,5 мл 0,8 % раствора тиобарбитуровой кислоты, перемешивали и помещали на кипящую водяную баню на 15 минут, охлаждали и измеряли оптическую плотность проб при λ = 532 нм, используя в качестве раствора сравнения изотонический раствор NaCl. Расчет антиоксидантной активности (АОА) растительного экстракта проводили по формуле:
АОА = (Аконтр – Ах/Аконтр)×100 %,
где Ах – оптическая плотность исследуемого раствора, Аконтр – оптическая плотность исследуемого образца [9]
В работе все измерения регистрировали на спектрофотометре ПЭ-5400В (Россия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Метрологическая характеристика и результаты количественного определения суммы ФС в исследуемом извлечении из корней L. gmelinii представлены в таблице 1 и на рисунке 1.
Таблица 1
Метрологические данные определения фенольных соединений
в корнях L. gmelinii
| № | Масса навески, г | Сумма ФС, мг/мл | Метрологические данные | RSD, % |
| 1 | 10,01 | 15,24 | Хср = 15,25
S2 = 0,0014 S = 0,038 Sx = 0,009 ɛ = 12,37 % εср = 5,11% |
2,32 |
| 2 | 10,00 | 15,24 | ||
| 3 | 10,01 | 15,26 | ||
| 4 | 10,02 | 15,25 | ||
| 5 | 10,00 | 15,25 |
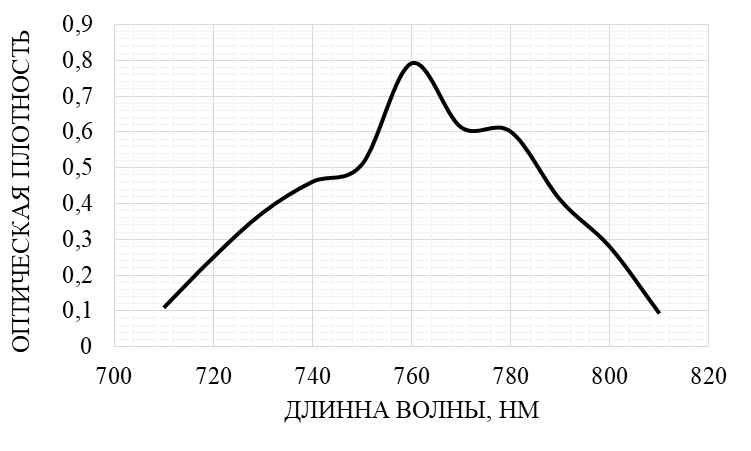
Рис. 1. Дифференциальный спектр поглощения фенольных соединений экстракта корней L. gmelinii.
В ходе эксперимента было выявлено, что максимум поглощения спиртового экстракта из корней L. gmelinii с при λ = 760 нм и оптической плотности (А) = 0,79 соответствует максимуму поглощения стандартного раствора галловой кислоты.
Принимая во внимание полученные результаты, было установлено, что максимум поглощения флавоноидов корней наблюдался при λ = 410 нм и А = 0,51, что соответствовало максимуму поглощения стандартного раствора рутина. По результатам спектрофотометрического анализа построен график зависимости значений оптической плотности от содержания флавоноидов в исследуемом фитоэкстракте (рис. 2).
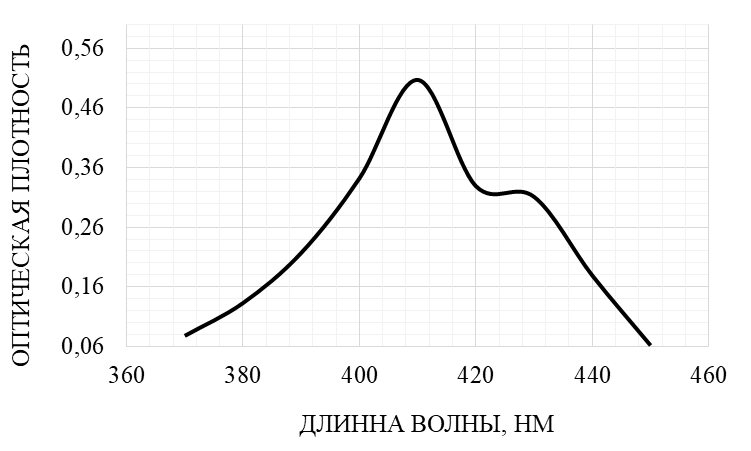
Рис. 2. Дифференциальный спектр поглощения флавоноидов экстракта корней L. gmelinii.
Метрологическая характеристика количественного содержания флавоноидов в сырье L. gmelinii представлена в таблице 2.
Таблица 2
Метрологические данные определения флавоноидов в корнях L. gmelinii
| № | Масса навески, г | Сумма флавоноидов, мг/мл | Метрологические данные | RSD, % |
| 1 | 10,01 | 5,98 | Хср = 6,00
S2 = 0,0025 S = 0,047 Sx = 0,016 ɛ = 14,75 % εср = 7,12% |
4,15 |
| 2 | 10,00 | 6,00 | ||
| 3 | 10,01 | 6,02 | ||
| 4 | 10,02 | 5,99 | ||
| 5 | 10,00 | 6,01 |
По результатам количественной оценки на содержание БАС экстракта корней L. gmelinii, произрастающих на территории Астраханской области и собранных во время фазы цветения, было выявлено, что исследуемый фитоэкстракт содержит 15,26±0,07 мг/мл (RSD = 2,32 %) фенольных соединений и 6,02±0,02 мг/мл
(RSD = 4,15 %) – флавоноидов.
Известно, что величина АОА более 10 % свидетельствует о наличии антиоксидантной активности. При расчете АОА учитывали, что экстракт имеет свою собственную окраску, которая поглощает определенную длину волны в видимой области спектра. В таблице 3 представлены результаты оценки антиоксидантной активности экстракта подземной части L. gmelinii.
Таблица 3
Антиоксидантная активность экстракта корней L. gmelinii
| Метод АОА | АОА экстракта корней L. gmelinii, % |
| Метод ингибирования супероксид-радикала | 31,25 ± 1,12 |
| Метод ингибирования ПОЛ | 56,78 ± 1,34 |
В целом, полученные экспериментальные данные, подтвердили наличие выраженной антиоксидантной и антирадикальной активности исследуемого фитоэкстракта. В ходе исследования было выявлено, что степень ингибирования супероксид-радикалов экстрактом корней L. gmelinii составила 31,25±1,12 %, суммарная АОА (степень ингибирования ПОЛ) – 56,78±1,34 %.
Высокая антиоксидантная и антирадикальная активность извлечения из корней L. gmelinii обусловлена особенностями химического состава и количественного содержания различных классов полифенольных соединений данного растения, которые способствуют «гашению» свободных радикалов, поглощению АФК и оказывают ингибирующее влияние на процессы ПОЛ [10, 11].
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования свидетельствуют о том, что фитоэкстракт L. gmelinii является эффективным антиоксидантным средством, способным предотвращать развитие свободнорадикальных процессов, разрушая структуры АФК. Таким образом, полученные экспериментальные данные свидетельствуют о том, что перспективным направлением является разработка фитопрепаратов, обладающих антиоксидантными и антирадикальными свойствами, на основе подземной части растения L. gmelinii, произрастающего в Астраханской области.
- Gabitova D. M. Mechanism of development of conditional radical oxidation processes in pathological processes. Bashkir Chemical Journal, 27(3), 32, (2020). doi: 10.17122/bcj-2020-3-32-35.
- Giesinger O. A., Dadali V. A. Free radical, peroxide and adventitious antioxidants. Therapist, 9, 36, (2021).
- Loskutova E. S., Vakhitov H. M., Kapralova A.M. [et al.], Lipoperoxidation processes in various pathological conditions and degree of correlation. Vyatka Medical Bulletin, 4(64), 92, (2019). doi: 10.24411/2220-7880-2019-10044.
- Martusevich A. K., Karuzin K. A., Samoilov A. S. Antioxidant therapy:consistent state, accessibility and prospects. Bioradicals and antioxidants, 5(1), 5, (2018).
- Gabitova D. M., Ryzhikova M. A. The effectiveness of the antioxidant action of plant flavonoids. Bashkir Chemical Journal, 27(4), 19, (2020). doi: 10.17122/bcj 2020 4 19 21.
- Korovkina A. S., Tsvetov N. S., Paukshta O. I. [et al.], Determination of the content of polyphenolic ingredients, antioxidant and antiadditional activity of ethanol extracts of Koenigia weyrichii plants produced at Colscom poluostrove. Chemistry of vegetable cheese, 3, 275, (2021). doi: 10.14258/jcprm.2021039226.
- Orlov Yu. P., Sviridov S. S., Kakulya Or. N. Pathophysiological aspects of acid, hypoxia and free radical calculation in critical conditions. Clinical nutrition and metabolism, 2(2), 66, (2021). doi: 10.17816/clinutr88951.
- Gavrilin M. S., Gritsenko Yu. S., Terekhov A. Yu. Determination of the amounts of phenolic compounds in the men’s Council is carried out sowing and evaluation of their anti-inflammatory activity. Chemistry of vegetable cheese, 3, 163, (2011).
- Fear Ya. L., Ignatovets O. S. Antioxidant and antiradic activity in vitro extracts from the leaves of Rubus chamaemorus L. (Rosaceae). Chemistry of vegetable cheese, 4, 319, (2021). doi: 10.14258/jcprm.2021049305.
- Teplova V. S., Isakova Or. P., Klein O. I. [et al.], Natural polyphenols: biological activity, pharmacological potential, through metabolic engineering (review). Applied Biochemistry and microbiology, 54(3), 215, (2018). doi: 10.7868/S0555109918030017.
- Furman Yu. S., Artyushkova Or. B., Anikanov A. S. Oxidative stress and antioxidants. Actual problems of social-humanitarian and scientific-technical knowledge, 1, 1, (2019).



