SANITARY AND BACTERIOLOGICAL ASSESSMENT OF COMMERCIAL MARINE FISH AND THE MARINE ENVIRONMENT NEAR THE COAST OF CRIMEA AND FRESHWATER FISH IN FARM FISHERIES OF THE PENINSULA
САНИТАРНО-БАКТЕРИОЛОГИЧЕСКАЯ ОЦЕНКА ПРОМЫСЛОВЫХ МОРСКИХ РЫБ И МОРСКОЙ СРЕДЫ ВБЛИЗИ ПОБЕРЕЖЬЯ КРЫМА И ПРЕСНОВОДНЫХ РЫБ В РЫБОВОДНЫХ ХОЗЯЙСТВАХ ПОЛУОСТРОВА
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №1, 2024
Publication text (PDF): Download
UDK: 579.63:639 (292.471)
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Kobechinsky V. G., Institute of Biochemical Technologies, Ecology and Pharmacy (structural subdivision) of V. I. Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
Stryukov A. A., Institute of Biochemical Technologies, Ecology and Pharmacy (structural subdivision) of V. I. Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
Artyomenko M. O. Institute of Biochemical Technologies, Ecology and Pharmacy (structural subdivision) of V. I. Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-1-113-130
PAGES:from 113 to 130
STATUS:Published
LANGUAGE:Russian
KEYWORDS: vibrios, species composition, sea water, commercial fish, mussels, Azov-Black Sea basin.
ABSTRACT (ENGLISH):
The shelf zones of the Republic of Crimea are places of mass migration of commercial fish – sawfish, anchovy, horse mackerel, silverside, herring, sprat, mackerel, etc. The coastal zone adjacent to the peninsula has a significant resource for growing commercial invertebrates (mussels, oysters, shrimp, etc.), but at the same time it experiences increasing anthropogenic pressure every year. Therefore, constant monitoring based on sanitary and bacteriological assessment of both the marine environment itself and the fish products and farmed invertebrates caught in these areas is so important.
The composition of seawater microflora has a wider spectrum than those found in the organisms of commercial fish and invertebrates. The following types of bacterioflora of the family Vibrionaceae have been identified in seawater: Vibrio parahaemolyticus, V. alginolyticus, V. vulnificus, V. alguillarum, V. fluvialis, and from the family Aeromonaceae, members of the genus Aeromonas. Moreover, it was V. alginolyticus, being a halophilic vibrio, that was sown from seawater more often than other species of the genus Vibrio. In total, 596 samples of sea and 243 samples of fresh water were studied over 2 years. TMC in seawater at fish sampling points was quite low (5.2–5.5 x 103 cells/g), increasing in summer at temperatures above 250 C to 8×104 cells/g. The contamination of soil with heterotrophic microflora, taking into account the seasons, varied from 4.6×109 to 9.3×1010 cells/g. An increase in bacterial contamination is observed in sea water and soils approaching urban areas due to the constant influx of terrigenous water, which is natural.
In organisms caught in the shelf zone of the seas and the Kerch Strait, 4 species of vibrios from the family were identified in 9 species of commercial fish and invertebrates (mussels). Vibrionaceae: Vibrio alginolyticus, V. parahaemolyticus, V. anguillarum, V. vulnificus and representatives of the genus Aeromonas, from the family Aeromonaceae, but their accumulation differs significantly in the species composition of fish. A total of 106 samples of aquatic organisms were selected to assess the bacterioflora. The most common Vibrio in the studied biomaterial was V. parahaemolyticus, which was sown in 68 samples (64.2 %), and it was found both in sea water and in marine organisms. Further, in descending order, vibrios of the genus Aeromonas were found (14/13.2 %), which were identified in 4 species of fish: red mullet, goby, carp, silver carp; V. anguillarum (12/11.3 %) was found only in pilengas; V. alginolyticus was found in biomaterial (10/9.4 %) of 4 species of hydrobionts: red mullet, sprat and anchovy, as well as in mussels. In mussels, V. parahaemolyticus and V. alginolyticus were most often sown, taking into account the sampling sites.
The highest incidence of aeromonads was established in the study of freshwater fish, but their level in tissues is extremely low. In general, the level of vibrio infection in marine commercial fish is quite low, so fish products from the Azov-Black Sea basin, according to our preliminary data, are safe for the population.
ВВЕДЕНИЕ
В России активно используется в пищевом рационе рыбная продукция, как из дикого улова, так и из аквакультуры. Федеральная служба государственной статистики РФ отмечает стабильный рост сектора рыболовства и аквакультуры с 2015 по 2022 год, вылов достиг общих объемов к 2023 г около 300 тыс. тонн [1]. По данным Минсельхоза потребление рыбы и рыбопродуктов в России на душу населения в 2022 году составило 22,6 кг/чел. в год с устойчивым ростом этого показателя по планам к 2030 г до 26-28 кг/чел. преимущественно за счет развития аквакультуры [2–4]. Поэтому крайне важно вести регулярный мониторинг за безопасностью данной продукции для населения по эпидемиологическим показателям.
Один из путей – регулярный контроль за микробиологическим составом морской воды, который на территории Российской федерации осуществляется в соответствии с ГОСТ 17.1.3.08-02 [5].
Прошедшие десятилетия в Азово-Черноморском бассейне уже запущены эвтрофикационные процессы в морских акваториях, загрязнение токсичными веществами морского шельфа, абразия берегов, сокращение видового разнообразия и рыбных запасов, существенные утраты рекреационных ресурсов, ограниченный охват планово-регулярной системой очистки морских вод в портах полуострова; нехватка современного комплекса водоочистных сооружений и обеззараживающих установок сточных вод населенных пунктов перед сбросом, соответствующих экологическим и санитарно-гигиеническим требованиям и т. д., что привело к снижению качества водных морских ресурсов [6, 7].
Поэтому лабораториями ФБУЗ «Центра гигиены и эпидемиологии в Республике Крым и городе федерального значения г. Севастополя» (Роспотребнадзора) осуществляется регулярный контроль за состоянием морской воды вблизи крымского побережья. По данным этой службы в 2021 г было исследовано 8449 проб морской воды на микробиологические показатели, из них 156 проб или 1,85 % (2020 год – 2,5 %), не отвечали требованиям безопасности по данным параметрам. По Республике Крым удельный вес нестандартных проб составил 1,65 % (2020 год – 2,4 %) (таблица 1). На контаминацию холерными вибрионами исследовано 1207 проб морской воды, нестандартные пробы не выявлены [8].
Таблица 1
Доля проб морской воды (%) по Республике Крым и г. Севастополю, не отвечающих санитарно-эпидемиологическим требованиям по микробиологическим показателям во временной динамике*
| Годы | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
| Республика Крым | 1,6 | 0,98 | 1,1 | 1,6 | 2,3 | 2,1 |
| г. Севастополь | 5,5 | 7,4 | 0,7 | 9,5 | 9,8 | 9,1 |
Примечание: *Источник: [8].
В целом по Республике Крым эти величины на достаточно низком уровне (0,98–2,3 %). В абсолютных цифрах рост незначителен, но отрицательная динамика все же четко прослеживается по крымскому региону. По санитарно-эпидемиологическим показателям прослеживается рост с 1,1 % до удвоения – 2,3 % в 2021 г., что безусловно сказывается на качественных показателях морской воды.
Поэтому представляет значительный интерес разногодичные исследования разнообразия и динамики численности наиболее часто встречающихся представителей семейства Vibrionaceae, которые преобладают среди гетеротрофной микрофлоры морской воды и выявляются в организмах промысловых рыбах и моллюсках.
Представители рода Vibrio являются факультативными анаэробами, обладают бродильным и дыхательным типами метаболизма. Для роста и развития нуждаются в присутствии в среде NaCl (2–3 % и выше). Значительная часть видов хорошо растет в лаборатории при 37 °C, но для ряда морских вибрионов достаточны температура 25 °С и ниже, они грамотрицательные и подавляющее большинство оксидазоположительные. Некоторые из них могут быть патогенными, как для людей, так и для водных животных за счет широкого спектра продуцируемых ими факторов [9–16].
Целью исследования было сравнительное изучение видового состава и численности гетеротрофных вибрионов, встречающихся в промысловых рыбах Азово-Черноморского бассейна и ряда пресноводных рыб, выращиваемых в рыбоводных хозяйствах полуострова, т.к. до настоящего времени этот вопрос мало изучен и публикации единичны [17–19].
МАТЕРИАЛЫ И МЕТОДЫ
Существуют разнообразные методики по выявлению видового состава вибрионов в морской воде и морских организмах, позволяющие проводить их точную диагностику. Особенно значительное число публикаций по выявлению бактериофлоры у моллюсков из разных регионов страны и мира [17, 20–26].
Рыбопродукты отбирают согласно ГОСТу (31339-2006), исследуют в соответствии с санитарными правилами для предприятий и суден, изготавливающих продукцию из рыб и других водных живых ресурсов [14].
Гидробионтов отправляют из точек отбора вдоль крымского побережья Черного и Азовского морей в закрытых банках, ведрах и других сосудах, доставляя в лабораторию. Мелкие экземпляры гидробионтов исследуют групповым методом, в одну пробу объединяют содержимое кишечника и жабр от 10–15 экземпляров, добытых на одном участке. В этом случае они могут быть доставлены в одной ёмкости или отбирают илососами и черпаками, кладут в стерильные банки (200 мл). На площадках пробы морской воды берут в пяти точках объёмом 100–200 мл (в каждой) из нижележащих слоев, на уровне 5 см и ниже, также захватывая черпаком слой ила по всей глубине площади [13, 14].
Рыбу непосредственно перед исследованием фиксируют на препаровальной доске брюшком вверх. Поверхность брюшка обрабатывают спиртом и ножницами, производя медиальный разрез. Желчный пузырь отсекают от печени, разрезают и делают отпечаток на пластинке щелочного агара. Остатки желчи вместе с желчным пузырем помещают во флаконы с 50–100 мл 1 % пептонной воды. Посев кишечника делают, отсекая несколько петель в верхнем, среднем и нижнем отделах кишечника. Содержимое кишечника засевают в 1 % пептонную воду, а внутренней поверхностью стенки делают отпечатки на агаровые пластинки.
У крупных рыб в накопительную среду отбирают содержимое желчного пузыря, желудка, кишечника и жабры. Мелких рыб (мальков) и др. мелких гидробионтов измельчают ножницами по 10–20 экз. в одной пробе и делают посев суспензии петлей на чашку с агаром и в 1 % пептонную воду.
Метод состоит из нескольких этапов: накопления, выделения, очищения и идентификации микроорганизмов.
I этап
Первоначальное накопление вибрионов: к исследуемой воде добавляют раствор основного пептона до 1 % концентрации. Определяют рН, в случае необходимости подщелачивают 10 % раствором NаOH до рН 9,3±0,2. Время инкубации 18–24 часа.
II этап
С первой среды накопления делают высевы: на щелочной агар (для исключения холерного вибриона); на одну из элективных сред и по 5–8 мл для второй среды накопления. Пересевы в жидкие и на плотные среды делают с поверхности жидкой среды большой бактериологической петлей диаметром 5 мм. Проводят исследование материала методом ПЦР на ген гемолизина после 6 ч инкубации первой среды накопления.
III этап
Высев со второй среды накопления на одну из элективных сред.
IV этап
Отбор подозрительных на галофильные вибрионы колоний в посевах на плотные среды нативного материала, а также в высевах из 1-й и 2-й накопительных сред.
Чашки с посевами просматривают в проходящем свете невооруженным глазом или с помощью лупы, а также под стереоскопическим микроскопом в косо проходящем свете и отбирают подозрительные на вибрионы колонии для выделения и идентификации культуры.
На щелочном агаре или агаре на основе морской воды колонии галофильных вибрионов типичной S-формы – круглые, гладкие, плоские, голубоватые, гомогенные, с неровными краями, диаметр колоний 4–6 мм, прозрачные в проходящем свете и светло-серые с голубым или зеленоватым оттенком под стереоскопическим микроскопом в косо проходящем свете.
На агаре на основе морской воды колониям V. alginolyticus и V parahaemolyticus присущ эффект «роения». На элективных средах тиосульфат-цитрат-сахарозный агар с желчью (ТСВS агар) колонии V. alginolyticus имеют ярко-желтую окраску на зеленом фоне среды, полупрозрачные (рисунок 1).
Типичные колонии V. parahaemolyticus – круглые непрозрачные зеленого или голубого цвета диаметром 2–3 мм. Размеры колоний на агаре с использованием морской воды через 18–24 ч инкубации достигают 4–6 мм в диаметре.
На среде СЭДХ колонии V. alginolyticus имеет ярко-желтую окраску на голубом фоне среды, полупрозрачные, V. parahaemolyticus – синие. Размеры колоний на щелочном агаре через 18–24 ч инкубации достигают 3–5 мм в диаметре.
В отдельных случаях в посевах могут также встречаться атипичные колонии: на щелочном агаре – мутные с плотным центром, пигментированные (коричневые или светло-желтые), мелкие коккоподобные, шероховатые.
Подозрительные на галофильные вибрионы колонии, отсевают на одну из полиуглеводных сред (лактозосахарозная Клиглера), и на сектор пластинки щелочного агара для выделения чистой культуры, ее идентификации и определения чувствительности к антибиотикам.
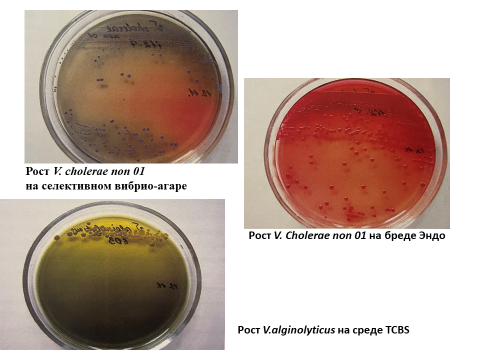
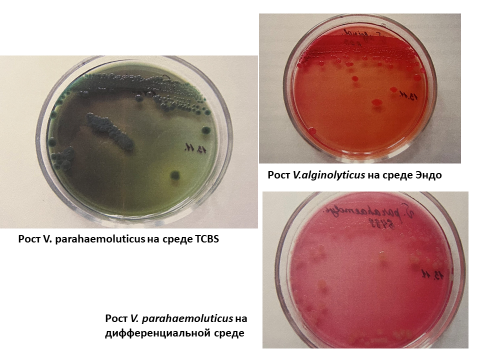
Рис. 1. Выращенные на различных питательных средах представители сем. Vibrionaceae.
V этап (через 24–36 ч от начала исследования)
Отбор культур для идентификации. На полиуглеводных средах отбирают культуры с типичным характером роста и изменениями, на лактозосахарозной среде наблюдается характерное для кислой реакции изменение цвета столбика при сохранении цвета скошенной части без образования газа.
С культурами, выросшими на пластинке щелочного агара ставят пробу на индофенолоксидазу на специальных индикаторных бумажках окси-тест или изготовленных в условиях лаборатории. С колониями, обнаруженными на цветных средах, пробу на оксидазу не проводят. Определяют морфологию микроорганизмов, а также чистоту отобранных культур, выросших на щелочном агаре и полиуглеводных средах. Культуры, дающие характерные изменения на полиуглеводных средах и положительные в пробе на оксидазу, проверяют в слайд-агглютинации с холерными сыворотками О и RO в разведении 1:50 для исключения холеры.
Проводят идентификацию выделенных на полиуглеводных средах культур, путем посева на следующие питательные среды: лактоза, манит, сахароза, манноза, арабиноза, инозит, Кодам, Хью-Лейфсона, бульон Кларка с 3 % NaCl, бессолевую пептонную воду, пептонную воду с 7 % NaCl, пептонную воду с 10 % NaCI, посев на пептонную воду с 3 % NaC1 для определения сероводорода, индола, протеолитических свойств, аминокислоты – лизин, аргинин, орнитин, а также контроль аминокислот. Для посева на биохимический ряд используют обычно 3-х часовую бульонную культуру.
VI этап
Учитывают результаты идентификации и выдают окончательный ответ о выделении культуры вибриона. Эпидемическую значимость оценивают по гемолитической активности и по результатам ПЦР. Также её оценивают по гемолитической активности на среде Вагатцума с определением гена гемолизина.
Культуры, имеющие признаки галофильных вибрионов по морфологии колоний и клеток, тесты на индофенолоксидазу и ферментативную активность на полиуглеводной среде, не агглютинирующиеся на стекле холерными сыворотками 01 и 0139 серогрупп, идентифицируют по тестам, определяющим принадлежность их к родам Aeromonas или Vibrio.
Анализ литературы [13–16] и нормативной документации [10–14] показал, что безопасность морской воды в эпидемическом отношении определяется, в первую очередь по общему микробному числу (ОМЧ). Этот показатель показывает степень бактериального загрязнения пробы воды, поэтому, чем она выше, тем больше вероятность присутствия патогенных микроорганизмов. В свете этого такие данные имеет большую информативность при сравнительных исследованиях, его повышение указывает на микробную контаминацию воды, причем эффективность результатов повышается при многократных исследованиях [13, 15].
На рисунке 2 показаны точки отбора проб рыб и моллюсков вдоль морского побережья полуострова и аквакультурных хозяйств в РК.
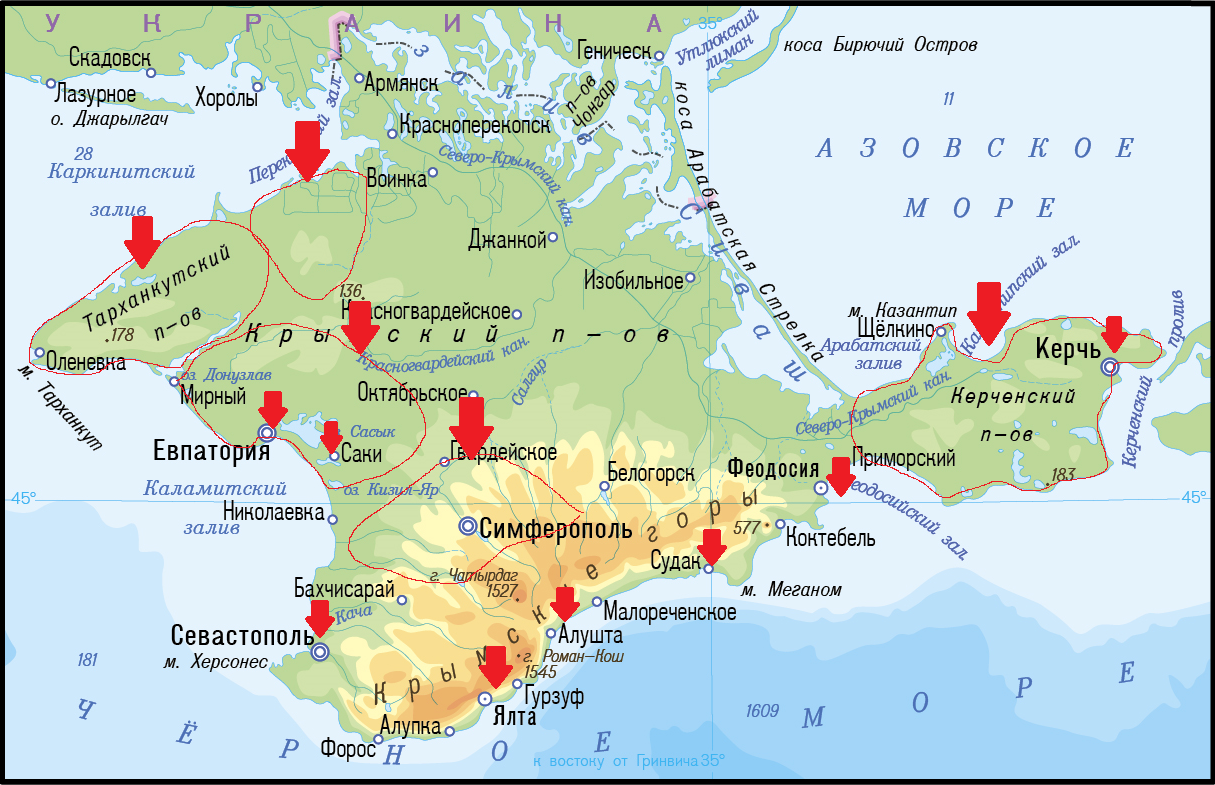
Рис. 2. Районы отбора проб морских и пресноводных рыб, моллюсков в РК: г. Керчь, Ленинский район, Симферопольский район, г. Саки, Сакский район, г. Феодосия, г. Судак, г. Евпатория, Черноморский район, Раздольненский район, г. Ялта, г. Алушта, г. Севастополь
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Всего за 2 года было исследовано 596 проб морской и 243 пробы пресной воды. ОМЧ в морской воде в точках отбора проб рыб был достаточно низкий
(5,2–5.5х103 кл./г), повышаясь в летний период при температуре более 25 0С до 8х104 кл/г. Обсемененность грунта гетеротрофной микрофлорой с учетом сезонов изменялась от 4,6х109 до 9,3х1010 кл/г. Повышение бактериальной контаминации отмечается в морской воде и грунтах, приближающихся к городским территориям из-за постоянного притока терригенной воды, что закономерно.
В морской воде были выявлены следующие виды сем. Vibrionaceae: V. alginolyticus, V. parahaemolyticus, V. anguillarum, V. fluvialis, V. vulnificus и представители рода Aeromonas из сем. Aeromonaceae. Виды V. cholerae non OI и V. cholerae OI39 высевались единично только в морской воде, взятой вблизи берега в местах впадения малых рек в море (в городах Ялта и Алушта).
В точках отбора проб морской воды и рыбопромысла холерные вибрионы не были выявлены.
Анализируя состав микрофлоры изучаемых водных организмов, учитывали, как доминирующие виды вибрионов, так и физиологическое состояние изучаемых проб различных видов рыб и моллюсков. Известно, что для любых животных характерна своя нормальная микрофлора, выполняющая множество функций, в том числе защиту от патогенных микроорганизмов [13–15]. На выявление спектра вибриофлоры в течение 2020–2021 г. проводились исследования гидробионтов – рыб и мидий (таблица 2). Рассмотрим распределение видов вибрионов, выделенных из проб рыбной продукции в лаборатории.
Таблица 2
Количество проб, в которых высевались патогенные представители сем. Vibrionaceae и сем. Aeromonaceae из гидробионтов Азово-Черноморского бассейна и представителей видов аквакультуры рыбохозяйств Республики Крым
| Вид рыбы и мидии | V. alginolyticus | V. parahaemolyticus | V. anguillarum | V.vulnificus | Aeromonas | Всего | |
| Абс. | % | ||||||
| Барабуля (Mullus barbatus ponticus) | 2 | 10 | 0 | 0 | 4 | 16 | 15,1 |
| Бычок-сирман (Neogobius syrman) | 0 | 18 | 0 | 0 | 6 | 24 | 22,6 |
| Карп (Cyprinus саrріо) | 0 | 0 | 0 | 0 | 2 | 2 | 1,9 |
| Пиленгас (Liza haematocheila) | 0 | 4 | 12 | 0 | 0 | 16 | 15,1 |
| Ставрида черноморская (Trachurus mediterraneus ponticus) | 0 | 12 | 0 | 0 | 0 | 12 | 11,3 |
| Толстолобик белый (Hypophthalmichthys molitrix) | 0 | 0 | 0 | 0 | 2 | 2 | 1,9 |
| Тюлька (Clupeonella cultriventris) | 2 | 2 | 0 | 0 | 0 | 4 | 3,8 |
| Хамса (Engraulis encrasicolus) | 2 | 18 | 0 | 2 | 0 | 2 | 20,8 |
| Мидия средиземноморская (Mytilus galloprovincialis) | 4 | 4 | 0 | 0 | 0 | 8 | 7,5 |
| % Кол-во | 10/9,4 | 68/64,2 | 12/11,3 | 2/1,9 | 14/13,2 | 106 | 100,0 |
По результатам проведенных работ в объектах исследований выявлено 4 вида вибрионов из сем. Vibrionaceae : Vibrio alginolyticus, V. parahaemolyticus, V. anguillarum, V. vulnificus и один род Aeromonas из сем. Aeromonaceae.
Дадим краткую характеристику этим представителям. Среди галофильных вибрионов по частоте и тяжести вызываемых ими заболеваний особое место занимают парагемолитические вибрионы. V. parahaemolyticus и V. alginolyticus – основные возбудители пищевых отравлений, вызванных зараженной рыбой или моллюсками. Они при посевах в лаборатории четко различимы, т. к. V. parahaemolyticus дает отрицательную реакцию Фогсс-Прскауэра и, как правило, не ферментирует сахарозу. Также этот вид не растет на 1 % пентонной воде с 10 % NaCI и не способен к ползучему росту в отличие от V. alginolyticus, который способен образовывать кислоту из сахарозы, маннозы и маннита [9, 13, 15, 27, 28]. Эти виды способны образовывать биопленки на чешуе рыб, повышая их численность [30].
Галофильный V. vulnificus, вызывает первичную септицемию, связанную с употреблением зараженных морепродуктов, а также раневые инфекции, возникающие при воздействии загрязненной морской воды на открытую рану, реже – инфекции желудочно-кишечного тракта [15, 16].
Род Aeromonas включает 12 видов, из которых в патологии человека имеют значение виды: A. hydrophila, A. caviae, A. veronia. Факультативные анаэробы. Растут на простых питательных средах и на щелочной пептонной воде. Хемоорганотрофы, обладающие дыхательным и бродильным типами метаболизма. Оптимальный диапазон размножения при температуре – 22–28 0С. Большинство видов хорошо растет при 37 0С, за исключением некоторых штаммов. Катаболизируют D-глюкозу и другие углеводы с образованием кислоты и часто газа. Оксидазоположительные и каталазоположительные. У человека вызывают широкий спектр заболеваний: гастроэнтериты, раневую инфекцию, диарею и др. [15, 27].
Анализ проводился на ведущих промысловых рыбах и мидиях Азово-Черноморского бассейна и ряда пресноводных рыб. Всего было проанализировано 106 проб на 9 видах. Самым распространенным вибрионом в изученном биоматериале был V. parahaemolyticus, который высевался в 68 пробах (64,2 %), причем он был обнаружен как в морской воде, так и в морских организмах. Далее в убывающем порядке встречались вибрионы рода Aeromonas (14/13,2 %), которые были выявлены в 4 видах рыб: барабуля, бычок, карп, толстолобик. V. anguillarum (12/11,3 %) обнаружен только в пиленгасе. V. alginolyticus установлен в биоматериале (10/9,4 %) следующих видов рыб: барабули, тюльки и хамсы, а также в мидиях. Самым редким вибрионом, который встретился лишь в хамсе, был V. vulnificus (2/1,9 %).
Следовательно, таксономический спектр вибрионов в морской воде Азово-Черноморского бассейна более разнообразен, чем в объектах промысла, что согласуется с данными исследователей из различных регионов страны и мира [20, 27–31]. Поэтому можно предположить, что не все виды бактерий из морской среды развиваются в рыбах и беспозвоночных, способны колонизировать и войти в состав ассоциированной микрофлоры внутренних поверхностей органов животных, вызывая патологию.
Рассмотрим более детально места взятия биоматериала на исследование с учетом территориальной принадлежности.
В Азовском море из морской воды отлавливались следующие виды рыб:
1. Пиленгас – Liza haematocheila (Temminck et Schlegel, 1845). Эти рыбы семейства кефалей обитают в западной части заливов Черного и Азовского морей. Их пищу составляет перифитон, детрит и мелкие беспозвоночные. Счищая верхний слой детрита с организмами бентоса, рыбы фильтруют их через жаберный фильтр в ротовую полость. Пробы рыб доставлялись из акватории Каркинитского залива и содержали V. parahaemolyticus и V. anguillarum. В пиленгасе обнаруживались типичные морские галофилы.
2. Тюлька черноморско-азовская – Clupeonella cultriventris (Nordmann, 1840). Рыба распространена в Азовском море и опресненных частях Черного моря, главным образом в его северо-западной части, у берегов Болгарии и Румынии, входит в низовья почти всех прилегающих рек. Отлов осуществлялся в Азовском море вблизи поселка Золотое. Исследования выявили в рыбе данного вида наличие V. alginolyticus. Обнаруженный в тюльке вибрион является галофильным микроорганизмом, естественным обитателем морских экосистем.
3. Бычок-сирман – Neogobius syrman (Nordmann, 1840). Этот вид распространен в Черном море у берегов Крыма, Кавказа, в Днепровском и Бугском лиманах, в реках Буг, Дон, в Азовском море вдоль западных и северных берегов. Питается тюлькой, хамсой и беспозвоночными (главным образом, ракообразными), в пище мальков преобладает зоопланктон. В рыбе, добытой в районе посёлка Золотое, обнаружен V. parahaemolyticus, один из наиболее часто высеваемых из моря вибрионов, и не менее распространенный в пресных водах Aeromonas.
4. Хамса или европейский анчоус – Engraulis encrasicolus (Linnaeus, 1758). Одна из важных промысловых рыб Черного и Азовского морей. Взрослые особи питаются личинками моллюсков и ракообразными. Отлов рыб производился в бухте Татарская в районе поселка Мысовое. Из хамсы, выловленной в Азовском море, высевался парагемолитический вибрион (V. parahaemolyticus) , что может указывать на попадание его в организм хищных рыб при поедании ими других, более мелких видов рыб. Выделенный из хамсы вид вибрионов очень распространен в морской воде, исследования выявили также эти вибрионы и у двустворчатых моллюсков (мидии). Пробы хамсы, привезенные из Керченского пролива отбирались в районе поселка Набережного и выявляли наличие в рыбе двух вибрионов – V. alginolyticus и V. parahaemolyticus. Причем V. alginolyticus в воде обнаруживается чаще, чем V. parahaemolyticus.
5. Барабуля или султанка – Mullus barbatus ponticus (Essipov, 1927). Она обитает в Черном море, реже в Азовском, заходит в осоленные заливы (Сиваш, Суджукская лагуна у Новороссийска). Питается в основном беспозвоночными. В Керченском проливе в пище преобладают мелкие ракообразные, отчасти крабы и полихеты. Более крупная барабуля питается рыбой. Пробы отбирались в районе поселка Золотое и содержали V. alginolyticus и V. parahaemolyticus. Оба выделенных представителя рода Vibrio обсеменяют большинство других морских рыб.
6. Черноморская ставрида – Trachurus mediterraneus ponticus (Aleev, 1956). Распространена в Черном море по всем берегам, в летнее время заходит в Азовское море, Сиваш, Мраморное море, Босфор. Питается в основном хамсой. Рыба, добытая в бухте Татарская, содержала V. parahaemolyticus.
В Черном море также производился отлов рыбы разных видов:
1. Бычок травяной или травяник – Gobius ophiocephalus (Pallas, 1814). Обитает в Черном море у берегов Крыма, Кавказа, в северо-западной части Черного моря, в Днепровском лимане, дельте Дуная, Сиваше, в Азовском море, западной его части. В бычках Каркинитского залива обнаружены галофильные вибрионы V. parahaemolyticus, обнаруженные в морской воде и выделенные из мелких рыб. Таким образом, можно сказать, что V. parahaemolyticus обнаруживается как в воде Черного моря, так и в живых объектах, населяющих ее.
2. Тюлька черноморско-азовская – Clupeonella cultriventris (Nordmann, 1840). Проведенные анализы выявили в рыбе данного вида V. alginolyticus. В рыбе данного вида, выловленной в Черном и Азовском морях, выявлена одинаковая вибриофлора.
3. Атерина, колючая хамса – Atherina pontica (Eichwald, 1831). Эта рыба распространена в Черном и Азовском море. Заходит как в пресные воды (южный Буг, Днестр), так и в осоленные заливы (Сиваш). Взрослые особи, как и молодь, питаются в основном планктоном. Пробы на вибрионы для этого вида дали отрицательный результат.
Мидии, как и другие двустворчатые моллюски, широко распространены в морях, имеют большое промысловое значение. Кроме того, они представляют ценный корм для рыб и других животных. Это эффективные биофильтраторы, имеющие существенное значение в биологической очистке воды. Кроме рыбы в Черном море отбирались пробы средиземноморской мидии (Mytilus galloprovincialis (Lamarck, 1819). Места отбора:
А. В районе памятника десантникам вблизи г. Евпатория мидии отбирались на расстоянии 100 м от берега. Проведенные анализы выявили в двустворчатых моллюсках парагемолитический вибрион.
Б. У поселка Новый Cвет в 50 м от берега на глубине 3–4 м. В мидиях обнаруживался V. alginolyticus и V. parahaemolyticus..
Помимо морских рыб, исследовались и пресноводные, выращенные в аквакультурных хозяйствах:
1. Толстолобик белый – Hypophthalmichthys molitrix (Valenciennes, 1844). В природе обитает в бассейне Амура и крупных реках Китая. Взрослые рыбы питаются фитопланктоном, для отцеживания которого имеют специальные приспособления (жаберные тычинки, образующие сетку). Рыбу доставляли их рыбхоза «Крымских партизан» Раздольненского района и из рыбзаводного пруда с. Донского Симферопольского района. Из обеих проб выделялись аэромонады.
2. Белый амур – Ctenopharyngodon idella (Valenciennes, 1844). Этот вид издавна является объектом разведения в прудах. Его выращивают в прудовых хозяйствах совместно с карпом и другими растительноядными рыбами дальневосточного комплекса – белым и пестрым толстолобиком в тех водоемах, где сильная зарастаемость водной растительностью. Рыбу привозили из пруда в районе станции Аграрник Симферопольского района; проведенные исследования вибрионов в рыбе не выявили.
3. Сазан – Cyprinus саrріо (Linnaeus, 1758) в природе распространен в медленно текущих равнинных реках, озерах. Взрослый – типичный бентофаг, питается личинками хирономид, семенами и частями растений, мелкими моллюсками. Одомашненный вид сазана называют карпом. Это основной объект прудового и индустриального рыбоводства. Карп поставлял Ишуньский рыбхоз Красноперекопского района. В пробах обнаружены вибрионы рода Aeromonas, которые весьма распространены в пресных водах.
Таким образом, проведенные исследования выявили, что из морских рыб как Черного, так и Азовского моря чаще выделяются галофильные вибрионы, для которых морская вода является естественной средой обитания. Причем, наиболее часто из гидробионтов выделяется парагемолитический вибрион.
V. alginolyticus, который в морской воде самый распространенный из галофилов, из рыб высевался всего в 5 пробах, а это 9,43 %. Процентное соотношение V. anguillarum, одного из редко высеваемых вибрионов, при исследованиях рыб составило 11,22 %. V. vulnificus, также крайне редко выявляемый в морской воде, выделен всего один раз из хамсы, выловленной в Азовском море. Наиболее сильное инфицирование вибрионами отмечено у бычка. Наибольшая высеваемость аэромонад выявлена при исследовании пресноводных рыб; обнаруживался Aeromonas и в морских рыбах (бычки, барабуля), но в очень немногих пробах.
По данным ряда исследований [32–34] рыбы и беспозвоночные также могут являться носителями V. cholerae О1, но наши данные выявили отсутствие его в гидробионтах. Зараженности холерным вибрионом нет, поэтому рыбный промысел по этому показателю в Черном и Азовском морях безопасен.
В целом, уровень инфицирования вибрионами промысловых рыб достаточно низкий, поэтому рыбопропродукция Азово-Черноморского бассейна по нашим предварительным данным безопасна для населения.
ЗАКЛЮЧЕНИЕ
- Проведены 2-х летние исследования по изучению видового состава гетеротрофных вибрионов, обитающих в морской воде Азово-Черноморского бассейна вблизи крымского побережья. Состав микрофлоры морской воды отличается более широким спектром. Были выявлены следующие виды из сем. Vibrionaceae: Vibrio alginolyticus, V. parahaemolyticus, V. anguillarum, V. fluvialis, V. vulnificus и представители рода Aeromonas из семейства Aeromonaceae. Виды V. cholerae non OI высевались в морской воде только вблизи берега в черте городов (в местах впадения малых рек), в точках отбора проб воды рыбопромысла они не были выявлены.
- В организмах, добываемых в шельфовой зоне морей и Керченского пролива у 9 видов промысловых рыб и беспозвоночных (мидий) выявлены 4 вида вибрионов из сем. Vibrionaceae: Vibrio alginolyticus, V. parahaemolyticus, V. anguillarum, V. vulnificus и представители рода Aeromonas из семейства Aeromonaceae.
- Самым распространенным вибрионом в изученном биоматериале был V. parahaemolyticus, который высевался в 68 пробах (64,2 %), причем он был обнаружен как в морской воде, так и в морских организмах. Далее в убывающем порядке встречались вибрионы рода Aeromonas (14/13,2 %), которые были выявлены в 4 видах рыб: барабуля, бычок, карп, толстолобик; V. anguillarum (12/11,3 %) обнаружен только в пиленгасе; V. alginolyticus установлен в биоматериале (10/9,4 %) 4 видов гидробионтов: барабули, тюльки и хамсы, а также в мидиях.
- В целом, уровень инфицирования вибрионами промысловых рыб достаточно низкий, поэтому рыбопропродукция Азово-Черноморского бассейна по нашим предварительным данным безопасна для населения.
- У пресноводных рыб, выращиваемых в аквакультурных хозяйствах: толстолобик белый и карп были обнаружены вибрионы рода Aeromonas, которые весьма распространены в пресных водах. В белом амуре вибрионы выявлены не были.
- Federal State Statistics Service of the Russian Federation. Consumption of fish products in 2015-2021 Access mode https://rosstat.gov.ru/storage/mediabank/. (Date of access: 11/29/2023).
- Order of the Ministry of Health and Social Development of the Russian Federation dated August 2, 2010 N 593 N “On approval of recommendations on rational standards for food consumption that meet modern requirements for a healthy diet.” Access mode: https: //prikazminzdravsotsrazvitija-rf-ot-02082010-n-593n/?ysclid=lftq48p9u7427308757. (Access date: 12/25/2023).
- Anoshina Yu. F., Naumkina T. V. State regulation of the fishery complex of the Russian Federation in modern conditions, State and municipal management. Scientific notes of SKAGS, 2, 102 (2020).
- Glubokovsky M. K., Glubokov A. I., Sinyakov S. A. Prospects for the development of the Russian fishery complex: monograph, 190 p. (M.: Creative Economy, 2018).
- Interstate standard. Protection of Nature. Hydrosphere. Rules for quality control of sea waters GOST 17.1.3.08-02. Access mode: https://docs.cntd.ru/document/1200008295 (Access date: 12/25/2023).
- Hydrology and geochemistry of the seas // Current state of pollution of the Black Sea waters, Pod. ed. Simonova A. I., Ryabinina A. I., 4, 3, 203 p. (Sevastopol: ECOSI-Hydrophysics, 1993).
- Black Sea Commission. Commission on the Protection of the Black Sea Against Pollution. 2019. The Black Sea. Access mode: http:// www.blacksea Commission.org. (Date of access: 02/25/2023).
- “Report on the state of the environment of the Republic of Crimea in 2021”, prepared by the Ministry of Ecology and Natural Resources. Simferopol, 2022. – 400 p. – Access mode: https://meco.rk.gov.ru/uploads/txteditor/meco/attachments/d4/1d/8c/d98f00b204e9800998ecf8427e/php2g3lnJ_php4qjkz8_2.pdf. (Date of access: 12/25/2023).
- Water quality. General requirements and guidelines for microbiological studies by inoculation on a nutrient medium. ISO 8199 – Access mode: http://samlib.ru/m/malyga_a_s/iso8199.shtml. (Date of access: 12/25/2023).
- Comprehensive assessment of the risk of bacterial intestinal infections transmitted by water: MR 2.1.10.0031–11 (approved by the Head of the Federal Service for Surveillance in the Sphere of Consumer Rights Protection and Human Welfare, Chief State Sanitary Doctor of the Russian Federation G. G. Onishchenko on July 31. 2011), 47 p. (M.: Federal Center for Hygiene and Epidemiology of Rospotrebnadzor, 2012).
- Water quality. Methodology for assessing and monitoring the microbiological environment for colony counts in water quality assessment tests. ISO 9998 – Access mode: https://zakonbase.ru/content/part/284191. . (Date of access: 12/25/2023).
- MUK 4.2.1884-04 “Sanitary-microbiological and sanitary-parasitological analysis of water from surface water bodies”, 75 p. (M., 2004).
- GOST 24849-2014. Water. Methods of sanitary-bacteriological analysis for field conditions. – Access mode: https://docs.cntd.ru/document/1200115427. (Date of access: 12/25/2023).
- GOST 31339-2006. Fish, non-fish objects and products from them. Acceptance rules and sampling methods (with Amendments No. 1, 2). Introduction to 2008-07-01, 16 p. (M., 2010).
- Medical microbiology, virology and immunology: Textbook, Ed. V. V. Zvereva, A. S. Bykova, 445 (M.: Publishing House “Medical Information Agency” LLC, 2016).
- Temyakova S. Yu., Pisanov R. V., Stupnikova E. V. Pathogenetic potential of Vibrio vulnificus as a causative agent of septic infections, Bacteriology, 8, 2, 72 (2023). DOI: 10.20953/2500-1027-2023-2-72-78.
- Sytnik N. A. Chemical-toxicological characteristics and sanitary-bacteriological state of the marine environment and mollusks of the Kerch Strait and the pre-strait of the Black Sea, News of higher educational institutions. North Caucasus region. Series Natural Sciences, 2 (218), 130 (2023).
- Zolotnitsky A. P., Kryuchkov V. G. Ο possible environmental consequences of large-scale cultivation of mussels in the shelf zone of the Black Sea, Intl. conf. “Modern problems of ecology of the Azov-Black Sea basin“, 30 (Kerch: YugNIRΟ, 2006).
- Lunkova N. I., Morozova M. A., Ivanova E. A., Dotsenko I. V., Dimitrova D V. Sanitary and microbiological assessment of oysters and the marine environment in the area of mussel-oyster farms on Lake Donuzlav, Sat. tr. 1X International Scientific and Practical. conf. “Environmental problems, a look into the future“, 422 (Southern Federal University, Rostov-on-Don, Taganrog, 2020).
- Beleneva I. A., Zhukova I. V. Seasonal dynamics of the number and biodiversity of marine heterotrophic bacteria inhabiting invertebrate animals and the water of Peter the Great Bay, Sea of Japan, Microbiology, 33 (78), 414 (2009).
- Youschimizu M., Kimura T. Study on intestinal microflora of salmonids, Fish Pathol., 10, 243 (1976).
- The Prokaryotes. An evolving electronic resource for the microbiological community, 2007. http:// 141.150.157.117:8080/prokPub/index.htm
- Pujalte M. J., Ortigosa M., Macian M. C., Garay E. Aerobic and facultative anaerobic heterotrophic bacteria associated to Mediterranean oysters and seawater, Int. Microbiol., 2, 259 (1999).
- Urdaci M. C., Marchand M., Grimont P. A. Characterization of 22 Vibrio species by gas chromatography analysis of their cellular fatty acids, Res. Microbiol. 141, 437 (1990).
- Guisande Y. A., Montes M., Farto R., Armada S. P., Perez M. J., Nieto T. P. A set of tests for the phenotypic identifications of culturable bacteria associated with Galician bivalve mollusk production, J. Shellfish Res., 23, 599 (2004).
- Garnier M., Labreuche Y., Nicolas J. L. Molecular and phenotypic characterization of Vibrio aestuarianus subsp francensis subsp nov., a pathogen of the oyster Crassostrea gigas, Systematic and Applied Microbiology, 31, 358 (2008).
- Nityaga I. M., Usha B. V., Prostova O. V. Verification of the method for isolating Vibrio parahaemolyticus from marine fish and fish products, Russian magazine “Problems of veterinary sanitation, hygiene and ecology”, 2 (30), 138 (2019).
- Zhang J., Cao Z., Li Z., Wang L., Li H., Wu F., Jin L., Li X., Li S., Xu Y. Effect of bacteriophages on Vibrio alginolyticus infection in the sea cucumber, Apostichopus japonicus (Selenka), J. World Aquac. Soc., 29, 149 (2015).
- Ren H., Li Z., Xu Y., Wang L., Li X. Protective effectiveness of feeding phage cocktails in controlling Vibrio parahaemolyticus infection of sea cucumber Apostichopus japonicas, Aquaculture, 503, 322 (2019).
- Beleneva I. A., Maslennikova E. F., Magarlamov T. Yu. Physiological and biochemical properties of halophilic vibrios Vibrio parahaemolyticus and V. alginolyticus isolated from hydrobionts of the Peter the Great Bay of the Sea of Japan, Marine biology, 30, 2, 114 (2004).
- Santavy D. L., Colwell R. R. Comparison of bacterial communities associated with the Caribbean sclerosponge Ceratoporella nicholsoni and ambient sea water, Mar. Ecol. Prog. Ser., 67, 73 (1990).
- Menshikova E. A., Kurbatova E. M., Mironova A. V. General ideas about the ecology of Vibrio cholerae, Veterinary pathology, 3, 23 (2016).
- Zhukova E. A. Ecological features of the relationship between cholera vibrios and other representatives of aquatic biota: abstract of thesis. dis. …cand. honey. Sciences, 14 p. (Volgograd, 2000).
- Castro Rosas J., Escartin E. F. Adhesion and colonization of Vibrio cholerae O1 on shrimp and crab carapaces, J. Food. Prot., 2, 492 (2002).
