SILVER SORPTION FROM NITRATE SOLUTIONS BY NATURAL ZEOLITES IN STATIC MODE
СОРБЦИЯ СЕРЕБРА ИЗ НИТРАТНЫХ РАСТВОРОВ ПРИРОДНЫМИ
ЦЕОЛИТАМИ В СТАТИЧЕСКОМ РЕЖИМЕ
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №2, 2024
Publication text (PDF):Download
UDK: 544.723. 622.772
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Belova T. P., Research Geotechnological Center of Far Eastern Branch of Russian Academy of Sciences (RGC FEB RAS), Petropavlovsk-Kamchatsky, Russian Federation
Khizhko Z. I. Research Geotechnological Center of Far Eastern Branch of Russian Academy of Sciences (RGC FEB RAS), Petropavlovsk-Kamchatsky, Russian Federation
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-2-274-283
PAGES:from 274 to 283
STATUS:Published
LANGUAGE:Russian
KEYWORDS: silver, sorption, zeolite, adsorption free energy, sorption capacity, physical sorption.
ABSTRACT (ENGLISH):
The paper presents experimental studies on silver sorption by natural forms of zeolites of mordenite-clinoptilolite (the Yagodninskoe deposit) and geilandite-clinoptilolite (the Seredochnoe deposit) types from nitrate solutions in the concentration range of 2 to 30 mg/l. The Langmuir, Freundlich, and Dubinin-Radushkevich equations are used to process the experimental results. The high values of correlation coefficients, R2, ranging from 0.90 to 0.96, indicate the applicability of the mentioned models. The Langmuir and Dubinin-Radushkevich models give similar values of maximum sorption capacity. At sorption by Yagodninskoe deposit zeolite, Amax, is equal to,
mmol/g: 3.71·10-3 according to the Langmuir model and 3.88·10-3 according to the Dubinin-Radushkevich model. In the case of silver sorption by Seredochnoe deposit zeolite, Amax, is equal, mmol/g: 2.11·10-3 and 2.43·10-3 respectively. The Langmuir model is used to calculate the adsorption equilibrium constants for a monolayer of silver ions on the surface of zeolite tuffs, including the inner surface. The constants are found to have values of 17.7 and 28.2 u. The calculated constants allow for the estimation of the Gibbs energy, kJ/mol: ΔG= –23.8 for Yagodninskoe deposit zeolite and ΔG= –25.0 for Seredochnoe deposit zeolite. The Gibbs energy’s negative values indicate that the sorption process occurs spontaneously, without requiring additional energy. The empirical coefficients, n, calculated from the Freundlich equation have the following values: n1.9 for Yagodninskoe deposit zeolite and n2.3 for Seredochnoe deposit zeolite.
Based on the calculation of adsorption free energy, E, (kJ/mol), which is a function of the Dubinin-Radushkevich constant, it is suggested that the physical sorption mechanism predominates in silver sorption by natural forms of zeolites in the studied concentration range.
ВВЕДЕНИЕ
Популярным по добыче драгоценным металлом, наряду с золотом, является серебро. По данным Геологической службы США (USGS) за 2022 год, мировые запасы серебра составляют 549 тысяч тонн. Этот металл используют в медицине, ювелирном производстве и электронике благодаря его уникальным свойствам [1]. Ввиду ограниченности распространения и большой области применения этого металла, повсеместно ведутся работы по уменьшению потерь серебра при добыче на горнодобывающих предприятиях. При гидрометаллургической обработке руд и россыпных месторождений серебро остается в техногенных отходах и сточных водах как побочный элемент при цианировании золота. В последние десятилетия вектор развития направлен и на переработку вторичных отходов – серебро, равно как и другие драгоценные металлы, содержится в твердых бытовых отходах, отработанном электронном оборудовании, транспортных средствах с истекшим сроком службы [2].
Очистка хвостохранилищ и сточных вод требует низких затрат и минимально негативного влияния на экологию. Под эти параметры подходит природный минеральный сорбент цеолит [3, 4]. Коммерческое использование благодаря обширности своего применения в различных сферах и широкого распространения в природе получил минерал клиноптилолит. Это водный алюмосиликат с каркасной структурой, образованной оксидами алюминия и кремния и катионами щелочных и щелочноземельных металлов. Из преимуществ цеолита можно выделить высокие удельную поверхность, каталитическую и ионообменную способности относительно других природных минеральных микропористых материалов, а также стоимость ниже синтетических сорбентов [5]. Цеолит используется для сорбции радиоактивных металлов [6, 7], тяжелых металлов [8, 9] и удаление аммиака [10] из сточных вод горнодобывающих шахт, смягчение «жесткой» воды [11].
В сорбции серебра используют не только неорганические минеральные сорбенты, но и органические, такие как угли и смолы. Модификации сорбентов различными компонентами помогают увеличивать извлечение серебра из растворов. Например, авторы [12] также отмечают рост адсорбции золота и серебра после модификации углеродного волокна целлюлозой. Исследования сорбции различных металлов хитином показывают, что с использованием физической и химической модификации этот полимер подходит для сорбции металлов первой группы, в том числе золота и серебра [13, 14]. При насыщении бентонита и цеолита тиокарбамидом адсорбция серебра увеличивается в разы [15, 16].
Помимо использования сорбентов для извлечения серебра из растворов сточных вод и кеков выщелачивания горнодобывающих предприятий, этим металлом модифицируют различные сорбенты для создания антибактериальных пленок, способствующих предотвращению разрушений и роста бактерий на поверхности гранул ионообменных смол [17].
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования являются цеолитовый туф Ягоднинского месторождения (ЯМ) Камчатского края, состоящий преимущественно из морденита и клиноптилолита, обменный ряд катионов которого Mg2+ < K+ < Ca2+ < Na+, и цеолитовый туф Середочного месторождения (СМ) Хабаровского края, состоящий из гейландита и клиноптилолита, обменный ряд катионов – Na+ < Mg2+ < K+ < Ca2+. Ранее нами [18] был описан детальный состав данных цеолитовых туфов и изучена их устойчивость при сорбции золота.
Для определения зависимости адсорбции от концентрации ионов Ag был приготовлен раствор нитрата серебра AgNO3, разбавленный дистиллированной водой. Концентрация серебра в модельных растворах варьировалась от 2 мг/л до 30 мг/л. Время контакта твердой и жидкой фазы составляло 24 часа, Т:Ж = 1:50.
Содержание ионов серебра в фильтрованных растворах по истечению времени определяли с помощью эмиссионного спектрометра параллельного действия с индуктивно-связанной плазмой ICPE-9000 («Shimadzu», Япония). Градуировочные образцы были изготовлены из мультистандарта (MultiElement Standard IV, Германия). Для приготовления модельных растворов была взята навеска нитрата серебра AgNO3 марки ч.д.а.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для описания процесса сорбции серебра двумя различными цеолитами ЯМ и СМ использовали известные математические модели Лэнгмюра, Фрейндлиха и Дубинина-Радушкевича [19–21].Статическую обменную емкость (A, ммоль/г) рассчитывали по уравнению:
,
где С0 и Сt – начальная и равновесная концентрации вещества в растворе, ммоль/л;
V – объем раствора, л;
m – навеска сорбента, г.
Линейная форма уравнения Лэнгмюра (уравнение 1) имеет вид
, (1)
где At и Amax – равновесная и предельная сорбционная емкость сорбента, ммоль/г;
k – константа адсорбционного равновесия, характеризующая прочность связи адсорбента и мономолекулярного слоя адсорбата.
Свободную энергию Гиббса ΔG рассчитывали по формуле:
,
где R – универсальная газовая постоянная, равная 8,314 Дж/моль·град К;
Т – температура в градусах Кельвина;
k – константа адсорбционного равновесия.
Построение графической зависимости в координатах линейной формы уравнения Лэнгмюра (рис. 1) позволило рассчитать величину предельной сорбционной емкости Amax и константу адсорбционного равновесия.
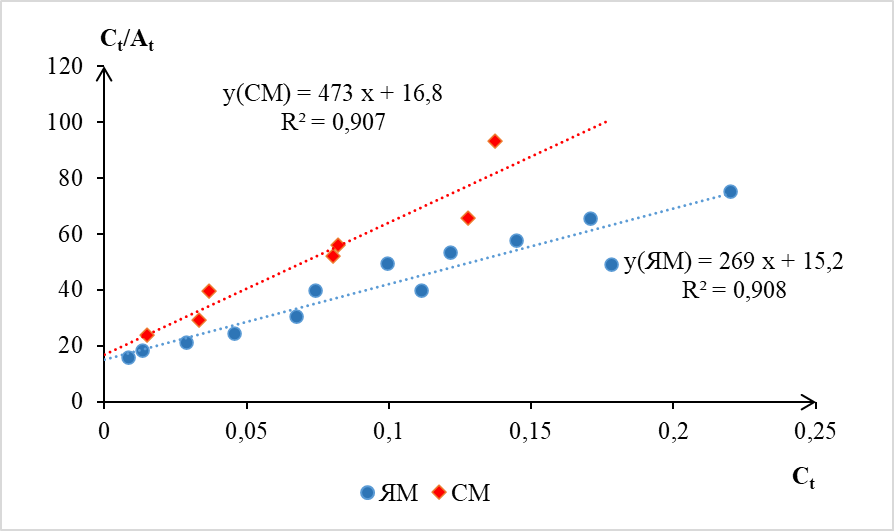
Рис. 1. Зависимость отношения равновесной концентрации к сорбционной емкости (C/At) цеолитов ЯМ и СМ от величины равновесной концентрации серебра (Ct) в растворе (линейная форма модели Ленгмюра).
Из графика видно, что точки удовлетворительно располагаются вдоль прямой и при сорбции цеолитом ЯМ (R2 = 0,908), и при сорбции цеолитом СМ (R2 = 0,907). При повышении исходной концентрации ионов серебра до значений более 15 мг/л разброс точек на графике увеличивается, что свидетельствует об отклонении от уравнения Лэнгмюра. Вероятно, это связано с вовлечением в адсорбцию активных центров, обладающих меньшей энергией. Линейные характеристики имеют разный угол наклона к оси x. Отсюда и различающаяся сорбционная емкость: 3,71·10-3 ммоль/г в первом случае и 2,11·10-3 ммоль/г во втором случае.
Применение уравнения Фрейндлиха в логарифмических координатах представляет собой уравнение прямой (уравнение 2). На графике (рис. 2) представлена зависимость логарифма сорбционной емкости в зависимости от логарифма равновесной концентрации.
, (2)
где 1/n – константа, показатель степени, зависящий от температуры и природы адсорбата;
k’ – константа Фрейндлиха.
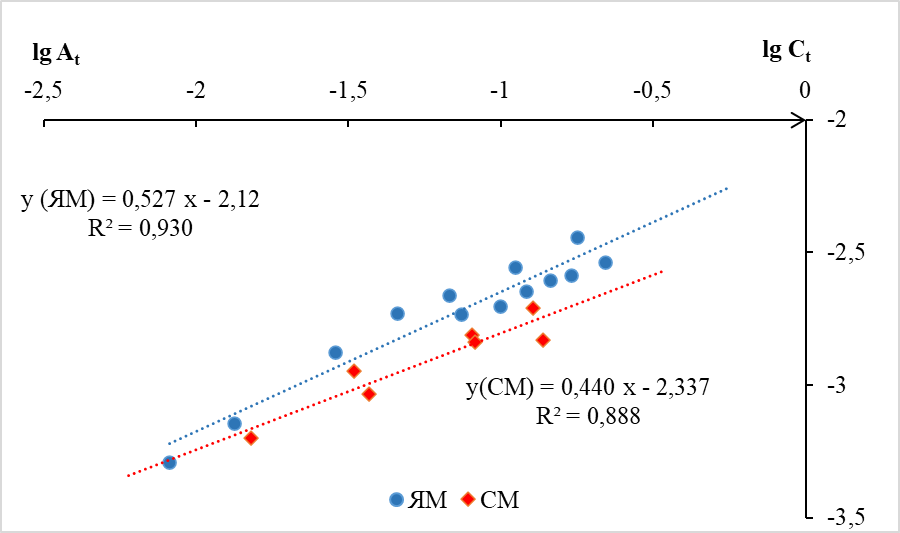
Рис. 2. Зависимость логарифма сорбционной емкости цеолитов ЯМ и СМ от логарифма равновесной концентрации серебра (модель Фрейндлиха).
Как видно из графика, линии тренда логарифмических зависимостей сорбционной емкости от равновесной концентрации имеют довольно высокие коэффициенты корреляции при сорбции цеолитом ЯМ (R2 = 0,923) и при сорбции цеолитом СМ (R2 = 0,888). Линия тренда, характеризующая сорбцию серебра цеолитом ЯМ располагается несколько выше соответствующей линии цеолита СМ. Угол наклона прямой ЯМ к оси x приблизительно на 20% больше, чем прямой СМ, следовательно, эмпирические коэффициенты n уравнения Фрейндлиха также различаются: n(ЯМ)1,9; n(СМ) 2,3. Данные приведены в таблице. Недостатком описанных выше моделей является невозможность определить механизм сорбционного процесса. Для решения этой задачи мы обработали экспериментальные данные по модели Дубинина-Радушкевича [19, 20], которая линеализуется в логарифмической форме (уравнение 3). График зависимости логарифма равновесной сорбционной емкости от квадрата потенциала Поляни ε2 приведен на рис. 3.
, (3)
где ε – потенциал Поляни
kDR– константа адсорбционного равновесия Дубинина-Радушкевича.
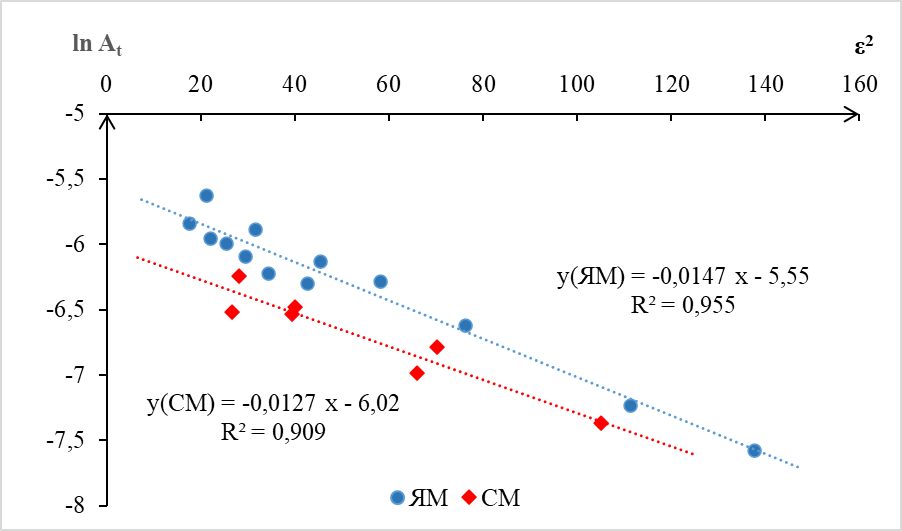
Рис. 3. Зависимость натурального логарифма сорбционной емкости цеолитов ЯМ и СМ от квадрата потенциала Поляни (модель Дубинина-Радушкевича).
Критерием для определения характера взаимодействия ионов серебра с твердой фазой сорбента может служить величина свободной энергии адсорбции E (кДж/моль), которая рассчитывается исходя из константы Дубинина-Радушкевича по уравнению:
Расчетным методом установлено, что при сорбции серебра цеолитом ЯМ значение свободной энергии E = 5,83 кДж/моль, а при сорбции цеолитом СМ – E = 6,27 кДж/моль. За границу между физической адсорбцией и ионным обменом принято считать свободную энергию E = 8,0 кДж/моль [20, 21]. Следовательно, исходя из полученных данных, можно сделать вывод, что оба природных цеолитовых туфа сорбируют серебро из азотнокислых растворов по механизму физической адсорбции. Другие расчетные данные приведены в таблице.
Таблица 1
Сорбционные характеристики поглощения ионов серебра цеолитами ЯМ и СМ в условиях статического эксперимента
| Условия расчета | Параметр | Цеолит, | |
| ЯМ | СМ | ||
| Исходная концентрация | С0, мг/л | от 2 до 30 | |
| С0, ммоль/л | от 0,0185 до 0,2781 | ||
| Время сорбции | t, час | 24 | |
| Уравнение Ленгмюра | Амакс, ммоль/г | 3,71·10-3 | 2,11·10-3 |
| k | 17,7 | 28,23 | |
| ΔG, кДж/моль | –23,8 | –25,0 | |
| R2 | 0,908 | 0,907 | |
| Уравнение Фрейндлиха | n | 1,899 | 2,274 |
| k’ | 7,57·10-3 | 4,32·10-3 | |
| R2 | 0,930 | 0,888 | |
| Уравнение Дубинина-Радушкевича | Амакс, ммоль/г | 3,88·10-3 | 2,43·10-3 |
| KDR, | –0,0147 | –0,0127 | |
| E, кДж/моль | 5,83 | 6,27 | |
| R2 | 0,955 | 0,909 | |
Величина теоретической максимальной сорбционной емкости цеолитов ЯМ и СМ, рассчитанные по моделям Лэнгмюра и Дубинина-Радушкевича имеет близкие значения. Так при сорбции цеолитом ЯМ Амакс, ммоль/г равна: 3,71·10-3 по модели Лэнгмюра и 3,88·10-3 по модели Дубинина-Радушкевича. В случае сорбции серебра цеолитом СМ Амакс равна, ммоль/г: 2,11·10-3 и 2,43·10-3 соответственно.
ЗАКЛЮЧЕНИЕ
Цеолиты Ягоднинского месторождения Камчатского края (ЯМ) и Середочного месторождения Хабаровского края (СМ) могут быть использованы для извлечения из нитратных растворов серебра в диапазоне концентраций от 2 до 30 мг/л.
Константы адсорбционного равновесия, рассчитанные по модели Ленгмюра, имеют значения 17,7 и 28,2 ед. и характеризуют взаимодействие монослоя ионов серебра поверхностью цеолитовых туфов, включая внутреннюю поверхность. Значения энергии Гиббса равны, кДж/моль: ΔG = –23,8 и ΔG = –25,0 для цеолитовых туфов ЯМ и СМ.
На основании анализа экспериментальных данных по модели Дубинина-Радушкевича установлено, что в диапазоне концентраций серебра от 2 до 30 мг/л преобладает механизм физической сорбции.
- Denisova L. T., Belousova N. V., Denisov V. M., Ivanov V. V., Application of silver (review), Journal of Siberian Federal University. Engineering & Technologies, 3 (2), 250 (2009). (in Russ.).
- Golnaraghi A., Asasian N., Sharifian S., Golnaraghi A., Biosorpion for sustainable recovery of precious metals from wastewater, Journal of Environmental Chemical Engineering, 8 (4), 103996 (2020). (in Russ.). https://doi.org/10.1016/j.jece.2020.103996.
- Korkuna O., Leboda R., Skubiszewska-Zie,ba J., Vrublevs`ka T., Gun`ko V., Structural and physicochemical properties of natural zeolites: clinoptilolite and mordenite, Microporous and mesoporous materials, 87 (3), 243 (2006). https://doi.org/10.1016/j.micromeso.2005.08.002.
- Inglezakis V., Kudarova A., Guney A., Kunayat N., Tauanov Zh., Efficient Mercury Removal from water by using modified natural zeolites and comparison to commercial adsorbents, Sustainable Chemistry and Pharmacy, 32, 101017 (2023). https://doi.org/10.1016/j.scp.2023.101017.
- Barragan P., Macedo M., Olguin M., Cadmium sorption by sodium and thiourea-modified zeolite-rich tuffs, Journal of Environmental Sciences, 52, 39 (2017). https://doi.org/10.1016/j.jes.2016.03.015.
- Abdollahi T., Towfight J., Rezaei-Vahidian H. Sorption of cesium and strontium ions by natural zeolite and management of produced secondary waste, Environmental Technology and Innovation, 17, 100592 (2020). https://doi.org/10.1016/j.eti.2019.100592.
- Shushkov D. A., Shuktomova I. I. Sorption of radioactive elements by zeolite-bearing rocks, Proceedings of the Komi science centre of the Ural division of the Russian Academy of Sciences, 1, 69 (2013). (in Russ.).
- Velarde L., Nabavi M., Escalera E., Antti L.-M., Akhtar F. Adsorption of heavy metals on natural zeolites: A review, Chemosphere, 328, 138508 (2023). https://doi.org/10.1016/j.chemosphere.2023.138508.
- Obaid Sh., Gaikwad D., Al-Rashedi K., Pawar P. Heavy metal ions removal from wastewater by the natural zeolites, Materials Today: Proceedings, 5, (9), 17930 (2018) https://doi.org/10.1016/j.matpr.2018.06.122.
- Zolfaghari M., Magdouli S., Tanabene R., Komtchou SP., Martial R., Saffar T. Pragmatic strategy for removal of ammonia from gold mine effluents using a combination of electro-coagulation and zeolite cation exchange processes: A staged approach, Journal of Water Process Engineering, 37, 101512 (2020). https://doi.org/10.1016/j.jwpe.2020.101512.
- Nasief N., Shaban M., Alamry Kh., Khan A., Asiri A. M., Abd El-salam H. Hydrothermal synthesis and mechanically activated zeolite material for utilizing the removal of Ca/Mg from aqueous and raw groundwater, Alamry [et al.] // Journal of Environmental Chemical Engineering, 9 (5) 105834. (2021). https://doi.org/10.1016/j.jece.2021.105834.
- Kovalskaya Ya. B., Zelichenko E. A., Ageeva L. D., Gurova O. A., Guzeev V. V. Granulated adsorbents based on vegetable raw materials for extraction of gold and silver from acid solutions, Proceedings of Universities. Applied chemistry and biotechnology, 6 (17), 76 (2016). DOI 10.21285/2227-2925-2016-6-2-76-82. (in Russ.).
- Tunaova Y. A., Fayzullina R. A., Shmakova Y. A. Using of model solutions to assess the sorption capacity of biopolymer enter sorbents, Vesting KSTU, 5, 57 (2011). (in Russ.).
- Radwan-Praglowska J., Janus L., Sierakowska A., Piatkowski M., Galek T., Szajna E., Tupaj M., Radomski P., Bogdal D. Ecofriendly chitosan-based super sorbent obtained under microwave radiation for valuable metals recovery from wastewater, Polymer Testing, 112, 107629 (2022). https://doi.org/10.1016/j.polymertesting.2022.107629.
- Krymova V. V., Sorption of silver(I) ions from aqueous solutions by modified bentonites, Scientific Notes of V.I. Vernadsky Crimean Federal University, 27 (4), 109 (2014). (in Russ.).
- Marchenkova T. G., Kunilova I. V. Research of sorption of copper, nickel, zink and silver on modified Sibai zeolite. MIAB. Mining Inf. Anal. Bull., 11, 298 (2004). . (in Russ.).
- Garipov I. T., Yuldashev A. B., Haidarov R. R., Gapurova O. U., Sadikov I. I., Prudnikova S. V., Evgrafova S. Yu. Preparation and application of the cationite with the silver nanoclusions, Upravlenie tekhnosferoj, 3(3), 386 (2020). (in Russ.). DOI10.34828/UdSU.2020.11.38.00
- Belova T. P., Khizhko Z. I. Stabitity of natural zeolites in sorption of gold from model solutions at different pH values, Scientific Notes of V.I. Vernadsky Crimean Federal University. Biology. Chemistry, 9 (2), 251 (2023). (in Russ.). DOI 10.29039/2413-1725-2023-9-2-251-258.
- Shumilova M. A., Petrov V. G. Adsorption models for describing equilibrium in the arsenite-ion – soil system, Teoreticheskaya i prikladnaya ekologiya, 4, 32 (2017). (in Russ.).
- Meroufel B., Benali O., Benyahia M., Zenasni M. A., Merlin A., George B. Removal of Zn (II) from Aqueous Solution onto Kaolin by Batch Design, Journal of Water Resource and Protection, 5, 669 (2013). DOI.org/10.4236/jwarp.2013.57067.
- Sari A., Tuzen M., Soylak M. Adsorption of Pb(II) and Cr(III) from Aqueous Solution on Celtek Clay, Journal of Hazardous Materials, 144 (1-2), 41 (2007). doi:10.1016/j.jhazmat.2006.09.080.



