TOXICITY OF PETROLEUM PRODUCTS IN LOW CONCENTRATIONS FOR SOME MARINE TEST OBJECTS UNDER EXPERIMENTAL CONDITIONS
Токсичность нефтепродуктов в низких концентрациях для некоторых морских тест-объектов в условиях эксперимента
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №2, 2024
Publication text (PDF):Download
UDK: 574.64:665.7
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Kuzminova N. S. A. O. Kovalevsky Institute of Biology of the Southern Seas of RAS, Sevastopol, Russia.; Sevastopol Environmentally-Educational Student Centre, Sevastopol, Russia
KHarchistov A. E. Sevastopol Environmentally-Educational Student Centre, Sevastopol, Russia
Kaliuzhnyi N. E. Sevastopol Environmentally-Educational Student Centre, Sevastopol, Russia
Alatartseva O. S. A. O. Kovalevsky Institute of Biology of the Southern Seas of RAS, Sevastopol, Russia.
Tenesheva A. M. Sevastopol Environmentally-Educational Student Centre, Sevastopol, Russia
Korzhanevskaya E. V. Sevastopol Environmentally-Educational Student Centre, Sevastopol, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-2-87-102
PAGES:from 87 to 102
STATUS:Published
LANGUAGE:Russian
KEYWORDS: Dunaliella salina, Artemia salina, diesel fuel, fuel oil, toxicity.
ABSTRACT (ENGLISH):
Currently, about 6 million tons of petroleum products enter the World Ocean as a result of releases of industrial and municipal wastewater, as well as shipping waste. This allows us to consider this type of pollution the most dangerous.
Our earlier studies showed that a concentration of petroleum hydrocarbons equal to 0.05 mg/l has a toxic effect on some marine test objects. The established fact of different responses of fish larvae to the addition of fuel oil and diesel fuel in the experiment with and without feeding was also interesting. This requires improving methods for analyzing the toxicity of xenobiotics and revising sanitary regulation data.
In this work, experiments were carried out to study the effect of low concentrations of diesel fuel and fuel oil on the microalgae Dunaliella salina (Dunal) Teodoresco, 1905 and the gill-footed crustacean Artemia salina (Linnaeus, 1758), since the most sensitive to the appearance of toxicants in the aquatic environment are representatives of phyto and zooplankton.
D. salina is a planktonic mobile algae. The choice as an object of study is due to its widespread use for assessing the toxicity of substances and water quality, including due to its resistance to a number of factors and toxicants. The choice of test object is also related to the significant role of this algae as a starting food, including in the critical living conditions of salt lakes.
The high resistance of A. salina from the Crimean salt lakes to petroleum products was noted earlier by other researchers. This object is simultaneously sensitive to complex pollution of water and individual toxicants. In water contaminated with petroleum products with concentrations below the maximum permissible limits A salina develops well, being often the only representative of zooplankton. This crustacean is widely used in biotesting of soils and waters contaminated with petroleum products.
In a medium with diesel fuel, an increase in the number of D. salina was observed at its concentrations of 0.025 and 0.05 mg/l. An increase in the content of this substance in the medium to 0.1 mg/l caused an inhibition of algae growth. Whereas fuel oil at a concentration of 0.1 mg/l stimulated an increase in the number of D. salina compared to the control. It was shown that the higher the concentration of fuel oil in the aquatic environment, the higher the speed of movement of D. salina cells, and under the influence of diesel fuel the opposite trend was observed.
The percentage of hatching of Artemia nauplii increased under the influence of low concentrations of diesel fuel and was lower than the control when exposed to fuel oil. Both fuel oil and diesel fuel at concentrations of 0.025, 0.05 and 0.1 mg/l had a toxic effect on Artemia nauplii, resulting in a decrease in their survival rate by more than 50 % for 7 days.
When feeding crustaceans with microalgae incubated in solutions with petroleum products, the toxic effect of fuel oil and diesel fuel on A. salina is reduced. However, the high solubility of diesel fuel and the decrease in the amount of food items (D. salina) enhance the toxic effect of the light fraction of petroleum products on crustaceans at concentrations of 0.05 and 0.1 mg/l.
Despite the fact that both types of petroleum products were toxic to Artemia nauplii, the presence of microalgae in the environment may reduce the level of danger for this test object.
ВВЕДЕНИЕ
При мониторинге уровней токсичных элементов исследовательские организации или контролирующие органы, делая вывод о степени опасности водной среды, опираются на значения предельно допустимых концентраций загрязняющих веществ (ПДК) [1].
В настоящее время в Мировой океан попадает около 6 млн. т нефтепродуктов в результате выпусков промышленных и городских сточных вод, а также отходов судоходства [2], что позволяет считать этот вид загрязнения главным и опасным [3].
Наши последние работы свидетельствуют, что ПДК нефтяных углеводородов 0,05 мг/л оказывает токсический эффект на некоторые морские тест-объекты. Интересным оказался и установленный факт разных откликов личинок рыб на внесение мазута и солярки в эксперименте с кормлением и без такового [4], что требует совершенствования методик анализа токсичности ксенобиотиков и пересмотра данных санитарного нормирования.
В данной работе были проведены эксперименты по изучению влияния низких концентраций дизельного топлива (ДТ) и мазута на микроводоросли Dunaliella salina (Dunal) Teodoresco, 1905 и жаброногого рачка Artemia salina (Linnaeus, 1758), так как наиболее чувствительными к появлению токсикантов в водной среде являются представители фито и зоопланктона.
Цель работы – оценить токсический эффект мазута и дизельного топлива в малых концентрациях на микроводоросли Dunaliella salina и рачка Artemia salina c учетом наличия/отсутствия пищи для последнего.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом первого исследования воздействия мазута и дизельного топлива в концентрациях 0,025 мг/л, ПДК (0,05 мг/л) и 0,1 мг/л на микроводоросли была выбрана альгологически чистая культура микроводоросли Dunaliella salina Teodor. 1905 (Chlorophyta). Эксперименты проводили на стерильной морской воде с добавлением питательной среды f/2 [5]. Численность клеток и скорость их движения определяли в камере Горяева на микроскопе Jenaval (Carl Zeiss, Jena). Продолжительность экспериментов составила 10 суток. Нефтепродукты в работе были использованы корабельные (моторные масла с судна «Профессор Водяницкий»: топливо дизельное, евро, сорт С, вид II, (ДТ-Л-К4, ГОСТ Р52368-2005. Следующее исследование: во все оставшиеся растворы с микроводорослями и соответствующими концентрациями ДТ и мазута вносили науплиусов артемии (возраст 5 суток). При этом повторно токсиканты и микроводоросли не добавляли. Параллельно проведено аналогичное исследование, при котором у науплиусов не было корма, а токсиканты (ДТ/мазут) были добавлены в вышеуказанных концентрациях однократно. Экспозиция – 7 суток.
Кроме того, были проведены еще 2 эксперимента на жаброногом рачке Artemia salina (Linnaeus, 1758): оценивали процент выклева при низких концентрациях (0,05 мг/л, 0,025 мг/л, 0,01 мг/л) мазута, а также дизельного топлива в течение 4 суток.
Эксперименты были проведены в трёх повторностях для каждой концентрации, включая контроль. Все полученные данные были обработаны статистически, используя приложение EXCEL-2016, и выражены в форме M±m, либо в процентах относительно контроля.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
D. salina – планктонная подвижная водоросль. Выбор в качестве объекта исследования обусловлен широким применением ее для оценки токсичности веществ и качества вод, в том числе из-за ее устойчивости по отношению к ряду факторов и токсикантов [6, 7–9]. Выбор тест-объекта связан и со значимой ролью данной водоросли как пищевого стартового корма, в том числе в критических условиях жизни соленых озер.
Численность клеток микроводорослей как в контроле, так и при концентрациях дизельного топлива 0,05 и 0,025 мг/л, несмотря на меньшие величины по сравнению с контролем, продолжала увеличиваться (достоверно с 4 до 10 суток) в ходе всей экспозиции (рис. 1). Токсичность дизельного топлива в концентрации 0,1 мг/л может быть связана и с «переломным» на 2 сутки снижением уровня кислорода. На 10 сутки численность клеток начинает все-таки достоверно (р≤0,05) повышаться, что приводит к восстановлению содержания растворенного кислорода, что было продемонстрировано в условиях природного эксперимента с дизельным топливом [10]. Тем не менее, именно эта концентрация оказала токсический эффект, так как численность клеток, как и скорость движения, снизились более, чем на 50 %. Сходные эффекты реагирования фитопланктона – замедление темпа деления и гибель клеток были отмечены и ранее для концентрации нефтепродуктов (керосина и мазута) 0,01 мл/л и менее [11].
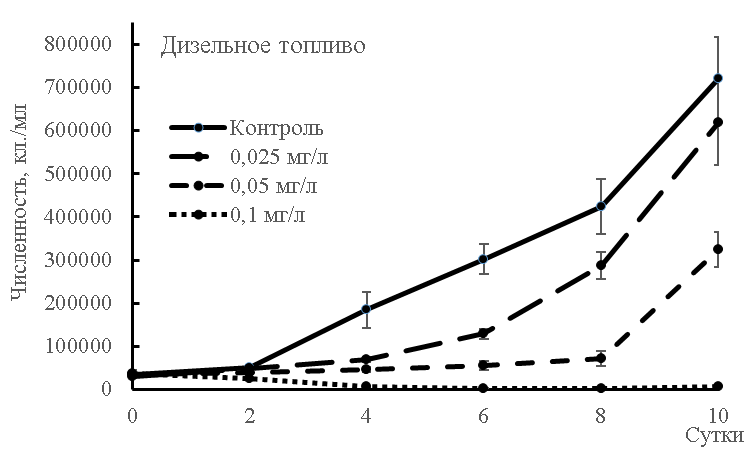
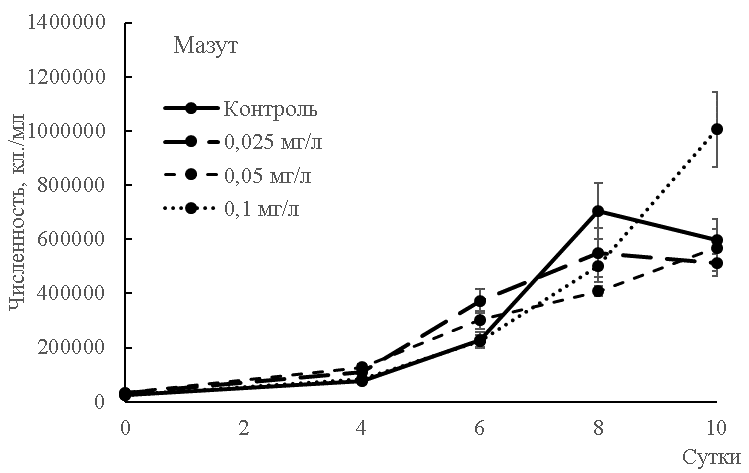
Рис. 1. Численность клеток культуры Dunaliella salina, подвергнутой действию нефтепродуктов.
Аналогичный эффект токсичности дизельного топлива был описан исследователями, работавшими с зелеными водорослями рода Chlorella в эксперименте, а также с природным фитопланктоном в условиях Антарктиды: низкомолекулярные углеводороды могут вызывать повреждение мембраны клеток и влияют на выработку пигментов, а в природных условиях блокируют цветение [12, 13]. Ароматические вещества дизельного топлива оказались высокотоксичными и для синезеленых микроводорослей [14].
Водорастворимые фракции нефти нарушают механизмы биосинтеза, необходимые для функционирования фотосинтетического аппарата (биосинтез хлорофилла а, гликолипидов и липидных пигментов) у чувствительных водорослей, в том числе Dunaliella tertiolecta [15].
Интересно, что мазут, напротив, простимулировал в нашем исследовании рост культуры и увеличение (после некоторого снижения до 6 дня) скорости движения после 6 суток. Максимальная плотность клеток была установлена для варианта влияния 0,1 мг/л мазута: на 10 сутки число клеток составило 1006173±139374 кл./мл. Имеется мнение, однако, что в сравнительном аспекте на примере синезеленых микроводорослей именно тяжелые нефтяные фракции более токсичны [16]. Стимулирующее влияние нефтяного ростового вещества – увеличение темпа деления клеток, интенсификация окраски хроматофоров, увеличение подвижности клеток и повышение интенсивности фотосинтеза – отмечено и для культур динофлагеллят, диатомовых [17, 18]. Этот факт и привел к многочисленным разработкам биологических методов снижения концентрации нефтепродуктов в воде и почве засчет активного роста бактерий, грибов и микроводорослей [19, 20, 13]. Та часть фракции нефтепродуктов, которая не токсична для зеленых микроводорослей рода Chlorella перерабатывается культурой за неделю, что в итоге составляет 38–57 % от общего объема нефти в концентрации 100 мг/л [21]. Высокая устойчивость другого вида зеленых микроводорослей Scenedesmus sp. отмечена для природных условий в зонах действия разливов сырой нефти [22].
Устойчивость к нефтепродуктам связана с генетической адаптацией и физиологической акклиматизацией [22], а также зависит от биотопа, в котором преимущественно находится вид (организмы бентоса устойчивее) [11].
Вместе с тем, намного меньшая доза дизельного топлива в нашем эксперименте была высокотоксичной для другого представителя отдела Chlorophyta. Следовательно, сходства реагирования представителей разных отделов, либо разных видов микроводорослей, относящихся к одному отделу, не имеется. Например, видоспецифичность реагирования на разные фракции сырой нефти показана для синезеленых водорослей [14]. Токсический эффект был показан для представителей разных отделов – синезеленых, зеленых, диатомовых и криптофитовых водорослей [23, 15].
Установлено, что сырая нефть была токсичнее мазута, хотя среди разных марок мазута есть и относительно безвредные [23], что, по-видимому, было в нашем эксперименте. Так, на примере Chlorella autotrophica установлено, что такие составляющие фракции – ароматические соединения как нафталин, метилнафталины, дибензотиофены, фенантрены и соединения с летучестью, большей, чем у метилнафталинов, не токсичны для микроводорослей. Парафиновая и асфальтовая фракции мазута также оказались нетоксичными. Можно предположить, что токсичность цельных мазутов обусловлена менее растворимыми в воде соединениями высококипящей ароматической фракции [23]. При воздействии водорастворимых фракций нефти, а также мазута Dunaliella tertiolecta [15] оказалась более устойчивой по сравнению с представителями синезеленых, диатомовых и криптофитовых микроводорослей [15, 24]. Массовый вид Skeletonema costatum оказался устойчивым к воздействию нефтепродуктов; при их концентрации от 10 до 80 мг/л данный представитель диатомовых не только хорошо рос, но и способствовал биоремедиации воды от нефтяных пятен [25].
Скорость движения клеток в наших экспериментах существенно не изменялась, кроме случая с соляровым маслом в концентрации 0,1 мг/л. Известно, что в норме клетки Dunaliella передвигаются со скоростью 48±2 мкм/с [9], что совпадает со значениями в нашем эксперименте (рис. 2). При токсическом воздействии нефтепродуктов этот параметр снижается. Так, при воздействии 75–174 мг/л масел и 98–800 мг/л сырой нефти подвижность Isochrysis sp. падает через 24 часа относительно контроля, наряду с понижением роста и выживаемости. Однако, до 200 мг/л сырой нефти отклонения в скорости движения клеток были небольшими [26], что также согласуется с результатами наших исследований. Достоверными относительно контроля являются величины скорости клеток на 4, 6, 10 сутки, а на 7 сутки для концентрации 0,1 мг/л мазута. Для дизельного топлива на 4, 8 и 10 сутки скорость достоверно (р≤0,05) отличалась от котрольных значений.
В природных условиях в различные сезоны года токсическое действие нефти проявляется в больших концентрациях (1,25−10,0 мг/л). При этом происходит снижение показателя чистой продукции во всех сезонах, вплоть до ее полного исчезновения с 10-х суток в концентрациях 2,5−10,0 мг/л [1].
Несмотря на высокую чувствительность к разным факторам представителей зоопланктонных сообществ, имеются сведения о высокой резистентности к нефти копепод и кладоцер; авторы сообщают о зависимости степени токсического воздействия нефтепродуктов от концентрации нефтепродуктов, продолжительности экспозиции и температурного фактора [27–30].
Высокая устойчивость артемии из крымских соленых озер к нефтепродуктам [31] также отмечена другими исследователями, данный объект одновременно чувствителен по отношению к комплексному загрязнению водоемов и/или отдельным токсикантам. В водоемах, загрязненных нефтепродуктами (до ПДК) артемия развивается хорошо, являясь подчас единственным представителем зоопланктона [32]. Artemia salina широко используется в биотестировании грунтов и воды, загрязненных нефтепродуктами [32].
При концентрации дизельного топлива 0,05 мг/л был зафиксирован наибольший процент выклева артемии (рис. 3). Во второй день выклев рачков при концентрациях 0,025 и 0,05 мг/л дизельного топлива был максимальным (рис. 3). При концентрации 0,01 мг/л максимум выклева произошел на четвертый день; его величина была ниже, чем в других опытных вариантах. Достоверными оказались лишь отличия между опытом (0,025 и 0,05 мг/л) и контролем на 3 сутки.

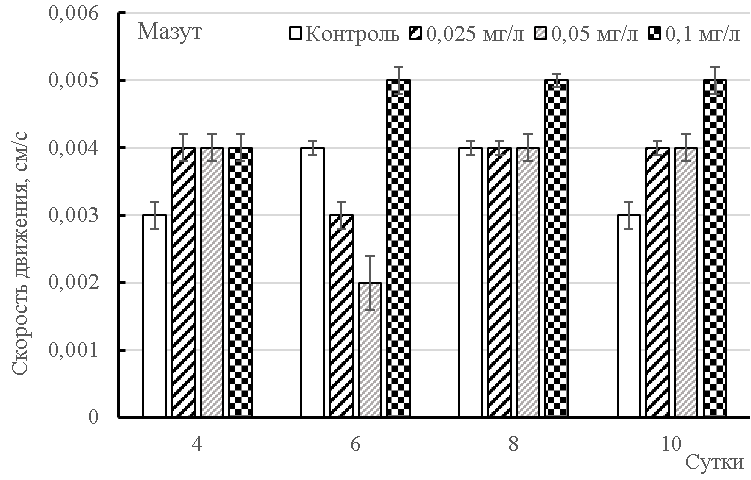
Рис. 2. Скорость движения клеток культуры Dunaliella salina, подвергнутой действию нефтепродуктов.
Отмечено, что при концентрации мазута 0,01 мг/л максимальный выклев рачка произошел на третий день (рис. 3). При остальных концентрациях на четвёртый день эксперимента рождаемость стала ниже контрольной. Под влиянием 0,025 и 0,05 мг/л мазута выклев рачков заметно ниже, чем под воздействием солярки. Достоверных (р≤0,05) различий между контрольными величинами и опытными не установлено.
Известно, что обилие микроводорослей, особенно жгутиковых очень важно для выживания, развития и размножения зоопланктонных ракообразных [33]. В нашем эксперименте как при воздействии мазута, так и легкой фракции нефтепродуктов, фактор кормления оказался весьма важным для проявления токсического эффекта.
Водоросли, которые инкубировались в течение 10 суток при максимальной концентрации мазута, были потреблены науплиусами в большей степени, чем в остальных вариантах. Выживаемость при этом была минимальной и ниже 30 % (рис. 4). Следовательно, даже при подкормке рачков мазут в концентрации 0,1 мг/л оказался высокотоксичным. С учетом того, что в этой части работы сам мазут присутствовал в следовом количестве, токсический эффект произошел только из-за потребления микроводорослей, следовательно в первой половине эксперимента микроводоросли, засчет способности к гетеротрофному питанию, по-видимому, накопили в себе токсикант. Накопление микроводорослями нефтепродуктов влияет не только на выживаемость различных видов зоопланктонных рачков, но и отражается на их репродуктивном потенциале, а также выживаемости ракообразных в следующем поколении [34]. Следует отметить, что достоверных отличий по отношению к контролю выявлено не было в этом эксперименте.
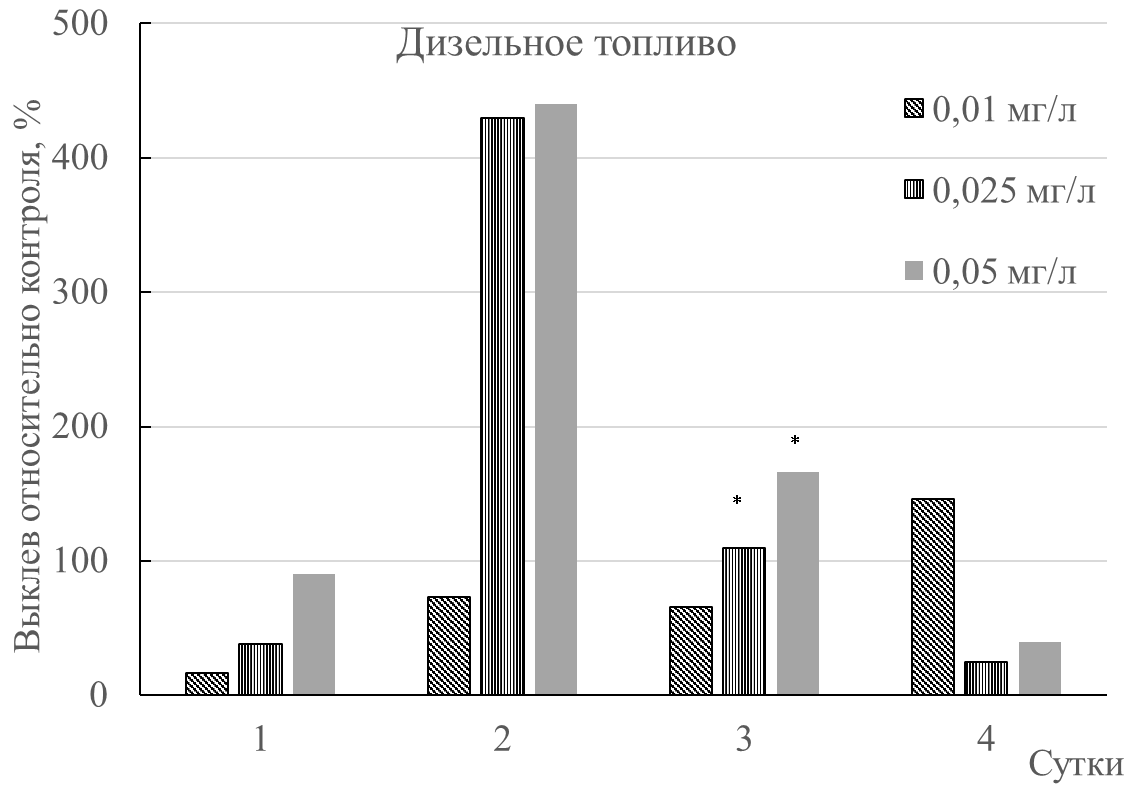
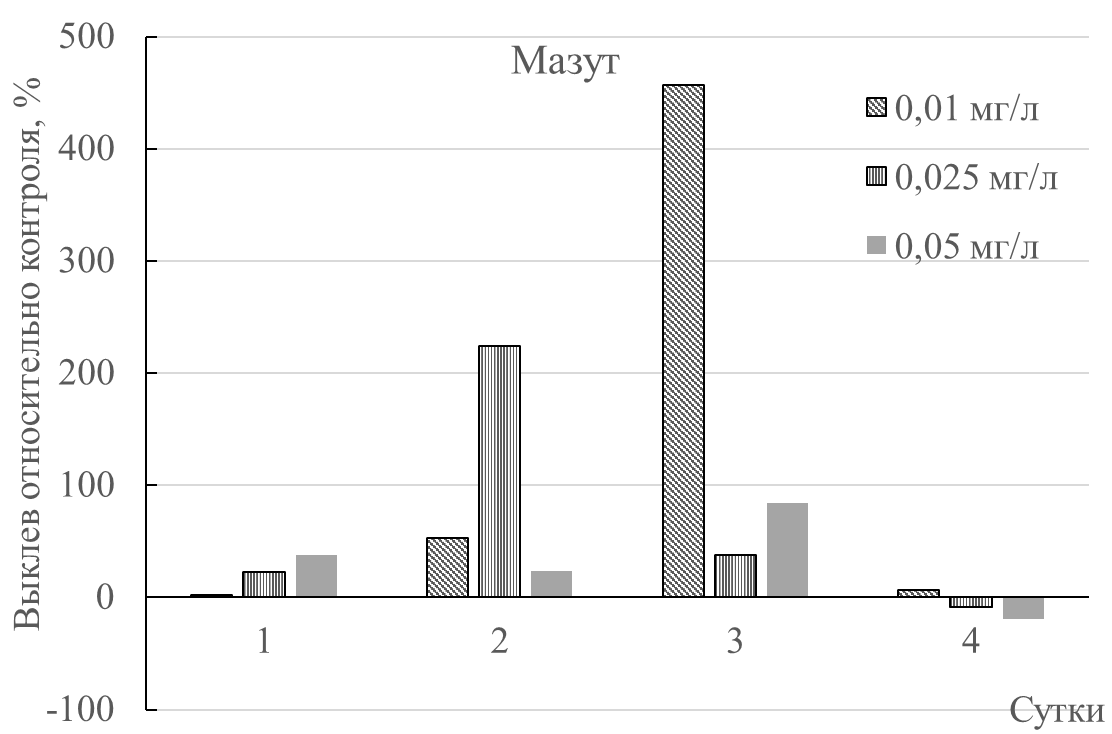
Рис. 3. Процент выклева науплиусов артемии при влиянии низких концентраций мазута и дизельного топлива; * – величины, достоверные по отношению к контролю.
Литературные сведения о биотестировании воды и грунтов, загрязненных нефтепродуктами, на ракообразных показали безвредные концентрации для разных представителей зоопланктона и зообентоса – 0,1 г/кг, а для воды концентрация, не вызывающая патологий у дафний Daphnia (Ctenodaphnia) magna – 0,034–0,136 мг/дм3 [3, 35].
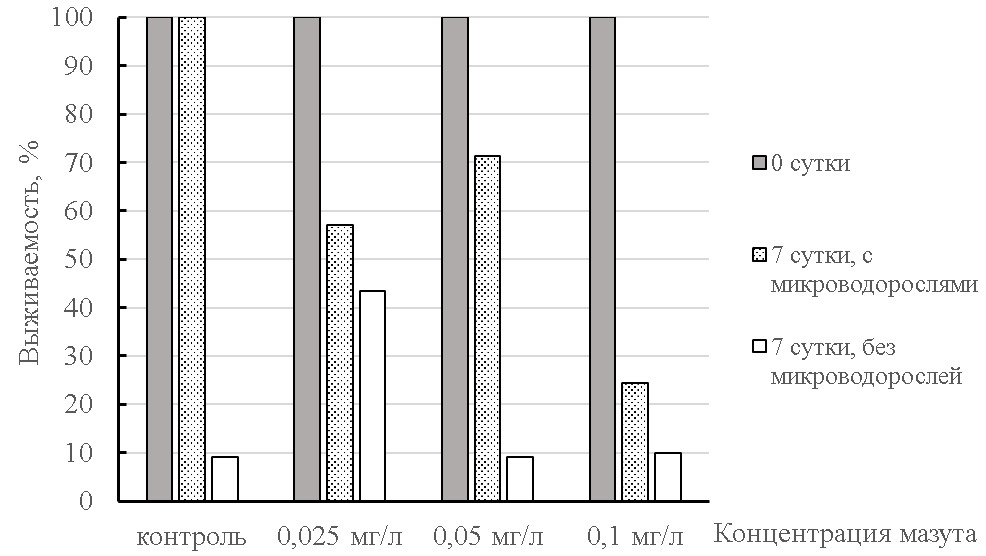
Рис. 4. Влияние мазута на выживаемость науплиусов артемии в среде с и без микроводорослей.
Наши данные свидетельствуют о том, что действующая ПДК для нефтепродуктов – величина завышенная. Без питания гибель жабронога была высокой и при добавлении НУ и в контроле, что наводит на мысль обязательной подкормки, особенно в долгосрочных токсикологических экспериментах.
Весьма сходные результаты получены другими исследователями: при оценке кратковременного действия мазута и солярового масла в концентрации 0,01 мл/л выживаемость рачков на 2 сутки составила 75 и 45 % соответственно [36]. В сочетании с нашими данными, можно предположить, что их число снизилось бы с ходом экспозиции несмотря на то, что концентрация кислорода при больших разбавлениях снижается незначительно [36], особенно в случае с дизельным топливом. Аналогичный эффект разного характера воздействия мазута и дизельного топлива также отмечен в указанной работе: дизельное топливо оказывает «химическое» воздействие на жабронога, в то время как мазут и нефть – «физиологическое» [36]. Более высокая токсичность легких нефтяных фракций установлена ранее и для Daphnia magna [35]. Степень токсичности аварийного разлива зависит от фракционного состава нефтяного поллютанта, и при повышенном проценте содержания тяжелых масляных фракций фактическая биологически безопасная концентрация ниже значений ПДК [35].
При более низких концентрациях тяжелой фракции нефти все-таки выживаемость была выше 50 % и превышала величины в эксперименте без кормления.
Выживаемость в растворах с дизельным топливом была ниже 20 % (рис. 5). Следует, однако, отметить, что, как и в случае с мазутом выживаемость науплиусов без питания была ниже, чем при наличии микроводорослей в воде (рис. 5). Можно заметить, что по мере роста концентрации токсиканта в первой части данного эксперимента пропорционально повышалась смертность A. salina, причём её величины превышали 50 % (рис. 5). Достоверными явились величины выживаемости рачков при содержании их в растворах с остатками культуры на 7 сутки, а также без микроводорослей – при воздействии 0,05 мг/л ДТ.

Рис. 5. Влияние дизельного топлива на выживаемость науплиусов артемии в среде с и без микроводорослей, * – величины, достоверные по отношению к контролю.
В случае с дизельным топливом изначально плотность культуры была тем ниже, чем выше концентрация ксенобиотика, а в конце эксперимента Dunaliella salina была обнаружена во всех вариантах в малых концентрациях (табл. 1). Это не могло не сказаться на числе выживших жаброногов. Клеток, служащих основным кормом, было критически мало, что усугубило токсический эффект легкой фракции нефти.
Таблица 1
Численность микроводорослей Dunaliella salina до и после недельной инкубации с науплиусами артемии (кл./мл)
| Сутки | Концентрация нефтепродуктов, мг/л | |||
| Контроль | 0,025 | 0,05 | 0,1 | |
| Мазут | ||||
| 0 | 544400±46700 | 494000±26400 | 653800±82800 | 726300±77400 |
| 7 | 6020±1220 | 3800±930 | 7300±1400 | 5000±840 |
| Дизельное топливо | ||||
| 0 | 720600±96200 | 619100±98000 | 324691±39800 | 6800±3300 |
| 7 | 1200±370 | 1700±490 | 550±210 | 460±210 |
Ранее нами было показано, что при экспериментальном воздействии нефтепродуктами выживаемость личинок атерины, при условии кормления науплиусами артемиии, была выше, чем без наличия пищи [4]. В то же время есть и противоречащие данные: при воздействии нефти на ранние стадии жизни рифовых рыб имеются серьезные долгосрочные для их экологии и выживания последствия, которые не связаны с выбором среды обитания, хищничеством или наличием пищи.
Наблюдаемые поведенческие изменения также не могут объяснить снижение роста и выживания в идеальных условиях с достаточным количеством еды, укрытия и отсутствия нападения хищников, так как рыбы добывали в эксперименте пищу с той же скоростью, что и контрольные экземпляры [2]. В случае с артемией, действительно существенных отличий между контролем и опытами по объему потребленных микроводорослей нет, но при максимальной концентрации мазута (0,1 мг/л) все-таки этот параметр был выше (табл. 1), что, в конечном счете, не повлияло на выживаемость – смертность рачков в этом варианте была максимальной (рис. 4). Интересно, что этот эффект бы ранее описан для других представителей зоопланктона – гиперактивность засчет увеличения скорости потребления микроводорослей при их инкубации в растворах с низкими концентрациями нефтепродуктов [34].
ЗАКЛЮЧЕНИЕ
- В растворе с дизельным топливом наблюдали постоянный рост численности Dunaliella salina только в вариантах 0,025 и 0,05 мг/л, но число клеток в варианте 0,1 мг/л было критически мало к концу экспозиции. Мазут в концентрации 0,1 мг/л простимулировал рост численности Dunaliella salina по сравнению с контролем.
- Чем выше концентрация мазута в растворах, тем выше скорость движения клеток Dunaliella salina, в то время как при добавлении дизельного топлива наблюдалась обратная тенденция, вплоть до полной их остановки.
- Процент выклева науплиусов артемии увеличивался при влиянии низких концентраций дизельного топлива и был ниже контроля при воздействии мазута.
- И мазут, и дизельное топливо в концентрациях 0,025, 0,05 и 0,1 мг/л оказали токсический эффект на науплиусов артемии, выразившийся в снижении их выживаемости более чем на 50 % в течение 7 суток.
- При кормлении рачков микроводорослями, инкубированными в растворах с нефтепродуктами, токсичность мазута и солярки снижается, однако высокая растворимость дизельного топлива и уменьшение количества пищевых объектов (Dunaliella salina) являются ключевыми факторами проявления бóльшей токсичности легкой фракции нефтепродуктов в концентрациях 0,05 и 0,1 мг/л.
Можно подытожить: низкие концентрации мазута оказали стимулирующий эффект на культуру микроводорослей D. salina, a дизельное топливо – наоборот. Противоположный эффект показан в отношении A. salina – внесение дизельного топлива простимулировало выклев жабронога. Несмотря на то, что оба вида нефтепродуктов были токсичны для науплиусов артемии, наличие в среде микроводорослей может снизить уровень опасности для этого тест-объекта.
Работа выполнена согласно госзаданиям «Изучение биогеохимических закономерностей радиоэкологических и хемоэкологических процессов в экосистемах водоемов Азово-Черноморского бассейна в сравнении с другими акваториями Мирового океана и отдельными водными экосистемами их водосборных бассейнов для обеспечения устойчивого развития на южных морях России» (№1023032000047-8-1.6.19,) и «Трансформация структуры и функций экосистем морской пелагиали в условиях антропогенного воздействия и изменения климата» (№1023032700553-3-1.6.16;1.6.19).
- Water quality standards for water bodies of fishery importance, including standards for maximum permissible concentrations of harmful substances in the waters of water bodies of fishery importance (as amended as of March 10, 2020).
- Johansen J. L., Allan B. J. M., Rummer J. L., Esbaugh A. J. Oil exposure disrupts early life-history stages of coral reef fishes via behavioural impairments, Nature Ecology & Evolution, 1, 1146 (2017).
- Tomilina I. I., Mikhailova L. V., Rybina G. E., Akatieva T. G. Effect of bottom sediments contaminated with oil products on planktonic and benthic crustaceans, Toxicological Bulletin, 2, 28 (2009).
- Kuzminova N. S., Vdodovich I. V., Soletsky R. A. Experimental effects of fuel oil and diesel fuel on silverside larvae, Bulletin of the Astrakhan State Technical University. Series: Fisheries, 27. https://doi.org/10.24143/2073-5529-2023-1-27-34 (2023).
- Andersen R. A. Algal Culturing Techniques, 589 p. (Elsevier Academic Press, Burlington, MA, 2005).
- Balnokin Yu. V., Medvedev A. V., Aleshina N. V., Strogonov B. P. Adaptation of the seaweed Dunaliella maritima to high salinity of water, Biology of the shelf zones of the World Ocean, Part 2, 137 (1982).
- Markina Zh. V. Application of microalgae to assess the quality of sea water and the action of detergents: abstract. dis. …cand. biol. Sci. – 03.00.18 Hydrobiology, 03 00 16 Ecology, 21 (Vladivostok: Institute of Marine Biology named after. A. V. Zhirmunsky Far Eastern Branch of the Russian Academy of Sciences, 2008).
- Markina Zh. V., Aizdaicher N. A. Dunaliella salina (Chlorophyta) as a test object for assessing pollution of the marine environment with detergents, Biology of the sea, 31, 4. 274 (2005).
- Masyuk N. P., Posudin Yu. I., Lilitskaya G. G. Photomotion of Dunaliella Teod cells. (Dunaliellales, Chlorophyceae, Viridiplantae), 264 (Kyiv, 2007).
- Movchan E. A., Stogov I. A., Primakov I. M., Kvitko K. V., Kolchenko A. A. Response of the biota of Arctic ephemeral water bodies to experimental pollution with diesel fuel, Modern problems of aquatic toxicology: Abstracts. report All-Russian conf. with international with the participation of specialists from near and far abroad countries (Borok, November 19-21, 2002), 96 (Borok, 2002).
- Mironov O. G., Lanskaya L. A. The influence of petroleum products on the development of marine phytoplankton, Questions of biooceanography, 161 (“Naukova Dumka”. K, 1967).
- Michel F., Delille D. Annual changes of microalgae biomass in Antarctic sea ice contaminated by crude oil and diesel fuel, Polar Biology, 21, 391 (1999).
- Radice R. P., De Fabrizio V., Donadoni A., Scopa A., Martelli G. Crude Oil Bioremediation: From Bacteria to Microalgae, Processes, 11, 442. https://doi.org/10.3390/ pr11020442 (2023).
- Singh A. K., Gaur J. P. Effects of Petroleum Oils and Their Paraffinic, Asphaltic, and Aromatic Fractions on Photosynthesis and Respiration of Microalgae, Ecotoxicology and environmental safety, 19, 8 (1990).
- Morales-Loo M. R., Goutx M. Effects of water-soluble fraction of the Mexican crude oil “Isthmus Cactus” on growth, cellular content of chlorophyll and lipid composition of planktonic microalgae, Marine Biology, 104, 503 (1990).
- Vshivtsev V. S. The influence of petroleum hydrocarbons on photosynthetic functions and the composition of fatty acids of membrane lipids of the cyanobacterium Anabaena variabilis: dis. …cand. biol. Sci. − 03.00.12 Physiology and biochemistry of plants, 149 (Moscow: Moscow State University named after. M. V. Lomonosova, 1985).
- Zgurovskaya L.N. Influence of oil growth substance on the reproduction rate of some species of planktonic algae of the Black Sea, Biology and distribution of plankton of the southern seas, 22 (1967).
- Roukhnyainen M. I., Mironov O. G. Development of some small marine flagellated algae in the presence of hydrocarbons, Hydrobiological studies of the north-eastern part of the Black Sea, 151 (Publishing house of Rostov University, 1973).
- Selifonova Zh. P., Chasovnikov V. K. On the issue of the state of hyperhaline reservoirs of the Taman Black Sea region, Marine Biological Journal, 1, 4, 40. http://mbj.imbr-ras.ru; doi:10.21072/mbj.2016.01.4.05 (2016).
- Sharapova I. E., Markarova M. Yu., Garabadzhiu A. V. Microbiological activity of oil-contaminated soil substrates during purification using complex biosorbents, News of the Samara Scientific Center of the Russian Academy of Sciences, 12, 1 (5), 1 (2010).
- Semenov Yu. V., Kharlamova T. A., Bodrov A. V. The use of chlorella microalgae for biological purification of water from oil pollution, Mining Information and Analytical Bulletin (scientific and technical journal), 11, 169 (2012).
- Carrera-Martinez D., Mateos-Sanz A., Lopez-Rodas V., Costas E. Adaptation of microalgae to a gradient of continuous petroleum contamination, Aquatic Toxicology, 101, 342 (2011).
- Batterton J. C., Winters K., Van Baalen C. Sensitivity of three microalgae to crude oils and fuel oils, Marine Environmental Research, 1, 1, 31 (1978).
- Pulich Jr. W. M., Winters K., Van Baalen C. The Effects of a No. 2 Fuel Oil and Two Crude Oils on the Growth and Photosynthesis of Microalgae, Marine Biology, 28, 87 (1974).
- Pi Y., Xu N., Bao M., Li Y., Lv D., Sun P. Bioremediation of oil spill polluted marine intertidal zone and its toxicity effect 2 on microalgae, Environmental Science Processes & Impacts, 17(4). rsc.li/process-impact. 1. DOI:10.1039/C5EM00005J (2015)
- Garr A. L., Laramore S., Krebs W. Toxic effects of oil and dispersant on marine microalgae, Bulletin of Environmental Contamination and Toxicology, 93, 654 (2014).
- Abdusamadov A. S. Current state and environmental and economic prospects for the development of fisheries in the Western Caspian region of Russia: abstract of thesis. dis. … doc. biol. Sciences: 03.00.16 Ecology, 03.00.32 – Biological resources, 46 p. (Makhachkala: Dagestan branch of the Caspian Research Institute of Fisheries (DO CaspNIRKH) and the Institute of Applied Ecology of the Dagestan State University, 2004).
- Ermolaeva N. I. Zooplankton of the taiga river under conditions of chronic oil pollution, Water resources, 47, 1, 68 (2020).
- Zagorodnyaya Yu. A. Assessment of the impact of an oil spill in the Kerch Strait in the fall of 2007, Ecology of the sea, 77, 17 (2009).
- Lapteva E. M., Loskutova O. A., Kholopov Yu. V. Ecological state of the Small Northern River after an emergency release of oil products, Water Resources, 46, 5, 523 (2019).
- Zhugailo S. S., Avdeeva T. M., Pugach M. N., Adzhiumerov S. N., Adzhiumerov E. N. Current state of hypersaline lakes of the Crimea according to hydrochemical and ecological-toxicological indicators, Proceedings of YugNIRO, 54, 116 (2017).
- Tynybaeva T. G., Kostina N. V., Terekhov A. M., Kurakova A. V. The Microbiological Activity and Toxicity of Oil-Polluted Playa Solonchaks and Filled Grounds within the Severnye Buzachi Oil Field (Kazakhstan), Eurasian Soil Science, 41, 10, 1115 (2008).
- Hovenkamp W. Instar-specific mortalities of coexiting Daphnia species in relation of food and invertebrate predation, Journal of planktonic Research, 12, 3, 483 (1990).
- Jonander C., Dahllof I. Short and long-term effects of low-sulphur fuels on marine zooplankton communities, Aquatic Toxicology, 227. 105592, 1, https://doi.org/10.1016/j.aquatox.2020.105592 (2020).
- Fomicheva G. P., Nasibulina B. M., Biryukova M. G. Crustaceans of the Volga River delta in conditions of emergency oil spills, Bulletin of the Astrakhan State Technical University. Series: Fisheries, 1, 27. DOI: 10.24143/2073-5529-2020-1-27-37 (2020).
- Shinkarevich E. D. Use of Artemia salina for environmental assessment of reservoirs, News of the St. Petersburg State Agrarian University, 50, 128 (2018).



