VASOTROPIC EFFECTS OF SECONDARY MYRTLE METABOLITES: EXPERIMENTAL STUDIES
ВАЗОАКТИВНОЕ ДЕЙСТВИЕ ВТОРИЧНЫХ МЕТАБОЛИТОВ МИРТА
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №2, 2024
Publication text (PDF):Download
UDK: 57.084: 547.19
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Chuyan E. N., V.I. Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
Mironyuk I. S., V.I. Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
Cheretaev I. V., V.I. Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
Ravaeva M. Yu., V.I. Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
Liventsov S. Yu., V.I. Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
Murtazaeva A. M., V.I. Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
Shevchuk O. M., Nikitsky Botanical Gardens – National Scientific Center of the RAS», Republic of Crimea, Russia
Baykova N. N. Nikitsky Botanical Gardens – National Scientific Center of the RAS», Republic of Crimea, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-2-254-273
PAGES:from 254 to 273
STATUS:Published
LANGUAGE:Russian
KEYWORDS: : vasotropic activity; arterial pressure; vascular tone; secondary metabolites of myrtle; essential oil; plant polyphenols
ABSTRACT (ENGLISH):
Currently, the searching of newly natural medicines that meet modern safety requirements and the development of effective herbal preparations based on them are priority areas of pharmacognosy, physiology, medicine. The raw material of myrtle (Myrtus communis L.), a medicinal plant of the Myrtaceae Juss family, is not registered in the Russian Pharmacopoeia as medicinal, there are no standardized methods of qualitative and quantitative determination of biologically active myrtle compounds represented by various groups of substances: phenolic acids, soluble tannins (gallotanins), proanthocyanides, flavonoids, essential oils, amino acids, essential elements, which is associated with a wide range of potential pharmacological activity of this plant. Since the vascular component of the cardiovascular system plays an important role in determining the activity of many pharmaceuticals and biologically active food additives, the purpose of this study was to identify the vasotropic activity of secondary myrtle metabolites obtained in the NBS-NSC.
The study of the syrups vasotropic activity with predominant components as a part of syrup such as phenolic acids (39.6 mg/L) or flavonoids (187 mg/L), including myricetin-3-O-rhamnoside, and myrtle essential oil hydrolate (0.025 %) was carried out on 40 mature male Wistar rats weighing 180–200 g (2.5 mL/kg, intragastrically, daily for 21 days), registering skin microcirculation parameters by laser Doppler fluometry using a laser blood flow analyzer “LAZMA-MC” (manufactured by SPE “Lazma”, Russia) and blood pressure using the NIBP200A system (“Biopac Systems, Inc.”, USA).
The vasotropic activity of the tested compounds containing a complex of myrtle secondary metabolites was revealed. The hydrolate of myrtle essential oil during the entire study period caused only a tendency to decrease blood pressure and vasodilation of the skin microvessels of rats. The vasotropic activity of syrups containing plant polyphenols was manifested in a different way, which is associated with the content of pharmacologically active components and the administration duration to animals. The results obtained significantly expand the understanding of the spectrum of biological efficacy of myrtle secondary metabolites complex, a relatively little-studied group of natural compounds, and clarify some mechanisms of their action. The conclusion is made about the prospects for further research, creation and introduction of new biologically active drugs based on a myrtle secondary metabolites complex.
ВВЕДЕНИЕ
В настоящее время поиск новых природных лекарственных средств, отвечающих современным требованиям безопасности, и разработка на их основе эффективных препаратов растительного происхождения являются приоритетными направлениями фармакогнозии, физиологии, медицины. Фитопрепаратам отведена значительная роль в реализации стратегии Российской Федерации лекарственного обеспечения населения на период до 2025 г. Это связано с тем, что химический состав растений чрезвычайно разнообразен, в него входят важнейшие биологически активные соединения (БАС): алкалоиды, сапонины, флавоноиды, органические кислоты, фенилпропаноиды, производные фенолов, эфирные масла (ЭМ) и т.д. Современные лекарственные средства, биологически активные добавки к пище и продукты функционального питания из растительного сырья полностью отвечают нормам качества, эффективности и безопасности, занимают важное место в современной медицине для первичной и вторичной профилактики и лечения различных заболеваний, в спортивной и восстановительной медицине, гериатрии и имеют ряд преимуществ по сравнению с синтетическими лекарственными препаратами, поскольку обладают уникальным химическим составом, более широким спектром фармакотерапевтического действия, низкой токсичностью на фоне высокой эффективности и минимизации побочных действий и противопоказаний [1, 2]. Однако несмотря на значительные результаты фармакологических исследований, технологические достижения в области создания новых веществ, число новых препаратов из растительного сырья, достигших рынка, остается небольшим. Поэтому расширение ассортимента препаратов природного происхождения, исследование их биологической и фармакологической активности является актуальным.
В настоящее время сырье мирта обыкновенного (Myrtus communis L.), лекарственного растения семейства Myrtaceae Juss не зарегистрировано в Российской фармакопее как лекарственное, отсутствуют стандартизированные методики качественного и количественного определения БАС мирта, которые представлены различными группами вторичных метаболитов: фенольными кислотами (галловой, эллаговой, чесночной, кофейной, сиреневой, ванильной), флавоноидами, растворимыми танинами (галлотанинами), проантоцианидами, ЭМ, аминокислотами, эссенциальными элементами, с чем связан широкий спектр потенциальной фармацевтической активности этого растения [3, 4]. По данным ряда авторов [5, 6], водные, водно-этанольные экстракты и ЭМ мирта обладают антибактериальным, антиоксидантым, седативным, антигипергликемическим, противодиабетическим, противовоспалительным, противомутагенным, противоатерогенным, гипотензивным, противоязвенным, антидиарейным, антипролиферативным эффектами, проапоптозным действием в раковых клетках, способствуют нормализации деятельности вегетативной и центральной нервной системы. Достаточно широкий диапазон терапевтических возможностей в сочетании с низкой токсичностью создает перспективу для разработки различных фармацевтических субстанций на основе сырья этого растения.
В ФГБУН «Ордена Трудового Красного Знамени Никитский ботанический сад – Национальный научный центр РАН» создан высокопродуктивный и морозоустойчивый сорт мирта обыкновенного, разработана технология размножения растений вегетативным способом для создания промышленных сырьевых плантаций, что позволяет получить однородное сырье высокого качества со стабильными характеристиками. Установлено, что биохимический состав сырья зависит от условий выращивания растений, в том числе почвенно-климатических условий возделывания культуры, инсоляции и пр. Установлено, что при выращивании на Южном берегу Крыма (северная граница естественного ареала мирта) в условиях сухого субтропического климата средиземноморского типа сырье мирта характеризуется высоким содержанием фенольных соединений, флавоноидов. В листьях мирта накапливается до 0.82 % ЭМ на абсолютно сухую массу, что почти в два раза больше, чем в сырье других регионов. Высокое содержание именно этих компонентов обусловливает высокие фармацевтические свойства сырья мирта, выращенного в условиях Южного берега Крыма [4].
Внедрение новых лекарственных средств в клиническую практику осуществимо лишь при условии детального изучения их специфической фармакологической активности и безопасности на этапе биоскрининговых исследований. Поскольку сосудистое микроциркуляторное (МЦ) русло осуществляет взаимосвязь тканевого метаболизма и центральной гемодинамики, первым вовлекается в физиологические и патологические процессы и играет важную роль в определении активности многих фармацевтических препаратов и БАД, целью настоящего исследования явилось выявление вазоактивного действия субстанций вторичных метаболитов мирта у здоровых животных.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования являлись фармацевтические субстанции: два вида экстрактов и гидролат мирта, изготовленные в ФГБУН «НБС-ННЦ» из высушенных листьев мирта (Myrtus communis L.), собранных в период плодоношения растения. Экстракцию сырья и приготовление экстрактов проводили в соответствии с методом, описанным в Государственной фармакопее РФ ХIII [7] с применением водного (образец I) и водно-этанольного (образец II) экстрагентов. Гидролат мирта (образец III) получали методом паровой отгонки, которую выполняли по методу Далматова [8]. Исследование качественного состава фенольного комплекса проводили с помощью метода высокоэффективной жидкостной хроматографии согласно ОФС1.2. 1.2.0005.15 [7], компонентный состав летучих соединений гидролата определяли с помощью аппаратно-программного комплекса на базе хроматографа «Хроматек-Кристалл 5000.2», оснащенного масс-спектрометрическим детектором. Идентификация состава выполнялась на основе сравнения полученных масс-спектров с данными библиотеки NIST 14 (Национальный Институт Стандартов и Технологий, США) и на основе рассчитанных индексов удерживания. Установлено, что в образце I преобладающими компонентами являются фенольные кислоты (39.6 мг/дм3) – эллаговая (22.5 мг/дм3) и галловая (17.1 мг/дм3), а сумма флавоноидов составила 26.0 мг/дм3, из которых основным является мирицетин-3-О-рамнозид (25.3 мг/дм3). В образце II преобладают флавоноиды, общая сумма которых составила 187.0 мг/дм3, в том числе флавоноид мирицетин-3-О-рамнозид (141.4 мг/дм3) и его галактозид (18.7 мг/дм3). Содержание фенольных кислот – галловой (25.7 мг/дм3) и эллаговой (9.8 мг/дм3) в процентном соотношении ниже, чем флавоноидов. Остальные компоненты содержатся в минорных концентрациях. Таким образом, в образце II общее содержание флавоноидов в 7.2 раза, а флавоноида мирицетин-3-О-рамнозида в 5.6 раз больше, чем в образце I. Содержание ЭМ в образце III составило 0.025 %. Основными компонентами ЭМ являются линалоол (76.0 мг/дм3) и миртенилацетат (275.0 мг/дм3).
Ранее была установлена токсичность водного извлечения и экстракта мирта обыкновенного [9], величина LD50 составила 50 мл/кг, на основании чего авторы исследования отнесли тестируемые экстракты к 5-му классу токсичности согласно классификации GHS (Globally Harmonized System of Classification and Labelling of Chemicals, Part3 Health Hazards, United Nations, 207).
Экспериментальная часть работы выполнена в Центре коллективного пользования научным оборудованием «Экспериментальная физиология и биофизика» кафедры физиологии человека и животных и биофизики ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского».
Лабораторные крысы («ФГУП «Питомник лабораторных животных «Рапполово») содержались в условиях вивария с естественным свето-темновым циклом при температуре 18–22 °С на подстиле на основе початков кукурузы (ООО «Зилубаг», Россия), со свободным доступом к воде и полноценному гранулированному корму ЛБК-120 (ЗАО «Тосненский комбикормовый завод», Россия). Все манипуляции с животными проводили согласно ГОСТ Р 53434-2009 от 02. 12. 2009 и правилами лабораторной практики при проведении доклинических исследований [10]. Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям этического комитета по биоэтике ФГАОУ ВО «Крымский федеральный университет им. В. И. Вернадского» (протокол № 10 от 06. 12. 2022 г.).
Крысы прошли карантин не менее 14 дней и были адаптированы к условиям лаборатории, взятию в руки (хэндлинг) и манипуляциям со стороны исследователя, показывали признаки здорового состояния. Для исследования были отобраны 40 половозрелых крыс-самцов линии Wistar массой 180–200 г., характеризующихся средней двигательной активностью и низкой эмоциональностью в тесте «открытого поля» (IR Actimeter, Pan Lab Harvard Apparatus» с двумя инфракрасными рамками, выполняющими роль датчиков движений и программным обеспечением Actitrack 2.0 (Pan Lab Harvard Apparatus», Испания), которые, как показано в наших и других исследованиях, составляют большинство в популяции, и поэтому у них развивается наиболее типичная реакция на различные воздействия физической и химической природы. Такой подход позволяет минимизировать количество животных в экспериментальной группе и получать надежные и воспроизводимые результаты исследований.
Дизайн эксперимента (рис. 1). В каждую группу (контрольная (1) и экспериментальные (2–4)) было отобрано по 10 крыс. Введение животным исследуемых образцов осуществляли принудительно интрагастрально с помощью внутрижелудочного зонда ежедневно в течение 21 дня: группа 2 – образец I; группа 3 – образец II; группа 4 – образец III в дозе 2.5 мл/кг в утреннее время (9.00–11.00 по МСК). Животным группы 1 (контрольная) вводили питьевую воду в той же дозе.
У животных всех групп на 1, 7, 14, 21 сутки наблюдения через 30 минут после введения тестируемых образцов регистрировали систолическое и диастолическое артериальное давление (САД и ДАД, мм рт. ст.)) с помощью системы NIBP200A («Biopac Systems, Inc.», США) с программным обеспечением «AcqKnowledge 4.2 for MP150». Датчик, измеряемый АД (Tail ircuffsensor 9.5), устанавливался на проксимальном конце хвоста крысы (рис. 1).

Рис. 1. Дизайн экспериментального исследования.
Показатели кожной микроциркуляции (МЦ) определяли методом лазерной допплеровской флуометрии (ЛДФ) с помощью лазерного анализатора кровотока «ЛАЗМА-МЦ» (производство НПП «Лазма», Россия). В ходе исследования оценивали неосцилляторные (показатель перфузии (ПМ, перф. ед.); среднее квадратическое отклонение (СКО, перф. ед.); коэффициент вариации (Кв, %)) и осцилляторные показатели МЦ (нормированные амплитуды эндотелиального
NO-зависимого (Аэ), миогенного (Ам), нейрогенного (Ан), дыхательного (Ад) и сердечного (Ас) ритмов), значения которых рассчитывали с помощью компьютерной программы обработки ЛДФ-граммы LDF 2.20.0.507WL. Амплитудно-частотные характеристики осцилляций кожного кровотока у крыс имеют определенные особенности [13]. Методика исследования и анализа показателей кожной МЦ у крыс подробно описана в работе [14].
Нейрогенный (НТ) и миогенный (МТ) тонусы рассчитывали согласно [11, 12]:
НТ (МТ) = σ*АДср. / Ан(Ам)*ПМ, (1)
где σ – среднее квадратичное отклонение показателя микроциркуляции,
АДср. – среднее артериальное давление, Ан – значение амплитуды колебаний перфузии в нейрогенном диапазоне; Ам – значение амплитуды колебаний перфузии в миогенном диапазоне.
Среднее артериальное давление у животных (АДср., мм рт. ст.) рассчитывали по формуле:
АДср. = ДАД + 1/3(САД – ДАД) (2)
Сумму Аmax в эндотелиальном, нейрогенном, миогенном и пульсовом частотных диапазонах расценивали как мощность механизмов, обеспечивающих приток крови в микроциркуляторное русло по формуле [11]:
ΣАmax = Аэ + Ан + Ам + Ас, (3)
где Аэ – значение амплитуды колебаний перфузии в эндотелиальном диапазоне; Ас – значение амплитуды колебаний перфузии в пульсовом (сердечном) диапазоне.
Поскольку в ЛДФ-грамме изменение амплитуды колебаний перфузии в дыхательном диапазоне (Ад) обусловлено периодическими колебаниями давления в венозном отделе МЦ, то соотношение притока крови к венозному оттоку (С) рассчитывали по формуле [11, 12]:
С = ΣАmax / Ад. (4)
Статистическую и графическую обработку экспериментальных данных осуществляли с помощью программ Graph Pad Prism 8.0 и «Microsoft Excel 2007». Проверку распределения данных на нормальность проводили с помощью критерия Шапиро-Уилка. Поскольку распределение данных не соответствовало нормальному, значимость различий между группами оценивали с помощью непараметрического критерия Краскела-Уоллиса с дальнейшим применением критерия Дана. Различия считались достоверными при p<0,05. С целью визуализации динамики вазотропных эффектов тестируемых образцов вторичных метаболитов мирта значения показателей МЦР и АД рассчитывали (в %) относительно значений контрольной группы, принятых за 100 %.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как показали результаты исследования, у животных 1 группы (контрольной) на протяжении 21-дневного наблюдения значения исследуемых показателей МЦ и АД были в пределах физиологической нормы и согласуются с результатами наших предыдущих исследований [14]. Однако под влиянием тестируемых образцов вторичных метаболитов мирта наблюдались определенные изменения регистрируемых показателей по сравнению с таковыми в контрольной группе животных, которые зависели как от их состава, так и от продолжительности введения (рис. 2–4).
ЛДФ-метрия активных, тонусформирующих факторов регуляции МЦ показала (рис. 2 а, б), что однократное введение образцов I и II привело к увеличению амплитуд эндотелиальных ритмов (Аэ на 31.47 %; p<0.05 и 66.45 %; p<0.05) у крыс 2 и 3 групп относительно значений в контроле. Наиболее выраженный, статистически значимый рост Аэ зарегистрирован у животных 3 группы, которым вводили образец II (Аэ увеличилась на 34.97 % (р<0.05) больше, чем у животных 3 группы после введения образца I). Известно, что медленные колебания эндотелиального ритма ЛДФ-граммы обусловлены секреторной активностью эндотелия и синхронизированы с периодическим релизингом оксида азота (NO) эндотелием сосудов, который играет важную вазодилатирующую роль и обеспечивает физиологическую регуляцию тонуса гладких мышц сосудов [11, 12]. Поэтому наблюдаемое увеличение амплитуды Аэ, зарегистрированное при введении животным образцов I и II, отражает увеличение базального уровня секреции NO, способствующего вазодилатации микрососудов.
Подтверждением этому является и повышение в ЛДФ-граммах крыс 2 и 3 групп амплитуд колебаний эндотелиально-независимого происхождения, а именно нейрогенных осцилляций (Ан) на 20.35 % и 62.22 % (p<0.05) соответственно относительно значений контрольной группы животных. Нейрогенные колебания ЛДФ-граммы отражают активность со стороны симпатических адренергических нервных волокон на гладкомышечные стенки микрососудов и характеризуют уровень нутритивного кровотока [11, 12]. Данные изменения свидетельствуют об ограничении вазоконстрикторного контроля артериолярного тонуса симпатическими нервами и подтверждаются снижением НТ прекапиллярных резистивных микрососудов на 30.08 % и 59.76 % (p<0.05) соответственно по сравнению с контрольной группой животных (рис. 3 а, б).
В первый день наблюдения в ЛДФ-граммах животных 2 и 3 групп также статистически значимо увеличились амплитуды миогенных осцилляций (Ам, на 24.24 % и 25.91 %; p<0.05), которые регистрируются не только на уровне сфинктеров, но и более проксимальных артериол и обусловлены периодической активностью гладкомышечных волокон артериол, приводя к изменению диаметра их просвета (вазомоции), и коррелируют с числом функционирующих капилляров [11, 12]. Уменьшение периферического сопротивления вследствие снижения МТ сосудов на 32.21 % и 48.15 % (p<0.05) относительно значений в контроле сопровождалось снижением САД и ДАД у животных этих групп в среднем на 15.78 – 16.72% (р<0.05) относительно значений исследуемых показателей в контроле (рис. 3 а, б).
Выявленные изменения со стороны регуляторных механизмов МЦР в первый день наблюдения у животных 2 и 3 групп при введении тестируемых образцов привели и к изменению ПМ (рис. 2 а, б), отражающего усредненную величину перфузии в капиллярах, артериолах и венулах [11, 12] на 28.40 и 54.84 % (р<0.05) соответственно относительно значений в контроле, что явилось следствием модуляции микроциркуляторных процессов со стороны активных механизмов регуляции: усиления выработки эндотелием NO, снижения активности симпатических эфферентов и дилатации гладкомышечных прекапилляров. Причем, после введения крысам образца II средняя величина перфузии кожных микрососудов увеличилась на 26.44 % (p<0.05) больше, чем после введения образца I (рис. 2 а, б).
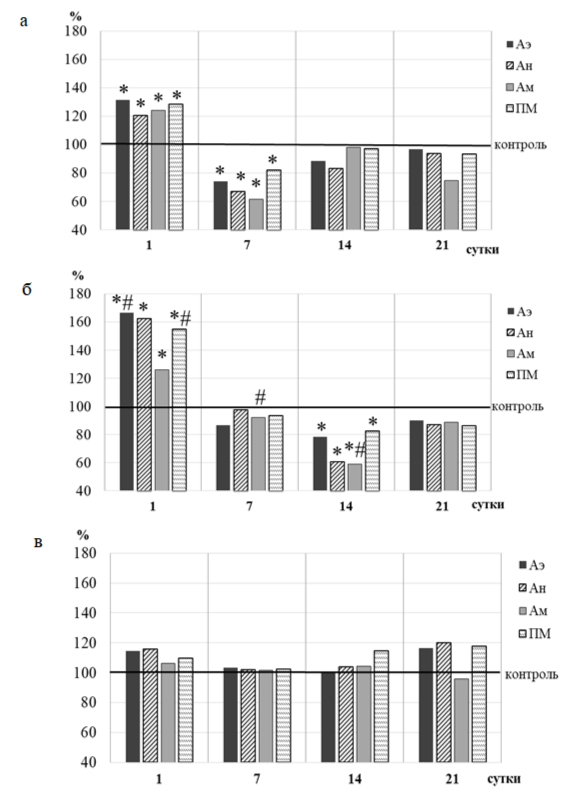
Рис. 2. Динамика амплитуд эндотелиальных (Аэ), нейрогенных (Ан), миогенных (Ам) ритмов и показателя микроциркуляции (ПМ) кожной микрогемодинамики у крыс 2 (а), 3 (б), 4 (в) групп относительно значений в 1 группе (контрольной), принятых за 100 % и обозначенных на графиках горизонтальной линией.
Примечания: * – уровень достоверности различий относительно значений показателей в контрольной группе животных; # – уровень достоверности различий значений показателей в группе 3 относительно значений показателей в группе 2 по критерию Краскела-Уоллиса.
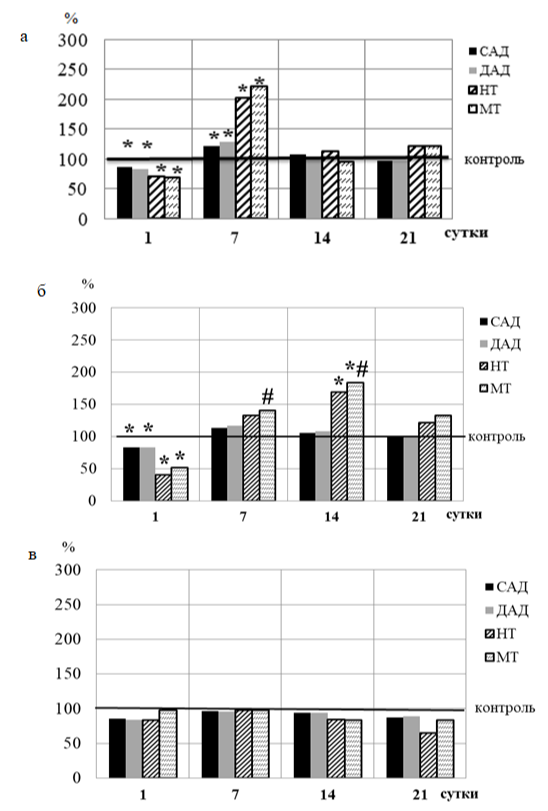
Рис. 3. Динамика систолического (САД) и диастолического (ДАД) артериального давления, нейрогенного (НТ) и миогенного (МТ) тонусов микрососудов кожи крыс 2 (а), 3 (б), 4 (в) групп относительно значений в 1 группе (контрольной), принятых за 100 % и обозначенных на графиках горизонтальной линией.
Примечания: те же, что на рис. 2.
Следует отметить, что при более длительном введении образцов I и II в ЛДФ-граммах крыс 2 и 3 групп зарегистрированы противоположные по сравнению с первым днем наблюдения изменения. Так, после 7-кратного введения крысам 2 группы образца I зарегистрировано статистически значимое снижение амплитуд эндотелиальных (Аэ, на 25.57 %; p<0.05), нейрогенных (Ан, на 33.00 %; p<0.05) и миогенных (Ам, на 38.41 %; p<0,05) ритмов на фоне повышения НТ на 102.29 % (p<0.05) и МТ на 120.25 % (p<0.05), что привело к снижению перфузии на 17.70 % (p<0.05) (рис. 2 а; 3 а). Указанные изменения свидетельствуют об уменьшении секреции NO эндотелием микрососудов, повышении симпатической адренергической активности, констрикции метартериол и прекапиллярных сфинктеров, которые в коже выполняют распределительную функцию и вносят максимальный вклад в формирование внутрисосудистого сопротивления на микроциркуляторном уровне.
Снижение мощности механизмов, обеспечивающих приток крови в МЦР, у животных 2 группы после введения образца I привело к уменьшению притока крови в прекапилляры на 32.00 % (p<0.05) относительно значений в контроле (рис. 4 а) на фоне статистически значимого снижения амплитуды дыхательной волны (на 56,70 %; р<0,05), которая в ЛДФ-грамме обусловлена периодическими колебаниями давления в венозном отделе МЦР [11, 12], тенденции к увеличению соотношения притока крови к венозному оттоку (на 19.92 %; p≥0.05 относительно значений в контроле), что указывает на уменьшение кровенаполнения венозного отдела МЦР (рис. 4 а). Указанные реакции со стороны МЦР сопровождались повышением АД (САД на 17.79 % и ДАД на 22.55 %; (p<0.05) у животных 2 группы (рис. 2 а).
В ЛДФ-грамме животных 3 группы в ответ на 7-кратное введение им образца II также было зарегистрировано снижение показателей МЦ и АД относительно значений в 1 день наблюдения, однако значения показателей статистически значимо не отличались от таковых в контроле (p≥0.05; рис. 2 б, 3 б, 4 б).
После 14-кратного введения животным 2 группы образца I наблюдалось повышение Аэ, Ам, Ан и ПМ на фоне снижения МТ, НТ и АД относительно значений данных показателей на 7 сутки регистрации и приближение их к значениям в контроле (p≥0.05) (рис. 2 а, 3 а, 4 а). У крыс 3 группы после 14-кратного введения образца II зарегистрированы более выраженные изменения, которые проявлялись в снижении амплитуд эндотелиальных (Аэ, на 21.55 %; (p<0.05), нейрогенных (Ан, на 39.22 %; p<0.05), миогенных (Ам, на 40.83 %; p<0.05) ритмов, показателя перфузии на 17.62 % (p<0,05) на фоне выраженного повышения МТ и НТ микрососудов в среднем на 76.26 % (p<0.05), что свидетельствует о развитии вазоконстриктрикции микрососудов, однако статистически значимых изменений АД при этом не выявлено (рис. 2 б, 3 б).
Рис. 4. Изменение притока крови (ΣАmax) и соотношения притока крови к венозному оттоку (ΣА/Ад) в микроциркуляторном русле у крыс 2 (а), 3 (б), 4 (в) групп относительно значений в 1 группе (контрольной), принятых за 100 %.
Примечания: те же, что на рис. 2.
В связи со снижением амплитуд тонусформирующих ритмов регуляции МЦ и уменьшением амплитуды пульсовой волны (Ас, на 40.21 %; p<0.05), величина которой прямо пропорциональна изменению притока крови в системе МЦ за счет пульсового кровенаполнения [12], произошло уменьшение притока крови в микрососуды на 31.40 % (p<0.05) от уровня значения в контроле на фоне уменьшения кровенаполнения венозного отдела МЦР, о чем свидетельствует статистически значимое снижение амплитуды дыхательной волны (Ад, на 38.60; p<0.05) и тенденция к увеличению соотношения притока крови к венозному оттоку (p≥0.05; рис. 4 б).
В ответ на 21-кратное введение образцов I и II в ЛДФ-граммах крыс 2 и 3 групп наблюдали приближение значений всех регистрируемых показателей ЛДФ и АД к уровню значений у животных контрольной группы (p≥0.05) (рис. 2 а, б; 3 а, б; 4 а, б).
У крыс 4 группы при многократном введении образца III статистически значимых различий значений исследуемых показателей не зарегистрировано во все сроки наблюдения, однако выявлена тенденция к увеличению перфузии крови в микрососудах и снижению сосудистого тонуса и АД (см. рис. 2 в, 3 в, 4 в).
Таким образом, выявлена вазоактивное действие тестируемых образцов, содержащих комплексы вторичных метаболитов мирта, выраженность которого значительно отличалась в зависимости от их состава и продолжительности введения животным.
Экспериментально установлено, что гидролат ЭМ мирта (образец III) на протяжении всего срока исследования вызвал лишь тенденцию к увеличению вазодилатации кожных микрососудов и снижению АД крыс. В доступной литературе имеются единичные данные о том, что линалоол – один из компонентов ЭМ гидролата – снижает кровяное давление, как у нормотензивных (1, 5, 10 и 20 мг/кг; внутривенно), так и гипертензивных (200 мг/кг; перорально) крыс, вероятно, из-за прямого воздействия на гладкую мускулатуру сосудов, приводящего к вазодилатации [15]. Следует, однако, отметить, что в нашем исследовании содержание линалоола в гидролате было значительно меньшим, а на тонус микрососудов и АД животных могли оказывать влияние и другие компоненты ЭМ, активность которых в отношении сосудистого тонуса не исследована.
Вазотропная активность образцов I и II, содержащих полифенолы растительного происхождения, проявлялась по-другому, а ее выраженность зависела от продолжительности действия на животных. В первые сутки наблюдения реакция микрососудов кожи крыс на их введение заключалась в достоверном увеличении перфузии, метаболической активности эндотелия, снижении жесткости сосудистой стенки резистивных микрососудов в результате снижения симпатических прессорных влияний, уменьшении тонуса прекапиллярных метартериол вследствие развития мышечной релаксации, вазодилатации и увеличения диаметра прекапилляров. Указанные изменения МЦР у животных 2 и 3 групп вызвали снижение АД, что обусловлено снижением периферического сопротивления, связанного с уменьшением тонуса сосудов. Однако после 7-кратного введения образца I и 14-кратного введения образца II развивалась противоположная реакция, характеризующаяся уменьшением перфузии на фоне снижения секреции NO, увеличения миогенного и нейрогенного тонусов сосудов, констрикции метартериол и прекапилляров, что привело к снижению кровенаполнения микрососудов. При этом нарушения венозного оттока не наблюдалось. В связи с увеличением общего периферического сопротивления микрососудов повысились и основные компоненты АД. При более продолжительном введении этих образцов (на 14 и 21 дни наблюдения у крыс 2 группы и на 21 день у крыс 3 группы) вазоконстрикторные реакции ослабевали и значения показателей МЦ и АД приближались к уровню контрольных значений, т.е. к физиологической норме.
Данные изменения вазоактивного действия тестируемых образцов I и II, по-видимому, связаны с их составом и содержанием фармацевтически активных компонентов сырья мирта. В образце I преобладающими компонентами являются фенольные кислоты, в том числе галловая и эллаговая, которые вызывают в настоящее время большой интерес у исследователей. Анализ экспериментальных исследований, проведенных in vitro и in vivo, указывает на большой потенциал галловой и эллаговой кислот, прежде всего, как антиоксидантов [16–19]. При этом доступные клинические исследования на людях, оценивающие терапевтические свойства и лечебные эффекты галловой кислоты, пока единичны, однако подчеркивают высокий терапевтический потенциал при заболеваниях с участием окислительного стресса в качестве одного из механизмов повреждения [20, 21].
В доступной литературе встречаются не многочисленные сведения и о влиянии эллаговой кислоты, являющейся димерным производным галловой кислоты, на сосудистую систему. В частности, оценивалось влияние эллаговой кислоты на мелкие брыжеечные артерии у крыс со спонтанной гипертензией, подвергшихся овариэктомии. Показано, что пероральное введение эллаговой кислоты в течение 4 недель сохраняло эндотелиально-зависимую вазодилатацию в предварительно суженных артериях спонтанно гипертензивных крыс в той же степени, что и лечение 17-β-эстрадиолом. Причем, указанный эффект исчезал в присутствии ингибитора синтазы оксида азота (метиловый эфир L-NitroG-L-аргинина). Более того, эллаговая кислота индуцировала высвобождение оксида азота сосудами, в том числе за счет увеличения общего уровня эндотелиальной синтазы оксида азота. На основании полученных данных авторы пришли к выводу, что эллаговая кислота обладает сосудорасширяющими свойствами, действующими посредством активации эндотелиальной синтазы оксида азота [22].
Число работ, посвященных исследованию биологической активности флавоноидов, которые являются преобладающим компонентом образца II, растет с каждым годом, что связано с многочисленными свидетельствами их положительного влияния на здоровье человека. Известно, что соединения, относящиеся к группе флавоноидов, являются кардиотоническими средствами, замедляют ритм сердечных сокращений и увеличивают их амплитуду, обладают
Р-витаминной активностью и, таким образом, способны уменьшать проницаемость и ломкость капилляров. Механизмы биологического действия флавоноидов весьма многообразны, однако в большинстве случаев первичной мишенью их действия является клеточная мембрана, изменение физико-химических свойств которой под действием флавоноидов может влиять на скорость окисления липидов и белков, обусловливая выраженную антиоксидантную активность растительных полифенолов [23, 24].
Исследования на животных и клеточных моделях человека и животных продемонстрировали высокий терапевтический потенциал мирицетин-3-O-рамнозида (основной компонент образца II) – антидиабетический, антиостеопорозный, противовоспалительный, гепатопротекторный, антиканцерогенный [25–29]. Показано, что мирицетин проявляет антиоксидантные свойства, по своей активности превосходящие свойства витаминов С и Е. Согласно данным обзора [30], биологическая активность мирицетина связана с его влиянием на различные клеточные процессы (апоптоз, гликолиз, клеточный цикл, энергетический баланс, уровень липидов, концентрацию белка в сыворотке и остеокластогенез). На основании анализа литературы с 2009 по 2019 год обоснована защитная роль мирицетина в профилактике сердечно-сосудистых заболеваний, что связано с его кардиопротекторным, антигипертензивным, антиатеросклеротическим, антигипергликемическим и антигиперлипидемическим действием [31].
Вызывают интерес данные [32], в которых показано, что мирицетин является ингибитором синтеза оксида азота и протеинкиназы С, которой отводится ведущая роль в механизмах увеличения чувствительности сократительного аппарата гладкомышечных клеток к ионам кальция [33]. Опосредованные протеинкиназой С пути сенситизации сократительных белков участвуют в ответных реакциях гладкомышечных клеток на увеличение внутрисосудистого давления в МЦР [34]. Возможно, именно с этим связано уменьшение миогенного тонуса микрососудов в первый день наблюдения и снижение на седьмой день у крыс 2 группы (образец I, мирицетин-3-О-рамнозид – 25.3 мг/л), на 14 день у крыс 3 группы (образец II, мирицетин-3-О-рамнозид – 141.4 мг/л) амплитуд эндотелиальных ритмов кожной МГД, которые синхронизированы с периодическим релизингом NO эндотелием сосудов.
Конечно, невозможно утверждать, обусловлены ли выявленные вазотропные свойства образцов I и II конкретными метаболитами мирта, содержащимися в преобладающем количестве в их составе, или их комбинированным действием, что, на наш взгляд, представляется наиболее вероятным, тем более, что комплекс вторичных метаболитов является для растений видоспецифичным фактором. Необходимо также отметить, что выявленные вазотропные реакции под влиянием комплекса вторичных метаболитов мирта, в отличие от эффектов, описанных в литературе [22, 32 и др.], зарегистрированы у здоровых животных, имеющих стабильный гомеостаз и высокие резервные возможности микрососудистого русла, что, по-видимому, и привело к концу срока наблюдения к адаптивным реакциям, связанным с нормализацией механизмов регуляции тонуса сосудов, притока и оттока крови. При изучении вазоактивных эффектов метаболитов мирта в условиях моделирования у животных патологии результаты будут иными, а также зависеть от ее нозологических форм.
Таким образом, полученные результаты значительно расширяют представление о спектре биологической эффективности комплекса вторичных метаболитов мирта и являются основой для выявления направленности их фармацевтического действия, в том числе, в экспериментальных моделях ишемии-реперфузии и сахарного диабета, среди ведущих механизмов развития и прогрессирования сосудистых осложнений которых выделяют дисфункции сосудистого эндотелия, оксидативный стресс, нарушение коагуляционной системы, активация протеинкиназы С и другие. Эти и другие данные позволят обосновать перспективность создания и внедрения новых биологически активных препаратов на основе комплекса вторичных метаболитов мирта.
ЗАКЛЮЧЕНИЕ
- Вазотропная активность образцов I и II зависела от продолжительности их введения животным: в первые сутки наблюдения реакция микрососудов кожи крыс на их введение заключалась в уменьшении тонуса прекапилляров, вазодилатации и снижении артериального давления; после 7-кратного введения образца I и 14-кратного введения образца II развивалась противоположная реакция, характеризующаяся вазоконстрикцией микрососудов и увеличением артериального давления; при более продолжительном применении (14–21 сутки) вазоконстрикторные реакции ослабевали и значения показателей микроциркуляции и артериального давления приближались к уровню контрольных значений, т.е. к физиологической норме.
- Выраженность вазотропных эффектов образцов I и II значительно отличалась в зависимости от их состава: при однократном введении образца II крысам вазодилатация более выраженная, что сопровождается достоверными различиями между значениями показателей микроциркуляции у крыс 2 и 3 группы; вазоконстрикция наблюдалась в разные сроки эксперимента, а именно на 7 сутки после введения образца I и на 14 сутки после введения образца II; вазоконстрикция сопровождалась достоверным повышением артериального давления только при введении образца I; ослабевание вазоконстрикции и развитие адаптивных реакций у крыс 2 и 3 группы отмечено в разные сроки эксперимента, а именно на 14 и 21 сутки после введения образцов I и II соответственно.
Работа выполнялась в рамках программ исследований № АААА-А21-121011990099-6 «Физиологические механизмы биологического действия факторов разной природы и интенсивности», запланированной в ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского» и темы FNNS-2022-0006НИР «Создание сортов эфиромасличных и лекарственных растений, содержащих значимые для здоровья человека биологически активные вещества, разработка на их основе и испытание средств для улучшения качества жизни человека», запланированной в ФГБУН «Ордена Трудового Красного Знамени Никитский ботанический сад – Национальный научный центр РАН».
- Boyko N. N., Bondarev A. V., Zhilyakova E. T., Pisarev D. I., Novikov O. O., Phytodrugs, analysis of Russian Federation pharmaceutical market. Research Result, Medicine and Pharmacy, 3(4), 30 (2017). Doi:10.18413/2313-8955-2017-3-4-30-38
- Sambukova T. V., Ovchinnikov B. V., Ganapolskii V. P., Yatmanov A. N., Shabanov P. D., Prospects for phytopreparations (botanicals) use in modern pharmacology, Obzory po klinicheskoj farmakologii i lekarstvennoj terapii, 15(2), 56 (2017). Doi.org:10.17816/RCF15256-63
- Dunaevskaya E. V., Logvinenko L. A., Content of essential elements in Myrtus communis L. the main phenological phases, Agrarnyj vestnik Urala, 5(172) (2020)
- Bakova E. Yu., Plugatar Yu. V., Bakova N. N., Konovalov D. A. Mineral and amino acid composition of the leaves of Myrthus communis L., Himija rastitel’nogo syr’ja 3, 217 (2019). Doi.org/10.14258/jcprm.2019034917
- Roustaeizade Z., Akhavan Karbassi M. H., Kheirollahi K., Therapeutic Efficacy of Different Concentrations of Myrtus communis (Essential oil of common myrtle) in the Treatment of Recurrent Aphthous Stomatitis: A Randomized Controlled Clinical Trial, Jorjani Biomedicine Journal, 6(3), 63 (2018) . Doi.org/10.1007/s00784-009-0267-3.
- Bagcilar S, Gezer C., Myrtle (Myrtus communis L.) and potential health effects, Journal of Pharmaceutical Sciences, 3(3), 205(2020). Doi.org/10.14814/phy2.15770
- Gosudarstvennaja farmakopeja RF HIV izd. [Jelektronnoe izdanie].http://femb.ru/femb/pharmacopea.php
- GOST 34213-2017 Syr’e jefiromaslichnoe cvetochno-travjanistoe. Metody otbora prob, opredelenija vlagi, primesej i jefirnogo masla, 19 s. (M.: Standartinform, 2019).
- Bakova E. Yu, Bakova N. N., Pozdnyakov D. I., Konovalov D. A., Orobinskaya V. N., Antioxidant properties and toxicity of aqueous extract and common myrtle syrup, 4, 108 (2023) Doi.org/10.37493/2307-910X.2022.4.11.
- Habriev R.U. Guideline for Experimental (Preclinical) Studying of New Pharmacological Substances. (M. Medicina, 2005)
- Krupatkin A. I., Sidorov V. V. Laser Doppler flowmetry of blood microcirculation. (M. Medicina, 2005).
- Kozlov V. I., Azizov G. A., Gurova O. A., Litvin F. B. Laser Doppler flowmetry in assessing the condition and disorders of blood microcirculation (2012).
- Humeau A., Koпtka A., Abraham P., Time-frequency analysis of laser Doppler flowmetry signals recorded in response to a progressive pressure applied locally on anaesthetized healthy rats, Physics in Medicine & Biology, 49(5), 843 (2004). Doi.org/10.1088/0031-9155/49/5/014.
- Chuyan E. N., Mironyuk I. S., Ravaeva M. Yu., Grishina T. V., Cheretaev I. V., Chernobai S. E., Changes in micro- and central hemodynamic parameters in rats under the action of acetylsalicylic acid and its coordination compounds with metals. Regional blood circulation and microcirculation, 20(4), 75 (2021) Doi.org/10.24884/1682-6655-2021-20-4-75-86
- Anjos P. J., Lima A. O., Cunha P. S., De Sousa D. P., Onofre A. S., Ribeiro T. P., Medeiros I. A., Antoniolli A. R., Quintans-Júnior L. J., Santosa M. R., Cardiovascular effects induced by linalool in normotensive and hypertensive rats, Zeitschrift für Naturforschung C. 68(5-6), 181 (2013). Doi.org/10.1515/znc-2013-5-603
- Ferk F., Kundi M., Brath H., Szekeres T., Al-Serori H., Mišík M., Saiko P., Marculescu R., Wagner K. H., Knasmueller S., Gallic Acid Improves Health-Associated Biochemical Parameters and Prevents Oxidative Damage of DNA in Type 2 Diabetes Patients: Results of a Placebo-Controlled Pilot Study. Molecular nutrition, 62(4), 10 (2018). Doi.org/10.1002/mnfr.201700482.
- Maruszewska A., Tarasiuk J., Antitumour effects of selected plant polyphenols, gallic acid and ellagic acid, on sensitive and multidrug-resistant leukaemia HL60 cells, Phytother. Res., 33(4), 1208 (2019). Doi.org/10.1002/ptr.6317.
- Toyama M. H., Rogero A., de Moraes L. L. F., Fernandes G. A., da Cruz Costa C. R., Belchor M. N., De Carli A. M., de Oliveira M. A., Gallic Acid as a Non-Selective Inhibitor of α/β-Hydrolase Fold Enzymes Involved in the Inflammatory Process: The Two Sides of the Same Coin, Pharmaceutics. 14(2), 368. (2022). Doi: 10.3390/pharmaceutics14020368.
- Kahkeshani N., Farzaei F., Fotouhi M., Alavi S. S., Bahramsoltani R., Naseri R., Momtaz S., Abbasabadi Z., Rahimi R., Farzaei M. H., Bishayee A., Pharmacological effects of gallic acid in health and diseases: A mechanistic review, Iran J Basic Med Sci, 22(3), 225 (2019). Doi: 10.22038/ijbms.2019.32806.7897.
- Gao J., Hu J., Hu D., Yang X., A Role of Gallic Acid in Oxidative Damage Diseases: A Comprehensive Review, Natural Product Communications, 14(8) (2019) Doi:10.1177/1934578X19874174
- Bai J., Zhang Y., Tang C., Gallic acid: Pharmacological activities and molecular mechanisms involved in inflammation-related diseases. Biomedicine & Pharmacotherapy, 133, 110985 (2021) Doi: 10.1016/j.biopha.2020.110985.
- Bragança F. S., Garcia W. R., Rouver W. N., Silva K., Almeida S. A., Mengal V., Peluso A. A., Endlich P. V., Bissoli N. S., Erick Roberto Gonçalves Claudio, Gláucia Rodrigues de Abreu, Ellagic Acid prevents vascular dysfunction in small mesenteric arteries of ovariectomized hypertensive rats, l, 105, 108995 (2022). Doi.org/10.1016/j.jnutbio.2022.108995.
- Kurkin V. A., Kurkina A. V., Avdeeva E. V., Flavonoids as biologically active compounds of medicinal plants, 11, 1897 (2013)
- Tarahovskij Yu. S, Kim Yu. A, Abdrasilov B. S., Muzafarov E. N. Flavonoids: biochemistry, biophysics, medicine, Pushchino. Sunchrobook, 310 (2013).
- Liao H. H., Zhu J. X., Feng H., Ni J., Zhang N., Chen S., Liu H. J., Yang Z., Deng W., & Tang Q. Z., Myricetin possesses potential protective effects on diabetic cardiomyopathy through in hibiting IκBα/NFκB and enhancing Nrf2/HO- 1. Oxidative Medicine and Cellular Longevity, 83, 70593 (2017). Doi.org/10.1155/2017/8370593.
- Qiu Y., Cong N., Liang M., Wang Y., & Wang J., Systems pharmacology dissection of the protective effect of myricetin against acute ischemia/reperfusion-induced myocardial injury in isolated rat heart, Cardiovascular Toxicology, 17(3), 277 (2017). Doi.org/10.1007/s1201
- Hu T., Yuan X., Wei G., Luo H., Lee H. J., Jin W., Myricetin-induced brown adipose tissue activation prevents obesity and insulin resistance in db/db mice, European Journal of Nutrition, 57(1), 391 (2018). Doi.org/10.1007/s0039 4-017-1433-z
- Zhang N., Feng H., Liao H. H., Chen S., Yang Z., Deng W., Tang Q. Z., Myricetin attenuated LPS induced cardiac injury in vivo and in vitro, Phytotherapy Research, 32(3), 459 (2018). Doi.org/10.1002/ptr.5989.
- Akhtar S., Najafzadeh M., Isreb M. Newton L., Gopalan R. C., Anderson, D., Anticancer potential of myricetin bulk and nano forms in vitro in lymphocytes from myeloma patients, Archives of Toxicology, 95(1), 337 (2021). Doi: 10.1007/s0020 4- 020- 02938 – 5. Doi.org/10.1007/s0020
- Imran M., Saeed F., Hussain G., Imran A., Mehmood Z., Gondal T. A., El- Ghorab A., Ahmad I., Pezzani R., Arshad M. U., Bacha U., Shariarti M. A., Rauf A., Muhammad N., Shah Z. A., Zengin G., Islam S., Myricetin: A comprehensive review on its biological potentials, Food Science & Nutrition, 9(12), 1 (2021). Doi:10.1002/fsn3.2513
- Wang L., Wu H., Yang F., Dong W., The Protective Effects of Myricetin against Cardiovascular Disease, 65(6), 470 (2019). Doi.org/10.3177/jnsv.65.470
- Pereira M., Siba I. P., Chioca L. R., Correia D., Vital M. A. B. F., Pizzolatti M. G., Santos A. R. S., Andreatini R., Myricitrin, a nitric oxide and protein kinase C inhibitor, exerts antipsychotic-like effects in animal models, Progress in Neuro-Psychopharmacology & Biological Psychiatry, 35, 1636 (2011). doi:10.1016/j.pnpbp.2011.06.002
- Kizub I., Pavlova A., Soloviov A., Proteinekinase C modulates miofilaments Ca2+–sensitivity in vascular smooth: possible role in vasospasm development, The Journal of Physiology, 26(1), 70 (2005).Doi.org/10.1006/jsre
- Albert A. P., Paper A. S., Large W. A., Properties of a constitutively active Ca2+ permeable non–selectiv cation channel in rabit ear artery myocytes, The Journal of Physiology, 549, 143 (2003). Doi.org/10.1113/jphysiol.2002.038190



