THE NATURE OF CHANGES IN THE FUNCTIONAL PARAMETERS OF FAST TYPE SKELETAL MUSCLE DURING THE DEVELOPMENT OF HYPERCORTISOLISM
ХАРАКТЕР ИЗМЕНЕНИЯ ФУНКЦИОНАЛЬНЫХ ПАРАМЕТРОВ
СКЕЛЕТНОЙ МЫШЦЫ БЫСТРОГО ТИПА В ДИНАМИКЕ РАЗВИТИЯ ГИПЕРКОРТИЦИЗМА
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №2, 2024
Publication text (PDF):Download
UDK: 591.473.3: 577.175.53
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Trush V. V., Federal State Budgetary Educational Institution of Higher Education “Donetsk State University”, Donetsk, DPR, Russia
Sobolev V. V., Federal State Autonomous Educational Institution of Higher Education “Crimean Federal University named after V. I. Vernadsky», Yalta, Republic of Crimea, Russia
Popov M. N., Federal State Autonomous Educational Institution of Higher Education “Crimean Federal University named after V. I. Vernadsky», Yalta, Republic of Crimea, Russia
Bondarenko N. N. Federal State Budgetary Educational Institution of Higher Education “Donetsk State Medical University named after M. Gorky», Donetsk, DPR, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-2-196-212
PAGES:from 196 to 212
STATUS:Published
LANGUAGE:Russian
KEYWORDS: glucocorticoids, dexamethasone, skeletal muscle, steroid myopathy, rats.
ABSTRACT (ENGLISH):
The objective of the work was to study the nature of changes in electrophysiological, contractile and ergometric parameters of fast-type skeletal muscle (m. tibialis anterior) in the dynamics of the development of iatrogenic hypercortisolism, modeled by the administration of dexamethasone (DM) in a dose equivalent to a moderate therapeutic dose for humans (0.25 mg/kg, 1 time in 2 days), for 10, 30 and 60 days.
Methodology. The studies have been carried out on sexually mature young female rats of age of 4-5 months (n=40), initially divided into 2 groups: control (intact, n=10, K-group) and experimental (n=30, received dexamethasone, DM-group). Dexamethasone (DM, KRKA, Slovenia) was administered once every 2 days, intraperitoneally, at a dose of 0.25 mg/kg for 10, 30 and 60 days (10DM, 30DM and 60DM-groups). At the end of the dexamethasone administration, an acute experiment on animals under deep anesthesia (sodium thiopental, 100 mg/kg), during which electrophysiological, contractile and ergometric parameters of the tibialis anterior muscle were assessed using electrophysiological methods (stimulated electromyography and ergography). The excitation and contraction of the muscle were induced by irritation of the peroneal nerve with a superthreshold electric current.
Results. The formation of neuromuscular disorders in the dynamics of the development of dexamethasone hypercortisolism occurs in the following sequence: the earliest diagnostic sign of steroid myopathy is a decrease in the ability of the muscle to recover after fatigue, while the most typical functional signs of severe steroid myopathy are a decrease in the reliability of synaptic transmission, deterioration of M-response parameters, ergometric indicators (when muscles work under heavy loads) and muscle resistance to fatigue. After subchronic (60 days) dexamethasone administration, normalization of the contractile parameters of the muscle is noted against the background of a decrease in its mass, the number of activated motor units (MU) and the absolute force of the tetanic contraction, as well as a significant expansion of the M-wave with normalization of its amplitude, which indicates in favor of a supposed increase density of MU.
Conclusion. With subchronic glucocorticoids administration, there is no full adaptation of the neuromuscular system to them, but some normalization of the parameters of the contractile function of skeletal muscle against the background of lengthening of M-responses serves as a good prognostic sign, reflecting the process of normalization of the functional state of skeletal muscle due to a presumed increase in the density of motor units.
ВВЕДЕНИЕ
Несмотря на достаточно хорошую изученность клиники стероидной миопатии, вопросы ее патогенеза и тем более компенсации остаются открытыми. Согласно литературным данным патологические изменения в нервно-мышечном аппарате при гиперкортицизме характеризуются большой сложностью и включают не только дистрофические изменения мышечных волокон [1, 2], но и электрофизиологические нарушения собственно мышечных волокон [3], синаптического звена [4, 5] и возможно мотонейронов [6–8]. Более того, исследованиями ученых казанской научной школы [9] показано, что в основе снижения мышечной силы под влиянием глюкокортикоидов (ГК) могут лежать не только длительно развивающиеся структурные и метаболические перестройки в нервно-мышечном аппарате, но и быстро реализующиеся вследствие негеномных их эффектов изменения синаптической передачи.
Кроме того, установленная некоторыми специалистами [10, 11] динамичность процесса мышечной атрофии при развитии гиперкортицизма, обусловленная активацией разных механизмов на разных его этапах, требует оценки функциональных параметров нервно-мышечного аппарата в динамике введения ГК.
В связи с этим целью работы явилось исследование характера изменения электрофизиологических, сократительных и эргометрических параметров скелетной мышцы быстрого типа (m. tibialis anterior) в динамике развития ятрогенного гиперкортицизма, моделируемого введением дексаметазона в дозе, эквивалентной умеренной терапевтической для человека (0,25 мг/кг, 1 раз в 2-е суток), на протяжении 10, 30 и 60 дней.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводились на 40 половозрелых молодых крысах-самках 4–5-месячного возраста с исходной массой тела 195–205 г. Животные были первоначально случайным образом разделены на 2 группы: контрольную (интактная, не подвергались никаким воздействиям, n=10, К-группа) и опытную (n=30, получали дексаметазон, ДМ-группа). Дексаметазон (ДМ, KRKA, Словения) вводили 1 раз в 2-е суток, внутрибрюшинно, в дозе 0,25 мг/кг на протяжении 10, 30 и 60 дней. Соответственно в пределах ДМ-группы в последующем были выделены 3 подгруппы: 10ДМ, 30ДМ и 60ДМ, отличающиеся количеством дней введения дексаметазона. Такой подход позволил нам исследовать характер изменения электрофизиологических, сократительных и эргометрических параметров скелетной мышцы в динамике развития ятрогенного гиперкортицизма.
По окончании сроков введения дексаметазона на животных в условиях глубокого наркоза (тиопентал натрия, 100 мг/кг) проводили острый опыт, в ходе которого с помощью электрофизиологических методов (стимуляционной электромиографии и эргографии) оценивали электрофизиологические, сократительные и эргометрические параметры передней большеберцовой мышцы в условиях вызванного ее возбуждения и сокращения, которые индуцировали раздражением сверхпороговым электрическим током малоберцового нерва.
Для регистрации исследуемых показателей мышечного сокращения использовалась экспериментальная установка, состоящая из 3-х каналов: канала электростимулятора, электромиографического и эргометрического.
Канал электростимулятора представлен собственно электростимулятором, построенным на основе функционального генератора ICL8038CCDP, оптронной гальванической развязки (ГР), перестраиваемым генератором стабильного тока (ПГСТ) и биполярными игольчатыми стальными электродами с межэлектродным расстоянием 1 мм, которые подводились в области бедра под малоберцовый нерв. Данный канал служил для нанесения на нерв электрических стимулов определенной силы, частоты, длительности и продолжительности раздражения, что обеспечивалось соответствующим переключением режимов генерации и подключением дополнительных схем генерации плавно нарастающей частоты импульсов или их амплитуды.
Электромиографический канал представлен отводящими биполярными игольчатыми стальными электродами с межэлектродным расстоянием 1 мм, электромиографическим биоусилителем (на основе измерительного усилителя INA118, kусил. = 200), гиратором-режектором (ослабление помехи частотой 50 Гц) и гальванической развязкой (ГР) собственно электростимулятора от биоэлектрического сигнала. Этот канал предназначался для регистрации вызванных электрических ответов мышцы при раздражении электрическими стимулами малоберцового нерва – М-ответов.
Эргометрический канал включал датчик перемещения (потенциометрический датчик ПТП-1), включенный в измерительный мост Уинстона, и усилитель тока (kусил. = 10). Описанный канал после соответствующей процедуры калибровки служил для измерения высоты, на которую поднимается груз во время сокращения мышцы с грузом, с возможностью последующего вычисления объема внешней работы, выполненной мышцей (мДж), и других миографических параметров.
С целью детальной оценки функционального состояния нервно-мышечного аппарата крыс использовались следующие подходы:
– определение некоторых параметров М-ответа передней большеберцовой мышцы, который индуцировали путем раздражения малоберцового нерва одиночными сверхпороговыми электрическими импульсами (длительность 150 мкс, частота 0,2 имп/с и сила тока 500 мкА);
– определение степени прироста амплитуды М-ответов по мере раздражения малоберцового нерва электрическими импульсами нарастающей силы (от 0,01 до 2В), на основании чего оценивали примерное количество активируемых ДЕ мышцы (методика Galea V. [12]);
– оценка устойчивости генерации М-ответов мышцей при низкочастотной стимуляции малоберцового нерва (4 имп/с), на основании чего определяли надежность нервно-мышечной передачи (методика Гехта Б.М. [13]);
– при оптимальной частоте стимуляции малоберцового нерва (30 имп/с) оценивали степень облегчения и депрессии синаптической передачи, на основании чего судили о возможном наличии пре- и постсинаптических расстройств. При этом длительность и сила электрических импульсов были такими же, как и при оценке надежности синаптической передачи – 150 мкс и 500 мкА соответственно. На основании записи серии М-ответов мышцы определяли изменение их амплитуды относительно 1-го. При этом увеличение амплитуды М-ответов более чем на 30 % относительно амплитуды 1-го при оптимальном режиме стимуляции нервно-мышечного аппарата (30 имп/с) указывает в пользу выраженного облегчения синаптической передачи, тогда как ее уменьшение более чем на 25 % – в пользу патологически значимой ее депрессии [13, 14];
– исследовали характер изменения амплитуды М-ответов при раздражении малоберцового нерва плавно нарастающей частотой (от 0,2 до 70 имп/с, длительность импульса составляла 100 мкс, сила тока 1000 мкА), на основании чего судили о степени синаптической потенциации и лабильности синаптической передачи;
– исследовали характер изменения амплитуды М-ответов в процессе выполнения мышцей утомляющей тетанической работы, индуцированной стимуляцией нервно-мышечного аппарата с высокой частотой (70 имп/с, длительность импульсов 0,5 мс и сила тока 1000 мкА), и сопоставляли изменение амплитуды М-волны с изменением амплитуды тетанического сокращения, на основании чего оценивали утомляемость нервно-мышечного аппарата;
– на основании эргограмм одиночных сокращений мышцы с внешней нагрузкой 20 г (при частоте стимуляции нервно-мышечного аппарата 4 имп/с, длительность импульсов 150 мкс каждый и сила тока 500 мкА) оценивали амплитудные и временные параметры одиночного сокращения;
– на основании эргограмм 6-секундных тетанических сокращений мышцы (длительность импульса 100 мкс, сила тока 1000 мкА) с внешними нагрузками 20 г (малая) и 70 г (большая) определяли амплитуду и скорость развития тетануса, а по соотношению амплитуды одиночных М-ответов и сокращений мышцы до и после
6-секундного тетануса оценивали соответственно степень посттетанического облегчения и посттетанической потенциации в мышце;
– на основании эргограмм высокочастотного тетанического сокращения мышцы (70 имп/с, длительность импульсов 0,5 мс и сила тока 1000 мкА) в процессе выполнения утомляющей работы (УР) с внешней нагрузкой 70 г определяли величину внешней работы мышцы, силу тетанического сокращения и продолжительность периодов максимальной и субмаксимальной работоспособности;
– оценивали характер изменения параметров М-ответов и одиночных сокращений мышцы после выполнения утомляющей работы относительно соответствующих исходных значений, на основании чего оценивали степень утомляемости и скорость восстановления после утомления нервно-мышечного аппарата.
Полученные экспериментальные данные обрабатывали с помощью стандартных методов вариационной статистики, представленных в пакетах анализа Excel-2010 и SPSS Statistics 7.0 и 17.0. Численное значение исследуемых параметров выражали в виде «среднее ± стандартная ошибка». Статистическую значимость различий между двумя средними арифметическими величинами определяли с помощью двухвыборочного t-теста Стьюдента для выборок с различными дисперсиями при заданном уровне значимости p<0,05, предварительно убедившись в том, что распределение значений в исследуемых вариационных рядах близко к нормальному (W-тест Шапиро-Уилка, Statistica 7.0).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изменение электрофизиологических, сократительных и эргометрических параметров m. tibialis anterior в процессе развития гиперкортицизма носило фазный характер: наиболее выраженное их ухудшение отмечалось спустя 30 дней введения дексаметазона с последующей тенденцией к нормализации по окончанию
2-месячного периода его применения.
Так, уже спустя первые 10 дней введения дексаметазона наблюдалось уменьшение (p<0,05 относительно контроля) массы мышцы (на 9 %), а после 30 дней применения – и количества активируемых ДЕ (на 43 %), которые сохранялись вплоть до окончания
2-месячного периода введения синтетического ГК (табл. 1).
Таблица 1.
Средние значения () массы мышцы и количества активируемых ДЕ животных контрольной и ДМ-групп
| Группа животных | Масса мышцы, мг | Количество активируемых двигательных единиц | |
| исходное (до УР) | после УР | ||
| К | 399,8±6,81 | 14,1±1,21 | 10,4±0,91, (-26•) |
| 10ДМ | 365,5±8,77, [-9*] | 13,5±1,07 | 9,8±0,87, (-28•) |
| 30ДМ | 363,9±8,50, [-9*] | 8,1±0,95, [-43*] | 5,3±0,61, [-49*], (-34•) |
| 60ДМ | 366,3±10,54, [-8*] | 8,4±0,88, [-40*] | 5,4±0,62, [-48*], (-36•) |
Примечание: * – в квадратных скобках указана статистически значимая разница показателя относительно контрольной группы (в %, р<0,05); • – в круглых скобках указана статистически значимая разница показателя после выполнения утомляющей работы (УР) относительно исходного значения соответствующей группы (в %, р<0,05).
Характер изменения параметров М-ответа в динамике 2-месячного периода введения дексаметазона. Дексаметазоновый гиперкортицизм обусловливал определенные изменения параметров М-ответа мышцы, характер которых зависел от длительности введения препарата. Так, спустя первые 10 дней введения дексаметазона наблюдалось некоторое укорочение латентного периода
М-ответа (на 12 %, р<0,05 относительно контроля) на фоне нормальных его амплитуды и длительности (табл. 2), что, по всей видимости, было связано с первоначальным облегчающим эффектом дексаметазона на синаптическую передачу. Спустя 30 дней введения дексаметазона наблюдалось ухудшение параметров М-ответа (р<0,05 относительно контроля): удлинение латентного его периода (на 19 %) и уменьшение амплитуды (на 37 %) на фоне неизменной длительности, у 40 % особей регистрировались полифазные потенциалы сниженной амплитуды (табл. 2). Электрофизиологические проявления стероидной миопатии в виде увеличения частоты полифазных потенциалов, уменьшения амплитуды и длительности потенциалов действия ДЕ мышц наблюдали и другие исследователи [13, 15], рассматривающие их как проявление первичного поражения мышечной ткани, а именно, дистрофических изменений мышечных волокон.
По окончании 2-месячного периода введения дексаметазона латентный период и амплитуда М-ответов нормализовывались, тогда как их длительность существенно увеличивалась (на 52 %, p<0,05 относительно контроля), и у 40 % особей регистрировались полифазные М-ответы нормальной или уменьшенной амплитуды (табл. 2). Данные факты на фоне уменьшенных относительно контроля (p<0,05) массы мышцы (на 8 %) и количества активируемых ДЕ (на 40 %) у животных 60ДМ-группы (табл. 1) свидетельствуют в пользу возможного увеличения площади ДЕ мышцы, в том числе вследствие расщепления мышечных волокон и компенсаторной иннервации разных участков одного и того же мышечного волокна, разделенного некротическим очагом [13]. В то же время, отсутствие увеличения амплитуды
М-ответов на фоне их удлинения свидетельствует в пользу низкой амплитуды потенциалов действия дегенеративно измененных мышечных волокон [14].
Таблица 2.
Средние значения () параметров М-ответа мышцы крыс контрольной и ДМ-групп
| Группа живот-ных | Параметры М-ответа | |||||||
| Латентный период, мс | Амплитуда, мВ | Длительность, мс | % полифазных потенциалов | |||||
| исход-ный | после УР | исход-ная | после УР | исход-ная | после УР | исхо-дный | после УР | |
| К | 1,2±0,05 | 1,3±0,06 | 2,9±0,33 | 1,7±0,25, (-36•) | 5,9±0,41 | 7,6±0,62, (+38•) | 0 | 0 |
| 10ДМ | 1,1±0,01[-12*] | 1,4±0,07(+34•) | 2,5±0,37 | 1,5±0,17(-39•) | 6,9±0,98 | 14,8±1,86(+113•), [+94*] | 20 | 20 |
| 30ДМ | 1,5±0,06[+19*] | 1,9±0,12(+34•), [+45*] | 1,8±0,20[-31*] | 1,0±0,18(-47•) [-43*] | 5,7±0,65 | 11,0±0,12(+93•), [+45*] | 40 | 20 |
| 60ДМ | 1,4±0,11 | 2,0±0,16(+38•), [+42*] | 3,9±0,70 | 1,6±0,39(-58•) | 9,0±1,02[+52*] | 12,6±1,02(+39•), [+60*] | 40 | 20 |
Примечания: • – в круглых скобках указана статистически значимая разница показателя после выполнения утомляющей работы относительно исходного значения соответствующей группы
(в %, р<0,05); * – в квадратных скобках указана статистически значимая разница показателя относительно соответствующего значения контрольной группы (в %, р<0,05).
Состояние синаптической передачи в динамике дексаметазонового гиперкортицизма. Для животных ДМ-групп были характерны определенные синаптические расстройства, проявляющиеся в снижении надежности синаптической передачи и повышенной утомляемости синапсов, исходной их заблокированности и сниженной лабильности (образцы записей серии М-ответов мышцы животных ДМ-группы при разных режимах стимуляции нервно-мышечного аппарата приведены на рис. 1).
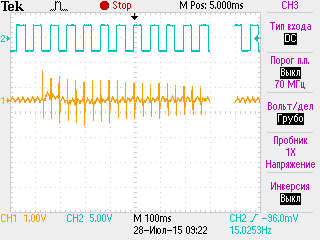
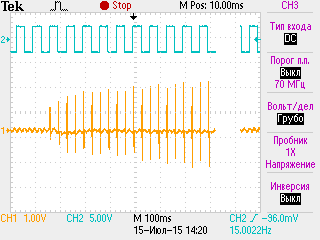
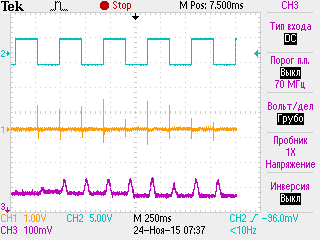
А Б В
Рис. 1. Образцы записей серии М-ответов m. tibialis anterior животных 30ДМ-группы при разных режимах стимуляции нервно-мышечного аппарата.
Примечания: на А представлена запись М-ответов и одиночных сокращений мышцы при частоте стимуляции малоберцового нерва 4 имп/с (прослеживается выраженный декремент амплитуды 5-го М-ответа относительно 1-го), на Б и В представлены записи серии
М-ответов мышцы при частоте стимуляции малоберцового нерва 30 имп/с, отражающие выраженное облегчение (Б) и депрессию (В) синаптической передачи. По каналу 1 (СН1) показана серия М-ответов мышцы, а по каналу 2 (СН2) – момент прохождения импульсов раздражающего тока, по каналу 3 (СН3) на рис. А – одиночные сокращения мышцы
Так, у части животных ДМ-групп наблюдался патологически значимый декремент амплитуды М-ответов при низкочастотной стимуляции малоберцового нерва
(4 имп/с), свидетельствующий в пользу снижения надежности синаптической передачи (рис. 2А). Наиболее высокая частота регистрации этого декремента была характерна для животных 30ДМ-группы (70 %), тогда как к окончанию 2-месячного периода введения дексаметазона она снижалась (до 40 %). Кроме того, у всех
ДМ-групп отмечалось не типичное для контроля удлинение латентного периода
М-ответа мышцы после выполнения утомляющей работы (на 33–38 % относительно исходного значения, р<0,05, табл. 2), свидетельствующее в пользу большей утомляемости синапсов и, возможно, сниженной надежности синаптической передачи, признаки которых наблюдались и в более ранних наших исследованиях [16].
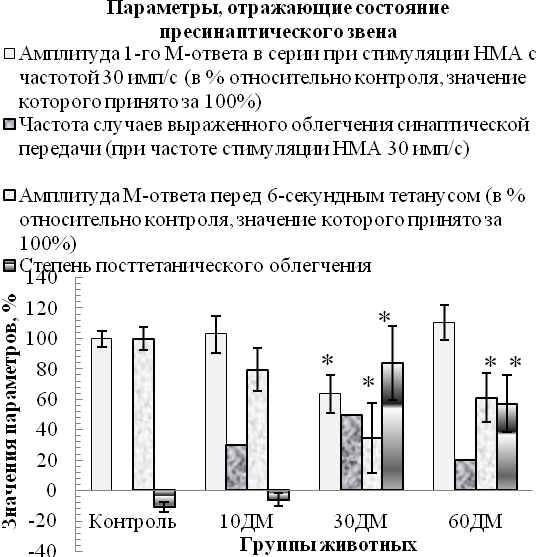
У части животных ДМ-групп наблюдалось патологически значимое облегчение синаптической передачи при оптимальном режиме стимуляции нервно-мышечного аппарата (30 имп/с), наибольшая частота которого (регистрировалось у 50 % особей до и 70 % особей после утомляющей работы) на фоне сниженной амплитуды 1-го М-ответа в серии (на 36 %, р<0,05 относительно контроля) была характерна для 30ДМ-группы (рис. 2Б). Кроме того, для 30ДМ- и 60ДМ-групп было типично увеличение степени посттетанического облегчения мышцы (в 7,7–5,3 раза, р<0,05 относительно контроля) на фоне сниженной относительно контроля (на 39–65 %, р<0,05) амплитуды исходного М-ответа (до тетануса, рис. 2Б). Данный факт вместе с патологически значимым облегчением синаптической передачи при оптимальной частоте стимуляции нервно-мышечного аппарата (30 имп/с), типичным для части животных 30ДМ- и 60ДМ-групп, свидетельствует в пользу частичной исходной заблокированности синапсов, отражающей наличие пресинаптических расстройств [14].
Вместе с тем, спустя первые 10 дней введения дексаметазона выраженное облегчение синаптической передачи при оптимальной частоте стимуляции нервно-мышечного аппарата (встречалось у 30 % особей) имело место на фоне нормальных амплитуды 1-го М-ответа в серии и степени посттетанического облегчения (рис. 2Б), а также значимого относительно контроля (р<0,05) укорочения латентного периода М-ответов (на 12 %, табл. 2). Данные факты указывают в пользу того, что возможной причиной такого облегчения могло служить первоначальное облегчающее действие дексаметазона на экзоцитоз медиатора. Признаки облегчения синаптической передачи на начальных этапах развития гиперкортицизма или под влиянием сравнительно невысоких доз ГК (5–10 мг/кг гидрокортизона) в исследованиях in vivo и in vitro наблюдали и другие специалисты [17–19].
Длительное введение дексаметазона обусловливало развитие постсинаптических расстройств в нервно-мышечном аппарате. Так, у части особей ДМ-групп отмечалась патологически значимая депрессия синаптической передачи при оптимальной частоте стимуляции малоберцового нерва (30 имп/с), которая встречалась в целом реже патологически значимого облегчения и с одинаковой частотой спустя 30 и 60 дней введения ГК (у 30 % особей, рис. 2В). Кроме того, для животных 30ДМ- и 60ДМ-групп было характерно гораздо более существенное, чем у контроля (р<0,05), уменьшение амплитуды М-ответов относительно 1-го в серии при высокой частоте стимуляции нерва (70 имп/с, рис. 2В), что указывает в пользу сниженной лабильности синапсов. Наблюдаемые нами признаки постсинаптических нарушений при длительном введении ГК согласуются с результатами исследований других специалистов [20, 21].
А Б
В
Рис. 2. Значения некоторых параметров, отражающих состояние синаптического аппарата в m. tibialis anterior в динамике развития дексаметазонового гиперкортицизма (на А приведены значения параметров, отражающих надежность синаптической передачи, на Б – значения параметров, отражающих состояние пресинаптического аппарата, на В – значения параметров, отражающих состояние постсинаптического аппарата)
Примечания: * – различия статистически значимы (р<0,05) относительно значений соответствующих параметров контрольной группы; • – изменение значения параметра после утомляющей работы статистически значимо (р<0,05) относительно соответствующего исходного значения
Характер изменения сократительных и эргометрических параметров скелетной мышцы в динамике дексаметазонового гиперкортицизма. Гиперкортицизм сопровождался расстройствами сократительной функции мышцы, особенно выраженными спустя 30 дней применения дексаметазона (рис. 3). Так, уже спустя первые 10 дней введения дексаметазона наблюдалось ухудшение параметров одиночного сокращения мышцы (p<0,05 относительно контроля): уменьшение амплитуды (на 24 %), скорости укорочения (на 49 %) и расслабления (на 33 %). Эти изменения были типичны и для 30ДМ-группы, а спустя 2-месячный период введения дексаметазона, несмотря на то, что амплитуда одиночных сокращений нормализовалась, скорость укорочения и расслабления оставались сниженными (на 30 % и 29 %, p<0,05 относительно контроля). Ухудшение параметров тетанического сокращения мышцы было отмечено только спустя 30 дней введения дексаметазона и только при работе мышцы с большой нагрузкой (70 г). У животных 30ДМ-группы отмечалось уменьшение (p<0,05 относительно контроля) амплитуды (на 32 %) и скорости развития (на 39 %) тетануса, внешней работы мышцы (на 34 %) и абсолютной силы тетанического ее сокращения (на 64 %). По окончании
2-месячного периода применения дексаметазона амплитуда и скорость тетанического сокращения нормализовывались, тогда как абсолютная сила тетанического сокращения оставалась сниженной (на 32 %, p<0,05 относительно контроля).
Таким образом, несмотря на нормализацию спустя 60 дней введения дексаметазона параметров М-ответа, амплитуды одиночного и амплитуды и скорости тетанического сокращений мышцы, скорость укорочения и расслабления при одиночном сокращении, а также абсолютная сила тетанического сокращения при работе мышцы с большой внешней нагрузкой (70 г) оставались сниженными.
Влияние дексаметазонового гиперкортицизма на функциональные параметры, характеризующие профиль скелетной мышцы. Для мышцы животных всех ДМ-групп были характерны функциональные признаки сдвига ее профиля в окислительную сторону: уменьшение (p<0,05 в сравнении с контролем) скорости расслабления при одиночном сокращении (на 29–56 %), удлинение периода полурасслабления после тетануса (на 40–67 %), уменьшение степени посттетанического потенцирования (на 38–55 %) на фоне увеличения соотношения между амплитудой тетануса и одиночного сокращения (до соотношения 4,8:1 против 3,6:1 у контроля, рис. 4). В связи с тем, что признаки сдвига профиля мышцы в окислительную сторону у животных ДМ-групп сочетались с уменьшением (p<0,05 относительно контроля) ее массы (у крыс всех ДМ-групп), количества активируемых ДЕ (у животных 30ДМ- и 60ДМ-групп), ухудшением параметров М-ответа, одиночного и тетанического сокращений, особенно выраженных в 30ДМ-группе, наиболее вероятной их причиной служили дистрофические изменения быстрых гликолитических мышечных волокон под действием синтетического ГК.
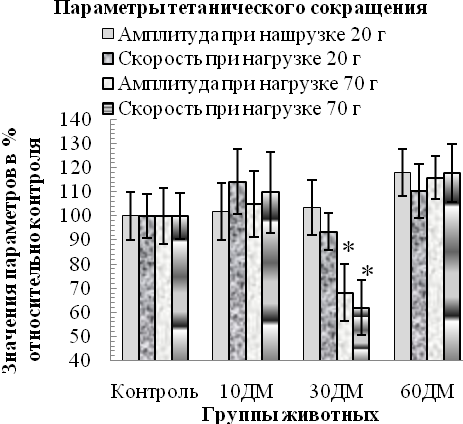
Рис. 3. Характер изменения сократительных и эргометрических параметров m. tibialis anterior в динамике развития дексаметазонового гиперкортицизма (значения параметров мышцы животных опытных групп приведены в % относительно соответствующих контроля, принятых за 100 %)
Примечания: * – различия статистически значимы (р<0,05) относительно значений соответствующих параметров контрольной группы
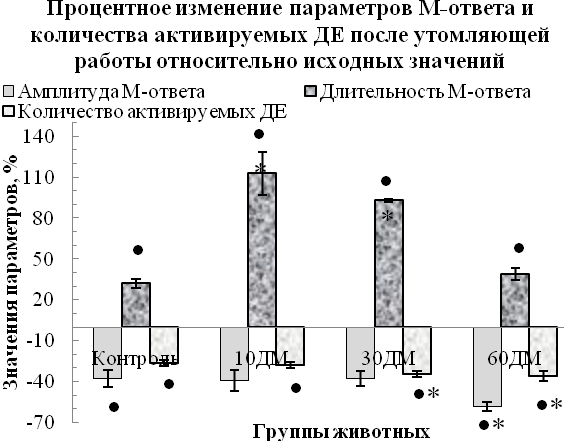
Влияние дексаметазонового гиперкортицизма на утомляемость мышцы и скорость ее восстановления после утомления. Длительное применение дексаметазона обусловливало большую утомляемость и меньшую, в сравнении с контролем, способность мышцы к восстановлению после утомляющей работы. В пользу этого свидетельствуют следующие факты. Во-первых, укорочение (р<0,05 относительно контроля) периода максимальной работоспособности мышцы
(на 29–31 %) при выполнении ею утомляющей работы, типичное для 30ДМ- и 60ДМ-групп (рис. 5А). Во-вторых, отмеченные во всех ДМ-группах более выраженные, в сравнении с контролем (р<0,05), ухудшение параметров М-ответов и одиночных сокращений и уменьшение количества активируемых ДЕ мышцы после выполнения утомляющей работы (рис. 5Б, 5В, табл. 2).
Рис. 4. Характер изменения функциональных параметров, отражающих профиль m. tibialis anterior в динамике развития дексаметазонового гиперкортицизма (значения параметров мышцы животных опытных групп приведены в % относительно соответствующих контроля, принятых за 100 %)
Примечания: * – различия статистически значимы (р<0,05) относительно значений соответствующих параметров контрольной группы
Степень адаптации периферического звена нервно-мышечного аппарата к длительному введению дексаметазона. По окончании 2-месячного периода введения дексаметазона наблюдалась нормализация ряда электрофизиологических, сократительных и эргометрических параметров мышцы: амплитуды М-ответа, одиночного и тетанического сокращений, внешней работы мышцы при тетаническом сокращении и его скорости. Такая нормализация отчасти может быть связана с адаптацией организма в целом и нервно-мышечного аппарата в частности к длительному введению ГК в постоянной дозе, но она не была обусловлена нормализацией состояния гликолитических мышечных волокон, в пользу чего указывают следующие факты. Во-первых, в 60ДМ-группе сохранялись уменьшенными (р<0,05 относительно контроля) масса мышцы (на 9 %) и количество активируемых ДЕ (на 43 %), а также отмечались функциональные признаки сдвига профиля мышцы в окислительную сторону – уменьшение скорости укорочения (на 30 %) и расслабления (на 29 %) при одиночном сокращении, удлинение времени полурасслабления после тетануса (на 43 %), уменьшение степени посттетанического потенцирования на фоне увеличения соотношения между амплитудой тетануса и одиночного сокращения (до соотношения 4,8:1 против 3,6:1 у контроля).
А Б
В
Рис. 5. Характер изменения параметров, отражающих работоспособность и устойчивость к утомлению m. tibialis anterior в динамике развития дексаметазонового гиперкортицизма. На А представлены значения параметров работоспособности мышцы животных опытных групп (в % относительно соответствующих контроля, принятых за 100 %). На Б и В приведена степень процентного изменения параметров М-ответа и одиночного сокращения мышцы после выполнения утомляющей работы относительно исходных значений
Примечание: • – степень изменения показателя после утомляющей работы относительно исходного значения соответствующей группы (р<0,05) статистически значима; * – различия статистически значимы (р<0,05) относительно значений соответствующих параметров контрольной группы
Во-вторых, у животных 60ДМ-группы сохранялось снижение абсолютной силы тетанического сокращения (на 32 %, р<0,05 относительно контроля), отмечались признаки сниженной лабильности синапсов, повышенной утомляемости мышцы, а у части животных наблюдались сниженная надежность синаптической передачи (у 40 % особей), патологически значимое ее облегчение (у 20 % особей) и депрессия (у 30 % особей) при оптимальном режиме стимуляции малоберцового нерва (30 имп/с).
Все эти патологические проявления свидетельствуют в пользу того, что нормализация сократительных параметров мышцы у животных 60ДМ-группы была обусловлена не нормализацией функционального состояния гликолитических мышечных волокон, а расширением ДЕ, в пользу которого указывает удлинение
М-ответов мышцы (на 52 %, р<0,05 относительно контроля) на фоне сниженных (р<0,05 относительно контроля) ее массы (на 9 %) и количества активируемых ДЕ (на 43 %). В связи с тем, что такое удлинение М-ответов не сопровождалось увеличением их амплитуды, можно заключить, что амплитуда потенциалов действия, генерируемых отдельными мышечными волокнами, была снижена [14], что еще раз доказывает сохранность дистрофических их изменений.
ЗАКЛЮЧЕНИЕ
- Формирование нервно-мышечных нарушений в динамике развития дексаметазонового гиперкортицизма происходит в следующей последовательности: наиболее ранним диагностическим признаком стероидной миопатии служит снижение способности мышцы к восстановлению после утомления, тогда как наиболее типичными функциональными признаками выраженной стероидной миопатии являются снижение надежности синаптической передачи, ухудшение параметров М-ответа, эргометрических показателей (при работе мышцы с большими нагрузками) и устойчивости мышцы к утомлению.
- После субхронического (60 дней) введения дексаметазона отмечается нормализация сократительных параметров мышцы на фоне уменьшенных ее массы, количества активируемых ДЕ и абсолютной силы тетанического сокращения, а также существенного расширения М-волны при нормализации ее амплитуды, что указывает в пользу предположительного увеличения плотности ДЕ.
- При субхроническом введении ГК отсутствует полноценная адаптация нервно-мышечного аппарата к ним, но некоторая нормализация параметров сократительной функции скелетной мышцы на фоне удлинения М-ответов служит хорошим прогностическим признаком, отражающим процесс нормализации функционального состояния скелетной мышцы за счет предположительного увеличения плотности ДЕ.
- Sakai H., Kimura M., Tsukimura Y., Yabe S., Isa Y., Kai Yu., Sato F., Kon R., Ikarashi N., Narita M., Chiba Y., Kamei J., Dexamethasone exacerbates cisplatin-induced muscle atrophy, Clin. Exp. Pharmacol. Physiol., 46, 19 (2019). DOI: https://doi.org/10.1111/1440-1681.13024
- Shin K., Ko Y. G., Jeong J., Kwon H., Fbxw7β is an inducing mediator of dexamethasone-induced skeletal muscle atrophy in vivo with the axis of Fbxw7β-myogenin-atrogenes, Mol. Biol. Rep., 45, 625 (2018). DOI: https://doi.org/10.1007/s11033-018-4185-9
- Minetto M. A., Botter A., Lanfranco F., Baldi M., Ghigo E., Arvat E., Muscle fiber conduction slowing and decreased levels of circulating muscle proteins after short-term dexamethasone administration in healthy subjects, Journal of Clinical Endocrinology and Metabolism, 95, 1663 (2010). DOI: https://doi.org/10.1210/jc.2009-2161
- Bu J., Zu H., Effects of pregnenolone intervention on the cholinergic system and synaptic protein 1 in aged rats, Int. J. Neurosci., 124, 117 (2014). DOI: https://doi.org/10.3109/00207454.2013.824437
- Yamate S., Nishigori H., Kishimoto S., Tezuka Y., Fukushima A., Sugiyama T., Nishigori H., Effects of glucocorticoid on brain acetylcholinesterase of developing chick embryos, J. Obstet. Gynaecol. Res., 36, 11 (2010). DOI: https://doi.org/10.1111/j.1447-0756.2009.01091.x
- Braun S., Askanas V., Engel W. K., Ibrahim E. N., Long-term treatment with glucocorticoids increases synthesis and stability of junctional acetylcholine receptors on innervated cultured human muscle, J. Neurochem., 60, 1929 (1993). DOI: https://doi.org/10.1111/j.1471-4159.1993.tb13422.x
- Agafonov B. V., Lagutina T. S., Deyanova A. F., On the mechanism of development of neuromuscular disorders in Itsenko-Cushing’s disease, Problemy endokrinologii (Problems of endocrinology), 6, 22 (1982). (In Russian)
- Neretin V. Ya., Kotov S. V., Sapfirova V. A., On the genesis of neurological changes in Itsenko-Cushing’s disease and Cushing’s syndrome. In: Voprosy endokrinologii: Respublikanskij sbornik nauchnyh rabot (Endocrinology issues: Republican digest of treatises) (Moscow, 1983), р. 35. (In Russian)
- Kamaliev R. R., Grishin S. N., Falou Zh. Yu., Ziganshin A. U., The effect of hydrocortisone, ATP and adenosine on rat skeletal muscle contraction, Kazanskiy meditsinskiy zhurnal (Kazan Medical Journal), 90, 556 (2009). (In Russian)
- Langendorf E. K., Rommens P. M., Drees P., Mattyasovszky S. G., Ritz U., Detecting the Effects of the Glucocorticoid Dexamethasone on Primary Human Skeletal Muscle Cells-Differences to the Murine Cell Line, Int. J. Mol. Sci., 21, 2497 (2020). DOI: https://doi.org/10.3390/ijms21072497
- Macedo A. G., Krug A. L., Souza L. M., Martuscelli A. M., Constantino P. B., Zago A. S., Rush J. W. E., Santos C. F., Amaral S. L., Time-course changes of catabolic proteins following muscle atrophy induced by dexamethasone, Steroids, 107, 30 (2016). DOI: https://doi.org/10.1016/j.steroids.2015.12.016
- Galea V., De Bruin H., Cavasin R., McComas A. J., The number and relative size of motor unites estimated by computer, Muscle and Nerve, 14, 1123 (1991). DOI: https://doi.org/10.1002/mus.880141114
- Geht B. M., Teoreticheskaya i klinicheskaya elektromiografiya (Theoretical and clinical electromyography) (Leningrad: Nauka, 1990). (In Russian)
- MacIntosh B. R., Gardiner Ph. F., McComas A. J., Skeletal muscle. Form and function. 2th ed. (Champaign: Human Kinetics, 2006)
- Agafonov B. V., Lagutina T. S., Deyanova A. F., On the electrophysiological characteristics of myopathy in Itsenko-Cushing’s disease, In the book. Voprosy endokrinologii: Trudy MONIKI im. M.F. Vladimirskogo (Issues of endocrinology: Proceedings of MONIKI im. M.F. Vladimirsky). (Moscow, 1980), 27, р. 47. (In Russian)
- Trush V. V., Sobolev V. I., Influence of long dexamethasone administration on electrophysiological parameters of the rat skeletal muscle at rest and exhaustion development, Eksperimental’naya i klinicheskaya farmakologiya (Experimental and clinical pharmacology), 81, 21 (2018). DOI: https://doi.org/10.30906/0869-2092-2018-81-5-21-26. (In Russian)
- Ziganshin A. U., Kamaliev R. R., Grishin S. N., Ziganshin B. A., Burnstock G., Interaction of hydrocortisone with ATP and adenosine on nervemediated contractions of frog skeletal muscle, Eur. J. Pharmacol., 607, 54 (2009). DOI: https://doi.org/0.1016/j.ejphar.2009.02.028
- Giniatullin A. R., Grishin S. N., Giniatullin R. A., Effect of hydrocortisone on atp receptors in the neuromuscular junction of the frog, Neurophysiology, 32, 217 (2000). DOI: https://doi.org/10.1007/bf02506583
- Bouzat C., Barrantes F. J., Assigning function to residues in the acetylcholine receptor channel region, Molecular Membrane Biology, 14, 167 (1997). DOI: https://doi.org/10.3109/09687689709048179
- Giniyatullin A. R., Grishin S. N., Giniyatullin R. A., The influence of glucocorticoid hormones, hydrocortisone and dexamethasone, on the modulating effects of purines in the neuromuscular junction of the frog, In the book: Dvigatel’naya aktivnost’: neyrofiziologicheskiye issledovaniya (Motor activity: neurophysiological research) (Kazan: Tan-Zarya, 2001), р. 163. (In Russian)
- Dodt C., Keyser B., Molle M., Acute suppression of muscle sympathetic nerve activity by hydrocortisone in humans, Hypertension, 3, 758 (2000). DOI: https://doi.org/10.1161/01.hyp.35.3.758
