THE CORRECTION BY ARGININE, MODERATE PHYSICAL ACTIVITY AND THEIR COMBINATION OF SKELETAL MUSCLE CONTRACTIVE FUNCTION DISTURBANCES` FOR STEROID MYOPATHY IN EXPERIMENTS ON RATS
КОРРЕКЦИЯ АРГИНИНОМ, УМЕРЕННОЙ ФИЗИЧЕСКОЙ НАГРУЗКОЙ И ИХ КОМБИНАЦИЕЙ НАРУШЕНИЙ СОКРАТИТЕЛЬНОЙ ФУНКЦИИ СКЕЛЕТНОЙ МЫШЦЫ ПРИ СТЕРОИДНОЙ МИОПАТИИ В ЭКСПЕРИМЕНТАХ НА КРЫСАХ
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №3, 2024
Publication text (PDF): Download
UDK: 577.112.385: 591.473.3: 615.357: 577.175.53: 612.532
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Trush V. V., Federal State Budgetary Educational Institution of Higher Education “Donetsk State University”, Donetsk, DPR, Russia
Sobolev V. V., Federal State Autonomous Educational Institution of Higher Education “Crimean Federal University named after V. I. Vernadsky», Yalta, Republic of Crimea, Russia
Popov M. N., Federal State Autonomous Educational Institution of Higher Education “Crimean Federal University named after V. I. Vernadsky», Yalta, Republic of Crimea, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-3-239-257
PAGES:from 239 to 257
STATUS:Published
LANGUAGE:Russian
KEYWORDS: skeletal muscle, dexamethasone, steroid myopathy, arginine, physical activity, rats.
ABSTRACT (ENGLISH):
The aim of the research was to study the effectiveness of the arginine (ARG, 100 mg/kg/day), moderate dynamic physical activity (FA) and their combination in compensating of impaired contractile function of m. tibialis anterior, caused by the administration of dexamethasone (DM, 0,25 mg / kg / 2 days, for 10 to 60 days), were studied in experiments on rats.
Methods. The experiments were held on young female rats (195–205 g), divided into 5 groups: control (n=10, C-group), the I-st experienced (n=30, received dexamethasone, DM-group), the II-nd experienced (n=30, received DM and daily swimming, DM+FA-group), III-rd experienced (n=30, received DM in combination with ARG, DM+ARG-group) and IV-th experienced (n=30, received DM in combination with ARG and daily swimming, DM+ARG+FA-group). Each experimental group was divided into 3 groups (n=10 in each) depending on the duration of the experimental exposure (10, 30 and 60 days).
Dexamethasone (KRKA, Slovenia) was administered at a dose of 0,25 mg/kg, once in 2 days, intraperitoneally, arginine («Cardioarginine», «Zdorovye», Ukraine) – daily, subcutaneously, at a dose of 100 mg/kg. Animals of DM+FA- and DM+ARG+FA-groups began to be subjected to physical activity from the 1-st day of medications administration, daily until the end of their administration periods. FA was modeled by swimming at a comfortable temperature (37 ± 1°C) at an arbitrary speed without additional weights, gradually increasing its duration from 5 to 60 minutes per day.
On anesthetized animals (sodium thiopental, 100 mg/kg), the parameters of the functional state of m. tibialis anterior under different modes of its contractions, using myography and ergography were studied during stimulation of the peroneal nerve with superthreshold electric current.
Results. ARG, FA and their combination, used with DM, prevented the deterioration of skeletal muscle (SM) resistance to fatigue, which is characteristic for DM-groups, and even led to an elongation (p<0.05 relative to control) of maximum (all these factors) and submaximal (arginine or its combination with swimming) periods of SM performance at certain stages of experimental exposure.
The use of the arginine, moderate FA and their combination, used with DM, had an ambiguous effect on the contractile parameters of the SM. ARG completely compensated the deterioration of the parameters of single and tetanic SM contractions caused by DM. In case of DM`s use in combination with FA, the change in the contractile parameters of the SM in the dynamics of the 2-month period of experimental exposure was of a phase nature: at the initial stages (10 days after) they worsened, while at the end of the 2-month period, they were normalized and the absolute force of tetanic contraction was even increased (p<0,05 relative to control). ARG, used in combination with FA and DM, prevented the deterioration in muscle contractile parameters typical for DM+FA-groups after the first 10–30 days of exposure, and at the end of the 60-day period of exposure, it led to an improvement of its ergometric parameters (p<0,05 relative to control).
Use in combination with DM the arginine, moderate FA and their combination, used with DM, had an ambiguous effect on the speed parameters of the SM`s contraction: ARG prevented the deterioration of the contraction`s speed parameters, while in case of DM`s use with FA or the combination «FA+ARG», their deterioration was noted.
Conclusion. ARG ensured full compensation of disorders of the SM`s contractile function caused by the DM`s administration. Moderate FA and its combination with ARG caused a deterioration of the SM contraction`s speed parameters on the background of an initial deterioration of its single and tetanic contractions` parameters among animals of the DM+FA-group. The results obtained cast doubt on the effectiveness of moderate aerobic physical activity to maintain fast muscles` normal functional parameters during glucocorticoid therapy. At the same time, in case of FA`s use in combination with glucocorticoid therapy, it is advisable to additionally administrate moderate pharmacological doses of the ariginine for better tolerability of skeletal muscles to FA.
ВВЕДЕНИЕ
Многие аспекты патогенеза стероидной миопатии остаются до конца не раскрытыми, что отчасти обусловлено разнообразием внутриклеточных сигнальных путей глюкокортикостероидов (ГКС) и зависимостью реализации определенных из них от типа клетки-мишени, а также от дозы и типа ГКС. В связи со сложностью генеза ГКС-индуцированных мышечных нарушений, пути их коррекции требуют дальнейших исследований. При этом большинство из предполагаемых способов компенсации мышечных расстройств при гиперкортицизме были опробованы in vitro на мышечных трубках С2С12 или миобластах и проявили эффективность в плане предотвращения их дистрофии [1–4]. Вместе с тем, данные, полученные на миотрубках in vitro, могут существенно отличаться от результатов in vivo, даже на животных моделях [5]. Кроме того, учеными казанской научной школы [6, 7] выявлено, что снижение мышечной силы при гиперкортицизме может быть обусловлено негеномными эффектами ГКС, вызывающими нарушение синаптической передачи, в связи с чем предотвращение мышечной атрофии может не обеспечить полной компенсации стероидной миопатии.
Наконец, установленная некоторыми специалистами [8, 9] динамичность процесса мышечной атрофии при развитии гиперкортицизма, обусловленная активацией разных механизмов на разных его этапах, требует оценки эффективности корректирующих средств в динамике введения ГКС.
В качестве рабочей гипотезы в настоящей работе было высказано предположение относительно возможной эффективности аргинина (АРГ) и умеренных физических нагрузок (ФН) динамического характера, применяемых по отдельности и в комплексе, в компенсации нарушений сократительной функции скелетной мышцы (СМ), вызванных терапевтическими дозами ГКС.
Выбор именно этих факторов для компенсации негативных эффектов ГКС на нервно-мышечный аппарат был обусловлен, прежде всего, их способностью через активацию различных сигнальных путей тормозить протеолиз и усиливать синтез белков в СМ [10–12], стимулировать митохондриальный биогенез в мышечных волокнах (МВ) и таким образом улучшать аэробное дыхание [13, 14]. Кроме того, выявлено антиоксидантное действие системы «аргинин – оксид азота» при определенной степени ее активности [15], а также усиление антиоксидантной защиты в СМ по мере их адаптации к умеренным ФН [16]. Вместе с тем, на начальных этапах ФН, напротив, оказывают прооксидантное действие [17], вызывая повышение концентрации активных форм кислорода (АФК) в МВ. В то же время умеренные концентрации АФК через активацию митогенно активных протеинкиназ обусловливают увеличение экспрессии PGC-1α в МВ [12], усиливающего митохондриальный биогенез и активирующего путь PGC-1α – ИФР-I – Akt – mTOR, ослабленные при гиперкортицизме [1, 18].
При этом уменьшить степень повреждения СМ под действием высоких концентраций АФК, образующихся при интенсивных ФН, по мнению некоторых авторов [19, 20], можно с помощью антиоксидантов, в том числе метаболита аргинина – NO, который в умеренных дозах оказывает антиоксидантное действие [15]. Все эти эффекты аргинина и его активных метаболитов должны предопределять лучшую переносимость и более эффективную адаптацию организма к ФН и, возможно, большую эффективность этой комбинации в компенсации ГКC-индуцированных мышечных нарушений, в сравнении с изолированным применением этих факторов.
Цель работы – оценить в экспериментах на крысах эффективность аргинина (АРГ, 100 мг/кг/сутки), умеренной динамической ФН и их комбинации в компенсации негативных эффектов длительно вводимого дексаметазона (ДМ, 0,25 мг/кг/1 раз в 2-е суток, на протяжении от 10 до 60 дней) на сократительную функцию СМ с преимущественным преобладанием гликолитических волокон (m. tibial anterior) в процессе формирования гиперкортицизма.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты были выполнены на 130 половозрелых молодых крысах-самках с исходной массой тела 195–205 г (виварий Республиканского лабораторного центра санитарно-эпидемиологической службы, г. Донецк). Животные в период выполнения экспериментов содержались в помещении кафедры физиологии человека и животных Донецкого национального университета с температурой воздуха 20–22 °С и 12-часовым циклом свет/темнота, имели свободный доступ к воде (ГОСТ Р 51232-98) и пище (ГОСТ 34566-2019). Протокол эксперимента, содержание животных и выведение их из опыта были составлены в соответствии c Европейской конвенцией о защите животных, используемых в эксперименте (директива 86/609/ЕЕС), принципами биоэтики, изложенными в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985), приказом МЗиСР от 23.08.2010 №708н «Об утверждении Правил лабораторной практики». Все манипуляции с животными проводили согласно с правилами асептики и антисептики в соответствии с Федеральным законом РФ «О ветеринарии» (№ 4979-1 от 14.05.1993) и ГОСТ 33044-2014 (2019). Протокол исследования одобрен этическим комитетом по биоэтике Донецкого национального университета (протокол №4 от 24 апреля 2020 г.).
Животные были случайным образом разделены на 5 групп: контрольную (интактная, не подвергались никаким воздействиям, n=10, К-группа), I опытную (n=30, получали дексаметазон, ДМ-группа), II опытную (n=30, получали ДМ и подвергались ежедневному плаванию, ДМ+ФН-группа), III опытную (n=30, получали ДМ и АРГ, ДМ+АРГ-группа) и IV опытную (n=30, получали ДМ, АРГ и подвергались плаванию, ДМ+АРГ+ФН-группа). В последующем каждая опытная группа была разделена на 3 группы (n=10 в каждой) в зависимости от продолжительности экспериментальных воздействий (10, 30 и 60 дней). Такой подход позволил нам проследить динамику изменений в нервно-мышечном аппарате в процессе насыщения организма синтетическим ГКС дексаметазоном, применяемым в комплексе с введением аргинина или действием ФН или комбинацией «АРГ + ФН».
Определение доз дексаметазона и аргинина для крыс осуществляли на основании данных клинического их применения на человеке, а также опыта использования этих препаратов в доклинических исследованиях на грызунах другими специалистами. При этом, исходя из умеренной суточной дозы ДМ для человека – 3 мг [21], рассчитывали эквивалентную ей дозу для крысы, используя тактику межвидового переноса доз с применением коэффициентов, учитывающих различия в удельной площади поверхности тела, определяющей уровень основного обмена [22]. Эквивалентная умеренной терапевтической дозе для человека доза ДМ для крыс составила 0,25 мг/кг.
При выборе дозы аргинина исходили из того, что его дозы в 3–8 г/сутки для человека при пероральном введении безопасны и не вызывают острых фармакологических эффектов [23]. Учитывая, что умеренная рекомендуемая доза аргинина для человека при пероральном введении составляет 3 г/сутки [23], а при парентеральном введении она должна быть ниже, чем при пероральном введении, на 50–60 %, поскольку при пероральном приеме в кровоток всасывается не более 60 % от принятой дозы [24], эквивалентная терапевтической для человека доза аргинина для крысы при парентеральном введении составляет 100 мг/кг.
В исследованиях на крысах установлено, что малые дозы L-аргинина
(20–50 мг/кг) способствуют увеличению образования оксида азота в тканях и соответственно повышению его содержания в плазме крови, тогда как большие (1000 мг/кг) оказывают противоположный эффект [25]. В связи с этим, а также учитывая возможный дефицит NO при ГК-терапии [26], нами была выбрана доза
L-аргинина – 100 мг/кг/сутки для длительного (до 2-х месяцев) парентерального приема.
Выбор в качестве аргининсодержащего средства именно препарата «Кардиоаргинин» был обусловлен, прежде всего, тем, что он является зарегистрированным лекарственным средством. При этом данный препарат, кроме аргинина содержит соли калия и магния в комплексе с аспарагинатом, облегчающим транспорт этих ионов внутрь клеток, что может быть полезным при гиперкортицизме, сопровождающимся развитием гипокалиемии [27]. Магний, как дополнительный компонент данного препарата способствует нормализации внутриклеточной концентрации калия [28]. При этом в литературе отсутствуют доказанные результаты относительно возможной эффективности калия, магния или аспарагиновой кислоты в ослаблении тяжести стероидной миопатии, а из аминокислот доказана эффективность аминокислот с разветвленной цепью (валина, лейцина и изолейцина) в ослаблении ДМ-индуцированной атрофии [29]. В связи с этим основным эффективным действующим веществом препарата «Кардиоаргинин», потенциально способным ослаблять тяжесть стероидной миопатии, является L-аргинин.
Наконец, выбор именно «Кардиоаргинина» был обусловлен еще и тем, что данный препарат проявил высокую эффективность в компенсации эндотелиальной дисфункции при застойной сердечной недостаточности и гиперлипидемии [30], что также немаловажно при длительной глюкокортикоидной терапии, сопровождающейся гиперлипидемией, гиперхолестеринемией и эндотелиальной дисфункцией [31].
Препараты вводили парентерально в связи с более высокой биодоступностью для организма, точностью дозирования и нивелированием индивидуальных особенностей всасывания в желудочно-кишечном тракте, в сравнении с пероральным введением. ДМ («KRKA», Словения) вводили 1 раз в 2-е суток в связи с продолжительным периодом биологической его «полужизни» (36-54 часа) и весьма пролонгированным эффектом, а «Кардиоаргинин» («Здоровье», Украина) – ежесуточно.
ФН моделировали путем плавания в цилиндрической емкости с гладкой поверхностью (диаметр емкости 100 см, глубина 150 см) при температуре воды 37±1°C без дополнительного отягощения с произвольной скоростью. Плавание начинали с первого дня введения препаратов с 5 минут в день, ежедневно увеличивая его продолжительность на 5 минут до доведения ФН до 1-часового периода (к 12 дню). Постепенное увеличение продолжительности плавания и применение ФН с интервалом в 24 часа было обусловлено тем, что регулярные ФН с постепенным увеличением интенсивности и интервалами в 24–72 ч рассматриваются как наиболее безопасные в отношении оксидативного стресса и связанной с ним нестабильности ДНК [32]. ФН выполнялась животными с произвольной скоростью и не представляла для них большой координационной сложности, а поскольку она не сопровождалась дополнительным отягощением, то являлась моделью аэробной нагрузки небольшой интенсивности [33].
По завершении сроков экспериментальных воздействий на животных в условиях глубокого наркоза (тиопентал натрия, 100 мг/кг, внутрибрюшинно) проводили острый опыт, в котором с помощью методов миографии и эргографии оценивали сократительные параметры m. tibialis anterior, используя методические подходы, описанные в более ранней нашей работе [34].
Статистическую значимость различий между средними арифметическими величинами сравниваемых групп (при условии сохранения нормального закона распределения, W-тест Шапиро-Уилка) определяли с помощью двухвыборочного
t-теста Стьюдента для выборок с различными дисперсиями и F-статистики при заданном уровне значимости p<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ изменения массы тела крыс ДМ-группы в течение 2-месячного периода введения ДМ выявил существенно меньший (р<0,01) ее прирост (+24 %) в сравнении с контролем (+50 %, см. табл.). При этом на фоне меньшего прироста массы тела за 2-месячный период у животных ДМ-группы, окружность живота у них превосходила контрольное значение (на 45 %, р<0,01, см. табл.), и при вскрытии по окончании острого опыта в брюшной полости визуализировались избыточные жировые отложения. Данный факт свидетельствует о развитии висцерального ожирения у животных ДМ-группы при длительном введении синтетического ГКС.
При комбинировании ДМ с плаванием прирост массы тела крыс за 2-месячный период (+46 %) был сопоставим с таковым контроля и в 2 раза большим (р<0,01), чем в ДМ-группе (+24 %). В случае введения ДМ в комплексе с АРГ или комбинацией «плавание + АРГ» прирост массы тела крыс за 2-месячный период (+38 % и 31 % соответственно) оказался значимо ниже контрольного (р<0,01), но превышал таковой ДМ-группы (р<0,01). При этом при комплексном применении ДМ с любым из компенсирующих факторов окружность живота спустя 2-месячный период введения препаратов значимо не отличалась от контроля и оказалась существенно меньше таковой 60ДМ-группы (р<0,05). Полученные данные указывают в пользу отсутствия выраженного висцерального ожирения в случае применения ДМ с любым из компенсирующих факторов.
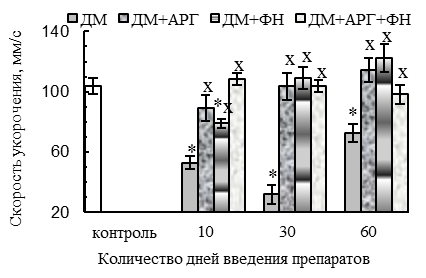
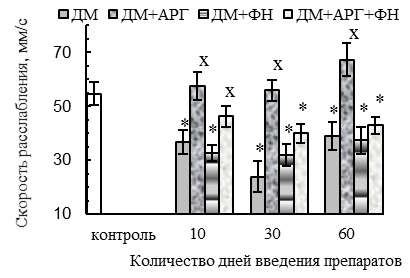
Изолированное применение ДМ сопровождалось ухудшением сократительной функции m. tibialis anterior, признаки которого отмечались уже после первых 10 дней введения синтетического ГКС и носили наиболее выраженный характер спустя 30 дней его применения. Так, для мышцы животных 10ДМ-группы было характерно ухудшение параметров одиночного сокращения (p<0,05 относительно контроля): уменьшение амплитуды (на 24 %, см. рис. 1 А), скорости укорочения (на 49 %, см. рис. 1 Б) и расслабления (на 33 %, см. рис. 1 В). Подобные изменения сохранялись и у крыс 30ДМ-группы, тогда как спустя 2-месячный период введения ДМ, амплитуда одиночных сокращений нормализовалась, но скорость укорочения и расслабления оставались сниженными (на 30 % и 29 %, p<0,05 относительно контроля).
Таблица
Средние значения () массы тела и окружности живота крыс контрольной, ДМ-, ДМ+АРГ-, ДМ+ФН- и ДМ+АРГ+ФН-групп в динамике
2-месячного экспериментального периода
|
Группа животных |
Исходные значения |
Через 10 дней |
Через 30 дней |
Через 60 дней |
||||
|
Масса тела, г |
Окруж-ность живота, см |
Масса тела, г |
Окруж-ность живота, см |
Масса тела, г |
Окруж-ность живота, см |
Масса тела, г |
Окруж-ность живота, см |
|
|
К |
202,0± 2,24 |
15,8± 0,53 |
222,5± 2,98• |
16,1± 0,56 |
260,0± 4,21• |
17,3± 0,60 |
303,0± 5,28• |
18,3± 0,65 |
|
ДМ |
200,6± 2,61 |
15,7± 0,52 |
193,6± 2,15* |
15,4± 0,53 |
213,1± 2,70*• |
18,9± 0,72• |
249,3± 5,70*• |
26,6± 1,03*• |
|
ДМ+АРГ |
205,5± 2,38 |
15,8± 0,52 |
198,6± 2,19* |
15,4± 0,50 |
231,5± 3,19*•х |
16,3± 0,54 |
272,0± 5,57*•х |
17,0± 0,62х |
|
ДМ+ФН |
204,6± 3,14 |
15,8± 0,53 |
217,0± 3,18•х |
15,4± 0,54 |
265,3± 4,38•х |
17,2± 0,64 |
306,3± 3,92*•х |
18,4± 0,74х |
|
ДМ+АРГ+ФН |
204,9± 2,32 |
15,8± 0,51 |
203,1± 2,50* |
15,2± 0,53 |
229,0± 2,31*•х |
15,2± 0,54х |
268,2± 3,32*•х |
15,9± 0,57х |
Примечание: * – различия статистически значимы (р<0,01) относительно соответствующих значений контрольной группы; • – различия статистически значимы (р<0,01) относительно исходного значения параметра соответствующей группы; х – различия статистически значимы (р<0,05) относительно значения соответствующего показателя ДМ-группы
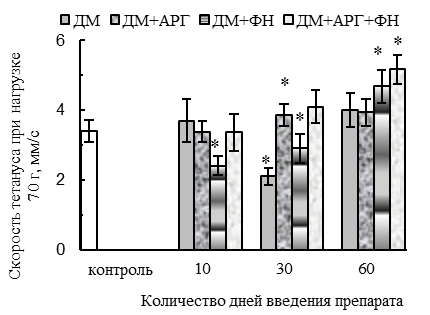
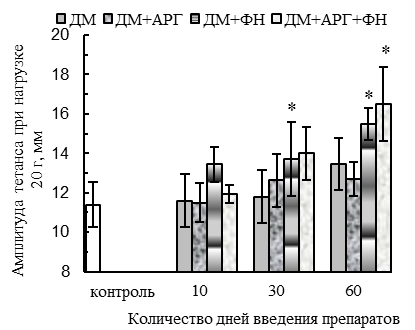
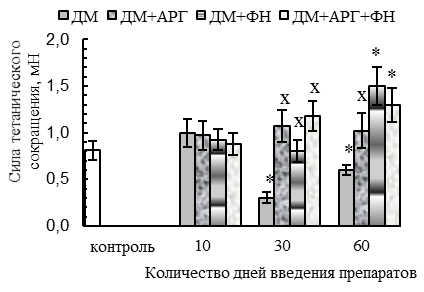
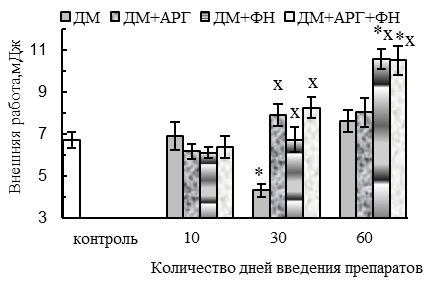
Ухудшение параметров тетанического сокращения СМ при изолированном применении ДМ наблюдалось при работе мышцы с большой нагрузкой (70 г) у животных 30ДМ-группы и проявлялось в уменьшении (p<0,05 относительно контроля) амплитуды (на 32 %, см. рис. 2 А) и скорости развития (на 39 %, см. рис. 2 Б) тетануса, внешней работы мышцы (на 34 %, см. рис. 2 В) и абсолютной силы тетанического ее сокращения (на 64 %, см. рис. 2 Г). По окончании 2-месячного периода применения ДМ амплитуда и скорость тетанического сокращения нормализовывались, но абсолютная сила тетанического сокращения оставалась сниженной (на 32 %, p<0,05 относительно контроля).
Все используемые нами факторы оказались в некоторой степени эффективными для предотвращения нарушений сократительной функции СМ, вызванных длительным введением ДМ (на протяжении 30–60 дней). При этом АРГ полностью компенсировал ухудшение амплитудных и временных параметров одиночного и тетанического сокращений исследуемой мышцы, вызванное ДМ (см. рис. 1, 2).

А Б
В Г
Д Е
Рис. 1. Средние значения параметров одиночного сокращения m. tibialis anterior (А-В) и показателей, отражающих ее гистохимический профиль (Г-Е), контрольных крыс и животных ДМ-, ДМ+АРГ-, ДМ+ФН- и ДМ+АРГ+ФН-групп.
Примечания: * – различия статистически значимы (р<0,05) относительно значения соответствующего показателя контрольной группы; х – различия статистически значимы (р<0,05) относительно значения соответствующего показателя ДМ-группы
В случае применения ДМ в комплексе с плаванием и АРГ сохранялось типичное для ДМ-групп уменьшение скорости расслабления при одиночном сокращении (на 27–22 % спустя 30 и 60 дней применения данной комбинации соответственно, р<0,05, см. рис. 1 В), тогда как амплитуда и скорость одиночного и тетанического сокращений, а также эргометрические параметры – внешняя работа и абсолютная сила тетанического сокращения – не ухудшались, в сравнении с контролем (рис. 1, 2). Более того, по окончании 2-месячного периода применения ДМ в комплексе с комбинацией «АРГ + плавание» наблюдалось увеличение (р<0,05 относительно контроля) внешней работы (на 59 %, см. рис. 2 В), абсолютной силы (на 60 %, см. рис. 2 Г), амплитуды (на 45 %, см. рис. 2 А) и скорости (на 58 %, см. рис. 2 Б) тетануса.
А Б
В Г
Рис. 2. Средние значения параметров тетанического сокращения m. tibialis anterior – амплитуды (А) и скорости (Б), а также эргометрических показателей – внешней работы (В) и абсолютной силы тетанического сокращения (Г) – при внешней нагрузке 70 г контрольных крыс и животных, получавших дексаметазон изолированно (ДМ-группа) или в комплексе с аргинином (ДМ+АРГ) или плаванием (ДМ+ФН-группа) или комбинацией «аргинин+плавание» (ДМ+АРГ+ФН-группа).
Примечания те же, что к рис. 1.
В случае же применения ДМ в комплексе с плаванием наблюдалось первоначальное ухудшение параметров одиночного сокращения мышцы, типичное и для ДМ-групп. В частности, имело место значимое относительно контроля (р<0,05) снижение амплитуды (на 39–33 % в 10ДМ+ФН- и 30ДМ+ФН-группах, см. рис. 1 А), скорости укорочения (на 24 % в 10ДМ+ФН-группе, см. рис. 1 Б) и расслабления (на 32–42 % на протяжении всего 2-месячного периода применения комбинации ДМ с плаванием, см. рис. 1 В) при одиночном сокращении, уменьшение скорости развития тетануса (на 29 %, у животных 10ДМ+ФН-группы, см. рис. 2 Б). Вместе с тем, для ДМ+ФН-групп не было характерно снижения абсолютной силы тетанического сокращения мышцы, отмеченное в 30ДМ- и 60ДМ-группах, напротив, этот параметр в 60ДМ+ФН-группе превышал уровень контроля (на 80 %, р<0,05, см. рис. 2 Г). Первоначальное (спустя первые 10 дней экспериментальных воздействий) ухудшение параметров одиночного и тетанического сокращения СМ у животных ДМ+ФН-группы может быть вызвано не только негативным влиянием ДМ, но отчасти и самой ФН.
Следовательно, эффективность в компенсации нарушений сократительной функции СМ проявили аргинин и его комбинация с ФН, тогда как при введении ДМ в комплексе с плаванием определенные нарушения сократительной функции СМ, отмеченные в ДМ-группах, сохранялись.
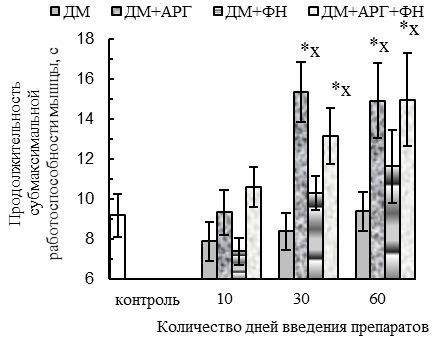
Изолированное применение ДМ обусловливало большую утомляемость СМ, в пользу чего свидетельствует укорочение (р<0,05 относительно контроля) периода максимальной работоспособности СМ (на 29–31 %) при выполнении ею утомляющей работы, типичное для 30ДМ- и 60ДМ-групп (см. рис. 3 А). Признаки повышенной утомляемости мышцы при длительном введении ДМ были отмечены и в более ранней нашей работе [35].

А Б
Рис. 3. Средние значения параметров работоспособности m. tibialis anterior – продолжительности периодов максимальной (А) и субмаксимальной (Б) работоспособности – при внешней нагрузке 70 г контрольных крыс и животных, получавших дексаметазон изолированно (ДМ-группа) или в комплексе с аргинином (ДМ+АРГ) или плаванием (ДМ+ФН-группа) или комбинацией «аргинин+плавание» (ДМ+АРГ+ФН-группа).
Примечания те же, что к рис. 1.
Все используемые средства предотвратили укорочение периода максимальной работоспособности СМ, типичное для 30ДМ- и 60ДМ-групп (см. рис. 3 А). Более того, АРГ и его комбинация с плаванием, используемые в комплексе с ДМ, обусловили удлинение относительно контроля (р<0,05) спустя 30 и 60 дней экспериментальных воздействий периодов максимальной (на 66–123 %, см. рис. 3 А) и субмаксимальной (на 43–67 %, см. рис. 3 Б) работоспособности СМ; при этом в случае применения комбинации ДМ с плаванием и АРГ удлинение максимальной работоспособности СМ отмечалось уже спустя первые 10 дней экспериментальных воздействий (на 39 %, р<0,05 относительно контроля, см. рис. 3 А).
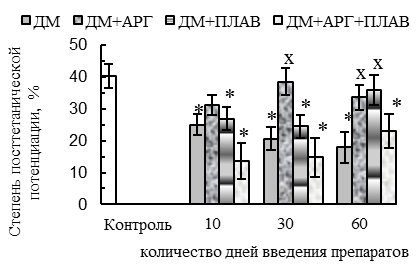
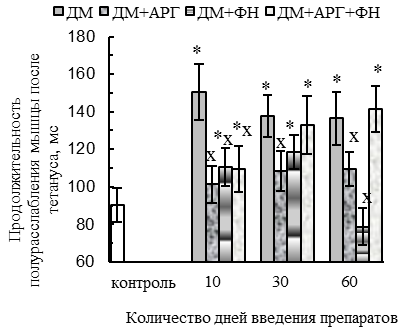
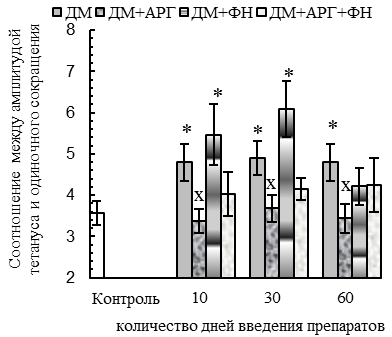
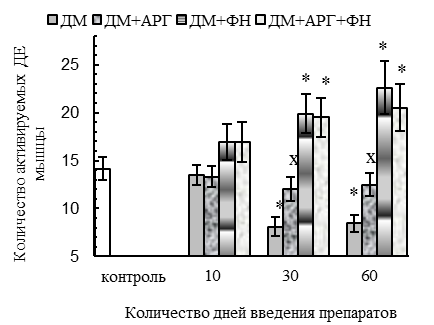
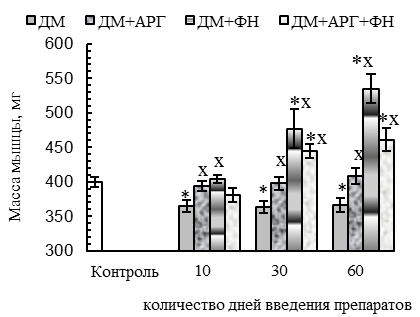
У животных всех ДМ-групп наблюдались функциональные признаки сдвига гистохимического профиля m. tibialis anterior в оксидативную сторону (p<0,05 относительно контроля): уменьшение скорости расслабления при одиночном сокращении (на 29–56 %, см. рис. 1 В), удлинение периода полурасслабления СМ после тетануса (на 40–67 %, см. рис. 1 Е), уменьшение степени посттетанического потенцирования (см. рис. 1 Г) на фоне увеличения соотношения между амплитудой тетануса и одиночного сокращения (до соотношения 4,8:1 против 3,6:1 у контроля, см. рис. 1 Д). Отмеченный сдвиг, вероятнее всего, был обусловлен дистрофическими изменениями части гликолитических МВ, в пользу чего косвенно указывают (p<0,05 относительно контроля) уменьшение массы СМ (на 8–9 % у крыс всех ДМ-групп, см. рис. 4 А), количества активируемых двигательных единиц (ДЕ, на 43–40 % у животных 30ДМ- и 60ДМ-групп соответственно, см. рис. 4 Б) и обсуждаемое выше ухудшение сократительных параметров СМ.
А Б
Рис. 4. Средние значения массы передней большеберцовой мышцы (А) и количества активируемых ее двигательных единиц (ДЕ, Б) контрольных крыс и животных, получавших дексаметазон изолированно (ДМ-группа) или в комплексе с аргинином (ДМ+АРГ) или плаванием (ДМ+ФН-группа) или комбинацией «аргинин+плавание» (ДМ+АРГ+ФН-группа).
Примечания те же, что к рис. 1.
По окончании 2-месячного периода введения ДМ наблюдалась нормализация ряда сократительных параметров СМ: амплитуды одиночного (см. рис. 1 А) и тетанического сокращений (см. рис. 2 А), внешней работы мышцы при тетаническом сокращении (см. рис. 2 В) и его скорости (см. рис. 2 Б). Такая нормализация отчасти может быть связана с адаптацией нервно-мышечного аппарата к длительному введению ГКС в постоянной дозе, но она не была обусловлена нормализацией состояния гликолитических МВ, в пользу чего указывают следующие факты. Во-первых, в 60ДМ-группе сохранялись уменьшенными (р<0,05 относительно контроля) масса СМ (на 9 %, см. рис. 4 А) и количество активируемых ДЕ (на 43 %, см. рис. 4 Б), а также отмечались функциональные признаки сдвига гистохимического профиля СМ в оксидативную сторону – уменьшение скорости укорочения (на 30 %, см. рис. 1 Б) и расслабления (на 29 %, см. рис. 1 В) при одиночном сокращении, удлинение времени полурасслабления после тетануса (на 43–51 %, см. рис. 1 Е), уменьшение степени посттетанического потенцирования (см. рис. 1 Г) на фоне увеличения соотношения между амплитудой тетануса и одиночного сокращения (до соотношения 4,8:1 против 3,6:1 у контроля, см. рис. 1 Д).
Во-вторых, у животных 60ДМ-группы сохранялось снижение абсолютной силы тетанического сокращения (на 32 %, см. рис. 2 Г) и отмечалось укорочение периода максимальной работоспособности СМ (см. рис. 3 А).
Все эти патологические проявления свидетельствуют в пользу того, что некоторая нормализация сократительных параметров мышцы у животных 60ДМ-группы была обусловлена не нормализацией функционального состояния гликолитических МВ, а расширением ДЕ на фоне сниженных (р<0,05 относительно контроля) ее массы (на 9 %, см. рис. 4 А) и количества активируемых ДЕ (на 43 %, см. рис. 4 Б). Признаки расширения ДЕ мышцы при длительном введении ДМ были отмечены и в более ранней нашей работе [36].
Весьма эффективным в предотвращении функциональных признаков сдвига гистохимического профиля СМ в оксидативную сторону оказался аргинин. В пользу этого свидетельствуют относительно нормальные (соответствующие контролю) в ДМ+АРГ-группах значения периода полурасслабления СМ после тетануса (см. рис. 1 Е), скорости расслабления мышцы при одиночном сокращении (см. рис. 1 В), степени посттетанического потенцирования (см. рис. 1 Г) и соотношения между амплитудой тетанического и одиночного сокращений (см. рис. 1 Д).
При комплексном применении ДМ с плаванием или комбинацией «плавание + АРГ» наблюдались функциональные признаки сдвига гистохимического профиля СМ в оксидативную сторону. В частности, скорость расслабления при одиночных сокращениях оказалась сниженной (р<0,05 относительно контроля) во всех ДМ+ФН-группах (на 32–42 %) и спустя 30–60 дней применения комбинации ДМ с плаванием и АРГ (на 27–22 %, см. рис. 1 В). Кроме того, для ДМ+ФН- и ДМ+АРГ+ФН-групп было характерно (р<0,05 относительно контроля) удлинение периода полурасслабления СМ после тетануса (на 29–57 %, см. рис. 1 Е), уменьшение степени посттетанической потенциации (см. рис. 1 Г) и увеличение соотношения между амплитудой тетануса и одиночных сокращений (до соотношения 5,5:1 – 6,1:1 против 3,6:1 у контроля, см. рис. 1 Д).
Вместе с тем, в ДМ+ФН- и ДМ+АРГ+ФН-группах функциональные признаки сдвига гистохимического профиля СМ отмечались на фоне нормальных (спустя первые 10 дней введения препаратов) и даже увеличенных, в сравнении с контролем (спустя 30-60 дней экспериментальных воздействий, р<0,05), массы СМ (см. рис. 4 А) и количества активируемых ДЕ (см. рис. 4 Б), внешней работы (см. рис. 2 В) и абсолютной силы тетанического сокращения (спустя 60 дней экспериментальных воздействий, см. рис. 2 Г). Данные факты указывают в пользу того, что основной причиной функциональных признаков сдвига гистохимического профиля СМ у животных ДМ+ФН- и ДМ+АРГ+ФН-групп служила динамическая ФН, а не дистрофические изменения гликолитических МВ под действием ДМ.
Таким образом, несмотря на компенсацию многих сократительных нарушений, вызванных ДМ, у животных, получавших ГКС на фоне ФН или ее комбинации с АРГ, сохранялись функциональные признаки сдвига гистохимического профиля СМ в оксидативную сторону, повлекшие нарушения некоторых временных параметров сокращения мышцы.
В пользу изменения гистохимического профиля быстрой СМ при комплексном применении ГКС и ФН свидетельствуют и другие авторы. Так, в исследованиях на крысах, получавших триамцинолон, показано, что в длинном разгибателе пальцев (быстрая мышца) значительно увеличивалась доля волокон типа I под действием ФН как средней, так и высокой интенсивности, тогда как доля волокон типа IIb значительно уменьшилась в группе умеренных ФН, сочетаемых с триамцинолоном, по сравнению с группой, получавшей триамцинолон без ФН [37].
Полученная в наших исследованиях достаточно высокая эффективность аргинина в компенсации ДМ-индуцированной миопатии и имеющиеся данные относительно возможного снижения активности системы «аргинин – оксид азота» под действием фармакологических концентраций ГКС [26] предопределяют целесообразность применения аргинина, как донатора NO, при ГКС-терапии. Учитывая безопасность этого средства для организма человека, допустимо дальнейшее клиническое его испытание с целью компенсации стероидной миопатии.
В случае применения ДМ в комплексе с ФН наблюдались типичные для ДМ-групп функциональные признаки сдвига гистохимического профиля СМ в оксидативную сторону, которые, вероятнее всего, обусловлены адаптацией СМ к динамической ФН, и отмечалось ухудшение параметров одиночного и тетанического сокращения СМ на начальных этапах воздействия данной комбинации.
АРГ, применяемый в комплексе с ФН и ДМ, улучшил переносимость ФН и предотвратил типичное для ДМ+ФН-групп первоначальное (спустя 10–30 дней эксперимента) ухудшение сократительных параметров СМ, а по окончании
2-месячного экспериментального периода у животных ДМ+АРГ+ФН-группы наблюдалось улучшение (р<0,05 относительно контроля) амплитудных и скоростных параметров тетанического сокращения СМ.
Вместе с тем, подобно ДМ+ФН-группам, для мышцы животных ДМ+АРГ+ФН-групп были характерны функциональные признаки сдвига гистохимического ее профиля в оксидативную сторону, вероятнее всего, обусловленные адаптацией к динамической ФН и предопределяющие ухудшение ее скоростных параметров, что ставит под сомнение целесообразность применения динамической ФН с целью компенсации негативных эффектов ГКС на быстрые СМ. В то же время, в случае применения ФН в комплексе с ГКС целесообразно проводить дополнительное введение умеренных терапевтических доз аргинина для лучшей адаптации СМ к ФН. Кроме того, сам по себе аргинин оказывает ряд полезных эффектов в плане компенсации многих проявлений стероидной миопатии.
ЗАКЛЮЧЕНИЕ
- Аргинин, ФН и их комбинация, используемые в комплексе с ДМ, предотвратили характерное для ДМ-групп ухудшение резистентности СМ к утомлению и привели даже к удлинению (р<0,05 относительно контроля) на определенных этапах экспериментальных воздействий периодов максимальной (все эти факторы) и субмаксимальной (АРГ или его комбинация с плаванием) работоспособности СМ.
- Применение АРГ, ФН и их комбинации в комплексе с ДМ неоднозначно сказывалось на сократительных и эргометрических параметрах мышцы:
- АРГ полностью компенсировал их ухудшение, вызванное ДМ;
- в случае использования в комплексе ДМ плавания спустя первые 10 дней наблюдалось ухудшение амплитудных и временных параметров одиночного и тетанического сокращения СМ (р<0,05 относительно контроля), тогда как по завершении 2-месячного периода – нормализация и даже увеличение (р<0,05 относительно контроля) абсолютной силы тетанического сокращения;
- АРГ, применяемый в комплексе с ФН и ДМ, предотвратил типичное для ДМ+ФН-групп ухудшение сократительных параметров мышцы спустя первые 10–30 дней воздействий, а по завершении 60-дневного периода воздействий обусловил улучшение эргометрических ее параметров (р<0,05 относительно контроля).
- Использование в комплексе с ДМ аргинина, умеренной ФН и их комбинации неоднозначно сказывалось на скоростных параметрах сокращения мышцы: АРГ предотвратил типичное для ДМ-групп их ухудшение, тогда как при применении ДМ с плаванием или комбинацией «плавание + АРГ» их ухудшение (р<0,05 относительно контроля) сохранялось.
- Учитывая относительную безопасность аргинина, а также полученные данные относительно его эффективности в компенсации нарушений сократительной функции быстрой мышцы в условиях ГКС-терапии, допустимо дальнейшее клиническое его испытание с целью компенсации стероидной миопатии. Установленные в работе факты относительно ухудшения скоростных параметров сокращения m. tibialis anterior крыс в случае комплексного применения ДМ с ФН динамического характера ставят под сомнение целесообразность применения аэробных физических нагрузок с целью компенсации негативных эффектов ГКС-терапии на быстрые скелетные мышцы. В то же время в случае применения ФН в комплексе с ГКС-терапией целесообразно проводить дополнительное введение умеренных фармакологических доз аргинина для лучшей адаптации скелетной мускулатуры к ФН.
- Chang J. S., Kong I. D., Irisin prevents dexamethasone-induced atrophy in C2C12 myotubes, Pflugers Arch., 472, 495 (2020). DOI: https://doi.org/10.1007/s00424-020-02367-4
- Park S. H., Oh J., Jo M., Kim J. K., Kim D. S., Kim H. G., Yoon K., Yang Y., Geum J. H., Kim J. E., Choi S. Y., Kim J. H., Cho J. Y., Water Extract of Lotus Leaf Alleviates Dexamethasone-Induced Muscle Atrophy via Regulating Protein Metabolism-Related Pathways in Mice, Molecules, 25, 4592 (2020). DOI: https://doi.org/10.3390/molecules25204592
- Adhikary S., Choudhary D., Tripathi A. K., Karvande A., Ahmad N., Kothari P., Trivedi R., FGF-2 targets sclerostin in bone and myostatin in skeletal muscle to mitigate the deleterious effects of glucocorticoid on musculoskeletal degradation, Life Sci., 229, 261 (2019). DOI: https://doi.org/10.1016/j.lfs.2019.05.022
- Kim H., Jang M., Park R., Jo D., Choi I., Choe J., Oh W. K., Park J., Conessine Treatment Reduces Dexamethasone-Induced Muscle Atrophy by Regulating MuRF1 and Atrogin-1 Expression, J. Microbiol. Biotechnol., 28, 520 (2018). DOI: https://doi.org/10.4014/jmb.1711.11009
- Archer-Lahlou E., Lan C., Jagoe R. T., Physiological culture conditions alter myotube morphology and responses to atrophy treatments: implications for in vitro research on muscle wasting, Physiol. Rep., 6, e13726 (2018). DOI: https://doi.org/10.14814/phy2.13726
- Grishin S. N., Gabdrakhmanov A. I., Khairullin A. E., Ziganshin A. U., The Influence of Glucocorticoids and Catecholamines on the Neuromuscular Transmission, Biologicheskie membrany (Biological membranes), 34, 251 (2017). DOI: https://doi.org/10.7868/S02334755170 40016
- Kamaliev R. R., Grishin S. N., Falou Zh. Yu., Ziganshin A. U., The effect of hydrocortisone, ATP and adenosine on rat skeletal muscle contraction, Kazanskiy meditsinskiy zhurnal (Kazan Medical Journal), 90, 556 (2009). (In Russ.)
- Langendorf E. K., Rommens P. M., Drees P., Mattyasovszky S. G., Ritz U., Detecting the Effects of the Glucocorticoid Dexamethasone on Primary Human Skeletal Muscle Cells-Differences to the Murine Cell Line, Int. J. Mol. Sci., 21, 2497 (2020). DOI: https://doi.org/10.3390/ijms21072497
- Macedo A. G., Krug A. L., Souza L. M., Martuscelli A. M., Constantino P. B., Zago A. S., Rush J. W. E., Santos C. F., Amaral S. L., Time-course changes of catabolic proteins following muscle atrophy induced by dexamethasone, Steroids, 107, 30 (2016). DOI: https://doi.org/10.1016/j.steroids.2015.12.016
- Cai X., Yuan Y., Liao Z., Xing K., Zhu C., Xu Y., Yu L., Wang L., Wang S., Zhu X., Gao P., Zhang Y., Jiang Q., Xu P., Shu G., α-Ketoglutarate prevents skeletal muscle protein degradation and muscle atrophy through PHD3/ADRB2 pathway, FASEB J., 32, 488 (2018). DOI: https://doi.org/10.1096/fj.201700670R
- Lomonosova Yu. N., Shenkman B. S., Nemirovskaya T. L., Signal effects of substrate stimulation of nNOS in rat skeletal muscle after eccentric exercise, Doklady akademii nauk (Reports of the Academy of Sciences), 452, 685 (2013). (In Russ.). DOI: https://doi.org/10.7868/S0869565213310216
- Safdar A., Little J. P., Stokl A. J., Hettinga B. P., Akhtar M., Tarnopolsky M. A., Exercise Increases Mitochondrial PGC-1a Content and Promotes Nuclear-Mitochondrial Crosstalk to Coordinate Mitochondrial Biogenesis, Journal of Biological Chemistry, 286, 10605 (2011). DOI: https://doi.org/10.1074/jbc.m110.211466
- Vladimirsky V. E., Vladimirsky E. V., Lunina A. N., Fesyun A. D., Rachin A. P., Lebedeva O. D., Yakovle M. YU., Tubekova (Ansokova) M. A., Molecular mechanisms of adaptive and therapeutic effects of physical activity in patients with cardiovascular diseases, Voprosy kurortologii, fi zioterapii i lechebnoi fi zicheskoi kultury (Problems of balneology, physiotherapy, and exercise therapy), 99, 69 (2022). (In Russ.). DOI: https://doi.org/10.17116/kurort20229902169
- Boger R. H., Bode-Boger S. M., The clinical pharmacology of L-arginine, Annu. Rev. Pharmacol. Toxicol., 41, 79 (2001). DOI: https://doi.org/10.1146/annurev.pharmtox.41.1.79
- Cabrales P., Tsai A. G., Intaglietta M., Exogenous nitric oxide induces protection during hemorrhagic shock, Resuscitation, 80, 707 (2009). DOI: https://doi.org/10.1016/j.resuscitation.2009.03.001
- Gorini G., Gamberi T., Fiaschi T., Mannelli M., Modesti A., Magherini F., Irreversible plasma and muscle protein oxidation and physical exercise, Free Radic. Res., 53, 126 (2019). DOI: https://doi.org/10.1080/10715762.2018.1542141
- Sagidova S. A., Influence physical activities on near-limit of free radical oxidation and reactivity microvascular in myocardium, Nauka i sport: sovremennye tendencii (Science and sport: current trends), 14, 83 (2017). (In Russ.)
- Geng H., Song Q., Cheng Y., Li H., Yang R., Liu S., Hao L., MicroRNA 322 Aggravates Dexamethasone-Induced Muscle Atrophy by Targeting IGF1R and INSR, Int. J. Mol. Sci., 21, 1111 (2020). DOI: https://doi.org/10.3390/ijms21031111
- Gunina L., The mechanisms of effects of antioxidants on the physical performance of athletes, Nauka v olimpijskom sporte (Science in Olympic sports), 1, 25 (2016). DOI: https://doi.org/10.32652/olympic2016.1_%25x
- Park M. Y., Jeong Y. J., Kang G. C., Kim M.-H., Kim S. H., Chung H.-J., Jung J. Y., Kim W. J., Nitric oxide-induced apoptosis of human dental pulp cells is mediated by the mitochondria-dependent pathway, Korean J. Physiol. Pharmacol., 18, 25 (2014). DOI: https://doi.org/10.4196/kjpp.2014.18.1.25
- Katzung B.G. Greenspan’s Basic and Clinical Pharmacology. B.G. Katzung (ed.). 14th ed. New York: McGraw-Hill Medical; 2018.
- Shekunova E. V., Kovaleva M. A., Makarova M. N., Makarov V. G., Dose selection in preclinical studies: cross-species dose conversion, Vedomosti Nauchnogo tsentra ekspertizy sredstv meditsinskogo primeneniya (Тhе Bulletin of the Scientific Centre for Expert Evaluation of Medicinal Products), 10, 19 (2020). DOI: https://doi.org/10.30895/1991-2919-2020-10-1-19-28. (In Russ.)
- Bоger R. H., The Pharmacodynamics of L-Arginine, J. Nutr., 137, 1650 (2007). DOI: https://doi.org/10.1093/jn/137.6.1650s
- Wu G., Morris S. M. Jr., Arginine metabolism: nitric oxide and beyond, Biochem. J., 336, 1 (1998). DOI: https://doi.org/10.1042/bj3360001
- Karimova R. G., Bilalov I. N., Garipov T. V., Activization of nitric oxide formation in the rats organism by different factors, Fundamental’nyye issledovaniya (Basic Research), 2, 53 (2015). (In Russ.)
- Zhelnin Y. V., Zvyagintseva T. V, Kryvoshapka O. V., Рost-traumatic regeneration of the alveolar bone and its relation to the nitric oxide metabolites in rats with glucocorticoid osteoporosis, Uspekhi sovremennogo estestvoznaniya (Progress of modern natural science), 5, 34 (2014). (In Russ.)
- Dreval A. V., Komeredus I. V., Budul N. A., Britvin T. A., Terpigorev S. A., Kabanova T. G., Chekanova A. V., Manifestations of hypercorticism in patients on the background of a short course of systemic glucocorticoids treatment, RMJ, 22, 1603 (2017). (In Russ.)
- Elin R. J., Magnesium metabolism in health and disease, Disease-a-Month, 34, 166 (1988). DOI: https://doi.org/10.1016/0011-5029(88)90013-2
- Nishida H., Ikegami A., Kaneko C., Kakuma H., Nishi H., Tanaka N., Aoyama M., Usami M., Okimura Y., Dexamethasone and BCAA Failed to Modulate Muscle Mass and mTOR Signaling in GH-Deficient Rats, PLoS One, 10, e0128805 (2015). DOI: https://doi.org/10.1371/journal.pone.0128805
- Korkushko O. V., Duzhak H. V., Shatylo V. B., Bondarenko Ye. V., Nedbailo A. V., Study of Kardioarginin – Zdorovia Effect on Motor Function of Vascular Endothelium in Patients with Hypertension over 60, Liky Ukraïny (Medicines of Ukraine), 1, 44 (2014). (In Russ.)
- Komerdus I. V., Budul N. А., Chekanova A. V., Systemic effects of glucocorticoid drugs: a guide for the General practitioner (literature review), RMJ, 1, 45 (2017). (In Russ.)
- Danese E., Lippi G., Sanchis-Gomar F., Brocco G., Rizzo M., Banach M., Montagnana M., Physical Exercise and DNA Injury: Good or Evil? Adv. Clin. Chem., 81, 193 (2017). DOI: https://doi.org/10.1016/bs.acc.2017.01.005
- Voltarelli F. F., Gobatto C. A., de Mello M. A. R., Minimun blood lactate and muscle protein of rats during swimming exercise, Biol. Sport., 25, 23 (2008).
- Trush V. V., Sobolev V. I., Efficiency of alphacalcidol in compensation of disorders of contractile functions of the skeletal muscle with dexamethazone hypercorticism in experiments on rats, Uchenyye zapiski Krymskogo federal’nogo universiteta imeni V.I. Vernadskogo. Biologiya. (Khimiya Scientific notes of the Crimean Federal University named after V.I. Vernadsky. Biology. Chemistry), 6 (72), 151 (2020). (In Russ.).
- Trush V. V., Sobolev V. I., Influence of long dexamethasone administration on electrophysiological parameters of the rat skeletal muscle at rest and exhaustion development, Eksperimental’naya i klinicheskaya farmakologiya (Experimental and clinical pharmacology), 81, 21 (2018). (In Russ.). DOI: https://doi.org/10.30906/0869-2092-2018-81-5-21-26
- Trush V. V., Sobolev V. I., Alphaсalcidol modulation of the dexamethazone effects on parameters of M-response of skeletal muscle of white rats, Pathological Physiology and Experimental Therapy, 65, 53 (2021). (In Russ.). DOI: https://doi.org/10.25557/0031-2991.2021.02.53-66
- Uchikawa K., Takahashi H., Hase K., Masakado Y., Liu M., Strenuous exercise-induced alterations of muscle fiber cross-sectional area and fiber-type distribution in steroid myopathy rats, Am. J. Phys. Med. Rehabil., 87, 126 (2008). DOI: https://doi.org/10.1097/PHM.0b013e31815869d0
