A MORPHOLOGY, ANATOMY AND GENETIC CHARACTERIZATION OF SOME THYME CULTIVARS FROM THE NIKITA BOTANICAL GARDEN COLLECTION
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 6 (72), №4, 2020
Publication text (PDF):Download
UDK: 633.81:581.8:575
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Bulavin I. V., FSFIS “The Nikita Botanical Gardens – National Scientific Center of the RAS”, Nikita, Yalta, Russian Federation
TYPE:Article
DOI:https://doi.org/10.37279/2413-1725-2020-6-4-24-35
PAGES:from 24 to 35
STATUS:Published
LANGUAGE:Russian
KEYWORDS: Thymus L., morphology, anatomy, RAPD-PCR, genetic similarity.
ABSTRACT (ENGLISH):
In the research works of various fields, including food industry and medicine, a great attention is paid to the medicinal and aromatic plants of the families Myrtaceae Juss., Lauraceae Juss. and Lamiaceae Martinov. Thymus L. is one of the most important genera of the Lamiaceae family, with aromatic and medicinal properties, it is one of the most popular plants with an essential oil, one of the ten best ones in the world. In the Nikita Botanical Gardens (NBG) on the ex situ collection plots, besides the introduced plants, there are thyme cultivars of the NBG selection. For further plant usage, a cultivar comprehensive study is necessary. Therefore, the objective of the research was a comparative morphological, anatomical analysis, an essential oil amount determination and a genetic similarity evaluation.
T. mastichina (L.) L. cv. Svetliachok, T. striatus Vahl. cv. Jubileiniy and T. vulgaris L. cv. Fantazia (NBG selection) were used. The leaf morphology was studied under the stereomicroscope, the organ sections were obtained on a freezing microtome, stained with methylene blue and examined under a light microscope, an essential oil was extracted using Ginsberg devices, DNAs were isolated with CTAB-method, genetic similarity was evaluated with RAPD-PCR on the basis of binary matrices in the PAST program.
A comparative morphological and anatomical analysis of the cultivars revealed the common structure of vegetative and generative organs. The differences were established in the stem color, the leaf blade sizes, the type of mechanical tissue under midrib, the area of inclusions with essential oil and its total amount. The analysis of a genetic similarity showed that T. mastichina cv. Svetliachok formed a separate cluster, cultivars of T. striatus (Jubileiniy) and T. vulgaris (Fantazia) were closer.
ВВЕДЕНИЕ
В исследовательских работах различного профиля, в том числе пищевой промышленности и медицины все больше внимания уделяется лекарственным и ароматическим видам растений семейств Myrtaceae Juss., Lauraceae Juss. и Lamiaceae Martinov [1, 2]. Представители семейства Lamiaceae, являясь космополитами, населяют различные экосистемы. Растения известны наличием железистых структур, ответственных за биосинтез и накопление эфирного масла [3]. Род Thymus L. включает около 250 таксонов, произрастающих в Европе, Северо-Западной Африке, Эфиопии, Азии и Гренландии [4], является одним из наиболее важных в семействе Lamiaceae [1, 2], а его представители, обладая ароматическими и лекарственными свойствами, относятся к категории популярных растений с эфирным маслом, входящим в десятку лучших в мире [5, 6]. Кроме того, отмечаются декоративные свойства чабрецов при их использовании в ландшафтном дизайне [7]. В связи с вышеизложенным, проводятся исследования морфолого-анатомических характеристик чабрецов различных видов и сортов [8], биохимического состава их эфирных масел с целью использования в медицине, парфюмерии и косметике [9], поддерживается селекционный процесс [10] для сохранения определенных генотипов и их последующей мультипликации, проводятся исследования в культуре in vitro [11], а также осуществляется генетический анализ, который позволяет определить уникальный популяционный генетический состав, отличающий растения в рамках своей группы, установить способность адаптироваться к меняющимся условиям среды [6]. Географическое распространение, факторы окружающей среды, генетические вариации являются определяющими при формировании внешнего облика растений [12]. В литературе акцентируется внимание на значительной морфологической вариабельности многих видов рода Thymus и отсутствии четких диагностических характеристик [4], что зачастую приводит к ошибкам при идентификации как живых растений, так и семян [13].
В коллекции Никитского ботанического сада (НБС) насчитывается пять сортов чабреца: T. mastichina L. (Светлячок), T. citriodorus Schreb. (Silver Queen), T. striatus Vahl. (Юбилейный), T. vulgaris L. (Фантазия, Ялос) [14]. Для дальнейшего использования растений необходимо всестороннее изучение сортов. Поэтому целью исследования был сравнительный морфолого-анатомический анализ органов растений, определение содержания эфирного масла и проведение RAPD-анализа для установления генетической близости.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве растительного материала были выбраны сорта чабреца Светлячок (T. mastichina), Юбилейный (T. striatus) и Фантазия (T. vulgaris), полученные путем свободного опыления в НБС (рис. 1).
Морфологию вегетативных органов изучали при помощи стереомикроскопа SMZ 460 (Nikon, Китай). Для исследования анатомии, срезы изготавливали на замораживающем микротоме МЗ-2 (Харьков, Украина), окрашивали раствором метиленовой сини и исследовали с использованием светового микроскопа СХ 41 (Olympus, Япония), оснащенного цифровой камерой SC 50 и программным обеспечением CellSens Imaging Software версии 1.17. Эфирные масла извлекали методом гидродистилляции на аппаратах Гинзберга [15] с последующим измерением объемов (дата сбора растений – май 2020 г.). ДНК выделяли из молодых неповрежденных листьев при помощи ЦТАБ-метода с добавлением 2% поливинилпирролидона (ПВП). ПЦР проводили с применением набора BioMaster HS-Taq PCR (Биолабмикс, Российская Федерация) в соответствии с протоколом производителя. Для RAPD-анализа использовали олигонуклеотидные праймеры – OPA1 5′-CAGGCCCTTC-3′, OPA2 5′-TGCCGAGCTG-3′,OPA3 5′-AGTCAGCCAC-3′, OPA4 5′-AATCGGGCTG-3′, OPA5 5′-AGGGGTCTTG-3′, OPA6 5′-GGTCCCTGA-3′. ПЦР проводили в термоциклере C1000 ™ Thermal Cycler (Bio-Rad, Сингапур). Условия реакции были следующими: начальная денатурация – 95 °С, 5 мин; денатурация 94 °С, 30 с; отжиг – 32°С, 30 с; элонгация – 72 °С, 30; конечная элонгация 72 °С, 5 мин (30 циклов). Амплифицированные фрагменты анализировали с помощью электрофореза в 1,5 % агарозном геле с 1 × TBE буфером при 85 В в течение 1 ч с использованием универсального источника питания PowerPacTM (Bio-Rad, Сингапур). Агарозный гель визуализировали с помощью системы гельдокументации E-box (Vilber Lourmat, Франция). Статистический анализ включал составление бинарных матриц по каждому из праймеров, в которых отмечалось «присутствие» (1) или «отсутствие» (0) фрагментов с одинаковой молекулярной массой на электрофореграмме. На основании суммарной матрицы RAPD была определена генетическая близость между исследуемыми образцами. Для построения дендрограммы применяли метод невзвешенного парно-группового кластерного анализа с арифметическим усреднением (UPGMA) с использованием программы PAST [16]. Для более точной статистической оценки вероятностного распределения был использован анализ бутстрэппинг с числом реплик, равным 1000. Процент повторов, при котором каждый узел поддерживается после многократной генерации выборок, отображается на дендрограмме в соответствующем узле.

Рис. 1. Сегменты молодых побегов сортов чабреца Светлячок (а), Юбилейный (б) и Фантазия (в).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследованы морфология и анатомия вегетативных и генеративных органов T. mastichina (Светлячок), T. striatus (Юбилейный) и T. vulgaris (Фантазия). Стебли имели округлую или четырехугольную форму, по цвету были фиолетовые (T. mastichina (Светлячок)) и желто-зеленые (T. striatus (Юбилейный), T. vulgaris (Фантазия)), одревесневающие со временем в нижней части. На эпидерме молодых стеблей обнаруживались кроющие трихомы и пельтатные железки. Листья (рис. 2) супротивные, короткочерешковые, простые, цельнокрайние, узкояйцевидные с острой верхушкой и низбегающим основанием, отличались наличием скрученности по краям (T. striatus (Юбилейный), T. vulgaris (Фантазия)), а так же размерами. Наибольшая площадь листа была характерна для T. mastichina (Светлячок) и составляла 0,1±0,007 см2, остальные виды имели несколько меньшие но близкие значения: T. striatus (Юбилейный) – 0,037±0,003 см2 и T. vulgaris (Фантазия) – 0,031±0,002 см2.

Рис. 2. Морфология листа исследуемых видов чабреца: а – листья (общий вид), б – верхняя сторона листа, в – нижняя сторона листа (стрелками показаны пельтатные железки).
С обеих сторон листа обнаруживали кроющие трихомы и пельтатные железки. Последние находились в небольших углублениях, образованных путем инвагинации клеток эпидермы вглубь листа, за счет чего формировалась волнистая поверхность. Чашечки исследуемых видов так же имели кроющие трихомы и железистые структуры, которые качественно отличались в зависимости от вида: у T. mastichina (Светлячок) выявляли в основном пельтатные железки, у T. striatus (Юбилейный) и T. vulgaris (Фантазия) – головчатые и пельтатные. Цветки зигоморфные, у T. mastichina (Светлячок) белые, у T. striatus (Юбилейный) и T. vulgaris (Фантазия) – сине-фиолетовые.
Анатомически (рис. 3) стебли и листья разных видов имели общий план строения. В стебле под эпидермой с кутикулой располагались несколько слоев колленхимы, с наибольшим ее развитием в углах (4–6 слоев). Ниже определялись несколько слоев паренхимы, проводящие элементы, которые формировали сплошное кольцо. В средней части стебля, в зависимости от места среза, обнаруживалась либо сердцевина, либо полость. Листовые пластинки характеризовались наличием эпидермальных клеток с кутикулой и дифференцированным мезофиллом. В центральной жилке четко выявляли элементы ксилемы и флоэмы, которые с нижней стороны были окружены тяжами механической ткани (склеренхимы), имевшей наибольшее развитие у T. striatus (Юбилейный) и T. vulgaris (Фантазия). У сорта Светлячок (T. mastichina) к центральной жилке примыкала колленхима. В сростнолистных чашечках под эпидермой различали рыхлый мезофилл, в котором выявляли проводящие пучки.
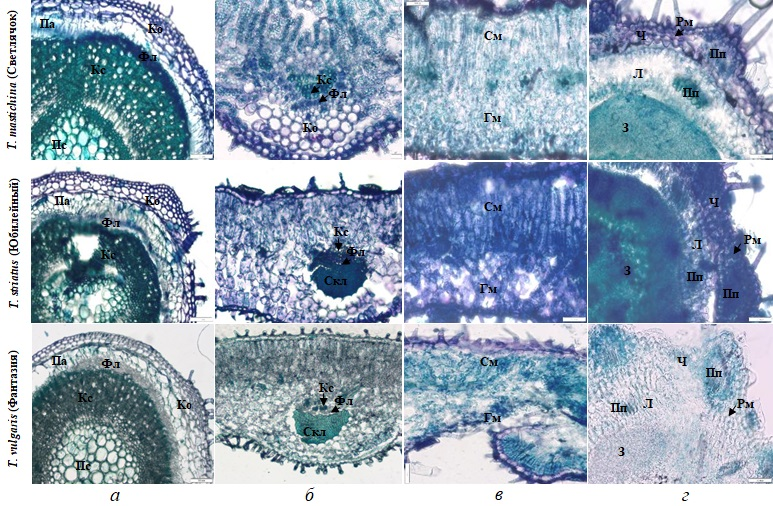
Рис. 3. Фрагменты поперечных срезов вегетативных и генеративных органов чабреца: а – стебель, б – центральная часть листа, в – мезофилл, г – цветок;
Ко – колленхима, Па – паренхима, Фл – флоэма, Кс – ксилема, Скл – склеренхима,
Пс – паренхима сердцевины, См – столбчатый мезофилл, Гм – губчатый мезофилл,
Ч – чашечка, Л – лепесток, З – завязь, Рм – рыхлый мезофилл, Пп – проводящий пучок.
Исследования локализации включений с эфирным маслом в стебле показали их наличие, в основном, в колленхиме и паренхиме. В листе включения выявляли в клетках эпидермы, губчатом и столбчатом мезофилле. В цветках наибольшее количество включений находилось в тканях завязи. Размеры включений варьировали в зависимости от органа и сорта растения (табл. 1).
Таблица 1
Площадь включений с эфирным маслом в тканях органов некоторых
сортов чабреца (мкм2)
| Орган/Сорт | M±m | ||
| Стебель | Лист | Цветок | |
| T. mastichina (Светлячок) | 3,91±1,05 | 21,2±1,32 | 3,14±0,34 |
| T. striatus (Юбилейный) | 4,92±1,22 | 6,52±1,06 | 5,23±0,72 |
| T. vulgaris (Фантазия) | 3,76±0,35 | 20,23±1,27 | 4,48±0,62 |
Наибольшая их площадь выявлена в листьях T. mastichina (Светлячок). Для остальных исследуемых видов отмечена единичность и невысокая частота встречаемости включений, как и в стеблях. Во внутренних структурах цветка включения с эфирным маслом характеризовались меньшими размерами, однако их встречаемость была выше. Данные анатомии подтверждаются исследованиями содержания эфирного масла в вегетативных и генеративных органах (табл. 2), где в соцветиях обнаружено наибольшее их количество.
Таблица 2
Содержание эфирного масла в органах исследуемых сортов чабреца
(сырая масса)
| Орган/Сорт | Cодержание эфирного масла (%) / 100 г | |
| Лист | Соцветия | |
| T. mastichina (Светлячок) | 1,18 | 1,82 |
| T. striatus (Юбилейный) | 0,21±0,02 | 0,45±0,01 |
| T. vulgaris (Фантазия) | 0,1±0,01 | 0,41±0,03 |
Генетический анализ показал, что использованные нами шесть праймеров RAPD генерировали 81 ампликон с размером в основном от 200 до 1500 п.н. Количество полос в выбранных праймерах варьировало от 3 (OPA 5) до 7 (OPA 1, 3, 6). Из дендрограммы (рис. 4) видно, что T. mastichina (Светлячок) образовывал отдельный кластер. Значение его генетического сходства с T. striatus (Юбилейный) составило 0,72, а с T. vulgaris (Фантазия) – 0,78. Сходство между T. striatus (Юбилейный) и T. vulgaris (Фантазия) равнялось 0,86.
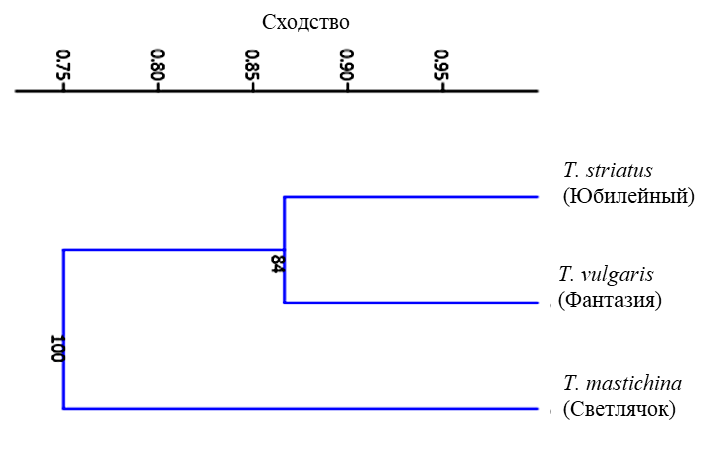
Рис. 4. Дендрограмма генетического сходства, построенная по результатам RAPD-ПЦР.
Исследованные нами сорта T. mastichina (Светлячок), T. striatus (Юбилейный) и T. vulgaris (Фантазия), полученные в НБС путем свободного переопыления, характеризовались общностью строения вегетативных и генеративных органов. Cовокупность морфолого-анатомических признаков (эпидермис с кутикулой, наличие кроющих трихом и железок, хорошо развитых механических тканей, небольшие листья) свидетельствует о ксероморфности данных сортов чабреца.
На фоне общих характеристик следует отметить отличительную морфологию и анатомию T. mastichina (Светлячок). У данного сорта стебли имели фиолетовую окраску, цветки – белую. Форма стебля не оценивалась нами как отличительный признак, поскольку из литературных данных известна ее изменчивость в зависимости от условий влагообеспеченности растений [17]. Листовые пластинки характеризовались большей опушенностью, площадью и отсутствием скрученности по краю, наличием колленхимы в области центральной жилки. T. striatus (Юбилейный) и T. vulgaris (Фантазия) по морфолого-анатомическим признакам были более близкими, однако сорт Фантазия (T. vulgaris) имел меньшую площадь листовой пластинки и характеризовался сниженным процентным содержанием эфирного масла сравнительно с сортом Юбилейный (T. striatus). Нами показано, что эфирное масло у исследованных растений накапливается во всех надземных органах, однако его количество органо-, и видоспецифично. Его наибольший процент выявлено в листьях и соцветиях T. mastichina (Светлячок), затем у T. striatus (Юбилейный) и T. vulgaris (Фантазия). В литературе для T. mastichina, произрастающего в Испании в июле месяце указывается вариация процентного содержания эфирного масла от 1,8 до 2,6 % [18], для T. striatus var. interruptus произрастающего в Турции – 0,39 %; 0,09 %; 1,27 %; 0,37 % в зависимости от месяца (май, июнь) и года сбора растений [19], для T. striatus Южной Албании в июне месяце – 2,2 % [20], и T. vulgaris собранного в июле в Румынии – 1,25 % [21]. Таким образом процентное содержание эфирного масла не только органо-, и видоспецифично, но также варьирует в зависимости от региона произрастания растений и месяца сбора. Более того, по данным литературы [22], у одного и того же вида отмечается тенденция к уменьшению содержания эфирного масла в зависимости от возраста – более зрелые растения имеют меньший выход.
Полученные нами морфолого-анатомические и биохимические данные хорошо согласуются с генетическим анализом и отдельной кластеризацией T. mastichina сорта Светлячок. T. striatus (Юбилейный) и T. vulgaris (Фантазия), являясь разными сортами и видами, характеризовались большим генетическим сходством.
ЗАКЛЮЧЕНИЕ
Нами показана общность строения вегетативных и генеративных органов сортов разных видов чабреца селекции НБС. Сходство проявлялось в наличии кутикулы, кроющих трихом и железистых структур на эпидерме вегетативных органов, форме листовых пластинок, анатомии стебля, листа и чашечки, наличии включений с эфирным маслом во внутренних тканях. В то же время, T. mastichina (Светлячок) имел отличительные признаки: стебли фиолетового цвета, листья больших размеров с ровным краем, белый венчик и большее процентное содержание эфирного масла в тканях листа и соцветий в пересчете на сырую массу T. striatus (Юбилейный) и T. vulgaris (Фантазия) характеризовались большим морфологическим сходством между собой. Тем не менее, T. striatus (Юбилейный) имел большую площадь листовых пластинок и процентное содержание эфирного масла в вегетативных и генеративных органах, сравнительно с T. vulgaris (Фантазия). Комплекс количественных и качественных характеристик подтвержден генетическим исследованием на основе RAPD-ПЦР.
REFERENCES
- Morales R. The history, botany and taxonomy of the genus Thymus, Thyme: the genus Thymus, 346 p. (edited by E. Stahl-Biskup, F. Saez. London, Taylor & Francis, 2002).
- Karaca М., İncea G., Aydin A., Elmasulu S. Y., Turgut K. Microsatellites for genetic and taxonomic research on thyme (Thymus L.), Turk. J. Biol., 39, 147 (2015). DOI:10.3906/biy-1406-20
- Ascensao L., Figueiredo A. C., Barroso J. G., Pedro L. L., Schripsema J., Deans S. G., Scheffer J. C. J. Plectranthus madagascariensis – morphology of the glandular trichomes, essential oil composition, and its biological activity, Internat. J. Plant Sci., 159, 31 (1998). DOI: 10.1086/297518
- Bartolucci F., Peruzzi L., Passalacqua N. Typification of names and taxonomic notes within the genus Thymus L. (Lamiaceae), Taxon, 62(3), 1308 (2013). DOI: 10.12705/626.1
- Rahimmalek M., Bahreininejad B., Khorrami M., Tabatabaei S.B.E. Genetic variability and geographic differentiation in Thymus daenensis subsp. daenensis, an endangered medicinal plant, as revealed by inter-simple sequence repeat (ISSR) markers, Biochem. Genet., 47, 831 (2009). DOI: 10.1007/s10528-009-9281-z.
- Dalir M., Safarnejad A. Morphological, molecular and phytochemical variation in some thyme genotypes, J. Medicinal Plants and By-products, 1, 41 (2017).
- Lawrence B. M., Tucker A. O. The genus Thymus as a source of commercial products, Thyme, the genus Thymus, 346 p. (edited by E. Stahl-Biskup, F. Sáez. London, Taylor & Francis, 2002).
- Razaei M., Safarnejad A., Arab M., Alamdari S. B. L., Dalir M. Investigation of morphologic variatio and essence value in several thyme native species (Thymus sp.) of Iran, J. Hortic. Sci., 30(3), 383 (2016). DOI: 10.22067/jhorts4.v30i3.30435
- Paliy A. E., Khlypenko L. A., Ezhov V. N., Vinogradov B. A. Sravnitelnyy analiz letuchikh soyedineniy efirnogo masla i etanolnogo ekstrakta chabretsa borozdchatogo (Thymus striatus Vahl.), Trudy Nikit. botan. sada, 133, 159 (2011) (in Russian).
- Carlen C. Breeding and cultivation of medicinal plants, Herbal medicines. Development and validation of plant‐derived medicines for human health, 519 p. (edited by G. Bagetta, M. Cosentino, M.T. Corasaniti, S. Sakurada. Boca Raton, CRC Press, 2012).
- Ozudogru E. A., Kaya E., Kirdok E., Issever-Ozturk S. In vitro propagation from young and mature explants of thyme (Thymus vulgaris and T. longicaulis) resulting in genetically stable shoots, In Vitro Cell. Dev. Biol. Plant., 47, 309 (2011). DOI 10.1007/s11627-011-9347-6
- Kutucalan D. A micromorphological study on the genus Thymus Lamiaceae in Turkey, Dissertation, 91 р. (Ankara, 2019).
- Al Karavi H. Osobennosti rosta, razvitiya i biokhimicheskogo sostava khozyaystvenno znachimykh predstaviteley roda Thymus L. v usloviyakh nechernozemnoy zony Rossiyskoy Federatsii, Dissertation, 158 p. (Moscow, 2018) (in Russian).
- Marko N. V., Logvinenko L. A., Shevchuk O. M., Feskov S. A. Annotirovannyy katalog aromaticheskikh i lekarstvennykh rasteniy kollektsii Nikitskogo botanicheskogo sada, 176 p. (Simferopol, IT «ARIAL», 2018) (in Russian).
- Isikov V. P., Rabotyagov V. D., Khlypenko L. A., Logvinenko L. E., Logvinenko L. A., Kutko S. P., Bakova N. N., Marko N. V. Introduktsiya i selektsiya aromaticheskikh i lekarstvennykh rasteniy: metodologicheskiye i metodicheckiye aspekty, 112 p. (Yalta, NBG-NSC, 2009) (in Russian).
- Hammer О., Harper D. A. T., Ryan P. D. PAST: Paleontological statistics software package for education and data analysis, Palaeontol. Electron., 4(1), 1 (2001).
- Abd Elbar O. H., Farag R. E., Shehata S. A. Effect of putrescine application on some growth, biochemical and anatomical characteristics of Thymus vulgaris L. under drought stress, Ann. Agri. Sci., 64, 129 (2019). DOI: https://doi.org/10.1016/j.aoas.2019.10.001.
- Cutillas A. B., Carrasco A., Martinez-Gutierrez R., Tomas V., Tudela J. Thymus mastichina L. essential oils from Murcia (Spain): composition and antioxidant, antienzymatic and antimicrobial bioactivities, PLoS ONE, 13(1), e0190790 (2018). DOI: https://doi.org/10.1371/journal.pone.0190790
- Husnu Can Baser K., Kurkcuoglu M., Tümen G. Essential oils of Thymus striatus Vahl var. interruptus Jalas from Turkey, J. Essent. Oil Res., 11(2), 253 (2011). DOI: 10.1080/10412905.1999.9701125
- Kontogiorgis C., Mpompou E.-M., Papajani-Toska V., Hadjipavlou-Litina D., Lazari D. Chemical composition and antioxidant activity of the essential oils isolated from Greek and Albanian Thymus species, J. Chem. Pharm. Res., 8(9), 180 (2016).
- Borugă O., Jianu C., Mişcă C., Goleţ I., Gruia A. T., Horhat F. G. Thymus vulgaris essential oil: chemical composition and antimicrobial activity, J. Med. Life, 7(Spec Iss. 3), 56 (2014).
- Hudaib M., Speroni E., Di Pietra A. M., Cavrini V. GC/MS evaluation of thyme (Thymus vulgaris L.) oil composition and variations during the vegetative cycle, J. Pharm. Biom. Anal., 29, 691 (2002). DOI: https://doi.org/10.1016/S0731-7085(02)00119-X



