Ученые записки Крымского федерального университета имени В. И. Вернадского
Биология. Химия. Том 11 (77). 2025. № 1. С. 29–40.
УДК 616.379-008.64: 57.084.1
DOI 10.29039/2413-1725-2025-11-1-29-40
БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ КРОВИ КРЫС ПОСЛЕ ПРИЕМА КУРСА ПРОБИОТИЧЕСКОГО МИКРОБНОГО КОНСОРЦИУМА НА ФОНЕ АЛЛОКСАН-ИНДУЦИРОВАННОГО ДИАБЕТА
Джелдубаева Э. Р., Ярмолюк Н. С., Ржевская В. С., Туманянц К. Н., Назырова Л. Э.
ФГАОУ ВО «Крымский федеральный университет им. В. И. Вернадского», Симферополь, Республика Крым, Российская Федерация
Е-mail: delviza@mail.ru
Целью данной работы явился анализ биохимических показателей крови крыс после введения пробиотического микробного консорциума (ПМК) на фоне аллоксан-индуцированного диабета. Измерены уровни глюкозы, белков, ферментов печени, липидного обмена и воспалительных маркеров.
Результаты исследования показали, что введение ПМК привело к незначительному снижению уровня глюкозы, частичному восстановлению функции печени (снижение АЛТ, АСТ) и почек (нормализация мочевины и креатинина), а также улучшению белкового и липидного обмена. Это свидетельствует о том, что ПМК оказывает гепатопротекторное и ренопротекторное действие. Данные подтверждают целесообразность использования пробиотиков в комплексной терапии диабета.
Ключевые слова: аллоксановый диабет, пробиотический микробный консорциум, биохимические показатели крови, крысы.
ВВЕДЕНИЕ
Сахарный диабет и его осложнения представляют одну из главных медико-социальных проблем XXI века. Данное заболевание сопровождается гипергликемией, нарушением обмена веществ, воспалительными процессами и поражением органов-мишеней (печень, почки, сердечно-сосудистая система и др.) [1–3]. На фоне изучения механизмов системных поражений органов при диабете особое внимание уделяется новым подходам к их профилактике и коррекции, которые могут стать эффективным дополнением к традиционной терапии.
Современные исследования показывают, что состояние микробиоты кишечника играет важную роль в регуляции углеводного обмена и системного воспаления [4, 5]. Одним из перспективных направлений является использование пробиотиков – микроорганизмов, которые способны модифицировать микрофлору, могут оказывать благоприятное воздействие на метаболические процессы, снижать уровень воспалительных цитокинов, корректировать инсулинорезистентность и уменьшать окислительный стресс [6]. Пробиотические микробные консорциумы (ПМК), состоящие из нескольких штаммов бактерий, демонстрируют более выраженный эффект по сравнению с монокомпонентными пробиотиками, что делает их особенно интересным объектом исследования.
Аллоксановый сахарный диабет является моделью, широко используемой в экспериментальной биологии и медицине для изучения патогенеза диабета и разработки методов лечения [7]. Аллоксан вызывает разрушение β-клеток поджелудочной железы, что приводит к развитию гипергликемии, аналогичной сахарному диабету 1 типа. Это сопровождается изменением биохимических показателей крови, включая повышение уровня глюкозы, нарушения липидного профиля и активности антиоксидантных систем [8]. Применение ПМК в таких условиях позволяет изучить их влияние на ключевые параметры метаболизма, что важно для понимания общего состояния организма.
Таким образом, изучение изменения биохимических показателей крови крыс с аллоксан-индуцированным диабетом под влиянием ПМК представляет актуальную и практически значимую задачу. Полученные результаты позволят лучше понять механизм действия ПМК и оценить их потенциал как средства комплексной терапии сахарного диабета.
В связи с вышеизложенным, целью данного исследования явилось выявление изменения биохимических показателей крови крыс после введения курса пробиотического микробного консорциума на фоне аллоксан-индуцированного диабета.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнялась в Центре коллективного пользования научным оборудованием «Экспериментальная физиология и биофизика» при кафедре физиологии человека и животных и биофизики в рамках программы исследований № АААА-А21-121011990099-6 «Физиологические механизмы биологического действия факторов разной природы и интенсивности» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского».
Эксперименты проводились на белых половозрелых крысах-самцах линии Wistar, которые были специально выведены для лабораторных исследований. Общая выборка составила 30 здоровых крыс, массой 300-350 грамм.
Согласно государственному стандарту РФ «ГОСТ 33216-2014, Руководство по содержанию и уходу за лабораторными животными, Правила содержания и ухода за лабораторными грызунами и кроликами, Правила оборудования помещений и организации процедур» – испытуемые животные содержались в адекватных условиях, в соответствии с тезисами вышеприведённого государственного норматива. В клетках присутствовал свободный доступ к воде и гранулированному комбикорму со сбалансированным содержанием белкового, жирового и углеводного баланса компонентов. Поение и кормление проводилось подконтрольно, согласно внутреннему распорядку работы вивария.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям этического комитета по биоэтике ФГАОУ ВО «Крымский федеральный университет им. В. И. Вернадского» (протокол № 5 от 2022 г.).
Животных разделили на 3 экспериментальные группы по 10 особей (рис. 1).
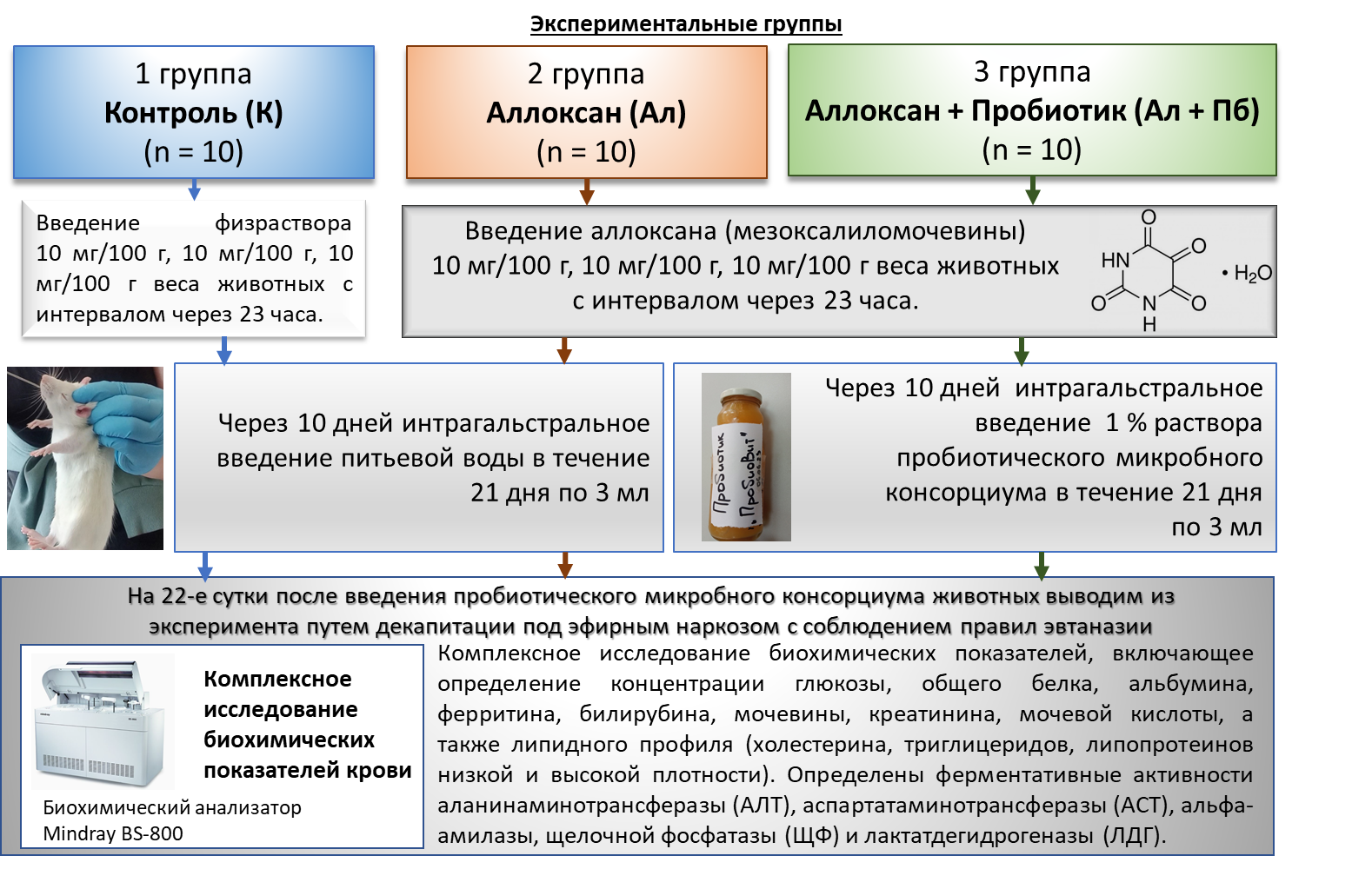
Рис. 1. План проведения экспериментального исследования.
В первой группе (Контроль, К) крысы содержались в стандартных условиях вивария, которым в течение 21 дня вводили по 3 мл питьевой воды.
У животных второй группы (Ал) за 10 дней до начала эксперимента был смоделирован аллоксановый диабет путем внутрибрюшинного введения аллоксана –моногидрата (C4H2N2O4·H2O; компания «Диаэм», Россия) в дозировке по 100 мг/кг в течение трех дней [9]. Далее в течение 21 дня им вводили интрагастрально с использованием желудочного орального зонда по 3 мл питьевой воды.
Животным третьей группы (Ал+Пб) также был смоделирован аллоксановый диабет, после чего на 11-й день начали вводить интрагастрально 1 % раствор ПМК по 3 мл в течение последующего 21 дня.
Синтез тестируемого ПМК проводился на кафедре ботаники и физиологии растений и биотехнологий ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского» под руководством Ржевской В. С. ПМК включал штаммы пробиотических микроорганизмов: Lactobacillus parabuchneri ВКМ В-3553D, Lactobacillus plantarum ВКМ В-3552D, Lactobacillus acidophilus ВКМ В-3563D, Enterococcus faecium ВКМ В-3551D, Brettanomyces bruxellensis ВКМ Y-3064D. Все штаммы микроорганизмов депонированы в Всероссийской коллекции микроорганизмов. Микробный консорциум получали путем совместного культивирования молочнокислых бактерий, энтерококка и дрожжей в жидкой питательной среде MRS в биореакторе Minifors 2 (Minifors 2 НТ, Швейцария) при температуре 32 °С и 50 об/ мин в течение 3-х суток. Учет численности микроорганизмов в консорциуме проводили методом предельных разведений. Биологическая концентрация бактерий микробного консорциума составила 1,3∙109 КОЕ.
На 22-е сутки животных выводили из эксперимента путем декапитации на гильотине («НПК Открытая наука, Россия») под эфирным наркозом. Кровь из шейных вен отбирали в вакуумные пробирки с разделительным гелем для сыворотки.
Биохимический анализ крови крыс провели автоматическим методом с использованием набора химических реактивов производства Mindray на анализаторе Mindray BS-800 (Shenzhen Mindray Bio-Medical Electronics Co., LTD; Китай)
Комплексное исследование биохимических показателей крови включало определение показателей углеводного (глюкоза, ммоль/л), белкового (общий белок, г/л; альбумин, г/л), мг/л), азотистого обменов (мочевина, ммоль/л; креатинин, мкмоль/л; мочевая кислота, мкмоль/л), ферментов печени, поджелудочной железы и других органов (аланинаминотрансфераза (АЛТ), ед/л; аспартатаминотрансфераза (АСТ), ед/л; щелочная фосфатаза (ЩФ), ед/л; альфа-амилаза, ед/л; лактатдегидрогеназа (ЛДГ), ед/л), липидного обмена (холестерин, ммоль/л; триглицериды (ТГ), ммоль/л; липопротеины низкой плотности (ЛПНП), ммоль/л; липопротеины высокой плотности (ЛПВП), ммоль/л)
Статистическую обработку и графическое представление экспериментальных данных проводили с использованием программ GraphPad Prism 8 (версия 8.4.3 (686) (GraphPad Software, США) и Microsoft Excel 2010 (Microsoft Corporation, США). Проверку распределения данных на нормальность осуществляли с помощью критерия Шапиро-Уилка. Поскольку распределение данных в подавляющем большинстве случаев не соответствовало нормальному, значимость различий между группами оценивали с помощью непараметрического критерия Краскела-Уоллиса. Множественные апостериорные сравнения значений показателей между группами проводили с помощью критерия Данна. В описании сравнения значений показателей в разных группах животных использовались %, которые рассчитывались по значениям медианы показателей соответствующих групп. Критический уровень значимости статистических гипотез (р) в данном исследовании принимали равным 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты исследования биохимических показателей крови крыс с аллоксан-индуцированным диабетом и после введения ПМК на фоне диабета показали значимые различия. У животных контрольной группы данные показатели находились в пределах нормативных значений [10] (табл. 1).
Таблица 1.
Биохимические показатели крови крыс в контроле (К), с аллоксан-индуцированным диабетом (Ал) и при дополнительном введении пробиотического микробного консорциума крысам на фоне аллоксанового диабета (Ал+Пр)
| Показатели | Экспериментальные группы | ||
| К | Ал | Ал + Пр | |
| Глюкоза, моль/л | 5,17 (5,01; 5,17) | 19,08 (16,97; 24,83) р < 0,04 | 15,08 (9,71; 17,72) р < 0,05 |
| Мочевина, ммоль/л | 7,65 (7,65; 8,47) | 13,50 (10,39; 14,66) р < 0,05 | 15,51 (15,43; 17,48) р < 0,02 |
| Креатинин, мкмоль/л | 40,60 (37,60 40,60) | 71,10 (69,30; 84,30) р < 0,05 | 42,40 (37,60; 69,30) |
| Общий белок, г/л | 65,40 (65,40; 67,00) | 57,40 (50,80; 61,80) | 59,20 (54,70; 60,20) |
| Билирубин общий, мкмоль/л | 1,05 (1,05; 1,58) | 1,53 (0,99; 18,28) | 1,45 (1,38; 1,53) |
| Аланинаминотрансфераза (АЛТ), ед/л. | 161,60 (118,00; 161,60) | 1053,30 (696,40; 1108,40) р < 0,05 | 256,70 (124,70; 296,60) |
| Аспартатаминотрансфераза (АСТ), ед/л. | 521,80 (521,80; 558,30) | 1077,50 (503,60; 2166,00) | 236,20 (233,60; 1113,10) |
| Альфа-амилаза, ед/л. | 614,00 (545,40; 714,00) | 1358,88 (882,90; 1532,80) | 1109,9 (1076,80; 1487,00) |
| Щелочная фосфатаза (ЩФ), ед/л. | 248,40 (248,40; 706,20) | 699,30 (515,40; 1218,10) | 1021,00 (695,20; 1354,00) |
| Холестерин, моль/л | 1,13 (1,13; 1,22) | 1,26 (1,10; 1,31) | 1,36 (1,25; 1,39) |
| Триглицериды (ТГ), ммоль/л | 0,97 (0,97; 1,85) | 0,91 (0,59; 1,06) | 1,34 (1,22; 1,40) |
| Липопротеины низкой плотности (ЛПНП), ммоль/л | 0,30 (0,20; 0,30) | 0,36 (0,35; 0,48) р < 0,05 | 0,28 (0,19; 0,47) |
| Липопротеины высокой плотности (ЛПВП), ммоль/л | 0,78 (0,43; 0,78) | 0,66 (0,54; 0,81) | 0,63 (0,54; 0,63) |
| Лактатдегидрогеназа (ЛДГ), ед/л. | 3676,80 (2543,00; 3676,80) | 1486,30 (1180,70; 2244,10) | 1859,90 (1194,90; 3662,00) |
| Мочевая кислота, мкмоль/л | 218,10 (218,10; 239,80) | 280,40 (246,50; 312,30) | 197,70 (186,60; 306,10) |
| Альбумин, г/л | 32,40 (30,10; 32,40) | 26,00 (20,00; 27,40) р < 0,05 | 22,20 (20,00; 24,90) р < 0,05 |
Примечание: Указаны медианы нижнего и верхнего квартилей (Me (Q25:Q75)). р<0,05 – достоверность различий по сравнению со значениями контрольной группы животных по критерию Данна.
Анализ биохимических показателей крови у крыс второй группы (Ал) показал значимое увеличение уровня глюкозы в 2,98 раз (p < 0,05) относительно контроля (рис. 2), что свидетельствует о том, что аллоксан вызывает разрушение β-клеток поджелудочной железы, приводя к резкому увеличению уровня глюкозы в крови и развитию гипергликемии, характерной для модели сахарного диабета [11]. Уровни общего белка и альбумина были ниже на 14,40 % (p < 0,05) и на 21,71 % (p < 0,05) по сравнению с контролем, что указывает на ухудшение белкового обмена и катаболизма при диабете, что может быть результатом протеинурии или метаболического дисбаланса [12].
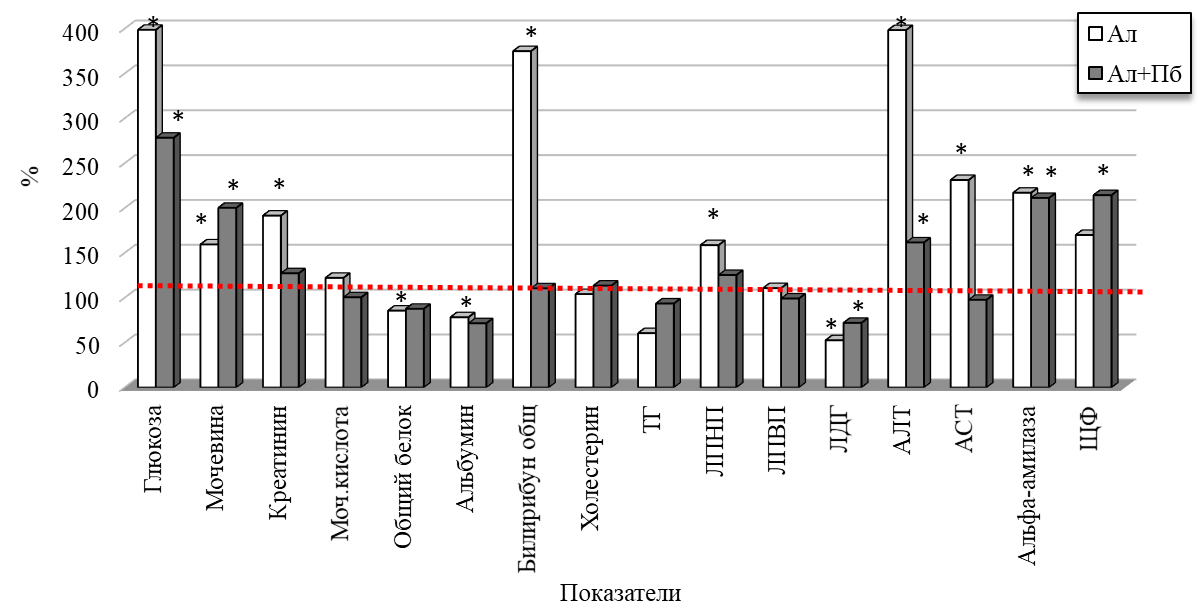
Рис. 2. Изменение биохимических показателей крови крыс с аллоксан-индуцированным диабетом (Ал) при введении пробиотического микробного консорциума (по сравнению с показателями контрольной группы животных, принятых за 100 %).
Показатели мочевины и креатинина увеличились на 59,43 % (p < 0,05) и 91,56 % (p < 0,05) относительно контроля, что указывает на нарушение азотистого обмена, снижение клубочковой фильтрации и почечной функции, что может быть вследствие развития диабетической нефронопатии [13]. Также отмечается увеличение общего билирубина (на 387,25 %), АЛТ (на 402,47 %; p < 0,05) и АСТ (на 131,28 %, p < 0,05) относительно контроля, что указывает на выраженную печеночную дисфункцию. Так, в работе [14] показано, что при диабете наблюдается стеатогепатит, что сопровождается повреждением гепатоцитов и повышением печеночных ферментов.
Уровни холестерина и ЛПНП увеличились на 4,11 % и на 58,60 % (p < 0,05) по сравнению с контролем, а ЛДГ снизился на 47,36 %. Нарушение липидного обмена при диабете связано с инсулинорезистентностью, что приводит к повышению ЛПНП и снижению ЛПВП [15].
Таким образом, полученные данные у крыс второй группы (Ал) подтверждают успешное моделирование сахарного диабета с развитием характерных метаболических нарушений, включая гипергликемию, дисфункцию печени и почек, ухудшение белкового и липидного обмена, а также изменения воспалительных маркеров.
У крыс третьей группы (Ал+Пб), которым проводилось введение 21-суточного курса ПМК на фоне аллоксанового диабета, уровень глюкозы в крови был выше контроля на 178,39 % (p < 0,05), но ниже уровня группы Ал, что показывает незначительное гипогликемическое действие ПМК. Уровень мочевины и креатинина увеличился на 100,25 % (p < 0,05) и на 27,28 % (p < 0,05) по сравнению с показателями животных контрольной группы, что может быть связано с активным выведением азотистых продуктов распада и частичном восстановлении почечной функции. Показатель мочевой кислоты снизился до 230 мкмоль/л, что близко к контрольным значениям. Незначительное восстановление уровня общего белка (снижение на 12,34 % относительно контроля) свидетельствует о частичном восстановлении белкового метаболизма. Уровень альбумина на 28,43 % (p < 0,05) ниже контроля, что говорит о продолжающихся нарушениях. Уровень общего билирубина был выше контроля на 10,52 %, АЛТ – на 61,66 %, АСТ близок к контрольным значениям, подтверждая гепатопротекторное действие ПМК. Уровень α-амилазы незначительно снизился относительно значений у крыс группы Ал (на 111,24 % (p < 0,05) выше контроля), что указывает на частичное восстановление. Уровень ЩФ увеличился до 1021,00 ед/л, что указывает на продолжающиеся метаболические нарушения. Уровни холестерина и ЛПНП увеличились на 13,48 % и 25,33 % соответственно относительно контрольных значений. При введении крысам, больным сахарным диабетом, ПМК, наблюдается увеличение уровня ЛДГ до 1859,90 ед/л (что на 28,01 % ниже контроля), это указывает на частичное восстановление энергетического метаболизма.
Следовательно, введение ПМК незначительно снижает уровень глюкозы, демонстрируя слабый гипогликемический эффект. В литературе имеются данные о гипогликемическом эффекте пробиотиков, который связан с восстановлением состава кишечной микробиоты и увеличением выработки короткоцепочечных жирных кислот (КЖК), способствующих улучшению чувствительности к инсулину [16, 17]. Подобные результаты ранее были продемонстрированы в исследованиях, где использование пробиотиков Lactobacillus acidophilus и Lactobacillus casei способствовало снижению гипергликемии у животных при разных моделях диабета [16].
Введение ПМК частично восстанавливает уровень альбумина и общего белка, улучшая белковый обмен, что связано с нормализацией кишечной микробиоты, улучшающей усвоение питательных веществ. Данные согласуются с исследованиями [19], где пробиотики способствовали улучшению абсорбции аминокислот и коррекции белкового дисбаланса у животных с метаболическими нарушениями.
У крыс третьей группы снижен уровень АЛТ по сравнению со второй группой, что подтверждает гепатопротекторный эффект пробиотика. Однако эти показатели остаются выше нормы, что говорит о продолжающемся повреждении печени, но с тенденцией к восстановлению. Нормализация уровня билирубина (уменьшение до контрольных значений) также указывает на улучшение функции печени. Данные находят подтверждение в работе [20], в которой показано, что пробиотики способствуют уменьшению воспалительных процессов в печени при неалкогольной жировой болезни печени и диабете.
Введение ПМК частично восстанавливает уровней мочевины и креатинина, что говорит о ренопротекторном действии. Несмотря на то, что данные показатели остаются выше нормы, их снижение по сравнению с группой Ал свидетельствует о частичном восстановлении почечной функции. Влияние пробиотиков на почки может быть связано с улучшением детоксикационной функции кишечника, снижением эндотоксинов и воспалительного ответа [21]. Исследования Andrade-Oliveira et al. [22] показывают, что метаболиты пробиотических бактерий способствуют улучшению функции почек и уменьшению оксидативного стресса. Также показано, что введение ПМК снижает уровень ЛПНП и стабилизирует липидный профиль, что свидетельствует о восстановлении окислительных процессов в тканях.
Нормализация биохимических показателей частично обусловлена улучшением состава микрофлоры. ПМК способствует восстановлению численности бифидо- и лактобактерий, которые играют ключевую роль в метаболизме глюкозы, воспалительных процессах и защите слизистой кишечника.
Таким образом, введение ПМК в условиях аллоксан-индуцированного диабета у крыс оказывает многофакторное положительное влияние на метаболические процессы, проявляя слабое гипогликемическое, гепато- и ренопротекторное действие, а также способствует нормализации липидного и белкового обмена. Эти данные согласуются с ранее опубликованными исследованиями о роли пробиотиков в регуляции оси «кишечник-мозг-метаболизм», что подтверждает перспективность дальнейшего изучения их применения в комплексной терапии диабета для коррекции его осложнений и улучшения метаболического состояния организма.
ЗАКЛЮЧЕНИЕ
У животных с аллоксан-индуцированным диабетом наблюдается выраженная гипергликемия, дисфункция печени и почек, ухудшение белкового и липидного обмена, а также изменения воспалительных маркеров. Эти данные подтверждают успешное моделирование сахарного диабета.
Введение 21-суточного курса пробиотического микробного консорциума на фоне аллоксан-индуцированного диабета у крыс оказывает положительное влияние на ключевые метаболические показатели. Применение ПМК способствует частичному восстановлению функции печени и почек, а также нормализует липидный и белковый обмен. Эти данные согласуются с ранее опубликованными исследованиями о роли пробиотиков в регуляции оси «кишечник-мозг-метаболизм», подчеркивая перспективность пробиотиков в комплексной терапии диабета. Однако для более глубокого понимания механизмов их действия необходимы дальнейшие исследования.
Работа выполнена на оборудовании ЦКП «Экспериментальная физиология и биофизика» в рамках инициативной темы № АААА-А21-121011990099-6 «Физиологические механизмы биологического действия факторов разной природы и интенсивности» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского».
Список литературы
- Henning R. J. Type-2 diabetes mellitus and cardiovascular disease / R. J. Henning // Future Cardiol. – 2018. – V. 14(6). – P. 491–509. doi: https://doi.org/10.2217/fca-2018-0045
- Дедов И. И. Сахарный диабет / И. И. Дедов, М. В. Шестакова, А. Ю. Майоров, М. Ш. Шамхалова // Сахарный диабет. – 2020. – Т. 23. – С. 42–114. doi: 10.14341/DM12505.
- Кураева Т. Л. Распространенность факторов социального риска у детей и подростков с сахарным диабетом 1 типа (СД1) в России, их связь с недостаточным метаболическим контролем / Т. Л. Кураева, А. В. Карпушкина, Е. А. Андрианова [и др.] // Сахарный диабет. – 2024. – № 27(5). – С. 401–410. https://doi.org/10.14341/DM12939
- Демидова Т. Ю. Абнормальная кишечная микробиота и нарушение инкретинового эффекта как причины развития сахарного диабета 2 типа / Т. Ю. Демидова, К. Г. Лобанова, Т. Н. Короткова, Л. Д. Харчилава // Медицинский вестник Юга России. – 2022. – Т. 13, № 1. – С. 24–42. doi: 10.21886/2219-8075-2022-13-1-24-42.
- Демидова Т. Ю. Влияние кишечной микробиоты на развитие инсулинорезистентности / Т. Ю. Демидова, К. Г. Лобанова, Н. С. Шевцова, Т. Н. Короткова, А. С. Кочина // Медицинский Совет. – 2022. – Т. 10. – С. 84–95. doi: 10.21518/2079-701X-2022-16-10-84-95.
- Парфенов А. И. Значение повышенной проницаемости кишечника в патогенезе внутренних болезней / А. И. Парфенов // Терапевтический архив. – 2024. – Т. 96, № 2. – С. 85–90. doi: 10.26442/00403660.2024.02.202587.
- Gati M. A. Physiological and histological study of experimental diabetes mellitus by alloxan / M. A. Gati // Int. J. Adv. Res. – 2016. – Vol. 4, No. 3. – P. 1814–1818.
- Биджиева Ф. А. Биохимические особенности аллоксан индуцированного сахарного диабета / Ф. А. Биджиева // Медицинский алфавит. – 2018. – Т. 31, № 2. – С. 12–14.
- Данилова И. Г. Способ моделирования аллоксанового диабета / И. Г. Данилова, И. Ф. Гетте: Патент на изобретение № 2534411; заявл. 27.11.2014; опубл. 27.11.2014. – Бюл. № 33.
- Макаров В. Г. Справочник. Физиологические, биохимические и биометрические показатели нормы экспериментальных животных / под ред. В. Г. Макарова, М. Н. Макаровой // СПБ.: Изд-во «ЛЕМА». – 2013. – 116 с.
- Lenzen S. The mechanisms of alloxan- and streptozotocin-induced diabetes. / S. Lenzen // Diabetologia. – 2008. – V. 51(2). – C. 216–226.
- Reaven G. M. The insulin resistance syndrome: Definition and dietary approaches to treatment / G. M. Reaven // Annual Review of Nutrition. – 2005. – V. 25. – P. 391–406.
- Kanwar Y. S. A glimpse of various pathogenetic mechanisms of diabetic nephropathy / Y. S. Kanwar, L. Sun, P. Xie, F. Y. Liu, S. Chen // Annual Review of Pathology: Mechanisms of Disease. – 2011. – V. 6. – P. 395–423.
- Targher G. Nonalcoholic fatty liver disease: A novel cardiometabolic risk factor for type 2 diabetes and its complications / G. Targher, C. D. Byrne // Diabetes Care. – 2013. – V. 36, № 5. – P. 1257–1263.
- Goldberg I. J. Triglycerides and heart disease: Still a hypothesis? / I. J. Goldberg, R. H. Eckel, R. McPherson // Arteriosclerosis, Thrombosis, and Vascular Biology. – 2011. – V. 31, № 8. – P. 1716–1725.
- Yadav H. Antidiabetic effect of probiotic dahi containing Lactobacillus acidophilus and Lactobacillus casei in high fructose fed rats / H. Yadav, S. Jain, P. R. Sinha // Nutrition. – 2008. – V. 24, № 5. – P. 430–436.
- Everard A. Diabetes, obesity and gut microbiota / A. Everard, P. D. Cani // Best Practice & Research Clinical Gastroenterology. – 2013. – V. 27, № 1. – P. 73–83.
- Vallianou N. G. Probiotics and inflammation: A review of the evidence / N. G. Vallianou, T. Stratigou, G. S. Christodoulatos, M. Dalamaga // Frontiers in Nutrition. – 2020. – V. 7. – P. 42.
- Hagihara M. The impact of probiotic Clostridium butyricum MIYAIRI 588 on murine gut metabolic alterations / M. Hagihara, R. Yamashita, A. Matsumoto [et al.] // Journal of Infection and Chemotherapy. – 2019. – V. 25, № 8. – P. 571–577. doi: 10.1016/j.jiac.2019.02.008.
- Tarantino G. Metabolic syndrome and non-alcoholic fatty liver disease: Further evidence from the gut–liver axis link / G. Tarantino, C. Finelli, A. Hines // Expert Review of Gastroenterology & Hepatology. – 2019. – V. 13, № 5. – P. 473–484. doi: 10.1016/j.mce.2015.02.018.
- Ranganathan N. Probiotic dietary supplementation in patients with stage 3 and 4 chronic kidney disease: A 6-month pilot scale trial / N. Ranganathan, E. A. Friedman, P. Tam [et al.] // Nutrients. – 2017. – V. 9, № 6. – P. 439. doi: 10.1185/03007990903069249.
- Andrade-Oliveira V. Adipokines as drug targets in diabetes and underlying disturbances / V. Andrade-Oliveira, N. S. Câmara, P. M. Moraes-Vieira // J Diabetes Res. – 2015. – Article ID 681612.
doi: 10.1155/2015/681612.
BIOCHEMICAL BLOOD PARAMETERS OF RATS AFTER A COURSE OF PROBIOTIC MICROBIAL CONSORTIUM ADMINISTRATION AGAINST THE BACKGROUND OF ALLOXAN-INDUCED DIABETES
Dzheldubaeva E. R., Yarmolyuk N. S., Rzhevskaya V. S., Tumanyants K. N., Nazyrova L. E.
V. I. Vernadsky Crimean Federal University, Simferopol, Russian Federation
E-mail: delviza@mail.ru
Diabetes mellitus is a complex metabolic disorder accompanied by chronic hyperglycemia and systemic damage to target organs, including the liver, kidneys, and cardiovascular system. One of the urgent challenges of modern experimental and clinical medicine is the search for new therapeutic agents that can complement standard approaches to the treatment and prevention of diabetes-related complications. In this context, special attention is given to the role of gut microbiota and the possibility of its targeted modulation through the use of probiotics.
The aim of the present study was to assess the effect of a probiotic microbial consortium (PMC), including strains of Lactobacillus parabuchneri, L. plantarum, L. acidophilus, Enterococcus faecium, and Brettanomyces bruxellensis, on the biochemical blood parameters of rats with alloxan-induced diabetes mellitus. The experiment was carried out on Wistar albino rats, which were divided into three groups: a control group, a diabetic group, and a diabetic group receiving a 21-day course of PMC after alloxan-induced diabetes modeling.
The obtained results showed that alloxan administration caused persistent hyperglycemia, disturbances in protein, nitrogen, and lipid metabolism, and a significant increase in hepatic enzyme activity, reflecting the systemic nature of metabolic shifts in diabetes. Administration of the PMC contributed to a reduction in blood glucose levels, partial restoration of total protein and albumin levels, normalization of creatinine, uric acid, and urea concentrations, as well as decreased alanine and aspartate aminotransferase activity. Moreover, there was a trend towards improvement in lipid profiles, including cholesterol and low-density lipoprotein levels.
Thus, PMC administration in the context of alloxan-induced diabetes positively affects key biochemical parameters, demonstrating moderate hypoglycemic, hepatoprotective, and renoprotective effects. These findings support the advisability of using probiotics as an adjunctive therapy for correcting metabolic disturbances in diabetes mellitus. Further research is required to clarify the molecular mechanisms of PMC action and evaluate its therapeutic potential under conditions of chronic hyperglycemia.
Keywords: alloxan-induced diabetes, probiotic microbial consortium, biochemical blood parameters, rats.
References
- Henning R. J. Type-2 diabetes mellitus and cardiovascular disease, Future Cardiol., 14(6), 491 (2018) doi: https://doi.org/10.2217/fca-2018-0045
- Dedov I. I., Shestakova M. V., Mayorov A. Yu., Shamkhalova M. Sh. Diabetes mellitus, Diabetes Mellitus, 23, 42 (2020). doi: 10.14341/DM12505.
- Kuraeva T. L., Karpushkina A. V., Andrianova E. A., et al. Prevalence of social risk factors in children and adolescents with type 1 diabetes mellitus (DM1) in Russia, their association with insufficient metabolic control, Diabetes Mellitus, 27(5), 401 (2024) https://doi.org/10.14341/DM12939
- Demidova T. Y., Lobanova K. G., Korotkova T. N., Kharchilava L. D. Abnormal intestinal microbiota and violation of the incretin effect as the causes of diabetes mellitus type 2, Medical Bulletin of the South of Russia, 13, 1, 24 (2022). doi: 10.21886/2219-8075-2022-13-1-24-42.
- Demidova T. Yu., Lobanova K. G., Shevtsova N. S., Korotkova T. N., Kochina A. S. Influence of intestinal microbiota on the development of insulin resistance, Medical Council., 10, 84 (2022)
doi: 10.21518/2079-701X-2022-16-10-84-95. - Parfenov A. I. Significance of increased intestinal permeability in the pathogenesis of internal diseases, Therapeutic archive, 96, 2, 85 (2024) doi: 10.26442/00403660.2024.02.202587.
- Gati M. A. Physiological and histological study of experimental diabetes mellitus by alloxan, Int. J. Adv. Res., 4, 3, 1814 (2016).
- Bidzhieva F. A. Biochemical features of alloxan induced diabetes mellitus, Medical Alphabet., 31, 2, 12 (2018).
- Danilova I. G., Gette I. F. Method of modeling alloxan diabetes, Patent for invention No. 2534411; avv. 27.11.2014; publ. 27.11.2014., Bulletin No. 33.
- Makarov V. G. Reference book. Physiological, biochemical and biometric indicators of the norm of experimental animals, edited by V. G. Makarov, M. N. Makarova, 116 (St. Petersburg: Izdvo “LEMA”. – 2013).
- Lenzen S. The mechanisms of alloxan- and streptozotocin-induced diabetes, Diabetologia, 51(2), 216 (2008).
- Reaven G. M. The insulin resistance syndrome: Definition and dietary approaches to treatment, Annual Review of Nutrition, 25, 391 (2005).
- Kanwar Y. S., Sun L., Xie P., Liu F. Y., Chen S. A glimpse of various pathogenetic mechanisms of diabetic nephropathy, Annual Review of Pathology: Mechanisms of Disease, 6, 395 (2011).
- Targher G., Byrne C. D. Nonalcoholic fatty liver disease: A novel cardiometabolic risk factor for type 2 diabetes and its complications, Diabetes Care, 36, 5, 1257 (2013).
- Goldberg I. J., Eckel R. H., McPherson R. Triglycerides and heart disease: Still a hypothesis? Arteriosclerosis, Thrombosis, and Vascular Biology, 31, 8, 1716 (2011).
- Yadav H., Jain S., Sinha P. R. Antidiabetic effect of probiotic dahi containing Lactobacillus acidophilus and Lactobacillus casei in high fructose fed rats, Nutrition., 24, 5, 430 (2008).
- Everard A., Cani P. D. Diabetes, obesity and gut microbiota, Best Practice & Research Clinical Gastroenterology, 27, 1, 73 (2013).
- Vallianou N. G., Stratigou T., Christodoulatos G. S., Dalamaga M. Probiotics and inflammation: A review of the evidence, Frontiers in Nutrition., 7, 42. (2020).
- Hagihara M., Yamashita R., Matsumoto A. [et al.] The impact of probiotic Clostridium butyricum MIYAIRI 588 on murine gut metabolic alterations, Journal of Infection and Chemotherapy., 25, 8, 571 (2019). doi: 10.1016/j.jiac.2019.02.008.
- Tarantino G., Finelli C., Hines A. Metabolic syndrome and non-alcoholic fatty liver disease: Further evidence from the gut–liver axis link, Expert Review of Gastroenterology & Hepatology., 13, 5, 473 (2019). doi: 10.1016/j.mce.2015.02.018.
- Ranganathan N., Friedman E. A., Tam P., et al. Probiotic dietary supplementation in patients with stage 3 and 4 chronic kidney disease: A 6-month pilot scale trial, Nutrients., 9, 6, 439 (2017).
doi: 10.1185/03007990903069249. - Andrade-Oliveira V., Câmara N. S., Moraes-Vieira P. M. Adipokines as drug targets in diabetes and underlying disturbances, J Diabetes Res., Article ID 681612 (2015) doi: 10.1155/2015/681612.

