Ученые записки Крымского федерального университета имени В. И. Вернадского
Биология. Химия. Том 11 (77). 2025. № 2. С. 132–144.
УДК 631.465:631.466
DOI 10.29039/2413-1725-2025-11-2-132-144
МИКРОБИОЛОГИЧЕСКИЕ И БИОХИМИЧЕСКИЕ СВОЙСТВА ПОЧВ ПРИ РАЗНЫХ СРОКАХ ПРИМЕНЕНИЯ СИСТЕМЫ ОРГАНИЧЕСКОГО ЗЕМЛЕДЕЛИЯ
Институт проблем экологии и недропользования АН РТ, Казань, Россия
Е-mail: viksoil@mail.ru
Проведено сравнение биологических свойств почв между хозяйствами, применяющими органическую систему земледелия в течение разного времени (5, 10 и 25 лет), и хозяйствами с традиционной системой земледелия и фоновыми участками, расположенными в непосредственной близости. Показано, что среди изученных параметров почв наиболее чувствительным к длительности применения органической системы земледелия является фермент фосфатаза, активность которого закономерно и статистически значимо изменяется со временем. Численность азотобактера в случае недостаточного увлажнения почв не проявляет себя в качестве индикатора. Численность трофических групп микроорганизмов в почвах статистически значимо изменяется по сезонам года, но отличия между органическими и традиционными полями проявляются только на уровне тенденции. Эколого-трофические индексы в качестве индикаторов требуют дополнительных исследований.
Ключевые слова: почва, органическое земледелие, ферментативная активность, трофические группы микроорганизмов, эколого-трофические индексы.
ВВЕДЕНИЕ
Развитие органического земледелия призвано способствовать не только получению экологически чистых продуктов питания, оно задумывалось, как способ обеспечить благоприятное состояние окружающей среды, сохранения и восстановления плодородия почв. В «Стратегии развития производства органической продукции в Российской Федерации до 2030 года», утвержденной распоряжением Правительства Российской Федерации от 4 июля 2023 г. № 1788-р подчеркивается, что органическое сельское хозяйство оказывает содействие в решении глобальных проблем, таких как смягчение негативных последствий изменения климата, сохранение биоразнообразия.
Органическое земледелие способствует получению пусть не самых высоких, но стабильных (устойчивых) урожаев, менее зависящих от колебаний погодных условий, чем при традиционном земледелии, использующем минеральные удобрения и пестициды [1, 2]. При перечислении факторов, обеспечивающих устойчивость агроэкосистем при органическом земледелии, обычно упоминают увеличение содержания гумуса, улучшение структуры почв при внесении органических удобрений и использовании правильных севооборотов [3–5]. Но это не все. Главным отличием органической агроэкосистемы от традиционной является восстановление полезной мезофауны, сбалансированного микробного и ферментного пулов почв, не подвергающихся воздействию искусственных удобрений и пестицидов [6, 7]. Именно они способствуют созданию динамического равновесия в системе почва-растения, приводящего к устойчивости агроэкосистемы.
Сертификат органического земледелия выдается после трехлетнего конверсионного периода, гарантирующего отсутствие остаточных количеств пестицидов и химических удобрений. Однако почва – самый медленно изменяющийся элемент наземных биогеоценозов. Перестроение и стабилизация взаимосвязей в почвенной экосистеме требует времени, длительность которого не определена до сих пор. По этой причине изучение изменения микробного и ферментативного пулов во времени при переходе к органическому земледелию по-прежнему остается актуальной задачей.
Цель данной работы – сравнить микробиологические и биохимические свойства почв при разных сроках применения системы органического земледелия.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования послужили земли трех фермерских хозяйств Республики Татарстан, использующих органическую систему земледелия на протяжении разного времени:
- Фермерское хозяйство в Арском районе, близ с. Новый Кинер, органическое земледелие применяется 5 лет;
- Высокогорский район близ с. Большие Ковали, срок применения органического земледелия 10 лет;
- Мензелиский район, близ с. Холодный ключ – органическая система земледелия практикуется более 25 лет.
Отбор смешанных образцов из пахотного горизонта произведен в конце мая – начале июня, а также в сентябре 2024 г. Почвенные образцы отбирались на полях органических хозяйств, соседних традиционных (применяющих минеральные удобрения и пестициды), а также на необрабатываемых фоновых участках.
Почвы хозяйств относятся к разным типам: в Арском и Высокогорской районах – серые лесные, в Мензелинском – черноземы типичные. Сравнивать напрямую величины микробного и ферментативного пулов в почвах разных районов было бы некорректно. Однако сравнивались не они, а разница свойств почв органических полей и расположенных по соседству традиционных полей и фоновых участков в каждом районе. Рабочая гипотеза предполагала, что, чем дольше применяется система органического земледелия, тем значительнее должна быть разница между почвами органических и традиционных полей, и ближе показатели органических полей и фоновых участков.
Определение численности трофических групп микроорганизмов проводилось при помощи посева разведениями почвенных взвесей на плотных питательных средах, Azotobacter – методом обрастания комочков на среде Эшби [8].
Ферментативную активность почв определяли с применением следующих методов: каталазы – методом Джонсона и Темпле, инвертазы – по Щербакову Т. А., фосфатазы – по методу Геллера И. Т. и Гинзбург К. Е.
В качестве эколого-трофических индексов были выбраны три коэффициента.
- Коэффициент минерализации и иммобилизации по Е. Н. Мишустину
Кмин=КАА/МПА,
где КАА – численность амилолитических микроорганизмов почвы, определяемых посевом на крахмал-аммиачном агаре; МПА – численность аммонификаторов, определяемых посевом на мясо-пептонном агаре.
2. Коэффициент гумификации
Кгум=(КАА+МПА)/Авт,
где Авт – численность автохтонной микрофлоры почв.
3.Коэффициент трансформации органических соединений
Ктр=(МПА+КАА)×(МПА/КАА).
Оценка статистической значимости разницы проводилась с использованием различных непараметрических и параметрических критериев и способов обработки данных.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Биохимические показатели
Установлено, что ферментативная активность почв органических полей после 5 лет применения органической системы земледелия ниже, чем на полях с традиционной системой земледелия (табл. 1), хотя разница статистически значима только для фосфатазы (t-тест, p<0,05).
После 10 лет средняя активность инвертазы и фосфатазы выше в почвах органических полей, хотя статистическая обработка показывает, что для всех ферментов разница между органическими и традиционными полями незначима.
Через 25 лет активность фосфатазы статистически значимо выше на органических полях по сравнению с традиционными и в весенний, и в осенний период, инвертазы – только в осенний (табл. 1).
Полученные результаты согласуются с литературными данными. Согласно исследованиям Куликовой А. Х. с соавторами и Калашникова Р. П. с соавторами внесение азотных удобрений способствует улучшению азотного питания и стимулированию активности фосфатазы [9, 10]. По этой причине в первые 5 лет перехода к органической системе активность фосфатазы на органических полях, где синтетические удобрения не вносились, была ниже, чем на традиционных полях. Однако далее при отсутствии регулярного допинга в виде минеральных удобрений вступают в силу механизмы саморегуляции в экосистеме. При недостатке подвижного фосфора в почве увеличивается поступление в почву фосфатаз микробного и растительного происхождения [11], с чем связано статистически значимое преобладание их количества на полях с 25-летним использованием органической системы земледелия.
Таблица 1
Ферментативная активность почв при разных сроках применения системы органического земледелия, M±m
| Система земледелия | Инвертаза, мг глюкозы /1г почвы за 4 часа | Фосфатаза Р2О5 мг/10г почвы за 24 часа | Каталаза мл 0,1 н KMnO4 за 20 мин | ||||
| весна | осень | весна | осень | весна | осень | ||
| Арский район (5 лет) | |||||||
| Традиционная | 5,5±0,4 | 4,6±0,2 | 4,8±0,1* | 4,8±0,1 | 2,3±0,1 | 2,7±0,0 | |
| Органическая | 4,4±0,1 | 4,4±0,2 | 4,0±0,3 | 3,8±0,4 | 2,1±0,1 | 2,7±0,1 | |
| Фон | 5,2±0,0 | 5,2±0,1 | 4,7±0,1 | 4,9±0,1 | 2,9±0,1 | 2,3±0,1 | |
| Высокогорский район (10 лет) | |||||||
| Традиционная | 5,8±0,0 | 3,6±0,3 | 3,0±0,4 | 2,7±0,2 | 2,2±0,1 | 3,3±0,3 | |
| Органическая | 6,0±0,1 | 4,0±0,4 | 4,1±0,9 | 3,0±0,6 | 2,0±0,2 | 3,0±0,5 | |
| Фон | 8,0±1,2 | 7,2±0,7 | 5,6±0,7 | 4,4±0,2 | 3,0±0,1 | 3,0±0,3 | |
| Мензелинский район (свыше 25 лет) | |||||||
| Традиционная | 7,0±0,1 | 5,6±0,0 | 9,7±0,1 | 8,5±0,1 | 3,7±0,0 | 3,9±0,1 | |
| Органическая | 8,0±0,5 | 7,2±0,6 | 10,9±0,3 | 11,4±0,4 | 3,8±0,1 | 3,9±0,0 | |
| Фон | 13,8±0,0 | 11,2±0,1 | 10,3±0,1 | 8,5±0,1 | 4,2±0,0 | 4,1±0,0 | |
* статистически значимая разница между органическими и традиционными полями
** отсутствие статистически значимой разницы между фоном и органическими полями
Активность каталазы на органических и традиционных полях не имела статистически значимых отличий ни в одном из хозяйств. Это согласуется с данными Калашникова Р. П. с соавторами, отмечавшими, что каталазная активность от внесения удобрений существенно не меняется, в отличие от фосфатазной [10].
Литературные данные о влиянии внесения удобрений на активность инвертазы противоречивы [12, 13].
Тенденция к максимальной активности ферментов на фоновых участках по сравнению с обрабатываемыми полями просматривается достаточно хорошо и согласуется с ранее полученными данными [13–16]. Однако вторая часть рабочей гипотезы – об отсутствии статистически значимой разницы между фоновыми участками и органическими полями получила весьма скромное подтверждение (табл. 1).
Микробиологические показатели
Численность бактерий рода Azotobacter, обычно проявляет себя как хороший индикатор земледельческого использования почв [13, 17]. Исследования, проведенные в 2020 г. на землях фермерских хозяйств в Рыбнослободском районе, показали, что почвы необрабатываемых фоновых участков бедны бактериями рода Azotobacter. Максимальная численность азотобактера обнаруживалась на традиционных полях, средняя – на органических полях [18]. Исследования, проведенные в 2024 г. в хозяйствах трех районов, не дали столь однозначного результата (табл. 2). В почвах Арского и Высокогорского районов четко прослеживаются отличия обрабатываемых полей от фоновых участков, что согласуется с литературными данными [17]. На фоновых участках Azotobacter не обнаруживался – обрастание комочков на среде Эшби равно 0 %, а то время, как на обрабатываемых полях численность бактерий этого рода достаточно высока (табл. 2). Статистически значимые отличия по численности азотобактера между традиционными и органическими полями наблюдались только в Арском районе в весенний период.
В почвах Мензелинского района в весенний период не выявлено значимых отличий по численности азотобактера между всеми исследованными участками – она везде одинаково низкая. В осенний период максимальная численность обнаружена на фоновом участке. По-видимому, в Мензелинском районе главным ограничивающим фактором развития азотобактера стало недостаточное увлажнение, к которому данный род бактерий очень чувствителен.
Таблица 2
Численность бактерий рода Azotobacter в почвах фермерских хозяйств
по результатам исследования 2024 г., % обрастания комочков
| Система земледелия | Арский район (5 лет) | Высокогорский район (10 лет) | Мензелинский район (свыше 25 лет) | |||
| весна | осень | весна | осень | весна | осень | |
| Традиционная | 34,5 | 21,5 | 98,3 | 94,0 | 0,0 | 6,9 |
| Органическая | 63,2 | 25,3 | 81,0 | 81,8 | 1,1 | 7,8 |
| Фон | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 22,2 |
Численность трофических групп микроорганизмов – довольно динамичный признак, как и их соотношение. Исследователи микробиологических параметров почв нередко сталкивались с тем, что данные, полученные на тех же полях в разное время, противоречат друг другу [19]. Тем не менее, этот показатель используется для оценки эколого-биологического состояния почв.
В данном исследовании рассматривалось пять трофических групп микроорганизмов, их численность представлена на рис. 1.
Прежде всего, обращает на себя внимание, что численность большинства трофических групп уменьшилась к осеннему периоду по сравнению с весенним в 1,5–10 раз. Причем в большинстве случаев эта разница статистически значима. Исключением являются микроскопические грибы, численность которых более стабильна, а на некоторых полях даже возрастает осенью.
| Весна | Осень | |
| Арский | 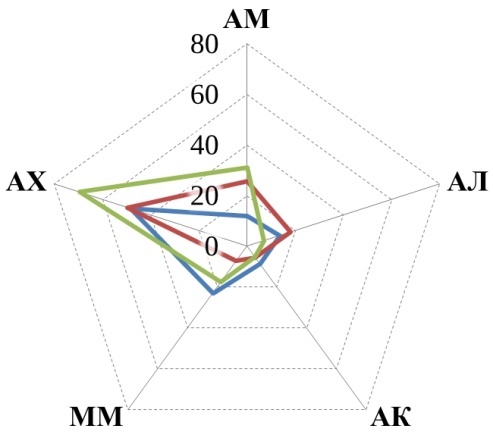 | 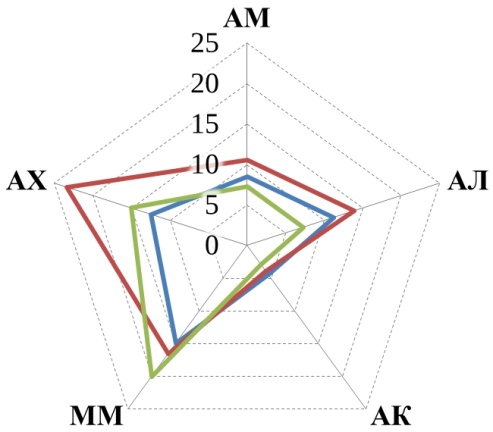 |
| Высокогорский | 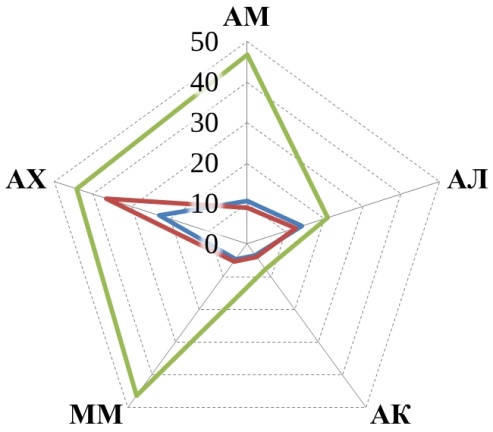 | 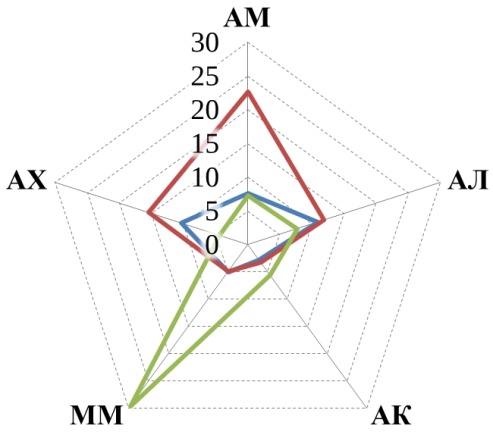 |
| Мензелинский | 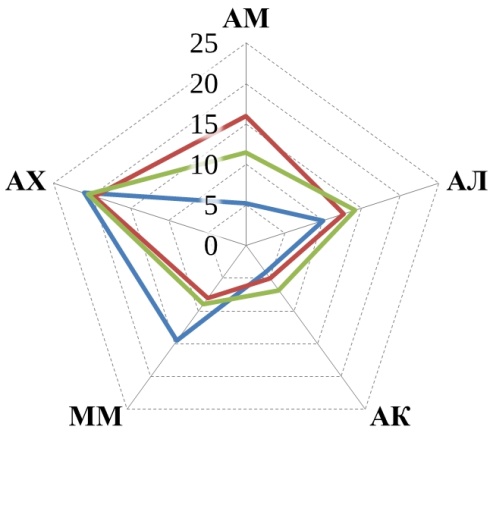 | 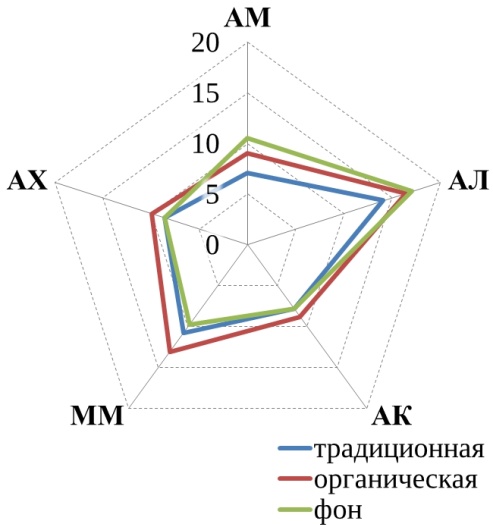 |
Рис. 1. Численность трофических групп микроорганизмов: АМ – аммонификаторы, АЛ – амиллолитики, АК – актиномицеты, ММ – микромицеты, АХ – автохтонные. Ед. изм: микромицеты в 104 КОЕ/г, остальные – в 106КОЕ/г.
Аммонифицирующие микроорганизмы почв (аммонификаторы) – способствуют разложению азотсодержащих органических соединений с образованием аммиака. В проведенном нами исследовании в 5 случаях из 6 более высокие средние значения численности аммонификаторов наблюдались в почвах органических полей по сравнению с традиционными (рис. 1). Однако обработка результатов не показала статистически значимой разницы. Статистически значимая разница между органическими полями и фоновыми участками также не обнаружена, зато разница существенна между традиционными полями и фоновыми участками (t-тест, p<0,05). Полученные результаты подтверждают ранее полученные данные для органических хозяйств Республики Татарстан [18, 20], а также согласуются с данными Зинченко М. К. о том, что длительное применение минеральных удобрений приводит к снижению численности аммонификаторов [21].
Амилолитические – микроорганизмы, использующие минеральный азот. Численность амилолитиков проявляет ту же тенденцию, что и численность аммонификаторов – в среднем на органических полях их больше, чем на традиционных. Хотя статистически значимая разница отмечена только на полях Мензелинского района, где органическое земледелие практикуется 25 лет. Полученные результаты согласуются с данными Завьяловой Н. Е. с соавторами [22], о снижении численности бактерий, усваивающих минеральный азот, на фоне применения минеральных удобрений.
Актиномицеты относятся к группе амилолитических микроорганизмов, но имеют свои особенности и подсчитываются отдельно. Участвуют в разложении трудноразлагаемых органических субстратов. В Арском районе средняя численность актиномицетов убывает в ряду: традиционные поля > органические поля > фоновые необрабатываемые участки. В двух других хозяйствах распределение численности актиномицетов обратное: фоновые участки > органические поля > традиционное земледелие.
Микромицеты – микроскопические грибы. Численность выявляемых колониеобразующих единиц микромицетов меньше, чем бактерий, но при этом общая биомасса мицелия грибов в почвах обычно больше [23], благодаря чему они оказывают значительное воздействие на разложение органических остатков. Четкой закономерности в распределении микроскопических грибов в почвах исследованных хозяйств не обнаружено. Обращает на себя внимание резкое увеличение численности микромицетов на фоновом участке в Высокогорском районе в осенний период, по-видимому, вызванное каким-то случайным фактором (рис. 1).
Автохтонные микроорганизмы – способны разлагать гумусовые вещества почв при значительном дефиците легкоразлагаемых органических веществ [8]. Единственная закономерность, которая четко прослеживается для автохтонных микроорганизмов во всех трех хозяйствах – это то, что в весенний период их численность больше, чем в осенний (рис. 1).
Эколого-трофические индексы (коэффициенты), рассчитанные по соотношениям численности трофических групп микроорганизмов, представлены в табл. 3.
Коэффициент минерализации/иммобилизации по Мишустину на органических полях в Арском и Мензелинском районах в весенний период меньше 1, что свидетельствует о процессах минерализации азота, а в осенний – больше 1, что говорит о преобладании процессов иммобилизации азота (табл. 3). Такой режим наиболее благоприятен, поскольку весной сельскохозяйственным растениям доступен минеральный азот для питания, а осенью иммобилизация азота микроорганизмами предотвращает его потери из почвы. Однако на органических полях Высогорского района наблюдалась противоположная картина. На традиционных полях всех хозяйств преобладали процессы иммобилизации азота, связанные, по-видимому, с интенсивным поглощением амилолитическими микроорганизмами минерального азота, поступающего с удобрениями.
Интенсивность процессов гумификации увеличивается осенью во всех исследованных почвах, о чем свидетельствует коэффициент гумификации. Полученный результат согласуется с данными Девятовой Т. А. с соавторами [24]. При этом в весенний период самый высокий коэффициент гумификации наблюдался на органическом поле Мензелинского района.
Таблица 3
Эколого-трофические индексы почв
| Система земледелия | Коэффициент минерализации | Коэффициент гумификации | Коэффициент трансформации органического вещества | ||||
| весна | осень | весна | осень | весна | осень | ||
| Арский район (5 лет) | |||||||
| Традиционная | 1,1 | 1,3 | 0,5 | 1,6 | 22,6 | 15,0 | |
| Органическая | 0,7 | 1,3 | 0,9 | 1,0 | 62,6 | 18,5 | |
| Фон | 0,2 | 1,0 | 0,5 | 1,0 | 8,4 | 14,7 | |
| Высокогорский район (10 лет) | |||||||
| Традиционная | 1,3 | 1,4 | 1,1 | 1,8 | 18,9 | 13,0 | |
| Органическая | 1,4 | 0,5 | 0,6 | 2,2 | 15,4 | 66,3 | |
| Фон | 0,4 | 1,1 | 1,5 | 3,4 | 150,8 | 14,1 | |
| Мензелинский район (свыше 25 лет) | |||||||
| Традиционная | 1,9 | 2,0 | 0,7 | 2,5 | 8,0 | 10,7 | |
| Органическая | 0,8 | 1,8 | 1,5 | 2,6 | 36,1 | 13,9 | |
| Фон | 1,2 | 1,6 | 1,2 | 3,2 | 20,9 | 17,0 | |
Коэффициент трансформации органических остатков в осенний период на органических полях выше, чем на традиционных, что, возможно, объясняется большей средней численностью аммонификаторов на органических полях.
ЗАКЛЮЧЕНИЕ
Подтверждено, что выявление биологических показателей почв, изменяющихся при переходе от обычного, традиционного земледелия к органическому и выявление микробиологических и биохимических индикаторов длительности применения органического земледелия является очень сложной задачей.
Численность всех пяти трофических групп микроорганизмов в почвах статистически значимо изменялась по сезонам года, весной она была выше, чем осенью. Однако отличия между органическими и традиционными полями проявились только на уровне тенденции для отдельных групп – средняя численность аммонификаторов и амилолитиков больше на органических полях. Закономерности схожи для хозяйств с разной длительностью применения принципов органической земледелия.
Среди эколого-трофических индексов наиболее перспективными, но требующими дальнейшего изучения являются коэффициент гумификации и коэффициент трансформации органических остатков.
Бактерии рода Azotobacter в серых лесных почвах проявили себя как индикатор для разделения фоновых необрабатываемых участков (0 % обрастания комочков) и земледельческого использования почв, независимо от системы земледелия (21–98 % обрастания). В черноземных почвах обилие азотобактера являлось показателем влажности почв, а не вида землепользования.
Из трех изученных ферментов фосфатаза оказалась лучшим индикатором длительности применения органической системы земледелия. Соотношение активности фосфатазы на органических и традиционных полях закономерно и статистически значимо изменялось в зависимости от длительности использования органической системы (5, 10 и 25 лет).
Для подтверждения полученных выводов исследования изменений микробиологических и биохимических свойств почв при органическом земледелии должны быть продолжены.
Список литературы
- Бачин С. Органика мифы и реальность / С. Бачин. – М.:ООО «ХлебСоль», 2016. – 128 с.
- Семенов А. М. Здоровая почвенная экосистема – основа здорового фитоценоза / А.М. Семенов, А. П. Глинушкин, М. С. Соколов // Успехи современной науки. – 2017. – Т. 2, № 10. – С. 29–33.
- Векленко В. И. Основные направления воспроизводства земельных ресурсов / В. И. Векленко, В. В. Дуплин, Н. Д Жмакина // Вестник Курской государственной сельскохозяйственной академии. – 2018. – № 3. – С. 150–157.
- Кислов А. В. Регулирование воспроизводства органического вещества и гумуса в почве при организации севооборотов в биологическом земледелии на Южном Урале / А. В. Кислов, В. Н. Диденко, А. В. Кащеев, А. С. Савраев // Зерновое хозяйство России. – 2012. – № 3. – С. 68–71.
- Долгополова Н. В. Плодородие почвы и устойчивость системы земледелия – залог производства сельскохозяйственной продукции / Н. В. Долгополова, А. А. Маньшин, М. Ж. Аширбеков, Е. А. Батраченко // Вестник Курской государственной сельскохозяйственной академии. – 2022. – № 4. – С. 6–15.
- Соколов М. С. Здоровая почва – условие развития агро- и социосфер (проблемно-аналитический обзор) / М. С. Соколов, А. М. Семенов, Ю. Я. Спиридонов, Е. Ю. Торопова, А. П. Глинушкин // Известия Российской академии наук. Серия биологическая. – 2020. – № 1 – С. 12–21.
- Zarb J. The importance of microorganisms in organic agriculture / J. Zarb, R. Ghorbani, A. Koochekiand, C. Leifert // Outlooks on Pest Management. – 2005. – No 16(2). – P. 52–55. DOI:10.1564/16apl02
- Емцев В. Т. Микробиология / В. Т. Емцев, Е. Н. Мишустин. – М.: Дрофа, 2008. – 445 с.
- Куликова А. Х. Ферментативная активность почвы в зависимости от систем удобрения / А. Х. Куликова, С. А. Антонова, А. В. Козлов // Вестник Ульяновской государственной сельскохозяйственной академии. – 2017. – №4(40). – С. 36–43.
- Калашников Р. П. Влияние минеральных удобрений на ферментативную активность черноземовидной почвы под посевами кукурузы / Р. П. Калашников, Е. А. Семенова, С. А. Фокин, Е. Б. Захарова // Дальневосточный аграрный вестник. – 2020. – № 3 (55). – С. 26–34.
- Лабутова Н. М. Основы почвенной энзимологии / Н. М. Лабутова, Т. А. Банкина. – Санкт-Петербург: Издательский дом Санкт-Петербургского гос. ун-та, 2013. – 102 с.
- Постовалов А. А. Роль минеральных удобрений в повышении супрессивности почвы и ограничении развития корневой гнили / А. А. Постовалов, С. Ф. Суханова // Известия Горского государственного аграрного университета. – 2021. – Т. 58(3). – С. 9–16.
- Зинченко М. К. Влияние приемов обработки и доз удобрений на ферментативную активность серой лесной почвы / М. К. Зинченко, С. И. Зинченко // Вестник Курской государственной сельскохозяйственной академии. – 2017. – № 8. – С. 3–5.
- Гордеева К. А. Влияние различных систем земледелия на агрохимические и биохимические показатели серой лесной почвы / К. А. Гордеева, Т. Г. Кольцова, В. И. Кулагина, Л. М. Сунгатуллина, А. М. Хайруллина // Российский журнал прикладной экологии. – 2024. – № 3 (39). – С. 34–38.
- Кольцова Т. Г. Оценка ферментативной активности серых лесных почв в органических и традиционных аргоценозах Предкамья Республики Татарстан / Т. Г. Кольцова, В. И. Кулагина, Л. М. Сунгатуллина, А. А. Андреева, Э. Х. Рупова // Российский журнал прикладной экологии. – 2022. – № 3 (31). – С. 34–42.
- Даденко Е. В. Применение показателей ферментативной активности при оценке состояния почв под сельскохозяйственными угодьями / Е. В. Даденко, М. А. Прудникова, К. Ш. Казеев, С. И. Колесников // Известия Самарского научного центра Российской академии наук. – 2013. – Т.15, №3. – С. 1274–1277.
- Газиев М. А. Роль органических и минеральных удобрений в развитии физиологических групп микроорганизмов в системе севооборота / М. А. Газиев, А. Т. Турдалиев, М. Ш. Низометдинов // Современные фундаментальные и прикладные исследования. – 2019. – №2. – С. 9‒12.
- Кулагина В. И. Информативность микробиологических и биохимических параметров для мониторинга почв при органическом земледелии / В. И. Кулагина, Л. М. Сунгатуллина, С. С. Рязанов, Р. Р. Шагидуллин, А. А. Андреева // Региональные геосистемы. – 2021. – Т. 45, № 4. – С. 459–470.
- Казеев К. Ш. Биодиагностика почв: методология и методы исследований: / К. Ш. Казеев, С. И. Колесников. – Ростов-на-Дону: Издательство Южного федерального университета, 2012. – 260 с.
- Кулагина В. И. Проверка набора параметров для интегральной оценки эколого-биологического состояния почв при органическом земледелии / В. И. Кулагина, Л. М. Сунгатуллина, С. С. Рязанов, А. М. Хайруллина, Р. Р. Шагидуллин, Э. Х. Рупова // Ученые записки Крымского федерального университета имени В.И. Вернадского. Биология. Химия. – 2021. – Т. 7 (73), № 1. – С. 90–102.
- Зинченко М. К. Мониторинг численности бактериальной микрофлоры в агроэкосистемах серой лесной почвы / М. К. Зинченко // Достижения науки и техники АПК. – 2019. – Т. 33, № 12. – С. 10–14.
- Завьялова Н. Е. Микробиологическое состояние дерново-подзолистой почвы Предуралья при длительном применении органических и минеральных удобрений / Н. Е. Завьялова, И. Г. Широких, В. Р. Ямалтдинова // Теоретическая и прикладная экология. – 2020. – № 1. – С. 151–159.
- Благовещенская Г. Г. Микробные сообщества почв и их функционирование в условиях применения средств химизации / Г. Г. Благовещенская, Т. М. Духанина // Агрохимия. – 2004. – №2. – С.80–88.
- Девятова Т. А. Влияние сельскохозяйственных угодий и подтипа почвы на микробное сообщество зональных почв на примере черноземов Каменной степи / Т. А. Девятова, Н. Б. Безлер, А. Н. Антонюк // Вестник ВГУ. Серия химия, биология, фармация. – 2003. – №1. – С. 46–49.
MICROBIOLOGICAL AND BIOCHEMICAL PROPERTIES OF SOILS UNDER DIFFERENT DURATIONS OF ORGANIC FARMING APPLICATION
Kulagina V. I., Sungatullina L. M., Shagidullin R. R., Ryazanov S. S., Khairullina A. M., Gordeeva K. A.
Research Institute for Problems of Ecоlogy and Mineral Wealth Use of Tatarstan Academy of
Sciences, Kazan, Republic of Tatarstan, Russia
E-mail: viksoil@mail.ru
Organic farming was conceived as a strategy to promote favorable environmental conditions, preserve and restore soil fertility, and as a pathway toward sustainable agriculture. By stabilizing agroecosystems, organic farming enables the production of non-record-breaking yet relatively stable yields. Agroecosystem sustainability is achieved through appropriate crop rotations and balanced microbial and enzymatic pools in soils not subjected to synthetic fertilizers or pesticides. The exact timeframe for stabilizing soil biological and biochemical properties during the transition to organic farming remains unclear, making the study of temporal changes in microbial and enzymatic pools an ongoing research priority. The aim of this study was to compare microbiological and biochemical soil properties under varying durations of organic farming implementation. The study focused on soils from three farms in the Republic of Tatarstan practicing organic farming for 5, 10, and 25 years, respectively. We compared these soils with those from neighboring farms using traditional practices and undisturbed background sites. Soil samples were collected in spring and autumn 2024. Microbial abundance across five trophic groups was determined via cultivation on solid media, alongside the activity of three enzymes (invertase, phosphatase, and catalase). Eco-trophic indices, including humification and organic residue transformation coefficients, were calculated. Phosphatase activity emerged as the most robust biomarker for assessing the duration of organic farming adoption. The ratio of phosphatase activity in organic versus traditional fields exhibited consistent and statistically significant trends: after 5 years, activity was significantly lower in organic fields; after 10 years, no differences were observed; and after 25 years, activity became significantly higher in organic fields. The introduction of nitrogen fertilizers helps improve nitrogen nutrition and stimulate phosphatase activity. For this reason, a decrease in phosphatase activity is observed in the first years after the transition to organic farming. However, in the absence of regular doping in the form of mineral fertilizers, self-regulation mechanisms in the ecosystem come into force. With a lack of mobile phosphorus in the soil, the flow of phosphatases of microbial and plant origin into the soil increases. In gray forest soils, Azotobacter bacteria served as a reliable indicator to distinguish cultivated from uncultivated areas, regardless of farming practices. In chernozems, however, Azotobacter abundance reflected soil moisture levels rather than land use type. Seasonal variations significantly affected all five microbial trophic groups, with higher abundances in spring than autumn. Differences between organic and traditional fields were limited to trends in specific groups, such as higher mean abundances of ammonifiers and amylolytics in organic soils. Actinomycetes belong to the group of amylolytic microorganisms, although they are counted separately. For microscopic fungi, seasonal fluctuations in abundance are less pronounced than for other trophic groups, and for autochthonous microflora, seasonal fluctuations in abundance are expressed best of all. These patterns were consistent across farms with differing organic farming histories. Among eco-trophic indices, the humification coefficient and organic residue transformation coefficient showed promise but require further validation. The humification coefficient was significantly higher in fields with 25 years of organic farming compared to adjacent traditional fields.
Keywords: soil, organic farming, enzyme activity, trophic groups of microorganisms, eco-trophic indices.
References
- Bachin S. Organics myths and reality, 128 p. (KhlebSol, Moscow, 2016).
- Semenov A. M., Glinushkin A. P., Sokolov M. S. Healthy soil ecosystem is the basis of healthy phytocenosis, Modern Science Success, 10, 29 (2017).
- Veklenko V. I., Duplin V. V., Zhmakina N. D. The main directions of reproduction of land resources, Bulletin of the Kursk State Agrarian University, 3, 150 (2018).
- Kislov A. V., Didenko V. N., Kashcheev A. V., Savraev A. S. Regulation of reproduction of organic matter and humus in the soil when organizing crop rotations in biological farming in the Southern Urals, Grain farming of Russia, 3, 68 (2012).
- Dolgopolova N. V., Manshin A. A., Ashirbekov M. Zh., Batrachenko E. A. Soil fertility and sustainability of the agricultural system is a guarantee of agricultural production, Bulletin of the Kursk State Agrarian University, 4, 6 (2022).
- Sokolov M. S., Semenov A. M., Spiridonov Yu. Ya., Toropova E. Yu., Glinushkin A. P. Healthy Soil – Condition of Stability and Development of the Argo- and Sociospheres (Problem and Analytical Review), Bulletin of the Russian Academy of Sciences. Biological Series, 1, 12 (2020).
- Zarb J., Ghorbani R., Koochekiand A., Leifert C. The importance of microorganisms in organic agriculture, Outlooks on Pest Management, 16(2), 52 (2005) DOI:10.1564/16apl02
- Emtsev V. T., Mishustin E. N. Microbiology, 445 p. (Bustard, Moscow, 2008).
- Kulikova A. Kh., Antonova S. A., Kozlov A. V. Soil enzyme activity depending on the fertilizer system, Vestnik of Ulyanovsk State Agricultural Academy, 4(40), 36 (2017).
- Kalashnikov R. P., Semenova E. A., Fokin S. A., Zakharova E. B. Mineral fertilizers and enzymatic activity of chernozem-like soil used corn crops, Far Eastern agricultural journal, 3, 26 (2020).
- Labutova N. M., Bankina T. A. Fundamentals of Soil Enzymology, 102 p. (Publishing House of the St. Petersburg State University, St. Petersburg, 2013).
- Postovalov A. A., Sukhanova S. F. Role of mineral fertilizers in increasing the soil suppressivity and limiting the root rot development, News of the Gorsky State Agrarian University, 58(3), 9 (2021).
- Zinchenko M. K., Zinchenko S. I. The influense of tillage practices and fertilizer rates on the fermentative activity of gray forest soil, Bulletin of the Kursk State Agrarian University, 8, 3 (2017).
- Gordeeva K. A., Koltsova T. G., Kulagina V. I., Sungatullina L. M., Khairullina A. M. Impact of various farming systems on agrochemical and biochemical characters in gray forest soil, Russian Journal of Applied Ecology, 3, 34 (2024)
- Koltsova T. G., Kulagina V. I., Sungatullina L. M., Andreeva A. A., Rupova E. H. Evaluation of the enzymatic activity of gray forest soil in organic and traditional agricultural landscapes of the Pre-Kama region of the Republic of Tatarstan, Russian Journal of Applied Ecology, 3, 34 (2022).
- Dadenko E. V., Prudnikova M. A., Kazeev K. Sh., Kolesnikov S. I. Application of enzyme activity for soil monitoring, Bulletin of the Samara Scientific Center of the Russian Academy of Sciences, 3, 1274 (2013).
- Gaziev M. A., Turdaliev A. T., Nizometdinov M. Sh. The role of organic and mineral fertilizers in the development of physiological groups of microorganisms in the crop rotation system, Modern fundamental and applied research, 2, 9 (2019).
- Kulagina V. I., Sungatullina L. M., Ryazanov S. S., Shagidullin R. R., Andreeva A. A. Informative Value of Microbiological and Biochemical Parameters for Soil Monitoring in Organic Farming, Regional geosystems, 4, 459 (2021).
- Kazeev K. Sh., Kolesnikov S. I. Soil biodiagnostics: methodology and research methods, 260 p. (Publishing House of the Southern Federal University, Rostov-on-Don, 2012).
- Kulagina V. I., Sungatullina L. M., Ryazanov S. S., Khayrullina A. M., Shagidullin R. R., Rupova E. H. Assessment of the set of parameters for an integral evaluation of an ecological and niological state of soils in organic agriculture, Scientific Notes of V.I. Vernadsky Crimean Federal University. Biology. Chemistry, 1, 90 (2021).
- Zinchenko M. K. Monitoring of Bacterial Microflora in Agroecosystems of Grey Forest Soil, Achievements of science and technology of the agro-industrial complex, 12, 10 (2019).
- Zavyalova N. E., Shirokih I. G., Yamaltdinova V. R. Microbiological status of the Pre-Urals sod-podzolic soil with long-term use of organic and mineral fertilizers, Theoretical and Applied Ecology, 1, 151 (2020).
- Blagoveshchenskaya G. G., Dukhanina T. M. Soil microbial communities and their functioning under chemical ization conditions, Agrochemistry, 2, 80 (2004).
- Devyatova T. A., Bezler N. B., Antonyuk A. N. The influence of agricultural landshaft and soil sub-type on the microbial association of zonal soils on the example of «Kamennaya Steppe» chernozems, Proceedings of Voronezh State University. Series: Chemistry. Biology. Pharmacy, 1, 46 (2003).

