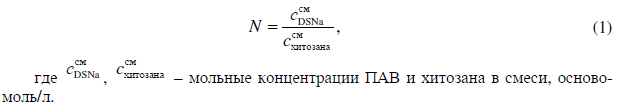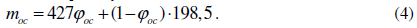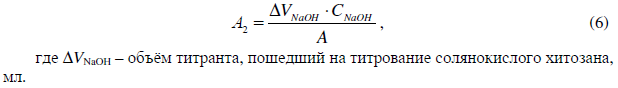Ученые записки Крымского федерального университета имени В. И. Вернадского
Биология. Химия. Том 11 (77). 2025. № 2. С. 359–369.
УДК 547.917:66.081:543.42
DOI 10.29039/2413-1725-2025-11-2-359-369
ОПРЕДЕЛЕНИЕ ОПТИМАЛЬНЫХ УСЛОВИЙ ОБРАЗОВАНИЯ ПАВ-ПОЛИЭЛЕКТРОЛИТНОЙ ПЛЁНКИ ПРИ ПОЛУЧЕНИИ МИКРОКАПСУЛ ХИТОЗАНА
Русяев С. В.1, Ткаченко Э. В.2, Яковишин Л. А.2, Гришковец В. И.3
1ФГАОУ ВО «Национальный исследовательский Томский политехнический университет»,
Томск, Россия
2ФГАОУ ВО «Севастопольский государственный университет», Севастополь, Россия
3Институт биохимических технологий, экологии и фармации (структурное подразделение)
ФГАОУ ВО «Крымский федеральный университет им. В. И. Вернадского», Симферополь, Россия
Е-mail: tkelly@rambler.ru
Работа посвящена определению оптимальных условий получения микрокапсул хитозана с оболочкой хитозан–додецилсульфат. Свойства оболочки экстраполировались из результатов, полученных при изучении характеристик твёрдого комплекса хитозан–додецилсульфат. Методами рентгенофлуоресцентного анализа и потенциометрического титрования изучены выход и состав твёрдого комплекса при различных соотношениях реагентов. Методом вольтамперометрии показана сорбционная способность микрокапсул к ионам свинца в течение 30 мин контакта. Доказано, что полученные микрокапсулы являются более эффективным сорбентом, чем индивидуальный комплекс хитозан–додецилсульфат.
Ключевые слова: хитозан, додецилсульфат натрия, инкапсуляция, сорбция, тяжёлые металлы, инверсионная вольтамперометрия, рентгенофлуоресцентный анализ, потенциометрическое титрование.
ВВЕДЕНИЕ
Процесс инкапсуляции представляет собой введение одного вещества в другое. Он является актуальным методом для транспорта веществ в те системы, в которых они теряют свои полезные свойства или их эффект должен быть пролонгирован. Данные особенности микрокапсул достигаются за счёт формирования на их поверхности протектирующего слоя, обладающего специфическими характеристиками, обусловленными природой составляющих её веществ, условиями образования самой плёнки и её структурой [1]. Изучение свойств защитной плёнки помогает сформировать критерии эффективной инкапсуляции и определить область использования микрокапсул при подборе соответствующих веществ, их концентрации и условий образования.
Перспективным методом является инкапсулирование с использованием полиэлектролитов. Так, полисахарид хитозан, обладающий рядом полезных свойств [2–4], относится к природным полиэлектролитам, позволяющим включать различные органические молекулы и накапливать ионы тяжёлых металлов. Это определяет его использование в качестве сорбента, однако растворимость в кислых средах ограничивает применение хитозана в твёрдом виде [5].
Электростатическое взаимодействие между полиэлектролитом и поверхностно-активным веществом приводит к образованию комплекса ПАВ–полиэлектролит, который, в зависимости от условий образования, может находиться как в растворимом, так и в нерастворимом виде. Установлено, что материал, полученный при взаимодействии этих веществ, как и сам хитозан, обладают сорбционными свойствами [6]. Таким образом, определение условий образования ПАВ–полиэлектролитной плёнки (соотношение компонентов в системе и в самом материале) позволит установить выход вещества и его максимальную сорбционную эффективность.
Распространённым методом получения микрокапсул является покапельное добавление внедряемого полиэлектролита в раствор, содержащий ПАВ [7]. Известно, что микрокапсулы, полученные данным способом, могут использоваться для доставки полезных веществ в организм [7]. На основании известных свойств материала защитной плёнки предполагается, что помимо транспортировки также возможно концентрирование веществ из внешней среды в самой микрокапсуле.
С целью поиска эффективных сорбентов нами получены микрокапсулы хитозана с оболочкой из хитозана с додецилсульфатом натрия (DSNa) и изучена их сорбционная способность к ионам свинца(II).
МАТЕРИАЛЫ И МЕТОДЫ
Для получения ПАВ-полиэлектролитного комплекса был использован хитозан в виде порошка (M = 200 кДа, СДА 83 %; ООО Биопрогресс, Россия). В качестве анионного ПАВ использован DSNa, представленный в виде гранул (Tainolin AS-95N, Taiwan NJC Corp., Тайвань).
Для приготовления растворов навеску хитозана растворяли в 0,1 М растворе HCl. Концентрация солянокислых растворов хитозана составляла 0,05 осново-моль/л.
Концентрацию DSNa, необходимую для приготовления смеси, определяли из соотношения N – отношения осново-мольных концентраций реагентов в смеси
Модельные растворы, содержащие ионы свинца, готовились из ГСО (водный раствор нитрата свинца(II) с концентрацией 5 мг/л).
Методика определения оптимальных условий образования нерастворимой плёнки. Для нахождения условий, при которых степень взаимодействия между веществами будет максимальной, эксперимент проводили при различных значениях параметра N = 0,1; 0,5; 1; 2.
Каждый образец ПАВ-полиэлектролитного комплекса получали медленным покапельным (1–2 капли в минуту) добавлением раствора DSNa объёмом 10 мл в солянокислый раствор хитозана аналогичного объёма при постоянном перемешивании. Концентрация растворов DSNa выбиралась исходя из заданных значений параметра N. Полученные растворы с осадками выдерживали 24 ч.
Осадки из смесей отделяли центрифугированием (5000 об/мин в течение 30 мин). С целью удаления остаточных включений HCl свежевыделенный осадок промывался раствором NaOH концентрацией 0,001 M и спирто-водяной смесью с соотношением 1:1.
С целью удаления остатков влаги осадки высушивали в сушильном шкафу при температуре 60 оС в течение 24 ч. Массу высушенных комплексов определяли на аналитических весах. В дальнейшем они были использованы для изучения состава нерастворимого комплекса.
Фильтрат, полученный после центрифугирования, использовался при титровании в качестве определяемого вещества.
Наибольший выход нерастворимого комплекса при наименьших затратах является оптимумом. Параметром, характеризующим достижение оптимума, является суммарный состав комплекса
где ϕос и ϕр – состав комплексов хитозан–DSNa в фазе осадка и раствора соответственно; Кос и Кр – степень перехода комплекса в осадок и в раствор соответственно.
Определение значений слагаемых в уравнении (2) при различном отношении концентраций компонентов в смеси N позволяет выявить минимальное соотношение компонентов, при которых значение ϕ равно единице.
Для определения состава нерастворимого ПАВ–полиэлектролитного комплекса использовались его высушенные образцы. Методом рентгенофлуоресцентного анализа определялись грамм-атомные соотношения серы и азота – молекул, по которым можно сравнить степень замещения хлорид-иона на додецилсульфат-ион. Исследования проводили с помощью рентгеноспектрального анализатора Спектроскан Макс GVM (ООО НПО СПЕКТРОН, Россия). Для определения качественного и количественного содержания элементов в образце пробу измельчали до однородного состояния и усредняли методом квартования. Затем готовили подложку из сухой борной кислоты под давлением 2000 кг, после этого наносили подготовленный образец и прессовали под давлением 7000 кг. Обработка спектров излучения осуществлялась с помощью программы Element Identification (Phenom), позволяющая использовать электронный микроскоп Phenom ProX для качественного и количественного анализа образцов.
Выход нерастворимого комплекса определялся в соответствии с формулой
где qос – выход нерастворимого комплекса, г; mоc – молекулярная масса элементарного звена нерастворимого комплекса; А – количество хитозана в растворе, моль.
Значение mос определялось по правилу аддитивности
Выход растворимого комплекса определялся по соотношению
Наличие непрореагировавших молекул хитозана с молекулами DSNa в растворе количественно устанавливали методом потенциометрического титрования приборе Иономер И-160 МИ (НПО Измерительная техника, Россия). Несмотря на ограниченную применимость, наблюдаемые потенциометрические скачки (пики) способны дать результаты для определения концентрации непрореагировавшего хитозана в растворах [8]. В качестве определяемого вещества использовались аликвоты центрифугатов объёмом 20 мл. Титрантом выступал водный раствор NaOH концентрацией 0,025 моль/л. Первый потенциометрический скачок отвечает за титрование избытка соляной кислоты в центрифугате. Второй скачок сигнала является точкой эквивалентности при титровании солянокислого хитозана, в которой будут оттитрованы все молекулы хитозана, находящиеся в растворе. Таким образом, количество хитозана, находящегося в растворе будет равно
Состав растворимого комплекса находился из соотношения
Методика приготовления плёнки с оптимальными условиями использовалась для дальнейшего получения микрокапсул (рис. 1).
Методика анализа сорбционной способности микрокапсул. Хитозан, капсулированный комплексом хитозан–DSNa получали методом покапельного добавления 20 мл стандартного раствора хитозана концентрацией 0,05 осново-моль/л к смеси 20 мл раствора DSNa концентрацией 0,2 моль/л и 20 мл раствора нитрата свинца(II) концентрацией 1000 мкг/л. Над поверхностью смеси находился слой гептана объёмом 30 мл, выполняющий роль эмульгатора. Время контакта раствора с микрокапсулами после окончания образования последних равно 30 мин. Процесс образования проводился при постоянном перемешивании, при этом скорость перемешивания была подобрана с учётом того, чтобы оболочка микрокапсул не порвалась. Отбор фильтрата проводился через канал с фильтром согласно схеме.
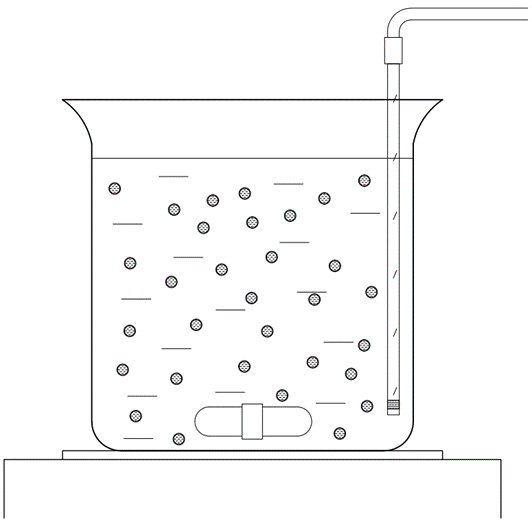
Рис. 1. Схема получения микрокапсул хитозана и сорбции ионов Pb(II).
Полученная после фильтрации смесь подвергалась вольтамперометрическому анализу. Для этого в анализируемую ячейку отбирали 20 мл смеси и 5 мл концентрированного фонового раствора, содержащего ионы Hg2+. Измерение проводили на вольтамперометрическом анализаторе Экотест-ВА (ООО Эконикс-Эксперт, Россия) на вращающемся дисковом углеситалловом электроде методом анодной инверсионной вольтамперометрии. Диапазон развёртки потенциала: (-700) – (-250) мВ; модуляция – 30 мВ/c. Время очистки и накопления – 60 с.
Количество свинца до сорбции определяли на исходном модельном растворе нитрата свинца концентрацией 500 мкг/л в аналогичных условиях. Концентрацию ионов свинца до и после сорбции определяли по площади пиков на вольтамперограмме.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ рентгенофлуоресцентных спектров приведён в виде таблицы 1, отношение ϕос определялось из мольного соотношения компонентов.
Таблица 1
Содержание серы и азота в комплексе хитозан–DSNa
| Мольное соотношение компонентов смеси N | ω(S), % | ω(N), % | ω(S), мол. доля | ω(N), мол. доля | φос |
| 0,1 | 7,82 | 4,01 | 3,95 | 4,63 | 0,85 |
| 0,5 | 5,09 | 2,26 | 2,5 | 2,54 | 0,98 |
| 1 | 6,01 | 3,2 | 3,83 | 3,66 | 1,05 |
| 2 | 9,85 | 4,13 | 5 | 4,79 | 1,04 |
С увеличением мольного отношения DSNa/хитозан состав нерастворимого комплекса приближается к стехиометрическому. Значение ϕос достигает единицы при значениях N, равных 1 и 2, то есть при данном отношении компонентов к одному элементарному звену хитозана присоединяется одна молекула ПАВ. Превышения значения указывает на наличие включений мицелл DSNa в структуре нерастворимого комплекса [9].
Массовый выход осадка, количество хитозана в растворе, молярная масса элементарного звена нерастворимого комплекса и его выход приведены в таблице 2.
Таблица 2
Массовые характеристики и выход нерастворимого комплекса
| N | qос, г | А, осново-моль | mос, г/осново-моль | Кос, % |
| 0,1 | 0,031 | 0,0005 | 393,4 | 16 |
| 0,5 | 0,108 | 0,0005 | 423,4 | 51 |
| 1 | 0,207 | 0,0005 | 437,6 | 95 |
| 2 | 0,220 | 0,0005 | 437,0 | 100 |
Рост массы осадка по мере роста соотношения ПАВ-полиэлектролит свидетельствует об увеличении связывания свободного хитозана в системе. При значении N, равного 2, наблюдается полное выпадение комплекса в осадок, выход максимален. Молекулярная масса также растёт с увеличением степени замещения. При данном значении N в растворе свободного хитозана не наблюдается, то есть выход растворимого комплекса равен нулю.
Потенциометрические кривые, полученные в ходе титрования смеси раствором NaOH приведены на рисунке 2. На рисунке 2 (а–в) наблюдается 2 потенциометрических пика, первый отвечает за титрование избытка соляной кислоты, второй – за титрование солянокислого хитозана. При росте числа N количество NaOH, затраченного на титрование хитозана уменьшается и при значении равном двум второго пика аналитического сигнала не наблюдается, что свидетельствует об отсутствии определяемых количеств полиэлектролита в смеси.
В таблице 3 приведены данные о составе растворимого и нерастворимого комплекса, по выходу нерастворимого комплекса, определению его элементного состава и результатам потенциометрического титрования. Из полученных значений следует, что хитозан полностью связывается DSNa и переходит в фазу осадка только при соотношении N = 2. Именно это соотношение ПАВ/полиэлектролит является оптимальным и использовалось при получении микрокапсул.
Таблица 3
Влияние состава смесей хитозана на состав комплекса
| N | φос | Kос | Кр | АII | AIII | φр | φ |
| 0,1 | 0,853 | 16 | 84 | 30 | 54 | 0,640 | 0,674 |
| 0,5 | 0,984 | 51 | 49 | 21,5 | 27,5 | 0,560 | 0,776 |
| 1 | 1,046 | 95 | 5 | 4,5 | 0,5 | 0,100 | 0,999 |
| 2 | 1,044 | 100 | 0 | 0 | 0 | — | 1,044 |
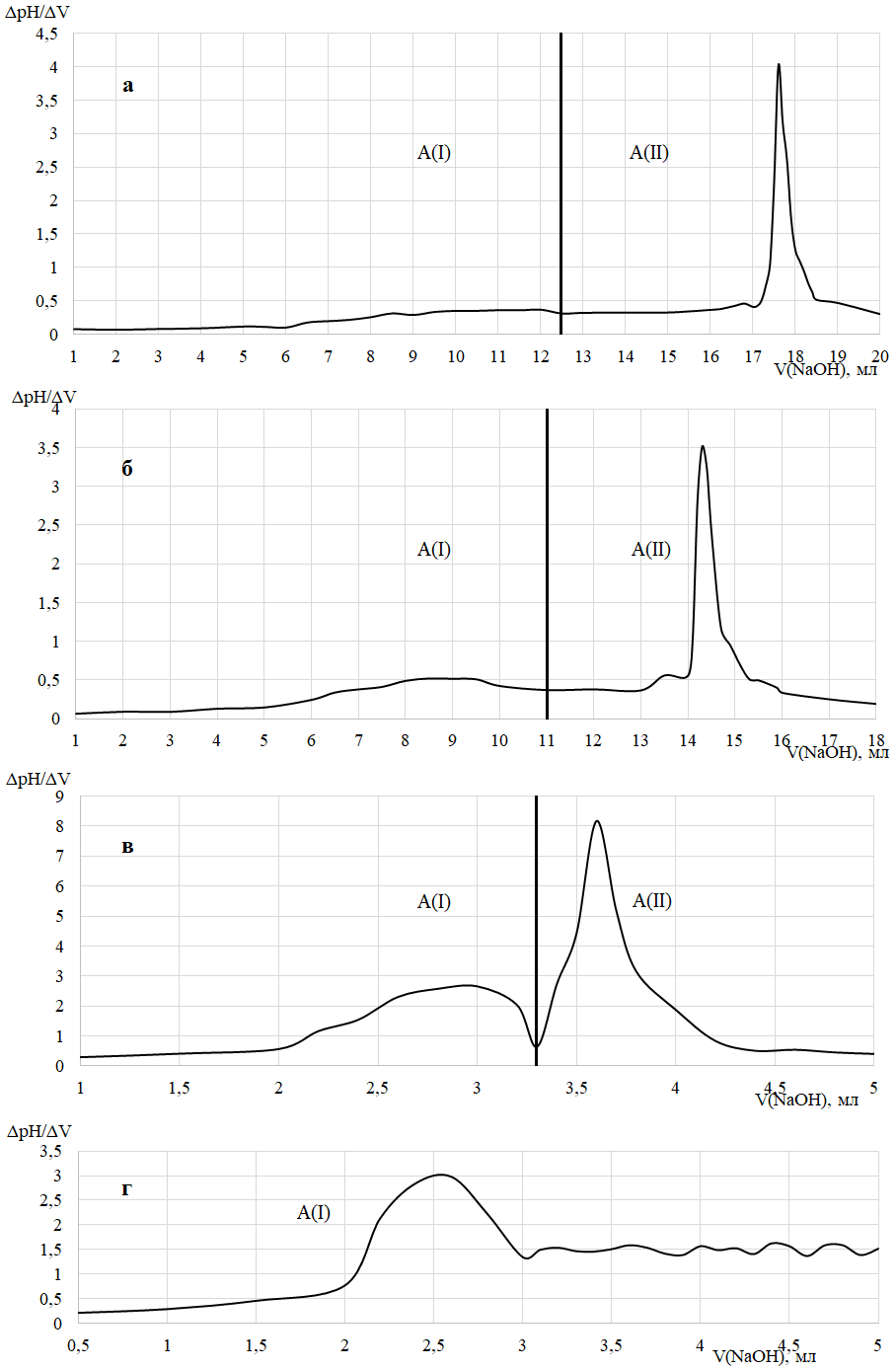
Рис. 2. Потенциометрические кривые, полученные в ходе титрования раствором NaOH центрифугатов хитозана–DSNa c значением N: а – 0,1; б – 0,5; в – 1; г – 2.
Аналитическими сигналами при определении сорбционных способностей микрокапсул являлись площади пиков анодного тока, пропорциональные высоте пиков тока, наблюдаемые при значениях потенциала от -470 мВ до -440 мВ. Вольтамперные кривые модельных растворов катионов свинца до и после сорбции представлены на рисунке 3.
Рис. 3. Вольтамперограммы растворов нитрата свинца до и после сорбции (CPb(II)=500 мкг/л).
Концентрация ионов свинца после сорбции определялась по соотношениям площадей пиков тока
Для корректной обработки вольтамперограммы производился пересчёт количества сорбента, который должен быть использован на 100 мл раствора. Массу сорбента, приходящуюся на 100 мл раствора, рассчитывали исходя из пропорции
где m40 – масса сорбента, приходящаяся на 40 мл раствора, г.
Значение m40 определялось по соотношению
где M – молярная масса элементарного звена хитозана, равная 163 г/моль.
С учётом пересчёта значение концентрации после контакта раствора с микрокапсулами находили по пропорции
Полученное после вышеперечисленных действий значение концентрации ионов Pb2+ равно 80 мкг/л.
Таким образом, степень извлечения ионов свинца из водных растворов составляет 84 %. Сопоставляя этот показатель с самим материалом плёнки, можно прийти к выводу о наличии дополнительной сорбции, происходящей благодаря проникновению ионов свинца через нерастворимую ПАВ-полиэлектролитную плёнку. Значение степени извлечения сопоставимо со степенью извлечения активированным углем за данный промежуток времени [10]. Из этого следует, что в агрессивных средах, где требуется дальнейшее разделение фаз, хитозан может быть использован в качестве сорбента в виде микрокапсул, покрытых нерастворимой ПАВ-полиэлектролитной плёнкой.
ЗАКЛЮЧЕНИЕ
- Определено отношение реагентов для получения нерастворимого комплекса с максимальным выходом, составляющее N=2. Показана зависимость состава комплексов от состава смесей солянокислых растворов хитозана и DSNa.
- Методом покапельного добавления были получены микрокапсулы, которые использовались для определения сорбции ионов свинца из модельного раствора.
- Установлено, что хитозан в микрокапсульной форме обладает дополнительной сорбционной активностью по сравнению с нерастворимым комплексом хитозан–DSNa. Она сопоставима с сорбционными способностями активированного угля.
Список литературы
- Семкина О. А. Критерии оценки качественных и количественных показателей микрокапсул / О. А. Семкина, О. М. Белошапкина, М. А. Джавахян // Вопросы биологической, медицинской и фармацевтической химии. – 2021. – Т. 24, № 12. – С. 11–17.
- Zargar V. A review on chitin and chitosan polymers: structure, chemistry, solubility, derivatives, and applications / V. Zargar, M. Asghari, A. Dashti // ChemBioEng Reviews. – 2015. – Vol. 2, № 3. – P. 204–226.
- Yakovishin L. Development and IR spectroscopic analysis of composite materials based on poly(methyl methacrylate) and chitosan / L. Yakovishin, E. Tkachenko, Y. Tolstenko [et al.] // Materials Science Forum. – 2022. – Vol. 1065. – P. 145–154.
- Yakovishin L. A. Composite materials based on dental acrylic plastic and chitosan / L. A. Yakovishin, E. V. Tkachenko // Chimica Techno Acta. – 2021. – Vol. 8, № 4. – 20218413.
- Тарановская Е. А. Очистка сточных вод с применением хитозана / Е. А. Тарановская, Н. А. Собгайда, И. Н. Алфёров [и др.] // Вестник ОГУ. – 2015. – № 10. – С. 322–325.
- Ткаченко Э. В. Изучение сорбционной способности комплекса хитозан-додецилсульфат натрия на примере сорбции ионов свинца / Э. В. Ткаченко, С. В. Русяев // Учёные записки Крымского федерального университета имени В. И. Вернадского. Биология. Химия. – 2023. – Т. 9 (75), № 2. – С. 268–275.
- Ринодо М. ПАВ-полиэлектролитные комплексы на основе производных хитина / М. Ринодо, Н. Р. Кильдеева, В. Г. Бабак // Российский химический журнал. – 2008. – Т. 52, № 1. – С. 84–91.
- Вихорева Г. А. Комплексообразование в системе додецилсульфат натрия-хитозан / Г. А. Вихорева, В. Г. Бабак, Е. Ф. Галич [и др.] // Высокомолекулярные соединения. – 1997. – Т. 39, № 6. – С. 947–952.
- Пышкина О. А. Полиэлектролиты / О. А. Пышкина, О. А. Новоскольцева, А. А. Ярославов. – М.: МГУ, 2022. – 97 c.
- Погорелов М. В. Сорбция ионов металлов материалами на основе хитозана / М. В. Погорелов, Е. В. Гусак, И. М. Бабич [и др.] // Журнал клинических и экспериментальных медицинских исследований. – 2014. – Т. 2, № 1. – С. 88–99.
OPTIMIZATION OF SURFACTANT-POLYELECTROLYTE MEMBRANE FORMATION CONDITIONS FOR chitosan MICROCAPSULE PRODUCTION
Rusyaev S. V.1, Tkachenko E. V.2, Yakovishin L. A.2, Grishkovets V. I.3
1Tomsk Polytechnic University, Tomsk, Russia
2Sevastopol State University, Sevastopol, Russia
3V. I. Vernadsky Crimean Federal University, Simferopol, Russia
E-mail: tkelly@rambler.ru
This work is dedicated to determining the optimal conditions for producing chitosan microcapsules with a chitosan–dodecyl sulfate shell. Studying its properties will help establish criteria for effective encapsulation and define the scope of microcapsule application by selecting appropriate substances, their concentrations, and formation conditions. A common method for producing microcapsules involves the dropwise addition of the encapsulating polyelectrolyte into a solution containing a surfactant, leading to the formation of a protective membrane on its surface.
The properties of the shell were extrapolated from the results of studies on the solid chitosan–dodecyl sulfate complex. Chitosan powder was used to prepare the surfactant-polyelectrolyte complex. Sodium dodecyl sulfate, in the form of granules, was employed as the anionic surfactant. Through preparative methods, X-ray fluorescence analysis, and potentiometric titration, data were obtained regarding the elemental composition and yield of both soluble and insoluble complexes, as well as the degree of saturation of functional groups. Experiments showed that chitosan completely associates with sodium dodecyl sulfate and precipitates only when the surfactant-to-chitosan ratio is two. This condition resulted in no polyelectrolyte in solution, complete precipitation, and a typical ratio of marker elements – sulfur and nitrogen – in the complex. This ratio was used for microcapsule synthesis.
To determine the sorption capacity of the microcapsules, an apparatus for their production was created. After a specific contact time with a lead solution, the filtrate was distilled into an analysis container. The mixture obtained after filtration was subjected to voltammetric analysis: a sample and a concentrated background solution containing mercury ions were introduced into an electrochemical cell. Measurements were performed using an ‘Ecotest-VA’ voltammetric analyzer with a rotating disk glassy carbon electrode by anodic stripping voltammetry. Lead ion removal from aqueous solutions reached 84 %, substantially exceeding the sorption of the insoluble chitosan complex and being comparable to activated carbon’s performance. This indicates additional sorption due to lead ions traversing the insoluble surfactant-polyelectrolyte membrane.
Keywords: chitosan, sodium dodecyl sulfate, encapsulation, sorption, heavy metals, stripping voltammetry, X-ray diffraction analysis, potentiometric titration.
References
- Semkina O. A., Beloshapkina O. M., Javakhyan M. A., Criteria for assessing qualitative and quantitative indicators of microcapsules, Issues of biological, medical and pharmaceutical chemistry, 24 (12), 11 (2021). (in Russ.).
- Zargar V., Asghari M., Dashti A., A review on chitin and chitosan polymers: structure, chemistry, solubility, derivatives, and applications, ChemBioEng Reviews, 2 (3), 204 (2015).
- Yakovishin L., Tkachenko E., Tolstenko Y., Korzh E., Development and IR spectroscopic analysis of composite materials based on poly(methyl methacrylate) and chitosan, Materials Science Forum, 1065, 145 (2022).
- Yakovishin L. A., Tkachenko E. V., Composite materials based on dental acrylic plastic and chitosan, Chimica Techno Acta, 8 (4), 20218413 (2021).
- Taranovskaya E. A., Sobgaida N. A., Alferov I. N., Morev P. V., Wastewater treatment using chitosan, Bulletin of OSU, 10, 322 (2015). (in Russ.).
- Tkachenko E. V., Rusyaev S. V., Study of the sorption capacity of the chitosan-dodecyl sulfate sodium complex using the example of lead ion sorption, Scientific Notes of the V. I. Vernadsky Crimean Federal University. Biology. Chemistry, 9 (2), 268 (2023). (in Russ.).
- Rinodo M., Kildeeva N. R., Babak V. G., Surfactant-polyelectrolyte complexes based on chitin derivatives, Russian Chemical Journal, 52 (1), 84 (2008). (in Russ.).
- Vikhoreva G. A., Babak V. G., Galich E. F., Galbraich L. S., Complexation in the sodium dodecyl sulfate-chitosan system, High-molecular compounds, 39 (6), 947 (1997). (in Russ.).
- Pyshkina O. A., Novoskoltseva A. A., Yaroslavov A. A., Polyelectrolytes, 97 p. (MSU, Moscow, 2022). (in Russ.).
- Pogorelov M. V., Gusak E. V., Babich I. M., Kalinkevich O. V., Kalinkevich A. N., Samokhvalov I. I., Danilchenko S. N., Sklyar A. M., Sorption of metal ions by chitosan-based materials, Journal of Clinical and Experimental Medical Research, 2 (1), 88 (2014). (in Russ.).