Ученые записки Крымского федерального университета имени В. И. Вернадского
Биология. Химия. Том 11 (77). 2025. № 1. С. 226–249.
УДК 616.379-008.64: 57.084.1
DOI 10.29039/2413-1725-2025-11-1-226-249
ОСОБЕННОСТИ ИЗМЕНЕНИЯ БИОХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ КРОВИ КРЫС В УСЛОВИЯХ РАЗНЫХ ЭКСПЕРИМЕНТАЛЬНЫХ МОДЕЛЕЙ АЛЛОКСАН-ИНДУЦИРОВАННОГО ДИАБЕТА
Чуян Е. Н., Ливенцов С. Ю., Дворецкая Н. И.
Федеральное государственное автономное образовательное учреждение высшего
образования «Крымский федеральный университет им. В. И. Вернадского», Симферополь,
Республика Крым, Россия
E-mail: elena-chuyan@rambler.ru
Необходимость современных исследований заключается в применении надежных экспериментальных моделей сахарного диабета (СД) на животных как для понимания патогенеза заболевания, так и для разработки новых медикаментозных и немедикаментозных методов его лечения. В экспериментальной практике наибольшее распространение получила химическая модель СД, в том числе с применением аллоксана, которая позволяет вызвать выраженные метаболические нарушения у крыс, сопровождающиеся устойчивым повышением содержания глюкозы в крови. В настоящем исследовании изучены изменения паттерна биохимических показателей крови крыс при аллоксан-индуцированном диабете в разных экспериментальных моделях (однократное введение доз 150 и 200 мг/кг, дробное введение (через 24 часа по 100 мг/кг) суммарной дозы 300 мг/кг). Летальность животных, изменения массы тела и биохимических показателей сыворотки крови, характеризующих углеводный, липидный, белковый обмены и воспалительный процесс, крыс всех экспериментальных групп свидетельствовали о существенном нарушении метаболизма, однако выраженность изменений зависела от экспериментальной модели и дозы вводимого аллоксана: дробное введение аллоксана в суммарной дозе 300 мг/кг привело к наиболее выраженным метаболическим нарушениям на фоне статистически значимого снижения летальности.
Ключевые слова: сахарный диабет; экспериментальные модели; аллоксан-индуцированный диабет; биохимические показатели крови крыс; углеводный, жировой, белковый обмены.
ВВЕДЕНИЕ
Сахарный диабет (СД) является третьим по распространенности неинфекционным заболеванием, приводящим к ранней инвалидизации и высокой смертности. По данным Международной диабетической федерации, в 2021 году около 537 миллионов взрослых (20–79 лет) страдают СД, число которых, по разным оценкам, возрастёт до 643 миллионов к 2030 году и 783 миллионов к 2045 году во всем мире [1]. СД описывается как гетерогенный синдром, обусловленный абсолютным (СД типа 1) или относительным (СД типа 2) дефицитом инсулина, который в первую очередь вызывает нарушение углеводного обмена, связанное с гипергликемией, а затем и остальных звеньев метаболизма, что приводит к поражению всех органов и систем организма, в первую очередь сердечно-сосудистой системы и почек [2–4].
В условиях стремительного роста заболеваемости актуальным для современных научных исследований является применение надежных, воспроизводимых и экономически эффективных экспериментальных моделей СД на животных, как для понимания патогенеза заболевания, так и для разработки новых медикаментозных и немедикаментозных методов его лечения. Следует подчеркнуть, что адекватное моделирование СД является необходимой основой доклинических испытаний антидиабетических средств, а использование разнообразных моделей даёт возможность для обоснований экстраполяции экспериментальных результатов на людей, больных СД.
В экспериментальной практике наибольшее распространение получила достаточно простая, относительно не дорогая и соответствующая патогенезу СД у человека, химическая модель, в которой наиболее часто используются стрептозотоцин и аллоксан. Эти соединения являются структурными аналогами глюкозы, за счет чего накапливаются в β-клетках островков Лангерганса и приводят к их гибели, оставляя альфа- и дельта-клетки поджелудочной железы неповрежденными, позволяют вызвать выраженные метаболические нарушения у грызунов и других животных, сопровождающиеся снижением выработки и секреции в кровь инсулина, вызывая состояние, характеризующее инсулинзависимый диабет (СД типа 1) [5–8]. Однако аллоксан (2,4,5,6-тетраоксипиримидин; 5,6-диоксиурацил – гидрофильное нестабильное соединение, синтезируемое путем окисления мочевой кислоты) обладает более низким прямым цитотоксическим эффектом по сравнению со стрептозотоцином, что позволяет более точно определять сроки выбранных метаболических событий и их патофизиологические последствия [9].
Исследования диабетогенных свойств аллоксана направлены преимущественно на анализ ранних механизмов их цитотоксического действия на уровне островкового аппарата поджелудочной железы [10], при этом основные изменения показателей метаболизма развиваются у животных на отдаленных сроках после введения препарата (10-е сутки и далее), и именно на этих сроках, как правило, аллоксан-индуцированные модели используются для изучения особенностей процессов обмена веществ в условиях гипоинсулинемии, механизмов действия разрабатываемых препаратов для лечения диабета и т. д. При этом требуется определенная осторожность не только при выборе экспериментальной модели СД, но и дозы препарата, поскольку у животных должны развиться осложнения диабета, сходные по этиологии с заболеванием у человека. Доза аллоксана зависит главным образом от вида животного, способа введения и состояния питания. Диабетогенная доза аллоксана для крыс колеблется между 100 и 200 мг/кг [11–15]. По данным литературы, при моделировании СД экспериментальные животные – крысы разных линий – проявляют выраженную вариабельность индивидуальной чувствительности к диабетогенному действию цитотоксических аналогов глюкозы. Причины различной чувствительности в ответ на введение диабетогенных доз аллоксана определяются большим количеством факторов, в том числе возрастом, полом, состоянием нервной и эндокринной систем, характером обмена веществ, состоянием внутренних органов. Данный феномен может быть связан с различиями в состоянии окислительно-восстановительного баланса [16], с активностью процессов регенерации островкового аппарата поджелудочной железы, восстановления его структуры и функции [17], со степенью активации глюкокортикоидной функции надпочечников [18] и т. д. Существенными недостатками СД, индуцируемого аллоксаном, являются отсутствие четкой зависимости доза–эффект, а также нейро-, гепато- и нефротоксичность препарата. Поэтому однократное введение большой дозы соединения, как правило, вызывает дегенеративные изменения в почках, печени, легких, кишечнике, семенниках и головном мозге, возникающие у части животных прежде, чем развивается СД, а, следовательно, приводящие к высокой летальности животных уже в первые сутки после введения диабетогенной дозы аллоксана, что снижает эффективность модели для длительных экспериментов [19–21]. Снижение дозировки соединения позволяет уменьшить его токсичность и летальность экспериментальных животных, но не приводит к устойчивой долгосрочной гипергликемии, что, по-видимому, связано с недостаточным количеством разрушенных β-клеток поджелудочной железы. Однако сравнительных исследований выраженности нарушений метаболизма на длительных сроках развития аллоксан-индуцированного диабета в зависимости от дозы аллоксана и способа его введения крайне мало, хотя они необходимы для решения вопроса о выборе модели в зависимости от задач и дизайна эксперимента.
Цель исследования: выявить особенности изменения паттерна биохимических показателей крови крыс, характеризующих углеводный (УО), белковый (БО), липидный (ЛО) обмены и воспалительный процесс, в условиях разных экспериментальных моделей аллоксан-индуцированного диабета.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальная часть работы выполнена в Центре коллективного пользования научным оборудованием «Экспериментальная физиология и биофизика» кафедры физиологии человека и животных и биофизики Института биохимических технологий, экологии и фармации ФГАОУ ВО «КФУ им. В.И. Вернадского».
В исследование включались половозрелые самцы крыс (n=71) без внешних признаков заболеваний, физических дефектов и травм линии Wistar (федеральное государственное бюджетное учреждение «Петербургский институт ядерной физики им. Б.П. Константинова национального исследовательского центра «Курчатовский институт», питомник лабораторных животных «Рапполово») средних массы (272,32 ± 22,70 г) и возраста (150,00 ± 12,00 дней), которые проявляли признаки здорового состояния, никогда не использовались в качестве объекта исследования и прошли карантин (14 дней) и адаптацию к условиям эксперимента, взятию в руки (хэндлинг).
Лабораторные крысы содержались в условиях вивария с естественным свето-темновым циклом при температуре 18–22 °С, на подстиле на основе початков кукурузы (ООО «Зилубаг», Россия) со свободным доступом к воде и полноценному гранулированному корму ЛБК-120 (ЗАО «Тосненский комбикормовый завод», Россия). Все манипуляции с животными проводили согласно ГОСТ Р 53434-2009 от 02.12.2009, правилам лабораторной практики при проведении доклинических исследований, этическим стандартам, утвержденным правовыми актами Российской Федерации, ГОСТ 33215-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур», Директиве 2010/63/EU Европейского парламента и совета Европейского союза по охране животных, «European Convention for the Protectionof Vertebrate Animals Used for Experimental and other Scientific Purposes (ETS 123)», Strasbourg, 1986, рекомендациям Комиссии по биоэтике ФГАОУ ВО «КФУ им. В.И. Вернадского».
Предварительно рандомным образом («методом конвертов») всех экспериментальных животных разделили на 4 группы. Аллоксан-индуцированный диабет создавали путем внутрибрюшинного введения крысам 2 – 4 групп раствора аллоксан-моногидрата (C4H2N2O4·H2O; компания «Диаэм», Россия) в дозе 150 (однократно; 2 группа (Ал150); n=29) [11, 13, 14, 22], 200 (однократно; 3 группа (Ал200); n=19) [11, 23] и 300 (дробно, троекратно по 100 мг/кг через сутки; 4 группа (Ал300); n=13) мг/кг массы тела [12, 24] в 0,2 мл физиологического раствора. Аллоксан вводили крысам после голодания в течение 24 часов для того, чтобы избежать конкурентного ингибирования между аллоксаном и глюкозой [21] Животным контрольной группы (1 группа; n=10) внутрибрюшинно вводили эквивалентный объем физиологического раствора (0,2 мл) однократно (n=5) и дробно (3 раза) через сутки (n=5).
Перед введением аллоксана и на 7, 14, 21, 28 и 31 сутки наблюдения у животных всех экспериментальных групп определяли массу тела (г) на весах AND DL-120 (Япония), а для установления диабетического статуса концентрацию глюкозы (ммоль/л) в капиллярной крови, которую брали из надреза кончика хвоста с помощью тест-анализатора глюкозы (АйЧек (iСheck), Тайвань), принцип метода которого основан на применении биосенсорной технологии (в качестве сенсора использован фермент глюкозооксидаза), позволяющей провести специфичный анализ на содержание бетта-D-глюкозы (диапазон измерений составляет от 1,7 до 41,7 ммоль/л).
Для определения концентрации глюкозы и кетоновых тел (ммоль/л) в моче использовали тест-полоски индикаторные для качественного и полуколичественного анализа мочи «Урополиан-10В» (ООО «АНАЛИТИКА-ОМСК»).
На 32 сутки эксперимента в 10.00 натощак животных выводили из эксперимента путём декапитации на гильотине («НПК Открытая наука, Россия») под изофлурановым наркозом. Кровь из шейных вен отбирали в вакуумные пробирки с разделительным гелем для сыворотки.
Материалом для исследований служила сыворотка крови, полученная двукратным центрифугированием по 10 мин при 1300 g при 250 С. В сыворотке крови анализировали значения показателей, характеризующих состояние БО, ЛО, УО, и С-реактивного белка (СРБ) на автоматическом биохимическом анализаторе ERBA-XL-180 («ErbaLachema», Чехия) с использованием фирменных наборов реагентов, предназначенных для работы на этом приборе.
Для оценки УО в сыворотке крови анализировали концентрацию глюкозы (ммоль/л) методом Триндера [25]. Состояние ЛО в сыворотке крови крыс определяли по уровню общего холестерина (ОХС, ммоль/л) и триглицеридов (ТГ, ммоль/л) методом Триндера в модификации Roeschlau [26, 27], холестерина липопротеидов низкой (ЛПНП, ммоль/л) и высокой плотности (ЛПВП, ммоль/л) с помощью холестериноксидазной реакции и количественного метода Триндера [25, 28]. Вычисляли индекс атерогенности [29] по формуле:
(ОХС-ЛПВП)/ЛПВП.
БО в сыворотке крови крыс анализировали по уровню общего белка (ОБ, г/л) биуретовым методом [30], мочевины (ммоль/л) уреазным кинетическим ферментативным методом и креатинина (мкмоль/л) кинетическим методом Яффе (без депротеинизации) [31]. Концентрацию С-реактивного белка (СРБ, мг/л) в сыворотке крови определяли с помощью количественного высокочувствительного CРБ-анализа методом иммунотурбидиметрии (измерение продукта реакции антиген – антитело методом конечной точки) с пределом обнаружения около 0,13 мг/л и высоким диапазоном измерения (0–140 мг/л) [32, 33].
Статистическую обработку и графическое представление экспериментальных данных проводили с использованием программ STATISTICA версия 12 (Statsoft, США) и Microsoft Excel 2010 (Microsoft Corporation, США). Проверку распределения данных на нормальность осуществляли с помощью критерия Шапиро-Уилка. Поскольку распределение данных в подавляющем большинстве случаев не соответствовало нормальному, значимость различий между группами оценивали с помощью непараметрического критерия Краскела-Уоллиса. Множественные апостериорные сравнения (post-hoc comparisons) значений показателей между группами проводили с помощью критерия Данна (Bonferroni-Dunn post hoc test, Dunn’s multiple comparison post-test). В таблице, на рисунках и в тексте значения показателей для соответствующей группы крыс представлены в виде медианы и нижнего и верхнего квартилей (Me (Q25:Q75)). В описании сравнения значений показателей в разных группах животных использовались %, которые рассчитывались по значениям медианы показателей соответствующих групп. Критический уровень значимости статистических гипотез (р) в данном исследовании принимали равным 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
После введения диабетогенных доз аллоксана наблюдалось несколько фаз изменений сахарной кривой в крови: первая фаза – гипергликемическая, достигающая максимума в течение первых 2–4 часов; вторая – гипогликемическая, которая в основном проявлялась на протяжении 15–24 часов, и третья фаза – фаза стойкой гипергликемии. Первые признаки СД у животных 2–4 групп проявлялись в виде изменения поведения (вялость, апатичность), потери массы тела, потускнении, потемнении и выпадении волосяного покрова, полидипсии, полиурии, гипергликемии, глюкоз- и кетонурии. Подобная форма реакции на введение аллоксана описана исследователями как диабетико-уремический синдром [11, 13, 15, 20].
В разные сроки развития аллоксан-индуцированного диабета погибло 42,62 % животных, что согласуется с данными других авторов [11, 20]. При этом летальность экспериментальных животных зависела от дозы аллоксана и способа его введения (однократно или дробно) и составила: во 2 группе (Ал150) 44,83 % (на 5–7 и 17–20 сутки наблюдения); в 3 группе (Ал200) 47,36 % (на 2–4 сутки наблюдения); в 4 (Ал300) 30,77 % (на 4, 14 и 21 сутки наблюдения). В контрольной группе гибели животных не наблюдалось.
Таким образом, минимальная летальность при аллоксан-индуцированном диабете зарегистрирована у крыс, которым вводили максимальную дозу препарата (300 мг/кг), но дробным способом, а максимальная – после однократного введения аллоксана в дозе 200 мг/кг.
У животных всех групп отмечалось изменение массы тела (рис. 1). В контрольной группе крыс наблюдалось увеличение массы тела, которая на 31 день наблюдения увеличилась на 16 % (p=0,002) от исходного значения. В экспериментальных группах, после введения аллоксана, напротив, зарегистрировано снижение массы тела в течение всего срока наблюдения. Так, в группах Ал150, Ал200 и Ал300 масса тела к 31 суткам наблюдения уменьшилась на 26 % (p1,2<0.001), 22 % (p=0,006) и 22 % (p1,4=0,011) соответственно относительно значений в контрольной группе крыс (рис 1), что является характерным признаком нарушения метаболических процессов при развитии аллоксан-индуцированного диабета и согласуется с данными других авторов [6, 23].
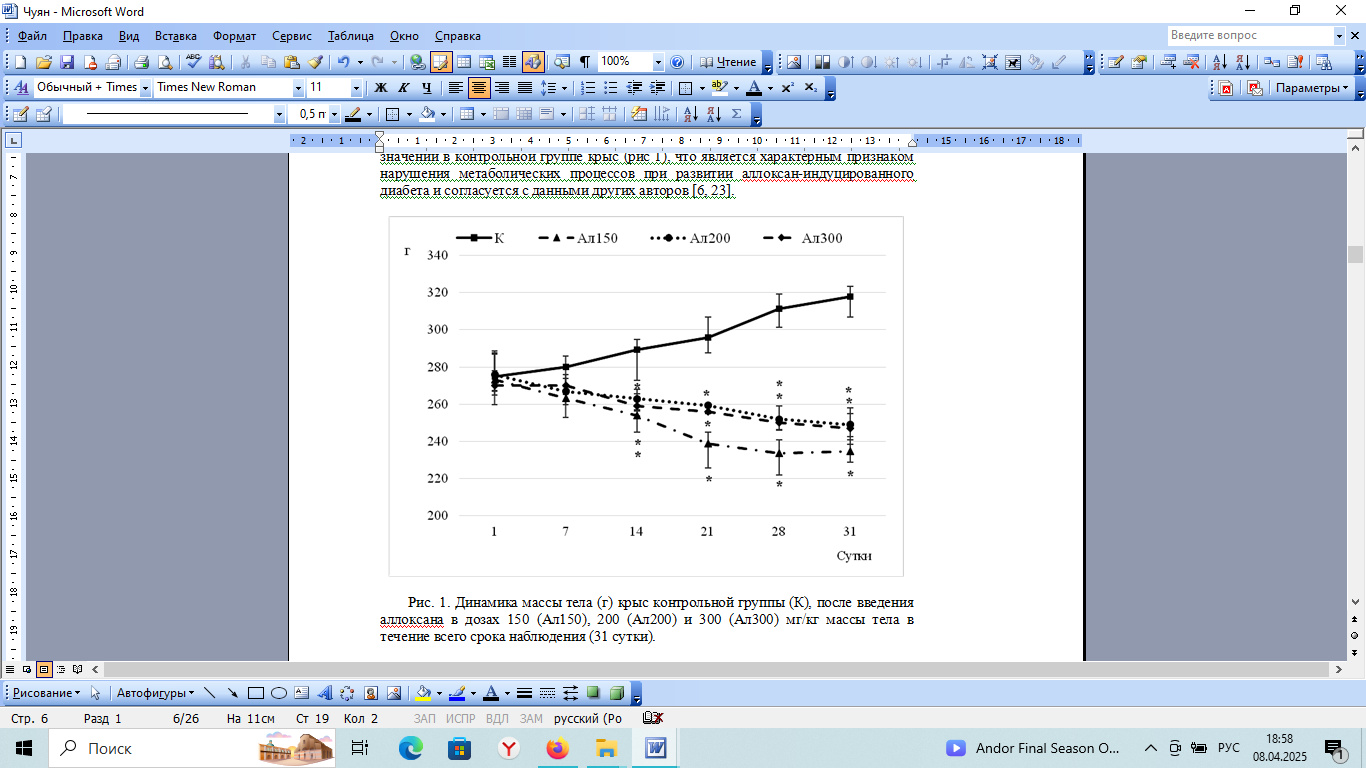
Рис. 1. Динамика массы тела (г) крыс контрольной группы (К), после введения аллоксана в дозах 150 (Ал150), 200 (Ал200) и 300 (Ал300) мг/кг массы тела в течение всего срока наблюдения (31 сутки).
Примечания: на графике представлены значения в виде медианы и нижнего и верхнего квартилей (Me (Q25:Q75)); * статистически значимое отличие по критерию Данна относительно значений показателей у крыс контрольной группы (p<0,05).
Концентрация глюкозы в капиллярной крови крыс контрольной группы на протяжении всего срока наблюдения (31 сутки) составила от 4,4 (3,9;5,3) до 4,7 (3,9;5,3) ммоль/л (рис. 2), что согласуется с данными других исследователей. На фоне развития аллоксан-индуцированного диабета зарегистрировано повышение уровня глюкозы в капиллярной крови крыс, что согласуется с литературными данными [15, 23]. Максимальное увеличение уровня глюкозы после введения препарата в наиболее ранний срок (7 сутки) наблюдалось у крыс 4 группы (Ал300) и составило 20,37 (20,37;25,2) ммоль/л, что на 338 % (p<0,001) превышало значение этого показателя у крыс контрольной группы. У животных 3 группы (Ал200) максимальная гликемия зарегистрирована 14 (27,4 (27,4;31,5) ммоль/л; на 477 % больше, чем в контроле (p<0,001)) и 21 (20,9 (16,1;23,8) ммоль/л; на 371 % больше, чем в контроле (p<0,001)) сутки эксперимента и статистически значимо превышала значение этого показателя у животных контрольной группы до конца эксперимента. У крыс 2 группы (Ал150) концентрация глюкозы в капиллярной крови с 7 (17,9 (14,0;22,0)) по 28 (10,3 (9,9;10,4)) сутки исследования также достоверно превышала значения этого показателя в контроле (p<0,05), однако была значимо ниже, чем у крыс 3 и 4 групп, а к 31 суткам эксперимента значения концентрации глюкозы приблизились к уровню контрольных значений (p=0,069) (рис. 2).
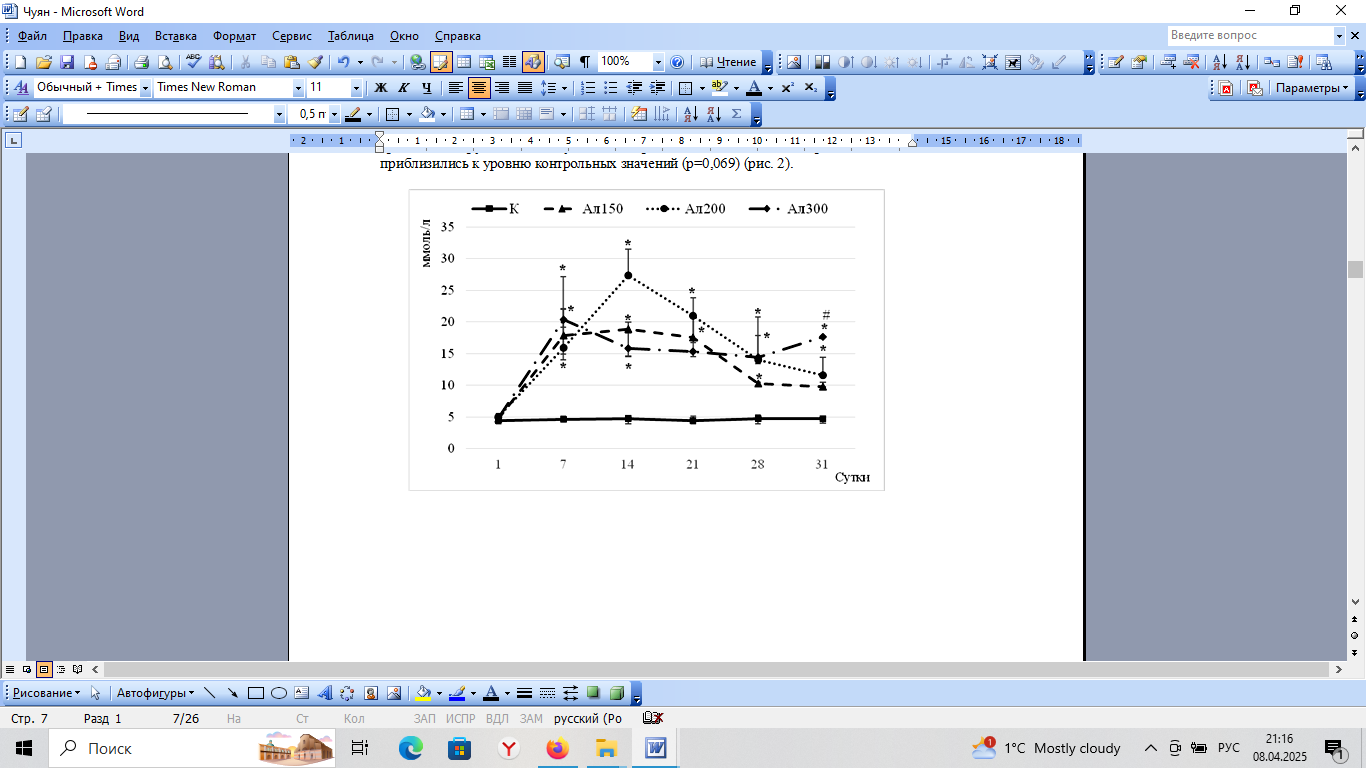
Рис. 2. Динамика концентрации глюкозы (ммоль/л) в крови крыс контрольной группы (К), после введения аллоксана в дозах 150 (Ал150), 200 (Ал200) и 300 (Ал300) мг/кг массы тела в течение всего срока наблюдения (31 сутки).
Примечания: # статистически значимое отличие относительно значений показателей у крыс группы Ал150 (p < 0,05) по критерию Данна; остальные как на рис. 1.
На 32 сутки наблюдения в сыворотке крови крыс контрольной группы гликемия составила 3,90 (3,70;4,00) ммоль/л, что соответствует физиологической норме [15, 34]. При этом концентрация глюкозы в сыворотке крови крыс через месяц после введения аллоксана в дозе 150 мг/кг увеличилась на 187 % (p=0,477), в дозе 200 мг/кг – на 367 % (p=0,001), в дозе 300 мг/кг – на 595 % (p<0,001) относительно значения этого показателя в контроле (табл. 1).
Таблица 1
Изменение биохимических показателей в сыворотке крови крыс контрольной группы (контроль), после введения аллоксана в дозах 150 (2), 200 (3) и 300 (4) мг/кг массы тела на 32 сутки экспериментального исследования (Me (Q25:Q75))
| ГруппаПоказатели | Контроль (1)n=10 | Аллоксан 150 (2) n=16 | Аллоксан 200 (3) n=10 | Аллоксан 300 (4) n=9 |
| Глюкоза (ммоль/л) | 3,90 (3,70; 4,00) | 11,20 (9,22;10,82) p1,2=0,477 | 18,20 (18,00;18,20) p1,3=0,001 p2,3=0,034 | 27,10 (27,10;27,10) p1,4<0,001 p2,4<0,001 p3,4=0,461 |
| Холестерин (ммоль/л) | 1,44 (1,37;1,53) | 1,35 (1,34;1,36) p1,2=1,000 | 1,93 (1,91;1,94) p1,3=0,465 p2,3=0,009 | 2,43 (2,43;2,43) p1,4=0,004 p2,4<0,001 p3,4=0,303 |
| Триглицериды (ммоль/л) | 1,29 (1,09;1,53) | 1,57 (1,55;1,60) p1,2=1,000 | 1,80 (1,58;1,80) p1,3=0,249 p2,3=1,000 | 2,67 (2,67;2,67) p1,4<0,001 p2,4<0,001 p3,4=0,121 |
| ЛПНП (ммоль/л) | 0,19 (0,15;0,21) | 0,35 (0,34;0,35) p1,2=0,477 | 0,89 (0,89;0,90) p1,3=0,001 p2,3=0,034 | 1,91 (1,91;1,91) p1,4<0,001 p2,4<0,001 p3,4=0,461 |
| ЛПВП (ммоль/л) | 0,82 (0,80;0,84) | 0,47 (0,44;0,47) p1,2=0,202 | 0,35 (0,35;0,37) p1,3<0,001 p2,3=0,008 | 0,37 (0,37;0,37) p1,4=0,001 p2,4=0,105 p3,4=1,000 |
| Общий белок (г/л) | 77,00 (74,00;78,00) | 60,00 (60,00;61,00) p1,2=0,011 | 55,00 (55,00;56,00) p1,3<0,001 p2,3=0,162 | 63,00 (60,00; 63,00) p1,4=0,312p2,4=1,000 p3,4=0,014 |
| Мочевина (ммоль/л) | 7,60 (7,60;7,9) | 11,90 (10,00;12,00) p1,2=0,027 | 13,80 (12,90;13,90)p1,3<0,001 p2,3=0,178 | 11,80 (11,80;12,00) p1,4=0,105 p2,4=1,000 p3,4=0,171 |
| Креатинин (мкмоль/л) | 75,00 (73,00;80,00) | 43,00 (41,00;43,00) p1,2=0,062 | 40,00 (40,00;44,00)p1,3=0,023 p2,3=1,000 | 27,00 (27,00;27,00) p1,4<0,001 p2,4=0,016 p3,4=0,198 |
Примечание: n – количество животных в группе; p1,2, p1,3, p1,4, p2,3, p2,4, p3,4 – уровень значимости отличий по критерию Данна между группами, обозначенными 1, 2, 3 соответственно.
Увеличение уровня глюкозы в крови животных после введения аллоксана отмечено и в других исследованиях [13–15, 22, 23, 35] и является характерным признаком развития СД, в том числе аллоксан-индуцированного. В нашем исследовании показано, что наиболее выраженный уровень гипергликемии как в капиллярной крови, так и в сыворотке крови, полученной из шейных вен после декапитации животных, зарегистрирован у крыс 4 группы (Ал300) (рис. 2; табл. 1).
Аллоксан представляет собой структурный аналог глюкозы, за счет чего связывается с транспортером глюкозы 2-го типа (GLUT2) в плазматической мембране β-клеток поджелудочной железы экспериментальных животных. Основным механизмом деструктивного действия аллоксана является генерация в циклической реакции с диалуроновой кислотой активных форм кислорода, которые инициируют разрушение β-клеток поджелудочной железы, имеющих низкую активность ферментов антиоксидантной защиты, или алкилирование ДНК, что вызывает снижение синтеза и секреции в кровь инсулина [10, 11, 36]. Кроме того, аллоксан ингибирует глюкокиназу, необходимую для секреции инсулина в ответ на стимуляцию глюкозой [37]. В ответ на введение препарата в организме животных запускается процесс, который проходит несколько последовательных фаз, описанных S. Lensen [10], в результате которого развиваются гипергликемия и диабетический синдром, аналогичный инсулинозависимому сахарному диабету 1 типа. Экспериментально доказано, что через 30 суток после введения крысам аллоксана происходило снижение концентрации инсулина в плазме крови на 34 % на фоне структурных нарушений со стороны островкового аппарата поджелудочной железы (уменьшение количества панкреатических островков, дистрофические изменения панкреатоцитов в виде кариопикноза и кариолизиса, признаки зернистой дистрофии или вакуолизации цитоплазмы), междольковых сосудов и микроциркуляторного русла в виде эндотелиоцитоза, полнокровия и капилляростаза [35, 38, 39].
Развитие гипергликемии стимулирует медленное прогрессирование нарушений углеводного обмена, повышение вязкости крови и в целом оказывает патологическое системное воздействие на функционирование всех органов и систем организма, поскольку инсулин является важнейшим анаболическим гормоном, который регулирует не только углеводный, но и липидный и белковый обмены [4].
Следует отметить, что у всех животных выделенных экспериментальных групп уже с первых суток после введения диабетогенного препарата увеличилась величина глюкозурии (со 2 суток после введения аллоксана и составила более 56 ммоль/л) и кетонурии (максимально с 3 суток (1,5–4,0 ммоль/л) до 5 суток (16,0 ммоль/л)). Известно, что для подтверждения диагноза «сахарный диабет» достаточно наличие повышения концентрации глюкозы в крови в сочетании с наличием глюкозы и кетоновых тел в моче. Референтное значение уровня кетоновых тел в моче является отрицательным, то есть в норме в моче кетонурия не выявляется, а ее появление свидетельствует о снижении интенсивности синтеза гликогена в печени при СД [40]. Диабетический кетоацидоз – это опасное для жизни состояние, которое может возникнуть при недостатке или полном отсутствии инсулина.
Присутствие кетоновых тел в моче свидетельствует о тяжелых нарушениях не только углеводного, но и липидного обмена, поскольку в условиях недостаточной утилизации глюкозы основным энергетическим субстратом в организме становятся свободные жирные кислоты. Окислительные процессы жирных кислот в печени связаны с образованием кетоновых тел, которые далее с током крови попадают в ткани. Негативные состояния, связанные с проявлением кетонурии, обусловлены накоплением в крови ацетона, который в силу его хорошей растворимости в липидах изменяет структурно-функциональные свойства мембран и, тем самым, проявляет общее токсическое влияние на организм.
В настоящем исследовании моделирование диабета с помощью аллоксана в разных дозах привело к изменениям биохимических показателей, характеризующих ЛО (табл. 1). У крыс контрольной группы концентрация ОХС в сыворотке крови составила 1,44 (1,37;1,53) ммоль/л, что соответствует физиологической норме [34]. Значение этого показателя у крыс группы Ал150 имело тенденцию к снижению (на 6 %; p=1,000), а группы Ал200 – к повышению (на 34 %; p=0,530) относительно значений у животных контрольной группы. При этом у животных 4 группы (Ал300) содержание ОХС статистически значимо на 69 % (p<0,001) превышало этот показатель в контрольной и на 80 % (p<0,001) во 2 (Ал150) группах крыс.
Следовательно, введение аллоксана в дозе 300 мг/кг привело к выраженной гиперхолестеринемии, что согласуется c литературными данными относительно влияния аллоксан-индуцированного диабета на уровень ОХС [13, 15, 20, 41]. Повышение уровня ОХС в крови свидетельствует о мобилизации ТГ из жировых депо, которые являются основным источником энергии на фоне гипергликемии. Действительно, у крыс 4 группы (Ал300) уровень ТГ в сыворотке крови достоверно вырос на 39 % (p<0,001) относительно значений в контрольной группе (табл. 1; рис. 3). Через месяц после введения крысам аллоксана в дозах 150 и 200 мг/кг уровень ТГ достоверно не отличался от такового в контрольной группе крыс (табл. 1).
Определение фракций холестерина в составе липопротеидов является важнейшим диагностическим критерием выявления фактора риска развития атеросклероза и его осложнений при СД. Аллоксановый диабет вызвал разнонаправленные изменения ЛПНП и ЛПВП, выраженность которых зависела от дозы вводимого крысам аллоксана. Во 2 группе крыс (Ал150) уровень ЛПНП статистически значимо не отличался от значений у животных в контроле (p=0,477). Однако в 3 (Ал200) и особенно в 4 (Ал300) группах концентрация ЛПНП, окисление которых является значимым событием в инициации атеросклеротического процесса [42], достоверно возрастала на 368 % (p=0,001) и 905 % (p<0,001) соответственно относительно значения этого показателя у животных контрольной группы (табл. 1).
Концентрация антиатерогенных ЛПВП в сыворотке крови крыс с аллоксан-индуцированным диабетом, напротив, снизилась: у крыс 2 группы (Ал150) на 43 % (p=0,202); 3 группы (Ал200) на 57 % (p<0,001) и 4 группы (Ал300) на 55 % (p<0,001) по сравнению с контролем (табл. 1). ЛПВП крови, участвующие в транспорте холестерина из периферических тканей в печень, где он в результате биохимических процессов окисляется до желчных кислот, которые выводятся в кишечник и удаляются из организма, препятствуют развитию воспалительного процесса, тромбоза, улучшают функционирование эндотелия, увеличивая активность и количество эндотелиальной NO-синтазы, тем самым повышая эндотелий-зависимую вазодилатацию, защищают от окисления белковую и липидную части ЛПНП, а, следовательно, обладают атеропротективными свойствами, являясь своеобразной защитой организма от различных сердечно-сосудистых осложнений [40–45]. Большое значение имеет тот факт, что ЛПВП могут прямо влиять на метаболизм глюкозы, стимулируя секрецию инсулина из панкреатических бета-клеток [46].
Таким образом, при аллоксан-индуцированном диабете у крыс 3 (Ал200) и особенно 4 (Ал300) групп отмечались значительные изменения липидограмм, сопровождающиеся гиперхолестеринемией, гипертриглицеридемией на фоне снижения концентрации ЛПВП и повышения концентрации ЛПНП, которые свидетельствуют о том, что дислипидемия при СД имеет атеросклеротическую направленность и указывают на риск развития диабетических ангиопатий [46, 47]. В данном исследовании развитие аллоксанового диабета привело к существенному росту индекса атерогенности у животных 3 и 4 групп до 4,51 (4,12;4,62) и 5,56 (5,56;5,56) соответственно, что в 6,35 (p<0,001) и 7,83 (p<0,001) превосходит таковой у крыс контрольной группы (рис. 3) и свидетельствует о наличии у животных этих групп атеросклеротических изменений сосудистого русла, что отражается, по данным других авторов [38], в гистологической картине крупных сосудов, характерной для диабетической ангиопатии.
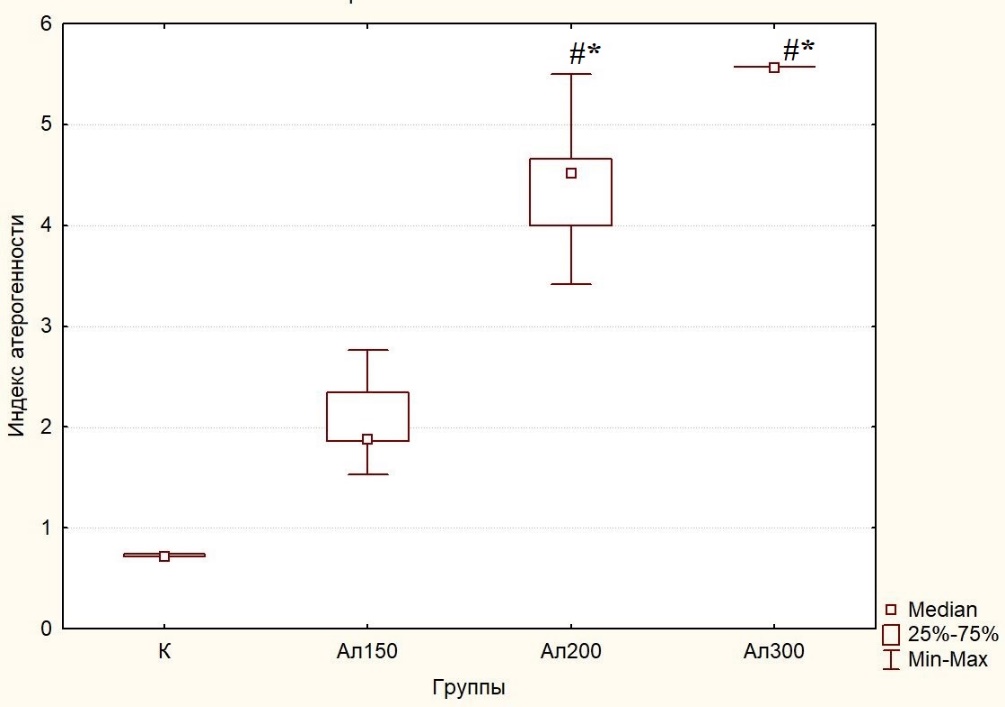
Рис. 3. Индекс атерогенности сыворотки крови крыс контрольной группы (К), после введения аллоксана в дозах 150 (Ал150), 200 (Ал200) и 300 (Ал300) мг на 1 кг массы тела на 32 сутки экспериментального исследования.
Примечания: те же, что на рис. 2.
Аллоксан-индуцированный диабет вызвал также существенные изменения биохимических показателей, характеризующих БО. Инсулиновая недостаточность при СД приводит к усиленному распаду тканевых белков, повышенному поступлению в кровь аминокислот, увеличению общего азота.
Концентрация ОБ (табл. 1) в сыворотке крови контрольной группы крыс не отличался от физиологической нормы [34]. В условиях аллоксан-индуцированного диабета концентрация ОБ снижалась относительно таковой в контроле: на 22 % (p=0,011) у крыс 2 группы (Ал150); на 29 % (p<0,001) у крыс 3 группы (Ал200); на 18 % (p=0,312) у крыс 4 группы (Ал300). При этом данный показатель оказался ниже референсных значений у крыс, т. е. наблюдалась гипопротеинемия, что может быть связано как с дегидратацией (недостаточное потребление воды, рвота, диарея, полиурия, диабетический ацидоз), так и с повышенным распадом белков в условиях существенной потери массы тела и развития патологических и воспалительных процессов (нарушениях функций переваривания и всасывания белков в результате нарушения деятельности поджелудочной железы), усилением распада белков в тканях при абсцессах и гангренах [48]. В данном эксперименте в экспериментальных группах животных наблюдались повреждения шерстяного покрова, кожные воспалительные реакции, что является косвенным подтверждением наличия, по крайней мере, хотя бы одного из таких патологических состояний. Указанные изменения оказались более выраженными у крыс после однократного введения аллоксана в дозах 150 и 200 мг/кг, чем в 4 группе крыс после дробного введения аллоксана в дозе 300 мг/кг. Это свидетельствует о более сильном повреждающем эффекте однократного введения аллоксана по сравнению с дробным.
Уровень мочевины (табл. 1) в контрольной группе крыс находился в границах физиологической нормы [34], однако после введения аллоксана крысам экспериментальных групп, ее концентрация в сыворотке крови значимо повышалась: у животных 2 группы (Ал150) на 57 % (p=0,027); у крыс 3 группы (Ал200) на 82 % (p<0,001); у крыс 4 группы (Ал300) на 55 % (p=0,105), что свидетельствует о нарушении БО, развитии уремии и указывает на наличие патологических изменений функций печени и почек [40]. При этом очевидно, что такие изменения оказались более выраженными при однократном введении аллоксана в дозах 150 и 200 мг/кг (табл. 1; рис. 4).
Уровень креатинина (табл. 1) в контрольной группе не выходил за пределы физиологической нормы [34]. На фоне аллоксан-идуцированного диабета наблюдалось достоверное снижение концентрации креатинина в сыворотке крови на 43 % (р=0,062) у крыс 2 группы, 47 % (p=0,023) у крыс 3 группы и 64 % (p<0,001) у крыс 4 группы (табл. 1: рис. 4). Креатинин – единственный метаболит креатина, который в основном (98 %) локализуется в поперечно-полосатых мышцах, а его концентрация в моче и сыворотке крови коррелирует с оценкой мышечной массы. Следовательно, снижение данного показателя свидетельствует о существенном уменьшении мышечной и общей массы экспериментальных животных за счет катаболизма белка, что согласуется с результатами, полученными в данном исследовании и представленными на рис. 1. Существует также связь между снижением уровня креатинина в сыворотке крови с гиперфильтрацией почечных клубочков и с повышенным метаболическим риском СД [49–51].
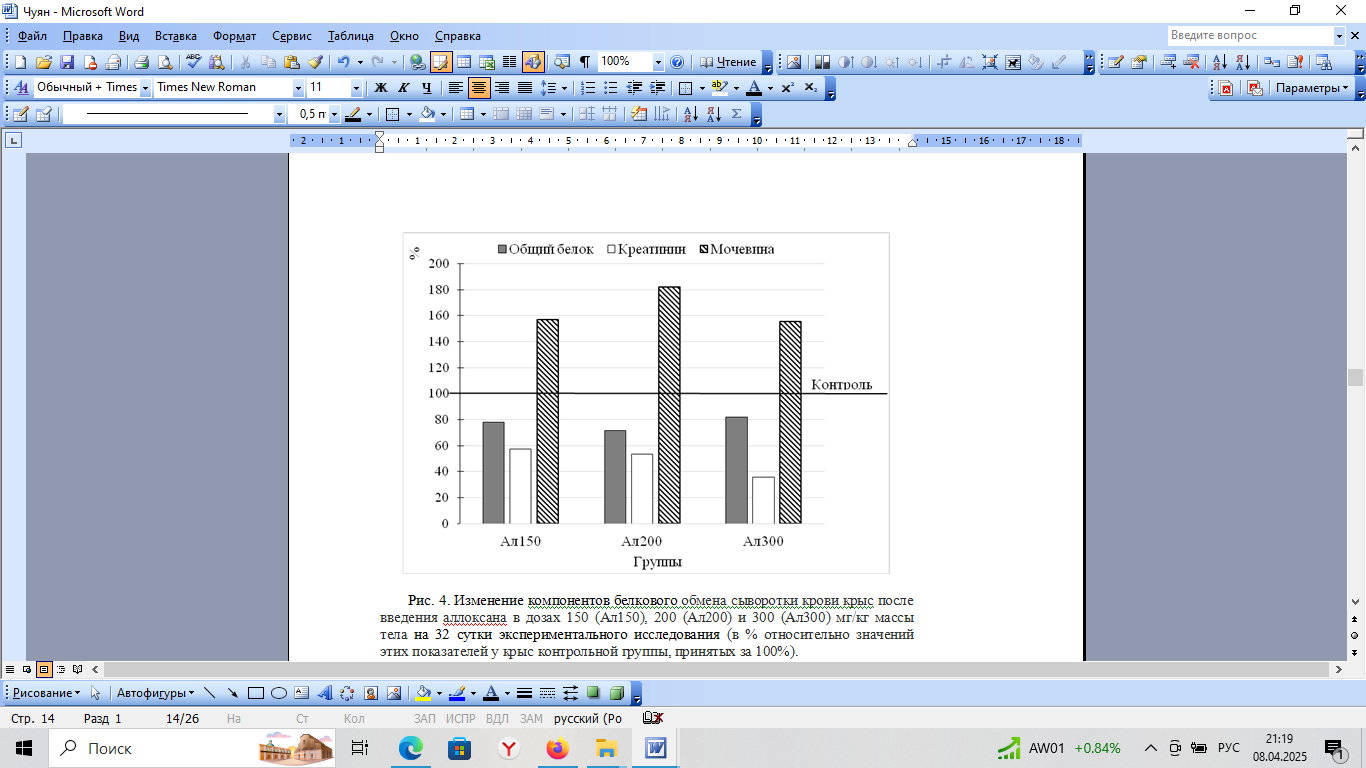
Рис. 4. Изменение компонентов белкового обмена сыворотки крови крыс после введения аллоксана в дозах 150 (Ал150), 200 (Ал200) и 300 (Ал300) мг/кг массы тела на 32 сутки экспериментального исследования (в % относительно значений этих показателей у крыс контрольной группы, принятых за 100 %).
Таким образом, изменения биохимических показателей, характеризующих ЛО и БО, произошли у животных в результате развития у них аллоксан-индуцированного диабета и могут быть следствием нарушения функций не только поджелудочной железы, но и почек и печени [52]. Структурные нарушения и механизмы повреждения печени при СД типа 1 у человека и животных обусловлены наличием инсулинзависимого механизма обмена глюкозы в гепатоцитах, участием этого органа во всех видах обмена и в инактивации 40–60 % инсулина, подтверждены на экспериментальных моделях и описаны в работах многих исследователей [24, 53]. Известно, что в гепатоцитах и клетках почечных канальцев крыс также, как и в поджелудочной железе, экспрессируется транспортер глюкозы GLUT2, поэтому введение аллоксана может оказывать токсическое действие на печень и почки [19], хотя гепатоциты крыс обладают более высокой антиоксидантной активностью, чем β-клетки островкового аппарата поджелудочной железы [37]. Диабетическое поражение печени связано прежде всего с ее жировой инфильтрацией с последующим некрозом и апоптозом гепатоцитов. Морфологические исследования показывают наличие значительных деструктивных процессов в печени крыс через 30 суток после введения аллоксана, в том числе очаговых некрозов гепатоцитов, что, вероятно, связано с усилением процессов свободнорадикального окисления, развивающихся вследствие накопления высвобождающихся из адипоцитов свободных жирных кислот [39].
Диабетическая нефропатия является одним из тяжелых хронических осложнений СД 1 типа и развивается приблизительно у 20,1 % больных [54]. В основе почечного повреждения, связанного с гипергликемией, лежит гликирование структурных белков организма с последующей их фиксацией на базальных мембранах почечных клубочков и отложением иммунных комплексов. Причем, нефротоксическое действие аллоксана, связанное с некрозом отдельных участков извитых канальцев почек, проявляется уже на ранних сроках после его введения, а почечная недостаточность, возникающая у части животных в первые пять суток после введения диабетогенной дозы аллоксана может стать причиной гибели крыс до развития СД [11]. На 30 сутки аллоксан-индуцированного диабета в почках крыс выявлены значительные нарушения гломерулярного аппарата, связанные с повреждением капиллярных петель, межпетлевыми спайками, формированием поврежденных «лапчатых» клубочков, а также существенное расширение мочевого пространства капсулы клубочков, свидетельствущее о нарушении проницаемости сосудистой стенки, дистрофические изменения эпителия канальцев и лимфогистиоцитарная инфильтрация интерстиция почки [55]. Известно, что развитие диабетической нефропатии при СД зависит от степени компенсации углеводного обмена: при декомпенсированном течении СД концентрация мочевины и креатинина ниже, чем при компенсированом течении заболевания. Поэтому можно предположить, что у крыс 3 и 4 групп на фоне введения аллоксана в дозах 200 и 300 мг/кг развивался СД более тяжелой степени, чем у крыс 2 группы, которым вводили более низкую дозу препарата.
Помимо непосредственных биохимических маркеров, таких как патологически повышенные уровни глюкозы и кетоновых тел в крови и моче, которые характеризуют начало развития СД, нарушений липидного и белкового обменов, приводящих к хроническим ангио-, ретино-, нефропатиям, печеночной патологии (стеатоз, гликогеновая гепатопатия и диабетический гепатосклероз) и другим тяжелым осложнениям, все большее число клинических исследований в последнее время фокусируется на биохимических маркерах, которые могут идентифицировать и/или выявить наличие и прогрессирование воспаления при СД, поскольку в патогенезе СД 1 типа имеют место воспалительные и аутоиммунные реакции, контролируемые иммунокомпетентными клетками крови и тканей и опосредованные цитокинами [35, 56]. Эти маркеры включают анализ изменений в сыворотке крови уровня СРБ, который синтезируется гепатоцитами в виде белка с относительной молекулярной массой 118 кДа, состоящего из пяти идентичных субъединиц, образующих циклический пентамер. Как показали результаты исследования, у крыс контрольной группы концентрация СРБ в сыворотке крови составила 0,30 (0,20;0,40) мг/л, а на 32 сутки моделирования аллоксан-индуцированного диабета увеличилась на 400 % (p=0,272) у крыс 2 (Ал150) группы, на 1200 % (p<0,001) у крыс 3 (Ал200) группы и на 767 % (p=0,008) у крыс 4 (Ал300) группы (рис. 5), что свидетельствует о проявлении симптомов острого воспаления при СД [4, 57].
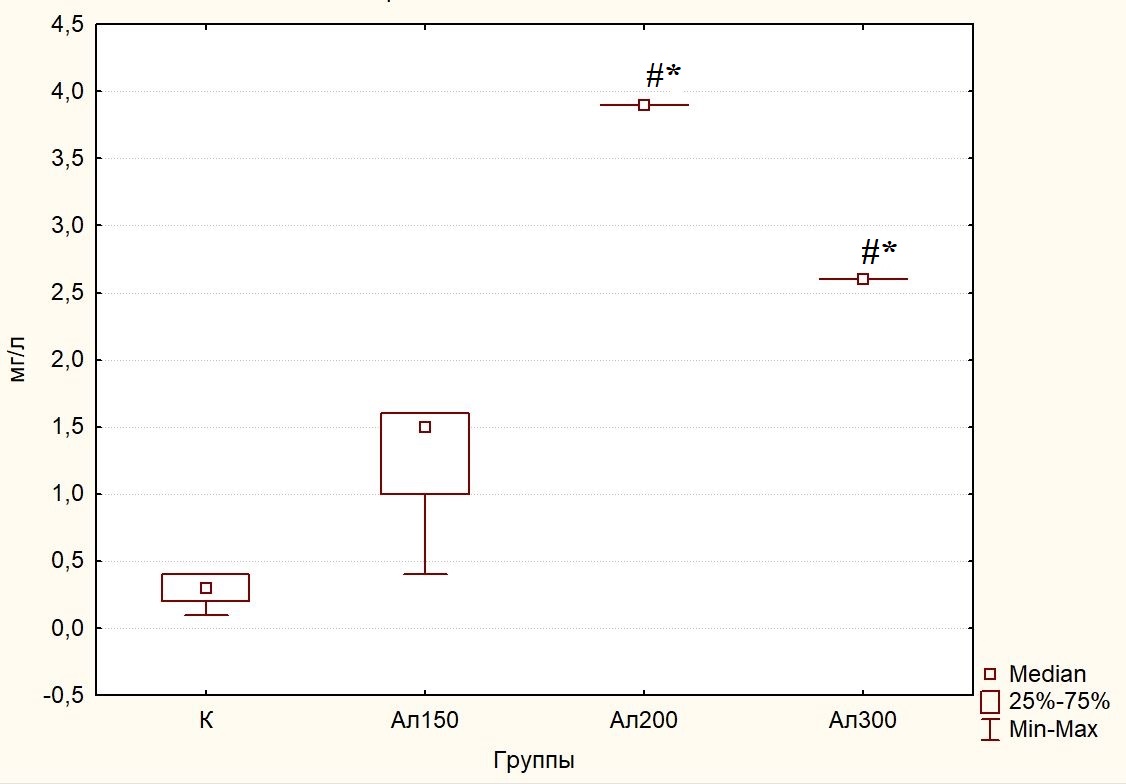
Рис. 5. Концентрация С-реактивного белка (мг/л) в сыворотке крови крыс контрольной группы (К), после введения аллоксана в дозах 150 (Ал150), 200 (Ал200) и 300 (Ал300) мг/кг массы тела на 32 сутки экспериментального исследования.
Примечания: те же, что на рис. 2.
В настоящее время появляется все больше публикаций, посвященных роли СРБ, определенного высокочувствительным методом, не только для прогнозирования и категоризации рисков развития сердечно-сосудистых осложнений, но и в диагностике СД. Гипергликемия в крови стимулирует выработку избыточного количества свободных радикалов, в том числе активных форм кислорода и азота, которые вызывают окислительный стресс, воспалительную реакцию, характеризующуюся повышением уровня СРБ в крови [57–59].
Введение крысам аллоксана, обладающего направленным токсическим действием в отношении инсулиноцитов [10], вызывает запуск воспалительного процесса. Согласно данным литературы, деструктивные процессы в панкреатических островках инициируют миграцию макрофагов, которые осуществляют фагоцитоз и презентацию β-клеточных антигенов Naïve CD4+
T-лимфоцитам, инициируя аутоиммунную реакцию против β-клеток [60]. Более того, макрофаги способны секретировать провоспалительные цитокины TNFα, IL-1, IL-6 (увеличение их уровня в плазме крови крыс с аллоксановым СД является закономерным явлением, отражающим развитие воспалительного процесса в островковой части поджелудочной железы крыс) и активные формы кислорода, которые являются триггерами каскада биологических реакций при СД и способствуют деструкции β-клеток [4]. В процессе развития аллоксанового диабета воспалительные реакции становятся системными, поскольку происходит повсеместное накопление гликированных белков (отражением является увеличение количества гликозилированного гемоглобина на 30 сутки исследования) и приводят к формированию хронических осложнений СД, таких как микроангиопатии, нейропатии, нефропатия, ретинопатия [35].
Установлено, что уровень СРБ у больных СД и сердечно-сосудистыми заболеваниями можно рассматривать в качестве маркера воспаления, окислительного стресса и эндотелиальной дисфункции, выраженность которых нарастает параллельно повышению средних значений этого показателя и ассоциируется с риском развития сердечно-сосудистых заболеваний [61–63]. Общим и взаимоотягощающим патогенетическим механизмом развития этих патологических состояний является дисфункция эндотелия и вялотекущее воспаление в интиме сосудов (отражением может быть уровень СРБ), основой которых служит дисбаланс медиаторов, обеспечивающих в норме оптимальное течение всех эндотелий зависимых процессов — барьерной функции, миграции клеток крови в сосудистую стенку и регуляции сосудистого тонуса, синтеза факторов, участвующих в гемостазе, иммуногенезе и воспалении [64, 65]. СД способствует развитию сердечно-сосудистых заболеваний посредством различных метаболических, структурных и биохимических изменений [66]. Хроническая гипергликемия способствует окислительному стрессу, повреждению тканей, увеличивая риск развития микрососудистых (ретинопатия, нефропатия и невропатия) и макрососудистых осложнений (застойная сердечная недостаточность, инсульт, ишемическая болезнь сердца, инфаркт миокарда и заболевания периферических сосудов).
ЗАКЛЮЧЕНИЕ
В ходе экспериментального исследования получены данные, подтверждающие эффективность аллоксановой модели диабета, которая в связи с низкой стоимостью, достаточно хорошей воспроизводимостью (заболеваемость у крыс составляет около 80 %), быстрым развитием заболевания (через 2–3 суток после введения препарата) имеет определенные преимущества перед другими моделями. Однако в результате высоких токсичности соединения для почек, печени и других органов, а, следовательно, летальности животных (минимум 30 %) необходимо обоснование эффективных доз аллоксана для достижения стабильной и длительной гипоинсулемии и гипергликемии.
Проведен сравнительный анализ выраженности нарушений метаболизма на длительных сроках развития аллоксанового диабета (32 дня) в зависимости от дозы (150, 200 и 300 мг/кг) и способа введения (однократно или дробно) препарата. Как показали экспериментальные исследования, направленность изменений биохимических показателей, характеризующих углеводный, липидный и белковый обмены, а также СРБ в используемых моделях аллоксан-индуцированного диабета одинакова и связана с разрушением β-клеток поджелудочной железы, снижением синтеза и секреции в кровь инсулина, гипергликемией, глюкоз- и кетонурией, однако их выраженность зависит от дозы и способа введения диабетогенного препарата.
У крыс 2 группы после однократного введения аллоксана в дозе 150 мг/кг концентрация глюкозы в крови достоверно превышала значения этого показателя в контроле (p<0,05) с 7 по 28 сутки исследования, а к 31 суткам эксперимента её значения приблизились к уровню контрольных значений (рис. 2; табл. 1). Это свидетельствует о том, что гипергликемия, возникающая у животных после введения аллоксана в дозе 150 мг/кг, нестабильна и может оказаться обратимым процессом, который по истечении определенного времени приведет к нормализации уровня глюкозы крови, а, следовательно, данную модель СД невозможно использовать в длительных экспериментах (более 30 дней). Особенности изменения биохимических показателей крови крыс этой группы, проведенные через 32 дня после введения аллоксана, также продемонстрировали отсутствие статистически значимых изменений (за исключением концентрации общего белка и мочевины в сыворотке крови) по сравнению с контролем, что свидетельствует о развитии непродолжительного СД легкой или средней тяжести.
Наиболее выраженный уровень гипергликемии как в капиллярной крови, так и в сыворотке крови, полученной из шейных вен после декапитации животных, зарегистрирован у крыс после введения однократной дозы аллоксана 200 мг/кг и особенно суммарной дозы 300 мг/кг (троекратно по 100 мг/кг через сутки). Изменения биохимических показателей сыворотки крови крыс этих экспериментальных групп свидетельствуют о существенном нарушении жирового и белкового метаболизма, развитии воспалительного процесса, что может быть следствием нарушения функций и структуры не только поджелудочной железы, но и почек, печени, кровеносных сосудов и других органов и свидетельствует о развитии СД тяжелой степени. При этом дробное введение аллоксана в суммарной дозе 300 мг/кг привело к наиболее выраженным метаболическим нарушениям на фоне статистически значимого снижения летальности по сравнению с однократным введением аллоксана в дозах 150 и 200 мг/кг.
Работа выполнена в рамках программы исследований № АААА-А21-121011990099-6 «Физиологические механизмы биологического действия факторов разной природы и интенсивности» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского».
Список литературы
- Sun H. IDF diabetes atlas: global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045 / H. Sun, P. Saeedi, S. Karuranga [et al.] // Diabetes Res. Clin. Pract. – 2022. – Vol. 183. – P. 109–119.
- Jwad M. Types of diabetes and their effect on the immune system / M. Jwad, H. Yousif Al-Fatlawi, P. D. Student // J. Adv. Pharm. Pract. – 2022. – Vol. 4, No. 1. – P. 21–30.
- Stanifer J. W. Prevalence, risk factors, and complications of diabetes in the Kilimanjaro region: a population-based study from Tanzania / J. W. Stanifer, C. R. Cleland, G. J. Makuka [et al.] // PLoS One. – 2016. – Vol. 11, No. 10. – P. e0164428.
- Дедов И. И. Сахарный диабет в Российской Федерации: распространенность, заболеваемость, смертность, параметры углеводного обмена и структура сахароснижающей терапии по данным федерального регистра сахарного диабета, статус 2017 г. / И. И. Дедов, М. В. Шестакова, О. К. Викулова [и др.] // Сахарный диабет. – 2018. – Т. 21, № 3.
- Gati M. A. Physiological and histological study of experimental diabetes mellitus by alloxan / M. A. Gati // Int. J. Adv. Res. – 2016. – Vol. 4, No. 3. – P. 1814–1818.
- Бафаев Ж. Т. Особенности типологических свойств животных в клиническом течении экспериментальной модели аллоксанового диабета / Ж. Т. Бафаев, А. А. Мавланов, З. Н. Хамидова // Новый день в медицине. – 2022. – Т. 1, № 39. – С. 257–263.
- Rashmi P. Rodent models for diabetes / P. Rashmi, A. Urmila, A. Likhit [et al.] // 3 Biotech. – 2023. – Vol. 13. – P. 80.
- Madhariya R. Experimental animal models: tools to investigate antidiabetic activity / R. Madhariya, B. Dixena, A. Ram [et al.] // Curr. Pharm. Des. – 2023. – Vol. 29, No. 2. – P. 79–94.
- Зайчик А. Ш. Патофизиология. Т. 2. Основы патохимии / А. Ш. Зайчик, Л. П. Чурилов. – СПб. : Элби-СПб., 2001. – 687 с.
- Lenzen S. The mechanisms of alloxan- and streptozotocin-induced diabetes / S. Lenzen // Diabetologia. – 2008. – Vol. 51. – P. 216–226.
- Баранов В. Г. Экспериментальный сахарный диабет. Роль в клинической диабетологии / В. Г. Баранов, И. М. Соколоверова, Э. Г. Гаспарян [и др.]. – Л. : Наука, 1983. – 240 с.
- Данилова И. Г. Способ моделирования аллоксанового диабета / И. Г. Данилова, И. Ф. Гетте: Патент на изобретение № 2534411; заявл. 27.11.2014; опубл. 27.11.2014. – Бюл. № 33.
- Эльбекьян К. С. Особенности протекания аллоксан-индуцированного сахарного диабета у экспериментальных крыс / К. С. Эльбекьян, А. Б. Ходжаян, Ф. А. Биджиева [и др.] // Медицинский вестник Северного Кавказа. – 2019. – Т. 14, № 1.2. – С. 264–267.
- Fajarwati I. Administration of alloxan and streptozotocin in Sprague Dawley rats and the challenges in producing diabetes model / I. Fajarwati, D. D. Solihin, T. Wresdiyati, I. Batubara // IOP Conf. Ser.: Earth Environ. Sci. – 2023. – Vol. 1174, No. 1. – P. 012035.
- Биджиева Ф. А. Биохимические особенности аллоксан индуцированного сахарного диабета / Ф. А. Биджиева // Медицинский алфавит. – 2018. – Т. 31, № 2. – С. 12–14.
- Behr G. A. Pancreas b-cells morphology, liver antioxidant enzymes and liver oxidative parameters in alloxan-resistant and alloxan-susceptible Wistar rats: a viable model system for the study of concepts into reactive oxygen species / G. A. Behr, E. G. da Silvaa, A. Romanelli [et al.] // Fundam. Clin. Pharmacol. – 2008. – Vol. 22. – P. 657–666.
- Закирьянов А. Р. Диабетические осложнения у крыс при длительных сроках моделирования сахарного диабета 1-го типа / А. Р. Закирьянов, М. А. Плахотний, Н. А. Онищенко [и др.] // Патол. физиол. эксперим. терапии. – 2007. – № 4. – С. 21–25
- Selyatitskaya V. G. Adrenocortical system activity in alloxan-resistant and alloxan-susceptible Wistar rats / V. G. Selyatitskaya, N. A. Palchikova, N. V. Kuznetsova // J. Diabetes Mellit. – 2012. – Vol. 2, No. 2. – P. 165–169.
- Elsner M. Importance of the GLUT2 glucose transporter for pancreatic beta cell toxicity of alloxan / M. Elsner, M. Tiedge, B. Guldbakke [et al.] // Diabetologia. – 2002. – Vol. 45, No. 11. – P. 1542–1549.
- Пальчикова Н. А. Гормонально-биохимические особенности аллоксановой и стрептозотоциновой моделей экспериментального диабета / Н. А. Пальчикова, Н. В. Кузнецова, О. И. Кузьминова, В. Г. Селятицкая // Бюл. СО РАМН. – 2013. – Т. 33, № 6. – С. 18–24.
- Radenković M. Experimental diabetes induced by alloxan and streptozotocin: the current state of the art / M. Radenković, M. Stojanović, M. Prostran // J. Pharmacol. Toxicol. Methods. – 2016. – Vol. 78. – P. 13–31.
- Торопова А. А. Влияние комплексного фитосредства на углеводный обмен, морфофункциональное состояние поджелудочной железы при экспериментальном аллоксан-индуцированном сахарном диабете / А. А. Торопова, Я. Г. Разуваева // Вестник Бурятского государственного университета. Медицина и фармация. – 2024. – № 3. – С. 41‒48.
- Ральченко И. В. Влияние метформина и инсулина на метаболические нарушения при аллоксановом диабете / И. В. Ральченко, С. Шилали, С. Н. Толстогузов // Сибирское медицинское обозрение. – 2023. – № 3. – С. 78–83.
- Блинкова Н. Б. Модуляция макрофага как фактор регуляции регенераторных процессов в печени крыс с аллоксановым диабетом / Н. Б. Блинкова, И. Г. Данилова, М. Т. Абидов // Гены и Клетки. – 2017. – Т. 12, № 3. – С. 44–44.
- Barcham D. An improved color reagent for the determination of blood glucose by the oxidase systeme / D. Barcham, P. Trinder // Analyst. – 1972. – Vol. 97, No. 151. – P. 142–145.
- Allain C. Enzymatic determination of total serum cholesterol / C. Allain, L. Poon, G. Chan [et al.] // Clin. Chem. – 1974. – Vol. 20, No. 4. – P. 470–475.
- Roeschlau P. Enzymatische Bestimmung des Gesampt-Cholesterins in serum / P. Roeschlau, E. Bernt, W. A. Gruber // Clin. Chem. Clin. Biochem. – 1974. – Vol. 12, No. 5. – P. 226–227.
- Nauk M. Measurement of high-density-lipoprotein cholesterol / M. Nauk, D. Wiebe, G. Warnick // Handbook of lipoprotein testing. – 2nd ed. – Washington DC: AACC Press, 2001. – P. 221–244.
- Климов А. Н. Обмен липидов и липопротеидов и его нарушения / А. Н. Климов. – СПб.: Питер, 1999. – 512 с.
- Cornall A. G. Determination of serum proteins by means of the biuret reaction / A. G. Cornall, C. J. Bardawill, M. M. David // J. Biol. Chem. – 1949. – Vol. 177, No. 2. – P. 751–766.
- Burtis C. A. Tietz textbook of clinical chemistry and molecular diagnostics / C. A. Burtis, E. R. Ashwood, D. E. Bruns. – 5th ed. – St. Louis: Elsevier, 2012.
- Claus D. R. Radioimmunoassay of human C-reactive protein and levels in normal sera / D. R. Claus, A. P. Osmand, H. Gewurz // J. Lab. Clin. Med. – 1976. – Vol. 87. – P. 120–128.
- Hind C. R. H. The role of serum C-Reactive protein (CRP) measurement in clinical practice / C. R. H. Hind, M. B. Pepys // Int. Med. – 1984. – Vol. 5. – P. 112–151.
- Макаров В. Н. Справочник. Физиологические, биохимические и биометрические показатели нормы экспериментальных животных / В. Н. Макаров, М. Н. Макарова. – СПб.: ЛЕМА, 2013 – 118 с.
- Данилова И. Г. Цитокиновая регуляция регенераторных процессов в поджелудочной железе при аллоксановом сахарном диабете у крыс и его коррекции соединением ряда 1,3,4-тиадиазина и липоевой кислотой / И. Г. Данилова, В. В. Емельянов, И. Ф. Гетте [и др.] // Медицинская иммунология. – 2018. – Т. 20, № 1. – С. 35–44.
- Яшанова М. И. Валидность моделей экспериментального диабета для изучения окислительного стресса / М. И. Яшанова, Т. Г. Щербатюк, В. Ю. Николаев // Журн. медико-биологических исследований. – 2019. – Т. 7, № 1. – С. 66–78.
- Szkudelski T. The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas / T. Szkudelski // Physiol. Res. – 2001. – No. 50. – P. 536–546.
- Михайличенко В. Ю. Эффект трансплантации культуры клеток поджелудочной железы при аллоксановом сахарном диабете у крыс в эксперименте / В. Ю. Михайличенко, С. С. Столяров // Международный журнал прикладных и фундаментальных исследований. – 2015. – № 9. – С. 670–672.
- Ломаева С. В. Особенности обмена биополимеров соединительной ткани в печени крыс с аллоксановым диабетом / С. В. Ломаева, И. Ф. Гетте, Т. С. Булавинцева [и др.] // Бюллетень сибирской медицины. – 2013. – Т. 12, № 6. – С. 38–42.
- Клиническая лабораторная диагностика (методы и трактовка лабораторных исследований) / под ред. В. С. Камышникова. – М.: МЕДпресс-информ, 2015. – 720 с.
- Mistry J. Antidiabetic activity of mango peel extract and mangiferin in alloxan-induced diabetic rats / J. Mistry, M. Biswas, S. Sarkar [et al.] // Futur. J. Pharm. Sci. – 2023. – Vol. 9. – P. 22.
- Rye K. A. Antiinflammatory actions of HDL: a new insight / K. A. Rye, P. J. Barter // Arterioscler. Thromb. Vasc. Biol. – 2008. – Vol. 28. – P. 1890–1891.
- Smith J. D. Dysfunctional HDL as a diagnostic and therapeutic target / J. D. Smith // Arterioscler. Thromb. Vasc. Biol. – 2010. – Vol. 30. – P. 151–155.
- Kontush A. Antiatherogenic function of HDL particle subpopulations: focus on antioxidative activities / A. Kontush, M. J. Chapman // Curr. Opin. Lipidol. – 2010. – Vol. 21. – P. 312–318.
- Souza J. A. Small, dense HDL 3 particles attenuate apoptosis in endothelial cells: pivotal role of apolipoprotein A-I / J. A. Souza [et al.] // J. Cell. Mol. Med. – 2010. – Vol. 14. – P. 608–620.
- Van L. S. High-density lipoprotein at the interface of type 2 diabetes mellitus and cardiovascular disorders / L. S. Van [et al.] // Curr. Pharm. Des. – 2010. – Vol. 16. – P. 1504–1516.
- Андрейченко И. А. Информативность изменений биохимических параметров сыворотки крови при сахарном диабете 2-го типа / И. А. Андрейченко, С. Д. Галкин // Вестник новых медицинских технологий. – 2011. – № 4. – С. 184–186.
- Бородин Е. А. Биохимия и клиническая лабораторная диагностика / Е. А. Бородин. – Благовещенск : Амурская ГМА Минздрава России, 2021.
- Harita N. Lower serum creatinine is a new risk factor of type 2 diabetes: the Kansai healthcare study / N. Harita, T. Hayashi, K. K. Sato [et al.] // Diabetes Care. – 2009. – Vol. 32. – P. 424–426.
- Lorenzo C. Risk of type 2 diabetes among individuals with high and low glomerular filtration rates / C. Lorenzo, S. D. Nath, A. J. Hanley [et al.] // Diabetologia. – 2009. – Vol. 52. – P. 1290–1297.
- Hjelmesæth J. Low serum creatinine is associated with type 2 diabetes in morbidly obese women and men: a cross-sectional study / J. Hjelmesæth, J. Røislien, N. Nordstrand [et al.] // BMC Endocr. Disord. – 2010. – Vol. 10. – P. 6.
- Буеверов А. О. Поражение печени при сахарном диабете 1-го типа / А. О. Буеверов, А. В. Зилов // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2021. – Т. 31, № 2. – С. 7–13.
- Jiang S. Hepatic functional and pathological changes of type 1 diabetic mice in growing and maturation time / S. Jiang, X. Tang, K. Wang [et al.] // J. Cell. Mol. Med. – 2019. – Vol. 23, № 8. – P. 5794–5807.
- Борисов А. Г. Диабетическая нефропатия: современные принципы классификации, диагностики и особенности сахароснижающей терапии / А. Г. Борисов, С. В. Чернавский, М. А. Смирнова, А. А. Стремоухов // Лечащий Врач. – 2021. – № 9 (24). – С. 53–58.
- Блинкова Н. Б. Реакция иммунокомпетентных клеток на структурные повреждения почки при экспериментальном аллоксановом диабете / Н. Б. Блинкова, И. Г. Данилова, И. Ф. Гетте, Т. С. Булавинцева // Российский иммунологический журнал. – 2017. – Т. 11 (20), № 2. – С. 257–258.
- Heier M. Inflammation in childhood type 1 diabetes; influence of glycemic control / M. Heier, H. D. Margeirsdottir, C. Brunborg [et al.] // Atherosclerosis. – 2015. – Vol. 238, № 1. – P. 33–37.
- Suryadinata R. V. Effectiveness of Lime Peel Extract (Citrus aurantifolia Swingle) against C-Reactive Protein Levels in Alloxan-Induced Wistar Rats / R. V. Suryadinata, A. Lorensia, K. Sefania // Glob. Med. Health Commun. – 2021. – Vol. 9, № 1. – P. 23–28.
- Asmat U. Diabetes mellitus and oxidative stress—a concise review / U. Asmat, K. Abad, K. Ismail // Saudi Pharm. J. – 2016. – Vol. 24, № 5. – P. 547–553.
- Richardson S. J. The Prevalence of Enteroviral Capsid Protein Vp1 Immunostaining in Pancreatic Islets in Human Type 1 Diabetes / S. J. Richardson, A. Willcox, A. J. Bone, A. K. Foulis, N. G. Morgan // Diabetologia. – 2009. – Vol. 52. – P. 1143–1151.
- Sproston N. R. Role of C-reactive protein at sites of inflammation and infection / N. R. Sproston, J. J. Ashworth // Front. Immunol. – 2018. – Vol. 9. – P. 754.
- Artasensi A. Type 2 Diabetes Mellitus: A Review of Multi-Target Drugs / A. Artasensi, A. Pedretti, G. Vistoli, L. Fumagalli // Molecules. – 2020. – Vol. 25, № 8. – P. 1987.
- Marton L. T. The Effects of Curcumin on Diabetes Mellitus: A Systematic Review / L. T. Marton, L. M. Pescinini-E-Salzedas, M. E. C. Camargo [et al.] // Front. Endocrinol. – 2021. – Vol. 12. – P. 669448.
- Chiavaroli L. Effect of low glycaemic index or load dietary patterns on glycaemic control and cardiometabolic risk factors in diabetes: systematic review and meta-analysis of randomised controlled trials / L. Chiavaroli, D. Lee, A. Ahmed [et al.] // BMJ. – 2021. – Vol. 374. – P. 1651.
- Brevetti G. Endothelial dysfunction: a key to the pathophysiology and natural history of peripheral arterial disease? / G. Brevetti, V. Schiano, M. Chiariello // Atherosclerosis. – 2008. – Vol. 197. – P. 1–11.
- Sima A. V. Vascular endothelium in atherosclerosis / A. V. Sima, C. S. Stancu, M. Simionescu // Cell Tissue Res. – 2009. – Vol. 335, № 1. – P. 191–203.
- Ho K. L. Metabolic, structural and biochemical changes in diabetes and the development of heart failure / K. L. Ho, Q. G. Karwi, D. Connolly [et al.] // Diabetologia. – 2022. – Vol. 65. – P. 411–423.
FEATURES OF BIOCHEMICAL BLOOD PARAMETERS CHANGES IN RATS UNDER DIFFERENT EXPERIMENTAL MODELS OF ALLOXAN-INDUCED DIABETES
Chuyan E. N., Liventsov S. Yu., Dvoretskaya N. I.
Federal State Autonomous Educational Institution of Higher Education “Crimean Federal University
named after V. I. Vernadsky», Simferopol, Republic of Crimea, Russia
E-mail: elena-chuyan@rambler.ru
The necessity of modern research lies in the use of reliable experimental models of diabetes mellitus (DM) in animals, both for understanding the pathogenesis of the disease and for developing new pharmacological and non-pharmacological treatment methods. In experimental practice, the chemical model of DM, including the use of alloxan, is the most widespread. This model induces pronounced metabolic disorders in rats, accompanied by a persistent increase in blood glucose levels. Objective of the study: to identify the features of biochemical changes in the blood of rats with alloxan-induced DM in different experimental models.
Alloxan-induced diabetes was induced in male Wistar rats (n=71) of average weight (272.32±22.70 g) and age (150.00±12.00 days) by intraperitoneal administration of alloxan monohydrate at doses of 150 mg/kg (2-All150; n=29), 200 mg/kg (3-All200; n=19), and 300 mg/kg (4-All300; n=13; fractionally, 3 times, 100 mg/kg every other day). Rats in group 1 (control, n=10) received an equivalent volume of physiological saline (0.2 ml). During the development of DM, body weight and peripheral blood glucose levels (from the tail tip) were measured dynamically on days 7, 14, 21, 28, and 31. After the experiment was concluded (day 32), key biochemical parameters were measured in blood serum, including glucose, total cholesterol, high- and low-density lipoproteins, triglycerides, total protein, urea, creatinine, and C-reactive protein. The measurements were performed using an automated biochemical analyzer ERBA-XL-180 («ErbaLachema», Czech Republic) with proprietary reagent kits designed for this device. The significance of differences between groups was assessed using Dunn’s nonparametric test.
The results of the study showed that the mortality rate of experimental animals depended on the dose of alloxan and the administration method (single or fractional). In the second group (All150), mortality was 44.83 %; the highest was in the third group (All200) at 47.36 %; and the lowest was in the fourth group (All300) with fractional administration at 30.77 %. One month after alloxan administration, the animals developed DM, which was accompanied by polydipsia, polyuria, hyperglycemia, ketonuria, weight loss, dulling, darkening, and shedding of fur. The maximum increase in blood glucose concentration in group 4 rats was observed at the earliest stage (day 7; 20.3 mmol/L), while in group 3 rats, it peaked on day 14 (27.4 mmol/L). Changes in the biochemical parameters of rat serum in all experimental groups indicated significant disturbances in carbohydrate, lipid, and protein metabolism. However, the severity of these changes depended on the experimental model and the alloxan dose: fractional administration of alloxan at a dose of 300 mg/kg resulted in the most pronounced metabolic disturbances, while significantly reducing mortality.
Keywords: diabetes mellitus; experimental models; alloxan-induced diabetes; biochemical blood parameters in rats; carbohydrate, lipid, and protein metabolism.
References
- Sun H., Saeedi P., Karuranga S. IDF diabetes atlas: global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045, Diabetes Res. Clin. Pract, 183 (2022).
- Jwad M., Yousif Al-Fatlawi H. Types of diabetes and their effect on the immune system / Student // J. Adv. Pharm. Pract, 4, 1 (2022).
- Stanifer J. W., Cleland C. R., Makuka G. J. Prevalence, risk factors, and complications of diabetes in the Kilimanjaro region: a population-based study from Tanzania, PLoS One, 11, 10 (2016).
- Dedov I. I., Shestakova M. V., Vikulova O. K. Saharnyj diabet v Rossijskoj Federacii: rasprostranennost’, zabolevaemost’, smertnost’, parametry uglevodnogo obmena i struktura saharosnizhayushchej terapii po dannym federal’nogo registra saharnogo diabeta, status 2017 g. Saharnyj diabet, 21, 3 (2018)
- Gati M. A. Physiological and histological study of experimental diabetes mellitus by alloxan, Int. J. Adv. Res., 4, 3 (2016).
- Bafaev Zh. T., Mavlanov A. A., Hamidova Z. N. Osobennosti tipologicheskih svojstv zhivotnyh v klinicheskom techenii eksperimental’noj modeli alloksanovogo diabeta, Novyj den’ v medicine, 1, 39 (2022).
- Rashmi P., Urmila A., Likhit A. Rodent models for diabetes, 3 Biotech., 13 (2023).
- Madhariya R., Dixena B., Ram A. Experimental animal models: tools to investigate antidiabetic activity, Curr. Pharm. Des., 29, 2 (2023).
- Zajchik A. Sh., Churilov L. P. Patofiziologiya. Osnovy patohimii., 688 (SPb. Elbi-SPb., 2001).
- Lenzen S. The mechanisms of alloxan- and streptozotocin-induced diabetes, Diabetologia., 51 (2008).
- Baranov V. G., Sokoloverova I. M., Gasparyan E. G. Eksperimental’nyj saharnyj diabet. Rol’ v klinicheskoj diabetologii, 240 (L.: Nauka, 1983).
- Danilova I. G., Gette I. F. Sposob modelirovaniya alloksanovogo diabeta. Patent na izobretenie № 2534411; zayavl. 27.11.2014; opubl. 27.11.2014. – Byul. № 33.
- El’bek’yan K. S., Hodzhayan A. B., Bidzhieva F. A. Osobennosti protekaniya alloksan-inducirovannogo saharnogo diabeta u eksperimental’nyh krys, Medicinskij vestnik Severnogo Kavkaza, 14, 1 (2019).
- Fajarwati I., Solihin D. D., Wresdiyati T., Batubara I. Administration of alloxan and streptozotocin in Sprague Dawley rats and the challenges in producing diabetes model, IOP Conf. Ser.: Earth Environ. Sci., 1174, 1 (2023).
- Bidzhieva F. A. Biohimicheskie osobennosti alloksan inducirovannogo saharnogo diabeta, Medicinskij alfavit., 31, 2 (2018).
- Behr G. A. da Silvaa E. G., Romanelli A. Pancreas b-cells morphology, liver antioxidant enzymes and liver oxidative parameters in alloxan-resistant and alloxan-susceptible Wistar rats: a viable model system for the study of concepts into reactive oxygen species, Fundam. Clin. Pharmacol., 22 (2008).
- Zakir’yanov A. R., Plahotnij M. A., Onishchenko N. A. Diabeticheskie oslozhneniya u krys pri dlitel’nyh srokah modelirovaniya saharnogo diabeta 1-go tipa, Patol. fiziol. eksperim. terapii., 4 (2007).
- Selyatitskaya V. G., Palchikova N. A., Kuznetsova N. V. Adrenocortical system activity in alloxan-resistant and alloxan-susceptible Wistar rats, J. Diabetes Mellit., 2, 2 (2012).
- Elsner M., Tiedge M., Guldbakke B. Importance of the GLUT2 glucose transporter for pancreatic beta cell toxicity of alloxan, Diabetologia., 45, 11 (2002).
- Pal’chikova N. A., Kuznecova N. V., Kuz’minova O. I., Selyatickaya V. G. Gormonal’no-biohimicheskie osobennosti alloksanovoj i streptozotocinovoj modelej eksperimental’nogo diabeta, Byul., SO RAMN. 33, 6 (2013).
- Radenković M., Stojanović M., Prostran M. Experimental diabetes induced by alloxan and streptozotocin: the current state of the art, J. Pharmacol. Toxicol. Methods., 78 (2016).
- Toropova A. A., Razuvaeva Ya. G. Vliyanie kompleksnogo fitosredstva na uglevodnyj obmen, morfofunkcional’noe sostoyanie podzheludochnoj zhelezy pri eksperimental’nom alloksan-inducirovannom saharnom diabete, Vestnik Buryatskogo gosudarstvennogo universiteta. Medicina i farmaciya, 3 (2024).
- Ral’chenko I. V., Shilali S., Tolstoguzov S. N. Vliyanie metformina i insulina na metabolicheskie narusheniya pri alloksanovom diabete, Sibirskoe medicinskoe obozrenie, 3. (2023).
- Blinkova N. B., Danilova I. G., Abidov M. T. Modulyaciya makrofaga kak faktor regulyacii regeneratornyh processov v pecheni krys s alloksanovym diabetom, Geny i Kletki, 12, 3 (2017).
- Barcham D. Trinder P. An improved color reagent for the determination of blood glucose by the oxidase systeme, Analyst., 97, 151 (1972).
- Allain C., Poon L., Chan G. Enzymatic determination of total serum cholesterol, Clin. Chem., 20, 4 (1974).
- Roeschlau P., Bernt E., Gruber W. A. Enzymatische Bestimmung des Gesampt-Cholesterins in serum, Clin. Chem. Clin. Biochem., 12, 5 (1974).
- Nauk M., Wiebe D., Warnick G. Measurement of high-density-lipoprotein cholesterol Handbook of lipoprotein testing. – 2nd ed., Washington DC: AACC Press, (2001).
- Klimov A. N. Obmen lipidov i lipoproteidov i ego narusheniya, SPb.: Piter, (1999).
- Cornall A. G., Bardawill C. J., David M. M. Determination of serum proteins by means of the biuret reaction, J. Biol. Chem., 177, 2 (1949).
- Burtis C. A., Ashwood E. R., Bruns D. E. Tietz textbook of clinical chemistry and molecular diagnostics – 5th ed., St. Louis : Elsevier, (2012).
- Claus D. R., Osmand A. P., Gewurz H. Radioimmunoassay of human C-reactive protein and levels in normal sera, J. Lab. Clin. Med., 87. (1976).
- Hind C. R., Pepys M. B. H. The role of serum C-Reactive protein (CRP) measurement in clinical practice, Int. Med., 5 (1984).
- Makarov V. N., Makarova M. N. Spravochnik. Fiziologicheskie, biohimicheskie i biometricheskie pokazateli normy eksperimental’nyh zhivotnyh, SPb.: LEMA, 118 (2013).
- Danilova I. G., Emel’yanov V. V., Gette I. F. Citokinovaya regulyaciya regeneratornyh processov v podzheludochnoj zheleze pri alloksanovom saharnom diabete u krys i ego korrekcii soedineniem ryada 1,3,4-tiadiazina i lipoevoj kislotoj Medicinskaya immunologiya, 20, 1 (2018).
- Yashanova M. I., Shcherbatyuk T. G., Nikolaev V. Yu. Validnost’ modelej eksperimental’nogo diabeta dlya izucheniya okislitel’nogo stressa Zhurn. mediko-biologicheskih issledovanij, 7, 1 (2019).
- Szkudelski T. The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas, Physiol. Res., 50 (2001).
- Mihajlichenko V. Yu., Stolyarov S. S. Effekt transplantacii kul’tury kletok podzheludochnoj zhelezy pri alloksanovom saharnom diabete u krys v eksperimente, Mezhdunarodnyj zhurnal prikladnyh i fundamental’nyh issledovanij., 9 (2015).
- Lomaeva S. V., Gette I. F, Bulavinceva T. S. Osobennosti obmena biopolimerov soedinitel’noj tkani v pecheni krys s alloksanovym diabetom, Byulleten’ sibirskoj mediciny, 12, 6 (2013).
- Klinicheskaya laboratornaya diagnostika (metody i traktovka laboratornyh issledovanij) / pod red. V. S. Kamyshnikova, 720 (M.: MEDpress-inform, 2015).
- Mistry J., Biswas M., Sarkar S. Antidiabetic activity of mango peel extract and mangiferin in alloxan-induced diabetic rats, Futur. J. Pharm. Sci., 9. 22 (2023)
- Rye K.-A., Barter P. J. Antiinflammatory actions of HDL: a new insight, Arterioscler. Thromb. Vasc. Biol., 28 (2008).
- Smith J. D. Dysfunctional HDL as a diagnostic and therapeutic target, Arterioscler. Thromb. Vasc. Biol., 30 (2010).
- Kontush A. Chapman M. J. Antiatherogenic function of HDL particle subpopulations: focus on antioxidative activities, Curr. Opin. Lipidol., 21 (2010).
- Souza J. A. Small, dense HDL 3 particles attenuate apoptosis in endothelial cells: pivotal role of apolipoprotein A-I., J. Cell. Mol. Med., 14 (2010).
- Van L. S. High-density lipoprotein at the interface of type 2 diabetes mellitus and cardiovascular disorders., Curr. Pharm. Des, 16 (2010).
- Andrejchenko I. A., Galkin S. D. Informativnost’ izmenenij biohimicheskih parametrov syvorotki krovi pri saharnom diabete 2-go tipa, Vestnik novyh medicinskih tekhnologij., 4 (2011).
- Borodin E. A. Biohimiya i klinicheskaya laboratornaya diagnostika, Blagoveshchensk: Amurskaya GMA Minzdrava Rossii, (2021).
- Harita N., Hayashi T., Sato K. K. Lower serum creatinine is a new risk factor of type 2 diabetes: the Kansai healthcare study, Diabetes Care, 32 (2009)
- Lorenzo C., Nath S. D., Hanley A. J. Risk of type 2 diabetes among individuals with high and low glomerular filtration rates, Diabetologia, 52 (2009).
- Hjelmesæth J., Røislien J., Nordstrand N. Low serum creatinine is associated with type 2 diabetes in morbidly obese women and men: a cross-sectional study, BMC Endocr. Disord., 10, 6 (2010).
- Bueverov A. O., Zilov A. V. Porazhenie pecheni pri saharnom diabete 1-go tipa, Rossijskij zhurnal gastroenterologii, gepatologii, koloproktologii., 31, 2 (2021).
- Jiang S., Tang X., Wang K. Hepatic functional and pathological changes of type 1 diabetic mice in growing and maturation time, J. Cell. Mol. Med., 23, 8 (2019).
- Borisov A. G., Chernavskij S. V., Smirnova M. A., Stremouhov A. A. Diabeticheskaya nefropatiya: sovremennye principy klassifikacii, diagnostiki i osobennosti saharosnizhayushchej terapii, Lechashchij Vrach, 9,24 (2021).
- Blinkova N. B., Danilova I. G., Gette I. F., Bulavinceva T. S. Reakciya immunokompetentnyh kletok na strukturnye povrezhdeniya pochki pri eksperimental’nom alloksanovom diabete, Rossijskij immunologicheskij zhurnal, 11, 2 (2017).
- Heier M., Margeirsdottir H. D., Brunborg C. Inflammation in childhood type 1 diabetes; influence of glycemic control, Atherosclerosis, 238, 1 (2015).
- Suryadinata R. V., Lorensia A., Sefania K. Effectiveness of Lime Peel Extract (Citrus aurantifolia Swingle) against C-Reactive Protein Levels in Alloxan-Induced Wistar Rats, Glob. Med. Health Commun, 9, 1 (2021).
- Asmat U., Abad K., Ismail K. Diabetes mellitus and oxidative stress—a concise review, Saudi Pharm. J., 24, 5 (2016).
- Richardson S. J., Willcox A., Bone A. J., Foulis A. K., Morgan N. G. The Prevalence of Enteroviral Capsid Protein Vp1 Immunostaining in Pancreatic Islets in Human Type 1 Diabetes, Diabetologia, 52. (2009).
- Sproston N. R., Ashworth J. J. Role of C-reactive protein at sites of inflammation and infection, Front. Immunol, 9. (2018).
- Artasensi A. Pedretti A., Vistoli G., Fumagalli L. Type 2 Diabetes Mellitus: A Review of Multi-Target Drugs, Molecules, 25, 8 (2020).
- Marton L. T., Pescinini-E-Salzedas L. M., Camargo M. E. C. The Effects of Curcumin on Diabetes Mellitus: A Systematic Review, Front. Endocrinol, 12 (2021).
- Chiavaroli L., Ahmed D. Lee, A. Effect of low glycaemic index or load dietary patterns on glycaemic control and cardiometabolic risk factors in diabetes: systematic review and meta-analysis of randomised controlled trials, BMJ, 374 (2021).
- Brevetti G., Schiano V., Chiariello M. Endothelial dysfunction: a key to the pathophysiology and natural history of peripheral arterial disease, Atherosclerosis, 197 (2008).
- Sima A. V., Stancu C. S., Simionescu M. Vascular endothelium in atherosclerosis, Cell Tissue Res., 335, 1 (2009).
- Ho K.L. Karwi Q. G., Connolly D. L. Metabolic, structural and biochemical changes in diabetes and the development of heart failure, Diabetologia, 65 (2022).

