Ученые записки Крымского федерального университета имени В. И. Вернадского
Биология. Химия. Том 11 (77). 2025. № 2. С. 186–198.
УДК 591.175
DOI 10.29039/2413-1725-2025-11-2-186-198
ФУНКЦИОНАЛЬНАЯ ОЦЕНКА МЫШЦ ГОЛЕНИ КРЫСЫ ПРИ НАРУШЕНИИ ДВИГАТЕЛЬНОЙ АКТИВНОСТИ
Сабирова Д. Э.1,2, Еремеев А. А.1, Балтина Т. В.1
1Казанский (Приволжский) федеральный университет, Казань, Россия
2Научно-технологический университет «Сириус», Федеральная территория Сириус, Россия
Е-mail: sabirova.dianka@list.ru
Изучение механизмов влияния двигательной активности на состояние скелетных мышц является актуальным на сегодняшний день. Целью данной работы являлась оценка состояния скелетных мышц у крысы при нарушении двигательной активности. Животные были разделены на группы с денервацией, тенотомией, антиортостатическим вывешиванием и их комбинациями. Оценивались изменения максимальной амплитуды М-ответа в икроножной, камбаловидной и большеберцовой мышцах на 7 и 50 сутки. Денервация вызвала значительное снижение амплитуды М-ответа на 7 сутки, которое не восстановилось к 50 суткам. Тенотомия привела к снижению амплитуды в икроножной и камбаловидной мышцах, но повышению в большеберцовой. Антиортостатическое вывешивание с денервацией усугубило снижение амплитуды, а с тенотомией показало различные изменения в зависимости от мышцы. Результаты указывают на важность нейронального контроля и афферентной иннервации в поддержании функциональных свойств мышц.
Ключевые слова: антиортостатическое вывешивание, денервация, тенотомия, М-ответ, атрофия мышц.
ВВЕДЕНИЕ
Скелетные мышцы – высокодинамичная ткань, реагирующая на различные раздражители, особенно на изменения механической нагрузки [1–3]. При потенциальных внешних раздражителях скелетные мышцы могут подвергаться обширной реконструкции для удовлетворения потребностей в сокращении и энергетическом обмене за счет высокой степени пластичности [4]. Следовательно, более активное использование или неиспользование напрямую влияет на фенотип скелетных мышц, влияя на метаболизм, экспрессию белка и морфологические характеристики [1–3]. У человека, мышечная атрофия часто связана со снижением качества жизни, подвижности в целом и снижением индивидуальной независимости [5, 6].
Одной из моделей, обычно используемых для изучения гиподинамии, является разгрузка задних конечностей, при которой задние конечности отрываются от земли, чтобы снять нормальную гравитационную нагрузку на мышцы [7]. Существует несколько альтернатив этому методу, таких как тенотомия, нейрэктомия, паралич, вызванный ботулином, и одностороннее наложение повязки на конечность [8]. Разгрузка скелетных мышц вызывает атрофию мышц, как это наблюдается из-за иммобилизации гипсом, длительного постельного режима или воздействия микрогравитации. Это называется «простой атрофией», поскольку это внутренние процессы (например, атрофия, ограниченная пораженной конечностью), а не под действием внешних или системных факторов [9]. При этом существует взаимодействие между атрофией от бездействия и атрофией, связанной с болезнью. Например, многие заболевания, связанные с атрофией, связаны с малоподвижным образом жизни, который, вероятно, усугубляет атрофию, вызванную бездействием [10, 11]. Атрофия от дисфункции снижает функциональность мышц, приводит к инвалидности, нарушению обмена веществ и даже к преждевременной смерти. Поэтому понимание метаболических и механических факторов, способствующих атрофии мышц при дисфункции и стратегий ее смягчения остается интересом многих исследований. Тем не менее, механизмы развития атрофии мышц при дисфункции остаются плохо определенными. Изучение механизмов влияния различных факторов, в том числе влияние нервного контроля, опорной и проприоцептивной афферентации, имеет важное значение для понимания изменений функционального состояния мышц при бездействии. Выяснение ведущего фактора позволит углубить понимание механизмов управления движениями и будет иметь как фундаментальное, так и практическое значение для разработки новых методов и оптимизации существующих подходов к восстановлению морфо-функционального состояния мышечного аппарата после нарушений двигательной активности.
Целью данной работы являлась оценка изменения функционального состояния мышц голени у крысы при различных нарушениях двигательной активности, сочетанной с антиортостатическим вывешиванием.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования
Двадцать пять взрослых нелинейных лабораторных половозрелых крыс самцов (массой 180–220 г) были использованы в настоящем исследовании. Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены. Все процедуры, выполненные с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и одобрены Локальным этическим комитетом Казанского федерального университета протокол № 30 от 28. 06. 2021 г.
Все процедуры проводили под комбинированным внутримышечным наркозом с использованием золетила («Zoletil 50» «Virbac», Франция), 0,5 мг/кг и ксилавета инъекционного (XylaVET, «Pharmamagist Ltd», Венгрия) 0,05 мл/кг – 0,5 мл/кг. Эвтаназия животных осуществлялась путем декапитации на гильотине.
В качестве модели гравитационной разгрузки задних конечностей использовали метод антиортостатического вывешивания (АОВ) по E. R. Morey-Holton в модификации Е. А. Ильина и В. Е. Новикова [12, 13]. Перед АОВ животное усыплялось. Хвост обрабатывали антисептическим средством, обматывали гипоаллергенным дышащим пластырем примерно на две трети, чтобы защитить кожу и избежать повреждений хвоста. На пластырь крепили клейкую упругую полосу и устанавливали дополнительные бандажи лейкопластыря, чтобы сформировать ручку, за которую животное подвешивается таким образом, чтобы задние конечности не касались поверхности (рис. 1). Угол наклона к поверхности пола 30о. Животное помещали в специальную клетку размером 25х25х30 см с открытой верхней частью. Хвост фиксировали на специальном штыре с кольцом для свободного перемещения животного в клетке. Передняя стенка клетки была сделана из оргстекла и позволяла осуществлять постоянное наблюдение за животным.

Рис. 1. Антиортостатическое вывешивание задних конечностей у крысы, схематическое изображение.
Тенотомию мышц задней левой конечности у крыс проводили путем иссечения Ахиллова сухожилия. Ахиллово сухожилие было аккуратно отрезано от дистальной части, прикрепленной к пяточной кости, к проксимальной части на 3 мм длиной без повреждения нерва и кровоснабжения [14].
Денервацию проводили путем пережатия седалищного нерва по методике C. De Angelis (1994). Для этого у животных в асептических условиях на отпрепарированный седалищный нерв накладывали зажим типа «москит» на 40 секунд (в результате, часть нервных волокон может сохранить свои свойства и обеспечить проведение возбуждения); протяженность раздавленного участка – 2 мм; место пережатия – на 1.5–2 см выше коленного сустава; затем рана послойно зашивалась [15].
Экспериментальные группы
Животные были случайным образом разделены на группы: группа денервации («Д», n=5) – животные с денервацией седалищного нерва; группа тенотомии («Т», n=7) – животные перенесли операцию тенотомии; группа антиортостатического вывешивания с денервацией («АОВ+Д», n=5) – животные, у которых провели денервацию в сочетании с антиортостатическим вывешиванием задних конечностей; группа антиортостатического вывешивания с тенотомией («АОВ+Т», n=8) – животные, у которых провели тенотомию в сочетании с антиортостатическим вывешиванием задних конечностей. Контролем служили значение параметров до оперативного вмешательства.
Регистрация М-ответа при стимуляции седалищного нерва
Для раздражения и регистрации мышечных ответов использовали исследовательскую установку DataWave technologies на базе 8 канального стимулятора и 16 канального усилителя «A-M systems» (США).
С использованием игольчатых электродов регистрировали ответы мышц голени крысы (икроножной, камбаловидной, большеберцовой), вызванные стимуляцией седалищного нерва одиночными прямоугольными импульсами длительностью 0.5 мс с частотой 0.5 имп/мин. Интенсивность стимула варьировала от 0.1 до 10 В.
Для исследования состояния периферической части нервно-мышечного аппарата оценивали моторный (М) ответ, являющийся электрическим потенциалом мышцы, возникающим при раздражении эфферентов. Регистрировали М-ответ исследуемых мышц голени крыс до хирургического вмешательства, на 7 и 50 сутки. Определяли максимальную амплитуду М-ответа. Контролем служили результаты до оперативного вмешательства и были приняты за 100 %.
Изменение максимальной амплитуды М-ответа (Аmax) рассчитывалось следующим образом:
Аmax=(x2*100%)/x1 ,
где x1 – максимальная амплитуда М-ответа до эксперимента, x2 – максимальная амплитуда М-ответа после эксперимента.
Статистическую обработку проводили при помощи непараметрического статистического критерия Уилкоксона с использованием пакета прикладных программ Origin Pro software (OriginLab Corp, США). Для сравнения независимых групп между собой использовался непараметрический критерий Манна-Уитни. Данные представлены в виде среднего и стандартного отклонения (M ± SD), медианы и квартилей (Q1, Me, Q3). Уровень статистической значимости принимали при р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Максимальная амплитуда М-ответа в группе с денервацией после 7 суток снижалась до 7±3 % (р<0.05) от контроля во всех мышцах. К 50 суткам относительно 7 суток, не наблюдалось значительных изменений (рис. 2).
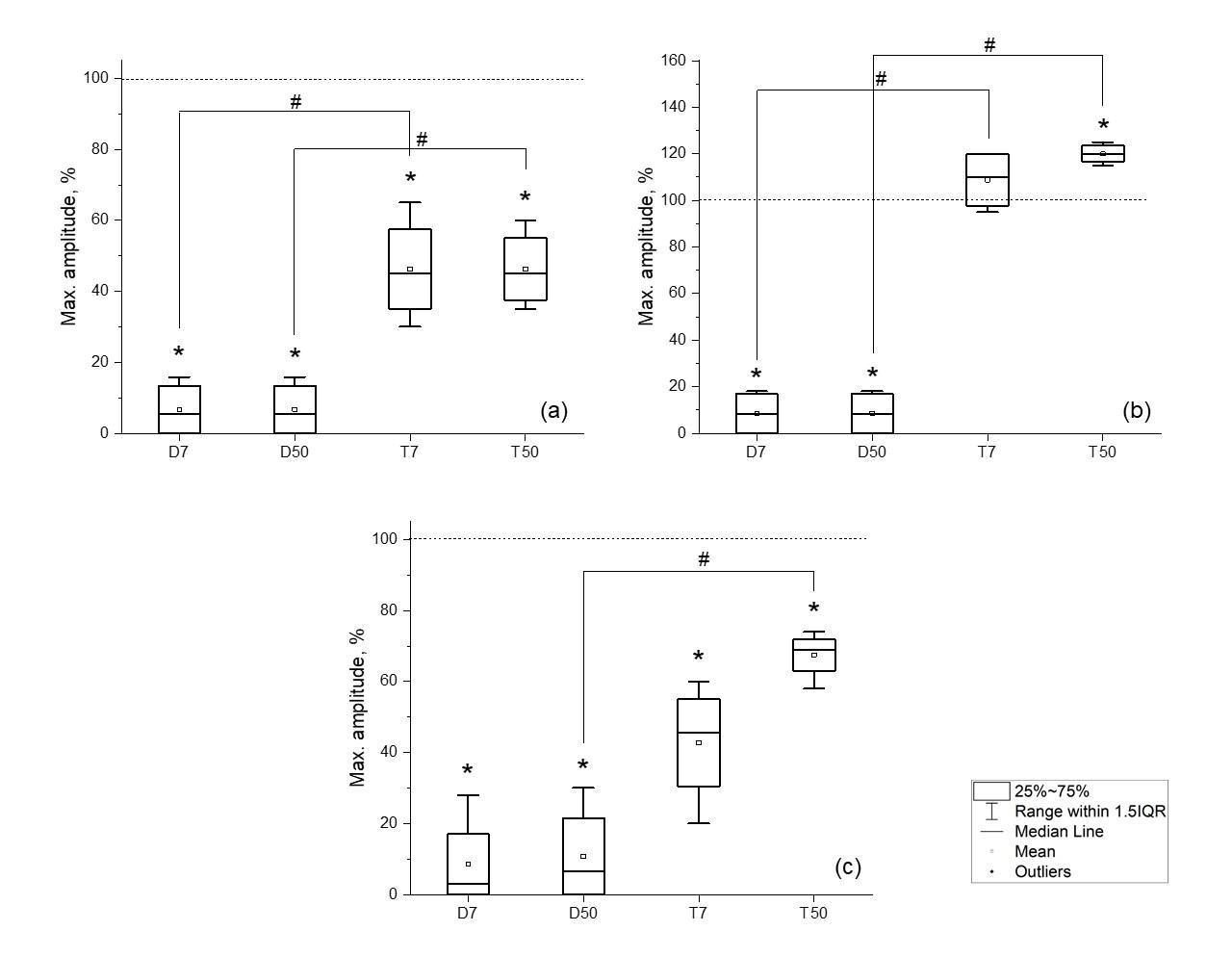
Рис. 2. Изменение максимальной амплитуды М-ответа икроножной мышцы (a), камбаловидной мышцы (b), большеберцовой мышцы (c) крыс в группах D7 (денервация 7 суток), D50 (денервация 50 суток), T7 (тенотомия 7 суток), T50 (тенотомия 50 суток). Серая линия – максимальная амплитуда до оперативного вмешательства; # достоверность между группами – p<0.05. * достоверность относительно контроля – p<0.05.
При тенотомии максимальная амплитуда М-ответа икроножной и камбаловидной мышц к 7 суткам падала до 46±20 % (р<0.05) и 43±15 % (р<0.05) соответственно. В большеберцовой мышце амплитуда М-ответа возрастала и составила 108±10 % (р<0.05) от контроля.
На 50 день эксперимента в икроножной мышце изменений относительно 7 суток не наблюдалось, однако в камбаловидной мышце максимальная амплитуда
М-ответа восстановилась до 68±10 % (р<0.05) от контроля, в ББМ увеличилась до 120±4 % (р<0.05) от контрольных значений. Таким образом при денервации наблюдали снижение амплитуды М-ответа во всех исследуемых мышцах. При тенотомии максимальная амплитуда М-ответа икроножной и камбаловидной мышц к 7 суткам падала. На 50 сутки в в камбаловидной мышце максимальная амплитуда М-ответ увеличилась относительно 7 суток. В большеберцовой мышце при тенотомии наблюдали увеличение амплиМ-ответа на 7 и 50 сутки по сравнению с контрольными значениями.
В группе АОВ сочетанного с денервацией к 7 суткам в икроножной мышце максимальная амплитуда М-ответа падала до 15±3 % (р<0.05) от контроля, в камбаловидной мышце до 18±7 % (р<0.05), в большеберцовой мышце до 24±8 % (р<0.05) от контрольных значений (рис. 3).
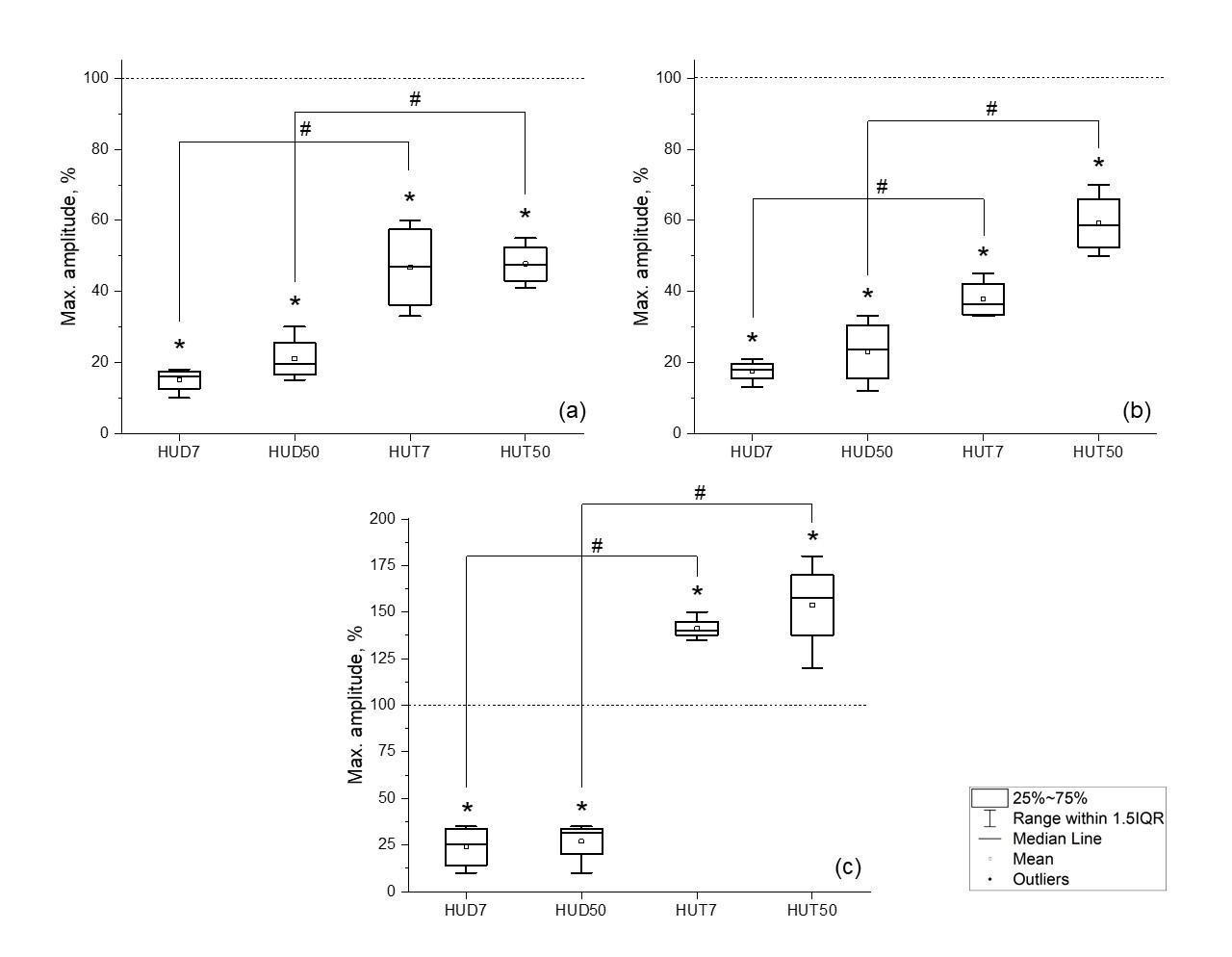
Рис. 3. Изменение максимальной амплитуды М-ответа икроножной мышцы (a), камбаловидной мышцы (b), большеберцовой мышцы (c) крыс в группах HUD7 (антиортостатическое вывешивание с денервацией 7 суток), HUD50 (антиортостатическое вывешивание с денервацией 50 суток), HUT7 (антиортостатическое вывешивание с тенотомией 7 суток), HUT50 (антиортостатическое вывешивание с тенотомией 50 суток). Серая линия – максимальная амплитуда до оперативного вмешательства; # достоверность между группами – p<0.05.* достоверность относительно контроля – p<0.05.
К 50 суткам амплитуда М-ответа восстанавливалась, так в икроножной мышце она составила 21±7 % (р<0.05) от контроля, в камбаловидной мышце – 23±10 % (р<0.05), в большеберцовой мышце 27±6 % (р<0.05) от контрольных значений.
При АОВ с тенотомией на 7 сутки максимальная амплитуда М-ответа падала в икроножной мышце до 47±6 % (р<0.05) от контроля, в камбаловидной мышце до 38±5 % (р<0.05). В большеберцовой мышце к 7 суткам амплитуда возрастала до 141±8 % (р<0.05) от контрольных значений.
На 50 сутки в икроножной мышце максимальная амплитуда М-ответа не изменялась относительно 7 суток, однако наблюдалось восстановление амплитуды М-ответа в камбаловидной мышце до 59±10 % (р<0.05) от контроля. В большеберцовой мышце к 50 суткам амплитуда М-ответа увеличилась до 153±20 % (р<0.05) от контрольных значений.
Таким образом в группе АОВ, сочетанной с денервацией наблюдали падение максимальной амплитуды М-ответа к 7 суткам во всех мышцах, на 50 сутки амплитуда М-ответа возрастала на 5–8 %. При АОВ, сочетанной с тенотомией в икроножной и камбаловидной мышце амплитуда снижалась к 7 суткам, однако на 50 сутки в камбаловидной мышце наблюдали увеличение амплитуды относительно 7 суток. В большеберцовой мышце применение АОВ с тенотомией привела к увеличению максимальной амплитуды М-ответа на 7 и 50 сутки относительно контрольных значений.
Также было проведено сравнение всех групп с наличием и отсутствием АОВ между собой на 50-й день эксперимента (рис. 4).
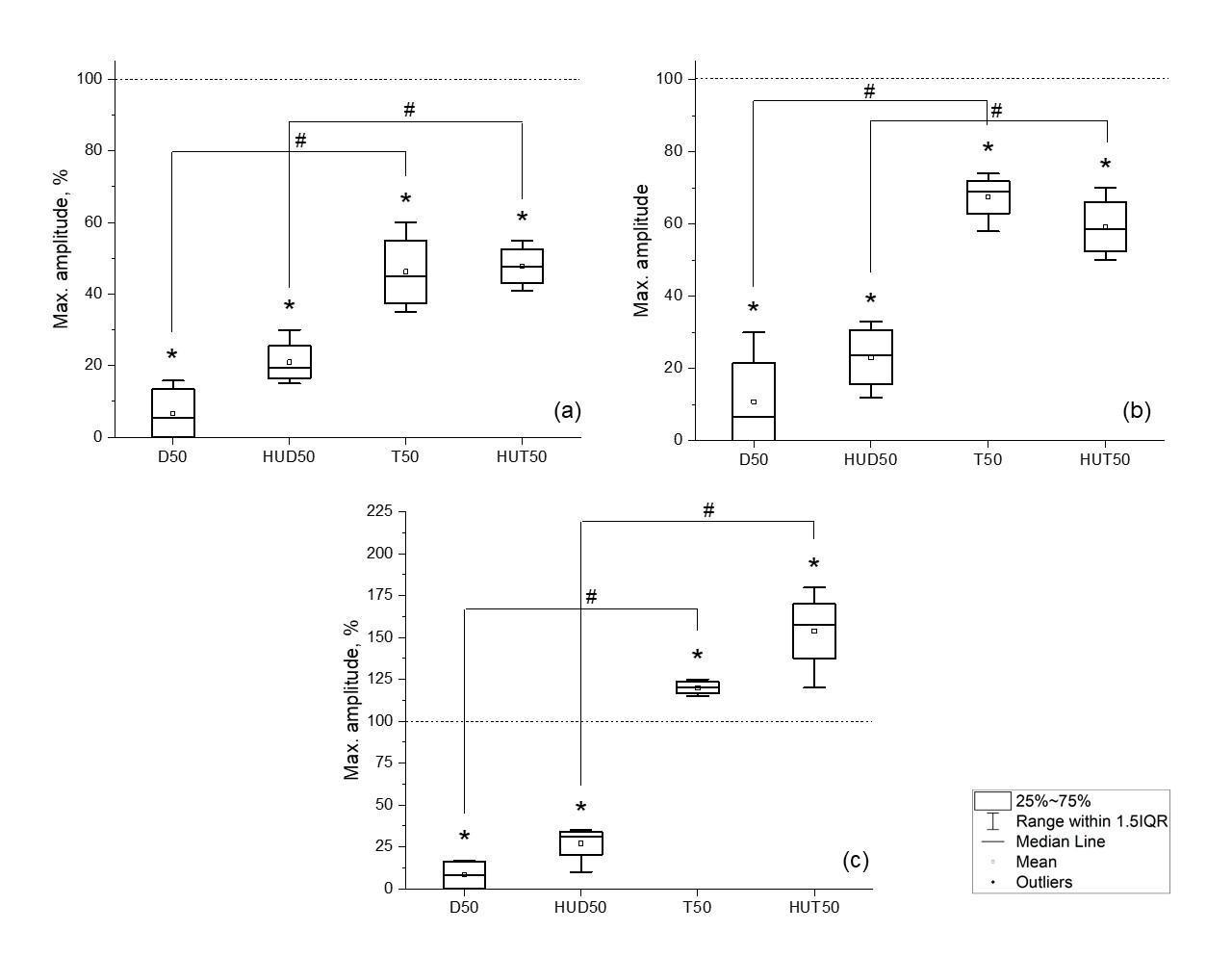
Рис. 4. Изменение максимальной амплитуды М-ответа икроножной мышцы (a), камбаловидной мышцы (b), большеберцовой мышцы (c) у крыс в группах D50 (денервация 50 суток); HUD50 (антиортостатическое вывешивание с денервацией 50 суток); T50 (тенотомия 50 суток); HUT50 (антиортостатическое вывешивание с тенотомией 50 суток). Серая линия – максимальная амплитуда до оперативного вмешательства; # достоверность между группами – p<0.05.* достоверность относительно контроля — p<0.05.
На рисунке видно, в мышцах голени задних конечностей крысы на 50 сутки при денервации происходило уменьшение максимальной амплитуды. Однако при применении АОВ сочетанной с денервацией во всех мышцах наблюдали увеличение амплитуды на 13–18 % относительно группы без влияния АОВ.
В икроножной и камбаловидной мышце при тенотомии на 50 сутки наблюдали падение максимальной амплитуды относительно контрольных значений, влияние АОВ в данном случае не привел к значительному изменению амплитуды М-ответа. В большеберцовой мышце, напротив, при АОВ сочетанном с тенотомией максимальная амплитуда увеличилась на 33 % по сравнению с группой без влияния АОВ.
Таким образом при денервации, при полном обездвиживании, во всех мышцах максимальная амплитуда М-ответа падала, и не восстанавливалась к 50 суткам. Однако устранение опорной афферентации оказывает в этих условиях положительное влияние.
При тенотомии и тенотомии сочетанной с АОВ, мы наблюдали падение амплитуды ответа задних групп мышц голени и увеличение амплитуды М-ответа передней большеберцовой мышцы, более выраженное при сочетанном влиянии, то есть именно при тенотомии мы отмечали негативное влияние АОВ.
Тенотомия, перерезка ахиллова сухожилия, а также применение денервации, пережатие седалищного нерва, одни из распространенных методов изучения роли нервно-мышечной активности в регуляции функциональных свойств поперечно-полосатых мышечных волокон различного функционального профиля. При тенотомии мышечное бездействие наблюдается на фоне потери афферентной (проприоцептивной), но сохраненной эфферентной иннервации [16], в то время, как при денервации наблюдается полная деафферентация, что также выражается в бездействии мышечной ткани.
При денервации наблюдается резкое снижение амплитуды М-ответа во всех мышцах, что подтверждает влияние нервной иннервации на функциональную активность мышц. Полное отсутствие функционального контроля со стороны нервной системы приводит к значительной атрофии и снижению мышечной активности [17]. Постепенное восстановление (или его отсутствие) амплитуды
М-ответа на 50 сутки указывает на невозможность компенсации утраченного нейронного контроля и неэффективность адаптивных механизмов.
Тенотомия приводит к устранению обратной связи между мышцами и нервной системой, что негативно сказывается на эффективности М-ответа в икроножной и камбаловидной мышцах [18]. Снижение (в камбаловидной до 38±5 % на 50 сутках) демонстрирует, что отсутствие обратной связи может препятствовать адекватной регуляции мышечной активности. Однако в большеберцовой мышце наблюдается преимущественное увеличение амплитуды М-ответа с течением времени. Это может быть следствием того, что эта мышца испытывает меньший негативный эффект от недостатка обратной связи, возможно, из-за своей функциональной роли и возможности адаптации к измененным условиям. Большеберцовая мышцы, вероятно, использует внутренние механизмы для компенсации утраты контроля со стороны нервной системы и отсутствия гравитации [19]. Это может включать увеличение активации за счет изменения двигательных паттернов или нейропластичности, позволяя ей активно участвовать в поддержании стабильности и баланса при отсутствии задних мышц на фоне нарушенной обратной связи.
Ряд наблюдений свидетельствует о том, что устранение опорной афферентации является основным механизмом, приводящим к «отключению» электрической активности двигательных единиц постуральной мышцы в условиях гравитационной разгрузки [20]. Наше исследование показало, что устранение гравитации в сочетании с денервацией резко снижает амплитуду М-ответа, что позволяет предположить, что гравитационные стимулы необходимы для поддержания мышечного тонуса. Это особенно заметно в икроножной и камбаловидной мышцах, что указывает на зависимость их активности от внешней нагрузки. Противоречивые результаты по большеберцовой мышце, где наблюдается увеличение амплитуды
М-ответа, подчеркивают уникальную адаптацию этой мышцы к измененным условиям, что может свидетельствовать о её особенности в работе с другими типами нагрузок или активации в условиях отсутствия гравитации. Анализ показывает важность взаимодействия между антагонистами, где ослабление одной группы мышц может привести к компенсаторным изменениям в другой [21]. В то же время, при АОВ с тенотомией, большеберцовая мышца демонстрирует обратное поведение, что может свидетельствовать о более сильной роли гравитационных нагрузок в обеспечении её активности. Это уменьшение напряжения на задние группы мышц указывает на то, что отсутствие гравитационного воздействия в сочетании с тенотомией может ослаблять активность контрольной обратной связи.
ЗАКЛЮЧЕНИЕ
Результаты подчеркивают важность как нервного контроля, так и обратной связи в поддержании мышечной активности. Устранение гравитационных факторов и нервного контроля (через денервацию и тенотомию) приводит к значительному снижению функций мышц. Продемонстрировано, что потеря обратной связи может иметь разные последствия в зависимости от функциональной специфики мышцы. В условиях, когда отсутствует как гравитация, так и нервная иннервация, нормальное функционирование мышечной ткани становится невозможным. Наши результаты позволяют предположить, что изменение свойств мышцы при мышечном бездействии обусловлено не только нарушением опорной афферентации, но и изменениями, в том числе, нейронального контроля.
Исследование взаимодействий между различными группами мышц, их функциональной зависимостью и адаптацией в условиях утраты гравитации и нервного контроля углубляет понимание мышечной физиологии и паттернов нервной иннервации. Это имеет значение для дальнейшей разработки теорий о работе мышечной системы.
Работа выполнена в рамках программы «Стратегическое академическое лидерство Казанского федерального университета» (ПРИОРИТЕТ-2030).
Список литературы
- Kalyani R. R. Age-related and disease-related muscle loss: the effect of diabetes, obesity, and other diseases / R. R. Kalyani, M. Corriere, L. Ferrucci // Lancet Diabetes Endocrinol. – 2014. – V. 2. – P. 819–829. doi:10.1016/S2213- 8587(14)70034-8.
- Atherton P. J. Control of skeletal muscle atrophy in response to disuse: clinical/preclinical contentions and fallacies of evidence / P. J. Atherton, P. L. Greenhaff, S. M. Phillips, S. C. Bodine, C. M. Adams, C. H. Lang // Am J Physiol Endocrinol Metab. – 2016. – V. 311. – P. 594–604. doi:10.1152/ ajpendo.00257.2016.
- Oikawa S. Y. The impact of step reduction on muscle health in aging: protein and exercise as countermeasures / S. Y. Oikawa, T. M. Holloway, S. M. Phillips // Front Nutr. – 2019. – 6. – 75. doi:10.3389/fnut.2019.00075.
- Pette D. Myosin isoforms, muscle fiber types, and transitions / D. Pette, R. S. Staron // Microsc. Res. Tech. – 2015. – V. 50. – P. 500–509.
- Nunes E. A. Disuse-induced skeletal muscle atrophy in disease and nondisease states in humans: mechanisms, prevention, and recovery strategies / Nunes E. A., Stokes T., McKendry J., Currier B. S., Phillips S. M. // American journal of physiology. Cell physiology. – 2022. – V. 322, №6. – P. 1068–1084. https://doi.org/10.1152/ajpcell.00425.2021
- Deane C. S. Skeletal muscle immobilisation-induced atrophy: mechanistic insights from human studies / C. S. Deane, M. Piasecki, P. J. Atherton // Clinical science (London, England : 1979). – 2024. – V. 138, № 12. – P. 741–756. https://doi.org/10.1042/CS20231198
- Criswell D. S. Overexpression of IGF-I in skeletal muscle of transgenic mice does not prevent unloading-induced atrophy / D. S. Criswell, F. W. Booth, F. DeMayo, R. J. Schwartz, S. E. Gordon, M. L. Fiorotto // Am J Physiol Endocrinol Metab. – 1998. – V. 275. – P. 373–379.
- Komori T. Animal models for osteoporosis / T. Komori // Eur. J. Pharmacol. – 2015. – V. 759. – P. 287–294. 10.1016/j.ejphar.2015.03.028
- Atherton P. J. Control of skeletal muscle atrophy in response to disuse: clinical/preclinical contentions and fallacies of evidence / P. J. Atherton, P. L. Greenhaff, S. M. Phillips, S. C. Bodine, C. M. Adams, C. H. Lang // American journal of physiology. Endocrinology and metabolism – 2016. – V. 311, № 3. – P. 594–604. https://doi.org/10.1152/ajpendo.00257.2016
- Bass J. J. Atrophy Resistant vs. Atrophy Susceptible Skeletal Muscles: «aRaS» as a Novel Experimental Paradigm to Study the Mechanisms of Human Disuse Atrophy / J. J. Bass, E. J. O. Hardy, T. B. Inns, D. J. Wilkinson, M. Piasecki, R. H. Morris, A. Spicer, C. Sale, K. Smith, P. J. Atherton, B. E. Phillips // Frontiers in physiology. – 2021. – V. 12. – P. 653060. https://doi.org/10.3389/fphys.2021.653060;
- Powers S. K. Oxidative stress and disuse muscle atrophy: cause or consequence? / S. K. Powers, A. J. Smuder, A. R. Judge // Current opinion in clinical nutrition and metabolic care. – 2012. – V. 15, № 3. – P. 240–245. https://doi.org/10.1097/MCO.0b013e328352b4c2
- Morey-Holton E. R. Spaceflight and bone turnover: correlation with a new rat model of weightlessness / E. R. Morey // BioScience. – 1979. – V. 29. – P. 168–172. 10.2307/1307797
- Ильин Е. А. Стенд для моделирования физиологических эффектов невесомости в лабораторных экспериментах с крысами / Ильин Е. А., Новиков В. Е. // Косм. биол. и авиакосм. мед. – 1980. – Т. 14, № 3. – С. 79–80.
- Baltina T. V. The state of the contralateral neuromotor apparatus of the rat in conditions of unilateral tenotomy / T. V. Baltina, A. A. Eremeev, I. N. Pleshchinskii // Neuroscience and Behavioral Physiology. – 2006. – Vol. 36, No. 4. – P. 385–389. – DOI 10.1007/s11055-006-0029-5
- De Angelis C. Acetyl-L-carnitine prevents agedependent structural alterations in rat peripheral nerves and promotes regeneration following sciatic nerve injury in young and senescent rats / C. De Angelis, C. Scarfo, M. Falcinelli, E. Perna, E. Reda, M. T. Ramacci, L. Angelucci // Exp. Neurol. – 1994. – Vol. 128. – P. 103–114.
- Арутюнян Р. С. Влияние хронической тенотомии на посттетанические ответы быстрых и медленных мышц крысы / Р. С. Арутюнян, Е. П. Жабко // Рос. физиол. журн. – 2011. – Т. 97, № 8. – С. 781–794.
- Chu X. L. Basic mechanisms of peripheral nerve injury and treatment via electrical stimulation / X. L. Chu, X. Z. Song, Q. Li, Y. R. Li, F. He, X. S. Gu, D. Ming // Neural Regen Res. – 2022. – V. 17, № 10. – P. 2185–2193. doi: 10.4103/1673-5374.335823. PMID: 35259827; PMCID: PMC9083151.
- Jamall A. A. Skeletal muscle response to tenotomy / A. A. Jamall, P. Afshar, R. A. Abrams, R. L. Lieber // Muscle & Nerve. – 2000. – Vol. 23(6). – P. 851–862.
- Juneja P. Anatomy, Bony Pelvis and Lower Limb: Tibialis Anterior Muscles / Juneja P., Hubbard J. B. – In StatPearls. StatPearls Publishing, 2023.
- Григорьев А. И. Роль опорной афферентации в организации тонической мышечной системы / А. И. Григорьев, И. Б. Козловская, Б. С. Шенкман // Российский физиологический журнал им. И. М. Сеченова. – 2004. – Т. 90, № 5. – С.507–521.
- Gorkovenko A. V. Muscle agonist-antagonist interactions in an experimental joint model / A. V. Gorkovenko, S. Sawczyn, N. V. Bulgakova, J. Jasczur-Nowicki, V. S. Mishchenko, A. I. Kostyukov // Exp Brain Res. – 2012. – V. 222, № 4. – P. 399–414. doi: 10.1007/s00221-012-3227-0. Epub 2012 Aug 29. PMID: 22926155; PMCID: PMC3460176.
FUNCTIONAL ASSESSMENT OF CALF MUSCLES IN RATS WITH IMPAIRED MOTOR ACTIVITY
Sabirova D. E.1,2, Eremeev A. A.1, Baltina T. V.1
1Kazan (Volga Region) Federal University, Kazan, Russia
2Sirius University of Science and Technology, Sirius Federal Territory, Russia
E-mail: sabirova.dianka@list.ru
Skeletal muscles are highly dynamic tissues that respond to various stimuli, especially changes in mechanical load. Therefore, active use or disuse directly affects the skeletal muscle phenotype, influencing metabolism, protein expression, and morphological characteristics. In this regard, it is relevant to study the mechanism of the influence of motor activity on the state of skeletal muscles. The aim of this work was to assess the state of skeletal muscles in rats with impaired motor activity.
The study was conducted on twenty-five adult nonlinear laboratory mature rats (weight 180–220 g) in compliance with bioethical standards. Animals were divided into groups with denervation («D», n = 5), tenotomy («T», n = 7) and their combinations with hindlimb unloading (HUD, n=5; HUT, n=8). The values of the parameters before surgery served as a control. To study the state of the peripheral part of the neuromuscular apparatus, the maximum amplitude of the motor (M) response of the gastrocnemius, soleus, and tibialis muscles of the hind limbs of a rat was assessed before surgery, on days 7 and 50.
Denervation caused a significant decrease in the maximum amplitude of the M-response in all muscles on day 7 (to 7±3 % of the control), which was not restored by day 50. Tenotomy decreased the amplitude in the gastrocnemius and soleus muscles to 46±20 % and 43±15 %, respectively, but increased it in the tibialis muscle (108±10 % of the control). By day 50, the amplitude in the soleus muscle recovered to 68±10 %, and in the tibialis muscle to 120±4 %. In the HU with denervation group, a decrease in the
M-response level was observed in the gastrocnemius, soleus, and tibialis muscles by day 7 (to 15±3 %, 18±7 %, and 24±8 %, respectively), with insignificant recovery by day 50. With HU with tenotomy, the amplitude in the gastrocnemius and soleus muscles decreased to 47±6 % and 38±5 %, while in the tibialis muscle it increased to 141±8 %. By day 50, the amplitude in the soleus muscle was restored to 59±10 %. In the tibialis muscle, there is a significant increase in amplitude by day 50 (153±20 %).
The results showed that on the 7th day of HU combined with denervation, there was also a deterioration in the condition of the peripheral part of the neuromuscular apparatus in the rat. Tenotomy, transection of the Achilles tendon, as well as the use of denervation, transection of the sciatic nerve, are some of the common methods for studying the role of neuromuscular activity in regulating the functional properties of striated muscle fibers of various functional profiles. During tenotomy, muscle inactivity is observed against the background of loss of afferent (proprioceptive), but preserved efferent innervation, while during denervation, complete deafferentation is observed, which is also expressed in muscle tissue inactivity. A number of observations indicate that the elimination of support afferentation is the main mechanism leading to the «switching off» of the electrical activity of the motor units of the postural muscle under conditions of hindlimb unloading. In our study, changes in the parameters of the M-response of the soleus muscle demonstrated that with a combination of the elimination of support afferentation and proprioceptive afferentation, as well as complete deafferentation, the negative impact of hindlimb unloading is aggravated. Based on the above observations, it can be assumed that the change in muscle properties during hindlimb unloading is caused, among other things, by changes in the neuronal control of the activity of motor units.
Keywords: hindlimb unloading, denervation, tenotomy, M-response, muscle atrophy.
References
- Kalyani R. R., Corriere M., Ferrucci L. Age-related and disease-related muscle loss: the effect of diabetes, obesity, and other diseases. The lancet. Diabetes & endocrinology, 2(10), 819 (2014). doi:10.1016/S2213-8587(14)70034-8
- Atherton P. J., Greenhaff P. L., Phillips S. M., Bodine S. C., Adams C. M., Lang C. H. Control of skeletal muscle atrophy in response to disuse: clinical/preclinical contentions and fallacies of evidence. American journal of physiology. Endocrinology and metabolism, 311(3), E594 (2016). https://doi.org/10.1152/ajpendo.00257.2016
- Oikawa S. Y., Holloway T. M., Phillips S. M. The Impact of Step Reduction on Muscle Health in Aging: Protein and Exercise as Countermeasures. Frontiers in nutrition, 6, 75 (2019). https://doi.org/10.3389/fnut.2019.00075.
- Pette D., Staron R. S. Myosin isoforms, muscle fiber types, and transitions. Microscopy research and technique, 50(6), 500 (2000). https://doi.org/10.1002/1097-0029(20000915)50:6<500::AID-JEMT7>3.0.CO;2-7
- Nunes E. A., Stokes T., McKendry J., Currier B. S., Phillips S. M. Disuse-induced skeletal muscle atrophy in disease and nondisease states in humans: mechanisms, prevention, and recovery strategies. American journal of physiology. Cell physiology, 322(6), 1068 (2022). https://doi.org/10.1152/ajpcell.00425.2021
- Deane C. S., Piasecki M., Atherton P. J. Skeletal muscle immobilisation-induced atrophy: mechanistic insights from human studies. Clinical science (London, England : 1979), 138(12), 741 (2024). https://doi.org/10.1042/CS20231198
- Criswell D. S., Booth F. W., DeMayo F., Schwartz R. J., Gordon S. E., Fiorotto M. L. Overexpression of IGF-I in skeletal muscle of transgenic mice does not prevent unloading-induced atrophy. The American journal of physiology, 275, E373 (1998). https://doi.org/10.1152/ajpendo.1998.275.3.e373
- Komori T. Animal models for osteoporosis. European journal of pharmacology, 759, 287 (2015). https://doi.org/10.1016/j.ejphar.2015.03.028
- Atherton P. J., Greenhaff P. L., Phillips S. M., Bodine S. C., Adams C. M., Lang C. H. Control of skeletal muscle atrophy in response to disuse: clinical/preclinical contentions and fallacies of evidence. American journal of physiology. Endocrinology and metabolism, 311(3), E594 (2016). https://doi.org/10.1152/ajpendo.00257.2016]
- Bass J. J., Hardy E. J. O., Inns T. B., Wilkinson D. J., Piasecki M., Morris R. H., Spicer A., Sale C., Smith K., Atherton P. J., Phillips B. E. Atrophy Resistant vs. Atrophy Susceptible Skeletal Muscles: «aRaS» as a Novel Experimental Paradigm to Study the Mechanisms of Human Disuse Atrophy. Frontiers in physiology, 12, 653060 (2021). https://doi.org/10.3389/fphys.2021.653060;
- Powers S. K., Smuder A. J., Judge A. R. Oxidative stress and disuse muscle atrophy: cause or consequence?. Current opinion in clinical nutrition and metabolic care, 15(3), 240 (2012). https://doi.org/10.1097/MCO.0b013e328352b4c2
- Morey, E. R. Spaceflight and Bone Turnover: Correlation with a New Rat Model of Weightlessness. BioScience, 29(3), 168 (1979). doi:10.2307/1307797
- Ilin E. A., Novikov V. E. Stend dlia modelirovaniia fiziologicheskikh éffektov nevesomosti v laboratornykh éksperimentakh s krysami [Stand for modelling the physiological effects of weightlessness in laboratory experiments with rats]. Kosmicheskaia biologiia i aviakosmicheskaia meditsina, 14(3), 79 (1980).
- Baltina T. V., Eremeev A. A., Pleshchinskii I. N. The state of the contralateral neuromotor apparatus of the rat in conditions of unilateral tenotomy. Neuroscience and behavioral physiology, 36(4), 385 (2006). https://doi.org/10.1007/s11055-006-0029-5
- De Angelis C., Scarfò C., Falcinelli M., Perna E., Reda E., Ramacci M. T., Angelucci L. Acetyl-L-carnitine prevents age-dependent structural alterations in rat peripheral nerves and promotes regeneration following sciatic nerve injury in young and senescent rats. Experimental neurology, 128(1), 103 (1994). https://doi.org/10.1006/exnr.1994.1117
- Arutiunian R. S., Zhabko E. P. Rossiiskii fiziologicheskii zhurnal imeni I.M. Sechenova, 97(8), 781 (2011).(in Russ.)
- Chu X. L., Song X. Z., Li Q., Li Y. R., He F., Gu X. S., Ming D. Basic mechanisms of peripheral nerve injury and treatment via electrical stimulation. Neural regeneration research, 17(10), 2185 (2022). https://doi.org/10.4103/1673-5374.335823
- Jamali A. A., Afshar P., Abrams R. A., Lieber R. L. Skeletal muscle response to tenotomy. Muscle & nerve, 23(6), 851 (2000). https://doi.org/10.1002/(sici)1097-4598(200006)23:6<851::aid-mus3>3.0.co;2-a
- Juneja P., Hubbard J. B. Anatomy, Bony Pelvis and Lower Limb: Tibialis Anterior Muscles. [Updated 2023 Aug 28]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-. Available.
- Grigor’ev A. I., Kozlovskaia I. B., Shenkman B. S. Rol’ opornoĭ afferentatsii v organizatsii tonicheskoĭ myshechnoĭ sistemy [The role of support afferents in organisation of the tonic muscle system]. Rossiiskii fiziologicheskii zhurnal imeni I.M. Sechenova, 90(5), 508 (2004).(in Russ.)
- Gorkovenko A. V., Sawczyn S., Bulgakova N. V., Jasczur-Nowicki J., Mishchenko V. S., Kostyukov A. I. Muscle agonist-antagonist interactions in an experimental joint model. Experimental brain research, 222(4), 399 (2012). https://doi.org/10.1007/s00221-012-3227-0

