ANALYSIS OF MORPHOMETRIC INDICES OF THE STOMACH IN RATS DURING PROBIOTIC ADMINISTRATION
АНАЛИЗ МОРФОМЕТРИЧЕСКИХ ПОКАЗАТЕЛЕЙ ЖЕЛУДКА У КРЫС ПРИ ВВЕДЕНИИ ПРОБИОТИКА
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №3, 2024
Publication text (PDF): Download
UDK: 639+664
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Dzheldubaeva E. R., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Yarmolyuk N. S., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Rzhevskaya V. S., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Makalish T. P., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Tumanyants K. N., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Aedinova D. Z., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Nazirova L. E. V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-3-55-68
PAGES:from 55 to 68
STATUS:Published
LANGUAGE:Russian
KEYWORDS: probiotic, dysbiosis, rats,morphometric index, esophageal and pyloric parts of gastric mucosa.
ABSTRACT (ENGLISH):
The study of probiotic effects on gastric conditions represents an important direction in modern gastroenterology. Probiotics have the potential to prevent and treat a variety of gastric diseases, ranging from infectious and inflammatory processes to functional disorders and even cancer. The growing understanding of the role of the gastric microbiota and the development of new probiotic preparations make this area of research particularly relevant in the context of the increasing prevalence of gastroenterologic diseases and the need for new therapies. It is shown that the balance of microbiota can be disturbed “when the intensity of negative external influences exceeds the threshold values of the adaptation system of the organism” and when there are shifts in the metabolic activity of the gastric microflora itself. One of the most frequent causes of disorders is the impact of antibacterial drugs on it. In order to create a model of dysbiosis, antibiotic-induced stress in animals, combined use of probiotic with a broad-spectrum antibiotic is used in experiments, which allows us to evaluate physiological parameters during antibiotic therapy.
In connection with the above, the aim of this work was to reveal the changes in food intake and morphometric indices of the stomach in rats during administration of test probiotic in the model of dysbiosis.
Changes in morphometric parameters of the pyloric and esophageal sections of the stomach in rats during probiotic administration both at isolated administration and against the background of dysbiosis model were revealed.
At probiotic administration in animals on histological sections of the pyloric part of the stomach there is an increase in the covering epithelium, a decrease in the number of main cells and an increase in the lining and additional exocrinocytes, an insignificant decrease in the thickness of the mucosa and horny layer of the esophageal part of the stomach relative to the corresponding values of animals of the control group.
In animals under antibiotic administration there is a pronounced decrease in the thickness of the covering and glandular epithelium of the pyloric part, the number of epitheliocytes, an increase in the number of envelope cells and a decrease in the number of main and supplementary cells of the fundal section, a sharp decrease in the mucous and horny layers of the esophageal section of the stomach relative to the data in animals of the control group, which indicates various adverse effects of antibiotics on the state of the gastrointestinal tract.
In animals of the fourth group, subjected to the combined administration of probiotic and antibiotic, there was a sharp increase in the thickness of the covering epithelium by 70.53%, as well as a decrease in the thickness of glandular epithelium by 12.38% (p<0.05) compared to the data in animals of the control group, indicating the protective mechanisms of probiotic.
ВВЕДЕНИЕ
Изучение новых микробных консорциумов пробиотиков в настоящее время является актуальной областью исследований в связи с растущей осведомленностью о важности микробиоты для здоровья человека, а также необходимостью разработки более эффективных и целенаправленных методов коррекции нарушений микробиома. Проблемы, связанные с микробиотой, включают воспалительные заболевания кишечника, аллергии и аутоиммунные заболевания, антибиотикоиндуцированные диареи, метаболические расстройства и пр. [1], т.е. с развитием дисбиотического состояния [2]. Реализована идея создания новых препаратов – биологически активных микробиотических консорциумов – пробиотиков (ПБ) [4]. Разработка мультиштаммовых и персонализированных ПБ открывает широкие перспективы для профилактики и лечения заболеваний, а также для улучшения общего состояния здоровья [3, 5, 6]. Накапливаются доказательства их более широкой функциональной активности: наряду со способностью нормализовать функции кишечной микрофлоры ПБ могут способствовать усилению иммунитета, ослаблению проявлений пищевой аллергии, облегчать симптомы непереносимости лактозы, оказывать гипохолестеринемическое, антиканцерогенное и антимутагенное действие [7]. В последнее время появляются сообщения об обнаружении у некоторых штаммов антиоксидантных свойств [6].
Изучение влияния ПБ на состояние желудка представляет собой важное направление в современной гастроэнтерологии. Пробиотики имеют потенциал для профилактики и лечения различных заболеваний желудка, начиная от инфекционных и воспалительных процессов до функциональных расстройств и даже раковых заболеваний [8]. Рост понимания роли микробиоты желудка и развитие новых пробиотических препаратов делают эту область исследований особенно актуальной в контексте растущей распространенности гастроэнтерологических заболеваний и необходимости новых методов их терапии. Показано, что сбалансированность микробиоты может нарушаться «при превышении интенсивности негативных внешних воздействий над пороговыми значениями адаптационной системы организма» [9] и при сдвигах в метаболической активности самой микрофлоры желудка [10]. Одной из наиболее частых причин нарушений является воздействие на нее антибактериальными препаратами. С целью создания модели дисбиоза, антибиотико-индуцированного стресса у животных в экспериментах используют комбинированное применение пробиотика с антибиотиком широкого спектра, что позволяет оценить физиологические показатели при антибиотикотерапии.
В связи с вышеизложенным целью данной работы явилось выявить изменения пищевого потребления и морфометрических показателей желудка у крыс при введении тестируемого пробиотика в модели дисбиоза.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнялась в Центре коллективного пользования научным оборудованием «Экспериментальная физиология и биофизика» при кафедре физиологии человека и животных и биофизики в рамках программы исследований № АААА-А21-121011990099-6 «Физиологические механизмы биологического действия факторов разной природы и интенсивности» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского».
Эксперименты выполнены на белых половозрелых крысах-самках линии Wistar, которые были специально выведены для лабораторных исследований. Общая выборка животных составила 40 здоровых крыс, массой 220–240 г. Эксперимент проводился на крысах со средней двигательной активностью, низкой эмоциональной реакцией, определяемых в тесте «открытое поле», которых находилось большинство в популяции, вследствие чего у животных развивается типичная среднестатистическая реакция на действие различных раздражающих факторов, включая тестируемые химические соединения. Из общего количества отобранных крыс, было выделено четыре экспериментальные группы. Первой группе «Контроль» (К) в течение 14 дней путем зондирования вводили эквивалентный раствор физраствора. Второй групппе «Пробиотик» (ПБ) интрагастрально вводили по 3 мл 1 % раствора пробиотика путём зондирования в течение 14 дней. Третьей группе «Антибиотик» (АБ) вводили антибиотик «Доксициклин» в дозе по 5 мг/кг в течение 14 дней. Четвертой группе животных (АБ+ПБ) – вводили кобинированно антибиотик и пробиотик в течение 14 дней.
Синтез тестируемого пробиотика проводился на кафедре ботаники и физиологии растений и биотехнологий ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского» под руководством Ржевской В. С. Микробный консорциум включал штаммы пробиотических микроорганизмов: Lactobacillus parabuchneri ВКМ В-3553D, Lactobacillus plantarum ВКМ В-3552D, Lactobacillus acidophilus ВКМ В-3563D, Enterococcus faecium ВКМ В-3551D, Brettanomyces bruxellensis ВКМ Y-3064D. Все штаммы микроорганизмов депонированы в Всероссийской коллекции микроорганизмов. Микробный консорциум получали путем совместного культивирования молочнокислых бактерий, энтерококка и дрожжей в жидкой питательной среде MRS следующего состава (г/л): пептон ферментативный – 10,0; экстракт пекарных дрожжей – 4,0; твин-80 – 1,0 мл; мясной экстракт – 8,0; глюкоза – 20,0; калий фосфорнокислый однозамещенный – 2,0; натрий уксуснокислый 3-водный – 5,0; аммоний лимоннокислый однозамещенный – 2,0; магний сернокислый 7-водный – 0,1; марганец хлористый 4-водный – 0,05; рН среды – 6,3; режим стерилизации: 0,75 атм, 20 мин. Культивирование микроорганизмов проводили в биореакторе Minifors 2 объемом 4 л (Minifors 2 НТ, Швейцария) при температуре 32 °С и 50 об/ мин в течение 3-х суток. Учет численности микроорганизмов в консорциуме проводили методом предельных разведений. Биологическая концентрация бактерий микробного консорциума составила 1,3∙109 КОЕ.
Животных выводили из эксперимента путем декапитации. Подготовка гистологического материала осуществлена в ЦКП «Молекулярная биология» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского». Гистологические препараты готовили в соответствие со стандартными методиками. Фиксировали фрагменты пищеводной части (cardiаca) и тела (corpus) желудка в 10 %-м забуференном формалине (рН 7,2) в течение 24 часов. После этого осуществляли дегидратацию и пропитку парафином в микроволновом гистологическом процессоре LOGOS (Mielstone, Италия) с использованием программы, рекомендованной производителем. Пропитанные парафином кусочки органов заливали в блоки, из которых изготавливали полутонкие срезы толщиной 4 мкм. Срезы окрашивали гематоксилином и эозином [11].
Гистопрепараты просматривали под микроскопом DM2000 с объективами Plan5х, 10х и 40х и фотографировали камерой DFC295 (Leica). Морфометрические измерения выполняли на микрофотографиях в программе ImageJ с использованием шкалы TS-M1 PW106011 (1div=0.01mm) stage micrometer, используя метод наложения точечных морфометрических сеток [12].
Выбор методов и приемов микроскопирования осуществлялся согласно рекомендациям, изложенным в учебном пособии Л. Д. Тимченко, В. Н. Вакулина [13]. Морфометрический анализ на светооптическом уровне включал подсчет количества главных, добавочных и обкладочных клеток на единицу фундальных желез слизистой оболочки, измерение толщины слизистого слоя пилорического (железистого и покровного эпителия) и пищеводного (слизистой и рогового слоя) отделов и количество эпителиоцитов в желудочных ямках фундального отдела желудка крыс.
Согласно государственному стандарту РФ «ГОСТ 33216-2014, Руководство по содержанию и уходу за лабораторными животными, Правила содержания и ухода за лабораторными грызунами и кроликами, Правила оборудования помещений и организации процедур» – испытуемые животные содержались в адекватных условиях, в соответствии с тезисами вышеприведённого государственного норматива.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям этического комитета по биоэтике ФГАОУ ВО «Крымский федеральный университет им. В. И. Вернадского» (протокол № 5 от 2022 г.).
Статистическую обработку и анализ материала проводили с помощью непараметрических методов, применение которых позволила проверка полученных данных на закон нормального распределения. Вычисляли среднее значение исследуемых величин, ошибку средней. Проводилась оценка достоверного уровня различий между экспериментальными группами по U-критерию Манна-Уитни. Достоверными показателями считаются показатели меньше р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При проведении морфологического исследования стенки желудка интактных крыс установлено, что ее строение соответствовало нормальному, с учетом особенностей данного вида [14]. Морфометрические показатели желудка находились в пределах нормативных значений (табл. 1).
При экспериментальном введении пробиотика у животных второй группы (ПБ) на гистологических срезах пилорической части желудка отмечается тенденция к увеличению показателей толщины слизистой оболочки на 2,33 %, покровного эпителия на 12,02 %, и толщины железистого эпителия на 1,04 % относительно соответствующих значений контрольной группы (табл. 1, рис. 1). У животных третьей группы (АБ) на модели дисбиоза при введении антибиотика отмечается выраженное уменьшение показателей на 14,80 %, 24,97 % (р<0,05) и 13,46 % соответственно относительно данных контрольной группы. У животных четвёртой группы (АБ+ПБ), подвергнутых комбинированному введению пробиотика и антибиотика отмечается резкое увеличение толщины покровного эпителия на 70,53 % (р<0,05), а также уменьшение толщины железистого эпителия на 12,38 % по сравнению с данными контрольной группы животных (табл. 1, рис. 1, 2).
Таблица 1.
Морфометрические показатели желудка крыс при изолированном и комбинированном ведения пробиотика и антибиотика
| Показатели | Экспериментальные группы | |||
| К (1) | ПБ (2) | АБ (3) | ПБ+АБ (4) | |
| Пилорическая части желудка | ||||
| Толщина слизистой оболочки, мкм | 594,41±48,84 | 608,28±42,34 | 506,42±39,88* | 577,73±36,15 |
| Толщина покровного эпителия, мкм | 68,73±8,43 | 76,98±14,43 | 51,57±10,99 | 117,20±18,79 |
| Толщина железистого эпителия, мкм | 525,61±71,05 | 531,08±40,74 | 454,85±47,21* | 460,52±55,93* |
| Процентное соотношение экзокриноцитов | ||||
| Главные клетки | 35,58±4,60 | 32,65±1,76 | 29,79±4,34* | 36,11±3,15 |
| Обкладочные клетки | 26,59±1,81 | 26,89±1,82 | 39,37±3,32* | 23,99±3,26 |
| Добавочные клетки | 37,83±3,44 | 40,46±3,49 | 30,84±4,98* | 39,90±2,93 |
| Количество эпителиоцитов в желудочных ямках | 25,06±1,47 | 24,99±1,05 | 21,09±1,34* | 24,32±1,28 |
| Пищеводная часть желудка | ||||
| Толщина слизистого слоя, мкм | 419,28 ±22,40 | 352,29±27,48 | 140,70±16,20* | 242,87±20,48* |
| Толщина рогового слоя, мкм | 130,44±15,45 | 116,06±11,90 | 86,27±18,23* | 96,267±14,08 |
Примечание: Указаны средние ± стандартная ошибка средней, р<0,05 – достоверность различий по сравнению со значениями контрольной группы животных по U-критерию Манна-Уитни.
При выполнении анализа гистологических препаратов желудка крыс, подвергшихся моделированию дисбиоза (АБ), зарегистрированы дистрофические изменения однослойного призматического железистого эпителия с маленьким базофильным ядром и слабо эозинофильной цитоплазмой, они представлены высоко призматическими и уплощенными клетками, что выражается в виде локальных очагов десквамации покровного эпителия. В глубоких слоях слизистой оболочки, а также в мышечной пластинке и в подслизистой оболочке отмечается лейкоцитарная инфильтрация.
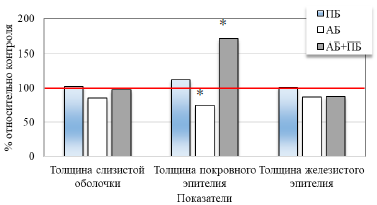
Рис. 1. Изменение толщины пилорической части желудка крыс при изолированном и комбинированном введении пробиотика и антибиотика (по сравнению с показателями крыс контрольной группы, принятых за 100 %).
Примечание: * – достоверность различий по сравнению со значениями контрольной группы животных по U-критерию Манна-Уитни.
Желудочные ямки на гистосрезах пилорического отдела желудка у крыс групп АБ и АБ+ПБ глубокие, длинные, заполненные слизью. Собственная пластинка слизистой оболочки отечна, отмечается лейкоцитарная инфильтрация на границе с мышечной частью данной оболочки. При этом визуализируются уменьшение мышечной оболочки и адвентиция, а также спазмирование кровеносных сосудов. Париетальные клетки значительно увеличены в размере. В желудочных железах определяется значительное укорочение шейки железы, являющейся выводным протоком и ведущей к дну желудочной ямки. Концевые отделы пилорических желез изменены: слизистые клетки полностью заполняют всю железу. Отмечаются очаги склероза, ведущие к деформации желудочных желез, а также к локальным некротическим изменениям. В подслизистой оболочке отмечается лейкоцитарная инфильтрация. Мышечная оболочка развита достаточно, отмечаются участки разрыхления гладкомышечных волокон.
Анализ количества эпителиоцитов в желудочных ямках фундального отдела выявил у животных второй (ПБ) и четвёртой (АБ+ПБ) групп, что данный показатель оставался на уровне значений контрольной группы, при этом у животных третьей группы (АБ) количество эпителиоцитов существенно уменьшилось на 15,84% (р<0,05) по сравнению с контрольными значениями (см. табл. 1). Это свидетельствует о повреждении слизистой оболочки желудка. Количество эпителиоцитов в желудочных ямках также может отражать скорость и эффективность процессов регенерации слизистой оболочки после повреждений или воспаления [15].
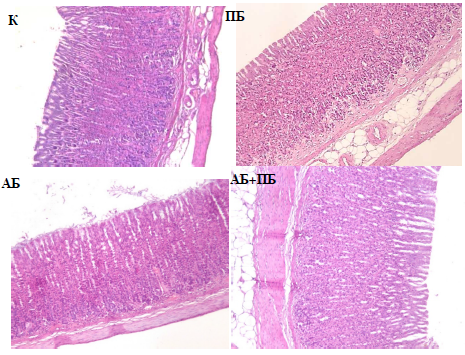
Рис. 2. Гистологические срезы пилорической части желудка крыс при изолированном и комбинированном введении пробиотика (ПБ) и антибиотика (АБ) (увел. х10).
При анализе процентного соотношения экзокриноцитов пилорической части желудка крыс выявлено, что у крыс второй группы (ПБ) зарегистрированы незначительные изменения относительно данных контрольной группы – уменьшение количества главных клеток на 8,23 % и несущественное увеличение обкладочных и добавочных клеток (см. табл. 1, рис. 3). Экзокриноциты несколько набухшие, ядра их полиморфны. Количество эпителиальных клеток уменьшилось по сравнению с контрольной группой.
У животных третьей группы (АБ) введение антибиотика вызвало значимое увеличение количества обкладочных клеток на 48,07 % (р<0,05) и уменьшение количества главных и добавочных клеток (на 16,29 (р<0,05) и 18,47 % (р<0,05)) относительно соответствующих значений в контроле. Визуализируются дистрофические изменения железистого эпителия с маленьким базофильным ядром и слабо эозинофильной цитоплазмой, они представлены высоко призматическими и уплощенными клетками, что выражается в виде локальных очагов десквамации покровного эпителия.
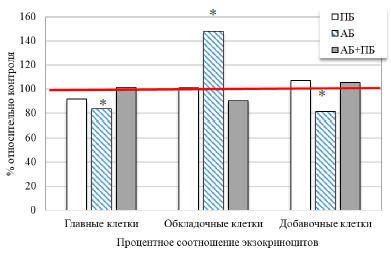
Рис. 3. Процентное соотношение экзокриноцитов пилорической части желудка крыс при изолированном и комбинированном введении пробиотика и антибиотика.
Примечание: * – достоверность различий по сравнению со значениями контрольной группы животных по U-критерию Манна-Уитни.
При комбинированном введении антибиотика и пробиотика у животных четвёртой группы (АБ+ПБ) зарегистрирована тенденция к увеличению главных и добавочных клеток и уменьшению количества обкладочных клеток на 9,81 % по сравнению с контрольными значениями.
Анализ пищеводной части желудка выявил у животных второй группы (ПБ), тенденцию к уменьшению толщины слизистого и рогового слоёв на 15,98 % и 11,02 % соответственно относительно значений контрольной группы (см. табл. 1, рис. 4, 5).
У животных третьей группы (АБ) отмечается резкое уменьшение данных показателей на 66,44 % (р<0,05) и 33,86 % (р<0,05) соответственно относительно контрольных значений. В эпителиальных пластах блестящий роговой слой определяется не четко и лишь в части препаратов. У крыс четвертой группы (АБ+ПБ) при комбинированном введении антибиотика и пробиотика отмечается уменьшение толщины слизистого и рогового слоев на 44,07 % (р<0,05) и 26,26 % (р<0,05) соответственно относительно данных контрольной группы (см. рис. 4, 5).
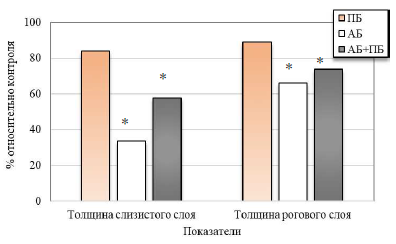
Рис. 4. Изменение толщины пищеводного отдела желудка крыс при изолированном и комбинированном введении пробиотика (ПБ) и антибиотика (АБ) (по сравнению с показателями крыс контрольной группы, принятых за 100 %).
Примечание: * – достоверность различий по сравнению со значениями контрольной группы животных по U-критерию Манна-Уитни.
Таким образом введение пробиотика вызвало незначительные изменения морфометрических показателей желудка. При этом толщина пилорической части желудка (слизистой оболочки, покровного эпителия и железистого эпителия) имела тенденцию к увеличению; процентное соотношение экзоцитов главных добавочных и обкладочных клеток оставалось на уровне контрольного значения, и толщина пищеводного отдела желудка (слизистого и рогового слоя) незначительно уменьшилась относительно контрольных значений. При моделировании дисбиоза с помощью антибиотика в слизистой желудка отмечается уменьшение толщины слизистого и рогового слоя пищеводного отдела желудка; увеличение количества обкладочных и уменьшение количества главных и добавочных экзоцитов пилорической части желудка, уменьшение эпителиоцитов в желудочных ямках фундального отдела и уменьшение толщины покровного эпителия в пилорической части желудка по сравнению со значениями у животных в контроле и при введении пробиотиков. При комбинированном введении антибиотика и пробиотика отмечаются менее выраженные изменения в толщине слизистого и рогового слоя пищеводной части желудка. Кроме того отношения экзокриноцитов, эпителиоцитов в железистых ямках также оставалось на уровне контрольных значений, в пилорической части желудка отмечается существенное увеличение толщины покровного эпителия, что свидетельствует о защитных механизмах пробиотика.
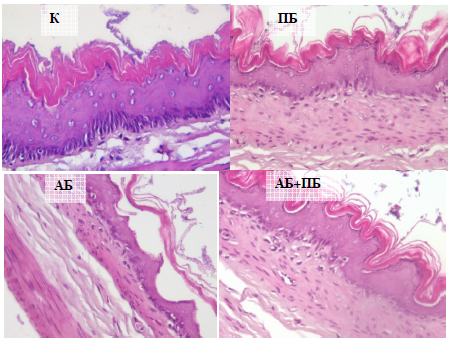
Рис. 5. Гистологические срезы пищеводной части желудка крыс при изолированном и комбинированном введении пробиотика (ПБ) и антибиотика (АБ) (увел. х40).
Так, изменение толщины слизистого покровного и железистого слоя пилорической и пищеводной частей желудка при введении антибиотика может указывать на то, что антибиотики, как правило, уничтожают бактерии, включая как патогенные, так и полезные виды, что приводит к дисбалансу или дисбиозу в составе микробиоты желудка, что в свою очередь может привести к изменениям в составе и функции слизистой оболочки [16]. Также антибиотики могут вызывать раздражение слизистой оболочки желудка, что может привести к изменениям в ее толщине. Это может быть связано с прямым токсическим воздействием антибиотиков или с изменениями в микробиоме, которые в свою очередь могут способствовать развитию воспалительных процессов. Вместе с тем, влияя на железистый слой слизистой оболочки, который ответственен за выработку слизи, антибиотики приводят к снижению секреции слизи, что в свою очередь может изменить толщину слизистой оболочки [17].
В целом, изменение в морфометрических показателях желудка при введении антибиотика может указывать на различные неблагоприятные эффекты антибиотиков на состояние желудочно-кишечного тракта.
Изменение толщины слизистого покровного и железистого слоя пилорической части желудка при комбинированном введении пробиотика и антибиотика выявило синергетический эффект – уменьшение негативных побочных эффектов антибиотиков на кишечную микрофлору, поддержание нормальной структуры и функций слизистой оболочки при сочетанном применении пробиотиков и антибиотиков. Так, изменение толщины слизистой пилорической и пищеводной частей желудка при введении пробиотика может свидетельствовать о способности к укреплению слизистого покрова и восстановлению эпителиального барьера при воздействии различных факторов, так как, например, антибиотико-индуцированный стресс, влияя на функции желудка. Кроме того, пробиотики влияют на состав и активность микробиоты желудка. Изменения в микробиоте могут влиять на состояние слизистой оболочки и приводить к изменениям в ее толщине. Эти изменения при введении пробиотика могут указывать на его положительное воздействие на состояние слизистой оболочки и функции желудка.
Таким образом, исследование эффективности новых микробиотных консорбциумов пробиотиков имеет значительную практическую значимость. С учетом роста проблемы антибиотикорезистентности и нежелательных побочных эффектов при длительном приеме антибиотиков, поиск альтернативных методов лечения и профилактики, таких как пробиотики, становится все более важным. Исследования новых пробиотиков позволяют определить оптимальный состав бактерий, их концентрацию и дозировку для максимальной эффективности в различных условиях, включая модели дисбиоза. Применение эффективных пробиотиков для восстановления микробиоты и профилактики заболеваний может способствовать улучшению здоровья населения, повышению эффективности лечения.
ЗАКЛЮЧЕНИЕ
- Выявлены изменения морфометрических показателей пилорического и пищеводного отделов желудка у крыс при введении пробиотика как при изолированном введении, так и на фоне модели дисбиоза.
- При введении пробиотика у животных на гистологических срезах пилорической части желудка отмечается увеличение покровного эпителия, уменьшение количества главных клеток и увеличение обкладочных и добавочных экзокриноцитов, незначительное уменьшение толщины слизистой и рогового слоя пищеводного отдела желудка относительно соответствующих значений контрольной группы животных.
- У животных при введении антибиотика отмечается выраженное уменьшение толщины покровного и железистого эпителия пилорической части, количество эпителиоцитов; увеличение количества обкладочных клеток и уменьшение количества главных и добавочных клеток фундального отдела, резкое уменьшение слизистого и рогового слоев пищеводного отдела желудка относительно данных животных контрольной группы, что указывает на различные неблагоприятные эффекты антибиотиков на состояние желудочно-кишечного тракта.
- У животных четвёртой группы, подвергнутых комбинированному введению пробиотика и антибиотика отмечается резкое увеличение толщины покровного эпителия на 70,53 % а также уменьшение толщины железистого эпителия на 12,38 % (р<0,05) по сравнению с данными животных контрольной группы, что свидетельствует о защитных механизмах пробиотика.
Работа выполнена на базе ЦКП «Экспериментальная физиология и биофизика» и ЦКП «Молекулярная биология» ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского»
- Simanenko V. I. [et al] Experience of experimental and preclinical study of autoprobiotics, Proceedings of the All-Russian Conference of gastroenterologists of the South-West region, 83 (Rostov-on-Don, 2009).
- Amerkhanova A. M., Alyoshkin V. A., Afanasyev S. S. [et al]. The role of probiotic microorganisms in modern technologies of preventive and regenerative medicine and the possibility of increasing the effectiveness of drugs based on them, Collection “New drugs”, 4, 4 (Moscow: Medicine, 2007).
- Ardatskaya M. D. Probiotics, prebiotics and metabiotics in the correction of intestinal microecological disorders, 94 (Moscow: Medicine, 2015).
- Sekendar A. Probiotics and Postbiotics as an Alternative to Antibiotics: An Emphasis on Pigs, Pathogens, 12 (7), 874. (2023).
- Jiang He, Lemei Chang, Lange Zhang [et al.] Effect of probiotic supplementation on cognition and depressive symptoms in patients with depression: A systematic review and meta-analysis, Baltimore, 24, 47. (2023).
- Russo F., Linsalata M., Orlando A. Probiotics against neoplastic transformation of gastric mucosa: effects on cell proliferation and polyamine metabolism, World J Gastroenterol, 20 (37), 13258 (2014).
- Koga Y. Microbiota in the stomach and application of probiotics to gastroduodenal diseases, World J Gastroenterol, 28 (47), 6702 (2022).
- Zachary D. Effect of Probiotic Supplementation on Intestinal Permeability in Overweight and Obesity: A Systematic Review of Randomized Controlled Trials and Animal Studies, Adv Nutr., 15, 234 (2024).
- Parfenov A. I. [et al.] Antibiotic-associated diarrhea, Expert. i klin. gastroenterol., 5, 92 (2002).
- Uspensky Yu. P., Baryshnikova N. V. World tendencies to expansion of probiotics use sphere: relevance of application of means on the basis of Bacillus subtilis. Consilium Medicum, Gastroenterology, 4 (56), 75 (2012).
- Mustafina L. R., Gerasimov A. V., Potapov A. V. [et al]. Private course of histology: textbook: in 2 parts, 169 (Tomsk: SibGMU, 2022).
- Mytsik A. V. Using the ImageJ program for automatic morphometry in histological studies, Omsk scientific bulletin, 2, 187 (2011).
- Timchenko L. D., Vakulin V. N. Fundamentals of microscopic technique for biologist: textbook, 164 (Stavropol: SGU Publishing House, 2005).
- Samodelkin E. I., Kosareva P. V., Chetvertnykh L. A., Shinkarik O. V. [et al.] Histological and hypsometric characteristics of the gastric mucosa of intact non-inbred white rats, Biology and Experimental Medicine, 2, 108 (2011).
- Kuvenyova M. L., Luzin V. I., Morozov V. N., Morozova E. N. Structural changes in the mucosa, muscle and submucosal layer of the rat stomach arising under the influence of epichlorohydrin, Scientific Vedomosti BelGU. Series Medicine. Pharmacy, 16 (213), 31, 225 (2015).
- Wauters L., Talley N. J., Walker M. M., Tack J., Vanuytsel T. Novel concepts in the pathophysiology and treatment of functional dyspepsia, Gut., 69 (3), 591 (2020).
- Shargin I. A., Liseenko I. V. Effect of antibiotics on fermented milk bacteria, Young Scientist, 5, 120 (2015).

