AGE-DEPENDENT PECULIARITIES OF THE OXIDATIVE STRESS PARAMETERS AND ANTIOXIDANTS CONTENT IN THE LIVER OF SCORPION FISH SCORPAENA PORCUS L. IN THE COASTAL WATERS OF THE BOLSHOI CAUCASUS
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 6 (72), №4, 2020
Publication text (PDF):Download
UDK: 597.5.591.11
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Zalevskaya I. N., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia
Rudneva I. I., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia; A. O. Kovalevskiy Institute of the Biology of the Southern Seas RAS, Sevastopol, Russian Federation
Selyukov А. G., Тyumen State University, Tyumen, Russian Federation
Scherba А. V., A. O. Kovalevskiy Institute of the Biology of the Southern Seas RAS, Sevastopol, Russian Federation
TYPE:Article
DOI:https://doi.org/10.37279/2413-1725-2020-6-4-78-89
PAGES:from 78 to 89
STATUS:Published
LANGUAGE: Russia
KEYWORDS: Black Sea, scorpion fish Scorpaena porcus, age, size and weight characteristics, morphological and physiological indices, liver, lipid peroxidation, antioxidants.
ABSTRACT (ENGLISH):
Comparative study of size-weight characteristics, lipid peroxidation (LPO) parameters and antioxidants content in the liver of marine scorpion fish Scorpaena porcus caught in the coastal waters of the Caucasus at the region of Shepsy village demonstrated age-related differences. The increase of the size and weight, the mass of the liver and gonads was observed in the elder fish, while the condition index varied less. Liver somatic index (LSI) increased in 2-3 years old animals, in the elder fish the growth of this parameters was slowly. Significant increase of gonadosomatic index (GSI) was noted in 4-5 years old animals, while the differences between 2 and 3 years groups were not observed. Lipid oxidation index and relative concentration of the ketodiens did not vary in age. Content of dien conjugates in hepatic lipids was significantly lower (p<0,001) in 3-4 years old fish as compared with the parameters of other studied age groups. TBA-reactive products concentration in the hepatic lipids increased with age and the highest values were observed in 5-6 years old animals. Significant correlation was shown between the content of TBA-reactive products in fish liver and the animals age (r = 0,88, p<0,05), while between the other studied parameters and fish age no significant relations were noted. Vitamin A and carotenoids concentration did not vary with age, however the tendency to increase was observed in 4 years old fish. The reasons of the growth of reactive oxygen species processes (ROS) and the increase of lipid peroxidation compounds concentration can be connected with the decrease of the defense mechanisms of the organism and the damage biomolecules, genetic defects, cell pathologies, tissues and organs and accumulation of xenobiotics in the fish, which impact the organism, accompanied with the oxidative stress. In elder animals the concentration of toxic substances is greater, and together with the decrease of the defense systems the cumulative toxic effect becomes mote considarable. The obtained results in this study provide the additional information for the understanding of the mechanisms of ROS theory of aging at the case of vertebrates of the natural populations. Further investigations could be strengthening to the study the role of endo- and exogenous conditions, modulating the age processes in aquatic organisms, which is important for the ontogenesis mechanisms and they dependence on natural and anthropogenic factors.
ВВЕДЕНИЕ
Изучение физиолого-биохимических особенностей рыб представляет несомненный интерес для понимания механизмов адаптаций низших позвоночных к условиям существования, а также при их изменении. Последнее особенно актуально в настоящее время в связи с выраженными климатическими флуктуациями и активным антропогенным воздействием на водную среду. Для выяснения влияния этих процессов на природные популяции рыб используют разные биохимические параметры, которые характеризуют нарушение гомеостаза в случае изменения условий существования и развития стрессовых реакций [1]. Эффективными биомаркерами в этом случае являются показатели, отражающие состояние оксидантно-антиоксидантного баланса, играющего важнейшую роль в поддержании гомеостаза организма [2, 3]. Свободнорадикальное окисление (СРО) характерно для многих физиологических процессов, происходящих при росте, развитии, созревании и репродукции [4]. При действии неблагоприятных факторов этот баланс смещается в результате усиления СРО, и происходит развитие окислительного стресса [5, 6]. Увеличение образования свободных радикалов и их накопление в клетках и тканях отрицательно влияет на жизнедеятельность организма, поскольку они обладают повреждающим действием на биомолекулы, мембраны и другие клеточные структуры.
Согласно свободнорадикальной теории старения [7] накопление этих соединений в клетках и тканях с возрастом приводит к развитию патологий, нарушает нормальное протекание многих физиологических процессов и функционирование органов и тканей. Исследование возрастных изменений у разных таксономических групп животных представляет интерес для выяснения механизмов, лежащих в основе роста, развития и старения организма. Если для высших животных эти процессы изучены относительно полно, то для рыб имеющаяся информация явно недостаточна [8, 9]. Это объясняется в том числе тем, что в природной среде сложно отобрать необходимое количество особей разных возрастных категорий. Поэтому возрастные изменения у рыб в основном изучены на видах, выращиваемых в условиях аквакультуры, что не всегда адекватно отражает реальные процессы, происходящие в организме в ходе онтогенеза у животных из природных популяций [10]. В связи с этим изучение биохимических показателей у разновозрастных рыб, обитающих в разных акваториях одного бассейна, является актуальным. В этом плане интересны организмы, ведущие оседлый образ жизни и не совершающие длительных миграций. К таковым относится морской ерш, который был определен нами в качестве биомонитора для Черного моря при экотоксикологической оценке состояния морской среды [11]. Проведенные ранее исследования морского ерша, обитающего в бухтах Севастополя, позволили выявить особенности его физиолого-биохимических характеристик в разные сезоны, годы, в разных акваториях, отличающихся уровнем антропогенного воздействия, половые и возрастные различия [11]. Следует отметить, что рыбы кавказского побережья в этом плане исследованы в меньшей степени и информация о них весьма ограничена [12]. На этом основании целью настоящей работы явилось изучение возрастной динамики показателей перекисного окисления липидов (ПОЛ) и содержания антиоксидантов (витамина А и каротиноидов) в печени морского ерша из прибрежных кавказских вод у поселка Шепси.
МАТЕРИАЛЫ И МЕТОДЫ
Рыб отлавливали в прибрежных водах Черного моря в районе курортного поселка Шепси Туапсинского района, расположенного в 9 км юго-восточнее Туапсе в устье реки Шепси.
Проводили полный биологический анализ рыб, находящихся на стадии зрелости гонад II, измеряли общую (ТL, см) и стандартную (SL, см) длину, массу тела и массу тела без внутренностей, а также определяли индекс печени (ИП) как отношение массы печени к массе рыбы без внутренностей (в %). Гонадосоматический индекс (ГСИ) вычисляли как отношение массы гонад к массе рыбы без внутренностей (в %). Упитанность рыб анализировали по Фультону как отношение массы рыб к длине в кубе, а также по Кларк как отношение массы рыбы без внутренних органов к длине в кубе [13]. Возраст рыб анализировали по чешуе (3 особи возрастом 2 года, 4 особи возрастом 3 года, 7 особей возрастом 4 года, 3 особи возрастом 5–6 лет).
Печень рыб извлекали, взвешивали, перфузировали холодным физиологическим раствором на холоду и заливали 96 %-ным этанолом. Образцы хранили в холодильнике перед определением параметров перекисного окисления липидов. Затем ткань гомогенизировали в растворе гексан:изопропанол в соотношении 2:1, перемешивали и определяли содержание продуктов ПОЛ в пределах длин волн 215–273 нм, рассчитывали индекс окисленности липидов как отношение показателей экстинкции при 232 нм к 215 нм, содержание диеновых конъюгатов, используя молярный коэффициент экстинкции для сопряженных диенов, равный 2,2 × 10 М-1 см-1 [14], результаты выражали в мкмоль мг-1 липидов. Относительное содержание кетодиенов определяли по отношению показателей экстинкции при 270 нм к 215 нм. При определении реактивных продуктов тиобарбитуровой кислоты (ТБК-реактивных продуктов) 0,1 мл липидного экстракта в гексане смешивали с 0,5 мл 0,8 %-ного раствора 2-тиобарбитуровой кислоты и 5%-ным раствором трихлоруксусной кислоты, кипятили 10 минут. Показатели экстинкции анализировали при длине волны 532 нм, расчет вели с использованием молярного коэффициента экстинкции, который для триметинового комп лекса, образуемого малоновым диальдегидом с 2-ТБК, равен 1,56 × 10 М-1 см. Результаты выражали в нмоль мг-1 липидов [15].
Содержание каротиноидов определяли в липидных экстрактах ткани печени рыб спектрофотометрически при длине волны 450 нм, витамина А – при длине волны 325 нм [16].
Статистический анализ результатов проводили общепринятыми методами, вычисляли среднее значение, ошибку средней, сравнение результатов осуществляли по критерию Стьюдента при p<0.05 [17].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Биологический анализ разновозрастных особей морского ерша приведен в таблице 1. Полученные данные показали последовательную динамику увеличения размеров и массы рыб, а также массы печени и гонад. В то же время величины упитанности рыб изменялись в меньшей степени (табл. 2). ИП активно возрастал у 2-х и 3-х годовалых рыб, у представителей более старших возрастных групп рост этого показателя был замедлен. Существенное увеличение ГСИ наблюдали у 4-х и 5-6-годовалых рыб, но не у 3-х годовалых по сравнению с 2-х годовалыми.
Результаты анализа показателей окислительного стресса в печени рыб позволили установить неоднозначную возрастную динамику (рис. 1). Индекс окисленности липидов не изменялся с возрастом, относительное содержание кетодиенов имело тенденцию снрижению у старших возрастных групп. Содержание диеновых конъюгатов в липидах печени было достоверно (p<0,001) снижено у 3-4-х годовалых рыб по сравнению с показателями других возрастных групп. Концентрация ТБК-реактивных продуктов в липидах печени рыб увеличивалась с возрастом, достигая максимальных величин у 5-6-годовалых рыб.
Таблица 1
Размерно—массовые характеристики рыб
| Параметры | Возраст, год | |||
| 2(n=3) | 3 (n=4) | 4 (n=7) | 5/6 (n=3) | |
| Общая длина, см | 12,56+0,98 | 16,95+1,05 | 16,79+0,64 | 20,57+0,37 |
| Стандартная длина, см | 10,05+0,63 | 13,05+1,13 | 13,58+ 0,53 | 16,33+0,28 |
| Высота, см | 4,32+0,99 | 5,73+0,52 | 6,99+1,03 | 5,72+0,40 |
| Масса рыбы, г | 25,03+4,36 | 50,93+11,92 | 65,62+6,14 | 106,83+6,51 |
| Масса рыбы без внутренностей, г | 24,21+1,53 | 44,31+11,03 | 53,60+3,83 | 85,63+8,52 |
| Масса печени, г | 0,51+0,06 | 1,52+0,64 | 2,09+0,40 | 3,53+1,18 |
| Масса гонад, г | 0,24+0,03 | 0,38+0,14 | 1,04+0,56 | 2,24+1,32 |
Таблица 2
Морфо-физиологические индексы морского ерша
| Параметры | Возраст, год | |||
| 2 (n=3) | 3 (n=4) | 4 (n=7) | 5/6 (n=3) | |
| Упитанность по Фультону | 2,48+0,41 | 2,31+0,13 | 2,61+0,15 | 2,45+0,08 |
| Упитанность по Кларку | 2,44+0,29 | 1,90+0,07 | 2,18+0,21 | 1,95+0,11 |
| ИП | 2,13+0,27 | 3,06+0,50 | 3,78+0,56 | 3,97+1,21 |
| ГСИ | 1,00+0,17 | 0,89+0,35 | 1,83+0,97 | 2,69+1,53 |
При этом установлена высокая корреляция между содержанием ТБК-реактивных продуктов в липидах печени и возрастом рыб (r = 0,88, p<0,05). Между концентрацией других изученных параметров ПОЛ и возрастом рыб значимой зависимости не отмечено.
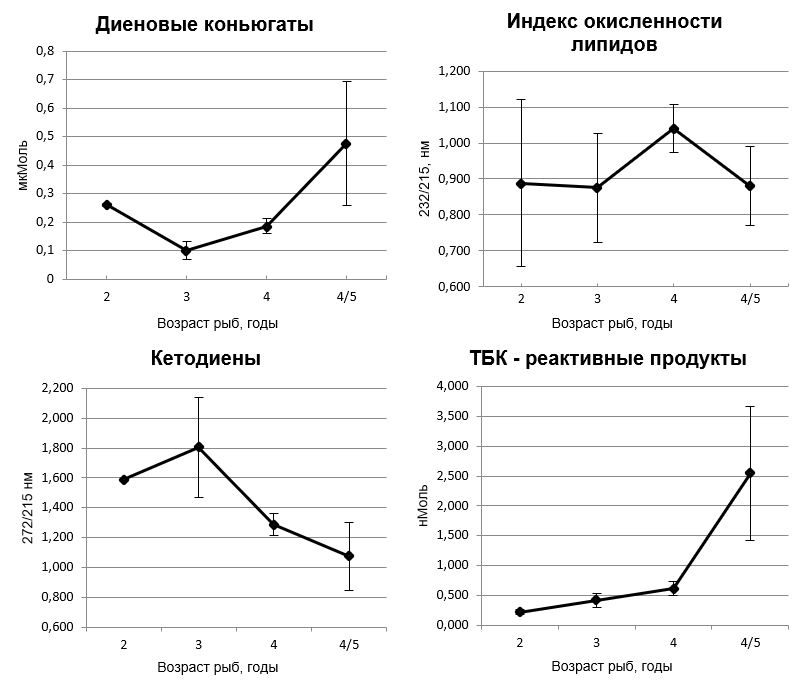
Рис. 1. Содержание продуктов ПОЛ ( на мг липидов)в печени морского ерша разного возраста.
Содержание витамина А и каротиноидов в липидах печени с возрастом не изменялась (рис. 2), но проявляло тенденцию к увеличению у 4-х годовалых рыб
Таким образом, результаты проведенных исследований позволили установить определенные возрастные различия содержания продуктов окислительного стресса и антиоксидантов в печени морского ерша. Печень рыб как и других позвоночных животных является многофункциональным органом, где происходят процессы синтеза необходимых организму веществ и детоксикация ксенобиотиков. Она является энергетическим источником для обеспечения многих физиологических процессов в организме, включая рост, развитие, созревание, репродукцию [18]. При этом с возрастом эти процессы могут существенно меняться, что отражается как на функционировании органа, так и маркеров, характеризующих его состояние.
Возрастные изменения оксидантно-антиоксидантного баланса продемонстрированы в тканях многих видов рыб, причем эти изменения имеют выраженные видовые особенности и являются тканеспецифическими [2, 4, 9, 19]. При этом исследователи в основном уделяли внимание сдвигам активности антиоксидантных ферментов, тогда как колебания параметров ПОЛ обсуждали в меньшей степени.
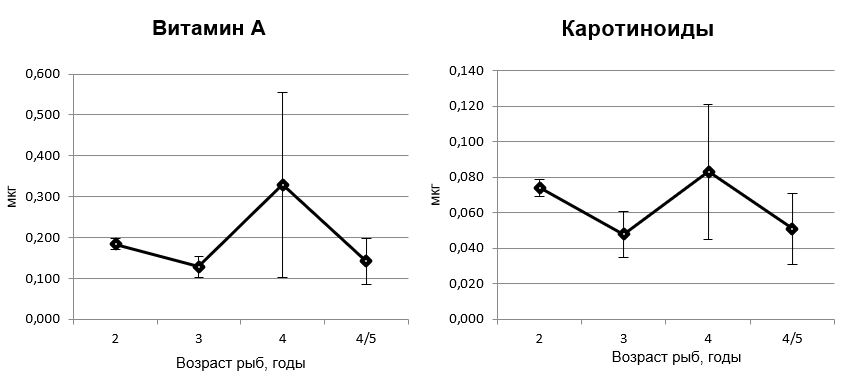
Рис. 2. Содержание антиоксидантов (на мг липидов) в печени морского ерша разного возраста
Было показано, что в тканях более молодых рыб активность антиоксидантных ферментов выше, чем у особей старших возрастных групп [20, 21]. Однако, возрастные сдвиги параметров окислительного стресса могут по-разному проявляться в тканях разных видов рыб. Так, ранее нами были установлены три варианта возрастных сдвигов активности антиоксидантных ферментов в эритроцитах крови рыб: 1. активность ферментов не изменялась с возрастом, 2. активность ферментов снижалась с возрастом и 3. активность ферментов увеличивалась с возрастом [22]. При этом у морского ерша, отловленного в прибрежных водах Севастополя, активность супероксиддисмутазы (СОД), каталазы (КАТ) и глутатионтрансферазы (ГСТ) в крови снижалась с возрастом, тогда как активность пероксидазы (ПЕР) и глутатионредуктазы (ГР) не изменялась. Возрастное увеличение активности глутатионпероксидазы (ГП) и КАТ было показано в крови адриатического лосося Acipencer naccarii [23]. Сходная динамика активности антиоксидантных ферментов была установлена в печени разновозрастных горбылей Totoaba macdonaldi, при этом было отмечено повышение активности ферментов в печени рыб, достигших половой зрелости [18]. Возрастное увеличение концентрации конечных продуктов ПОЛ (липофусцина) было обнаружено в тканях короткоживущей рыбы Nothobranchius rachovii, служащей моделью для изучения процессов старения, при одновременном снижении активности ГП, СОД и КАТ, в то время как активность теломеразы не зависела от возраста [19].
В настоящем исследовании нами не установлены существенные различия в содержании промежуточных продуктов ПОЛ у разновозрастных особей морского ерша, за исключением снижения концентрации диеновых конъюгатов у
3-4-годовалых рыб и последовательного возрастания уровня ТБК-реактивных продуктов. При этом четко прослеживается прямая корреляция между содержанием этих компонентов и возрастом рыб (r= 0,88).
Причинами усиления СРО и повышения концентрации продуктов ПОЛ могут быть как снижение защитных способностей организма и накопление в результате этого поврежденных биомолекул, генетических дефектов, патологий клеток, тканей и органов, так и аккумуляция ксенобиотиков в организме, оказывающих хронический токсический эффект, сопровождающийся окислительным стрессом. Причем у особей старших возрастных групп уровень токсикантов выше, и одновременно со снижением защитных свойств совокупный негативный эффект становится более выраженным. Так, например, было показано, что у двух видов скорпен Helicolenus dactilopterus и Pontinus huhlit накопление ртути в мышцах с возрастом существенно увеличивалось [24]. Такая же закономерность была обнаружена в печени, жабрах и мышцах леща Abramis brama, когда у рыб старших возрастных групп содержание тяжелых металлов значительно превосходило эти показатели у более молодых особей, а величины упитанности имели противоположную тенденцию [25]. Сходные данные были получены для кумжи Salmo trutta, когда у старших рыб содержание тяжелых металлов в тканях было значительно выше по сравнению с молодыми [26]. Совершенно очевидно, что накопление токсикантов в органах и тканях рыб является стрессовым фактором, который инициирует СРО и способствует накоплению продуктов ПОЛ в тканях, нарушает оксидантно-антиоксидантный баланс. Таким образом, с одной стороны с возрастом ослабевают защитные возможности организма, с другой стороны происходит накопление вредных соединений различной природы, вызывающих повреждения и нарушение биологических структур и их функций, что было отмечено у разных таксономических групп животных [27–29]. Нельзя исключать и активацию метаболических процессов в печени рыб старших возрастных групп, связанных с половым созреванием, увеличением размеров самого органа, что подтверждается высокой корреляцией между содержанием ТБК-реактивных продуктов и ИП (r=0,82).
Обращает на себя внимание высокое содержание витамина А в печени 3-х годовалых морских ершей, что может быть обусловлено интенсивным питанием рыб и поступлением витамина с пищей, его аккумуляцией в гепатоцитах для усиления антиоксидантной функции с целью компенсации снижения активности ферментов и защитных систем [18]. В печени рыб этой возрастной группы отмечено самое низкое содержание диеновых конъюгатов, о чем было сказано выше. Вероятно, половое созревание у 3-х годовалых рыб сопровождается существенной перестройкой метаболизма, включая оксидантно-антиоксидантный баланс.
Таким образом, результаты данного исследования вносят дополнительный вклад в свободнорадикальную теорию старения на примере низших позвоночных природных популяций. Дальнейшие исследования могут быть направлены на изучение роли эндо- и экзогенных условий, от которых зависят данные возрастные процессы, что важно для понимания механизмов онтогенеза и их зависимости от модулирующих их природных и антропогенных факторов.
ЗАКЛЮЧЕНИЕ
- С возрастом происходит увеличение размерно-массовых характеристик морского ерша, тогда как величины морфофизиологических индексов варьируют в меньшей степени.
- Содержание компонентов ПОЛ – диеновых конъюгатов и ТБК-реактивных продуктов в печени рыб увеличивалось с возрастом, концентрация кетодиенов имела тенденцию к снижению, а индекс окисленности липидов не изменялся.
- Содержание витамина А и каротиноидов в печени рыб разного возраста не различалось.
Работа выполнена в соответствие с темой государственного задания ФИЦ Институт биологии южных морей им. А. О. Ковалевского РАН «Функциональные, метаболические и токсикологические аспекты существования гидробионтов и их популяций в биотопах с различным физико-химическим режимом» номер гос. регистрации АААА-А18-118021490093-4.
REFERENCES
- Balasch J. C., Tort L. Netting the stress responses in fish, Frontiers in Endocrinology, 10, Article 62. (2019).
- Fernandes C., Fontaınhas-Fernandes A., Ferreira M., Salgado M. A., Oxidative Stress Response in Gill and Liver of Liza saliens, from the Esmoriz-Paramos Coastal Lagoon Portugal, Arch Environ Contam.Toxicol, 55, 262 (2008).
- Speakman J. R., Blount J. D., Bronikowski A. M., Buffenstein R, Isaksson C., Kirkwood T. B. Oxidative stress and life histories: Unresolved issues and current needs, Ecol. Evolution., 5, 5745 (2015)
- Birniy–Gauvin K., Costantini D., Cooke S. J., Willmore W. G. A comparative and evolutionary approach to oxidative stress in fish: a review, Fish Fish., 18, 928 (2017).
- Van Der Oost R., Beyer J., Vermeulen N. P. E. Fish bioaccumulation and biomarkers in environmental risk assessment: a review, Environ. Toxicol. Pharmacol., 3, 57 (2003).
- Beaulieu M., Thierry D., Gonzalez-Acuсa A. M., Polito M. J. Integrating oxidative ecology into conservation physiology, Conserv. Physiol., 1, cot 004. (2013).
- Harman D. The free radical theory of aging, Antioxid. Redox. Sign., 5, 557 ( 2003)
- Almaida-Pagan P. F., Ortega-Sabater C., Lucas-Sanchez A., Gonzalez-Silvera D., Martinez-Nicolas A., Rol de Lama M. A,. Mendiola P., de Costa J., Almaida-Pagan P. F. Age-related changes in mitochondrial membrane composition of Nothobranchius furzeri.: comparison with a longer-living Nothobranchius species , Biogerontology, 20 (Is. 1), 83 (2019).
- Parolini M., Iacobuzio R., Bassano B., Pennati R., Saino N. Age- and sex-dependent variation in the activity of antioxidant 2 enzymes in the brown trout (Salmo trutta), Fish Physiology and Biochemistry, 45, 145 (2019).
- Almroth B. C., Johansson A., Fцrlin L., Sturve J. Early-age changes in oxidative stress in brown trout, Salmo trutta, Comp. Biochem. Physiol. B., 155, 442 (2010).
- Ecotoxicological; studies the Black Sea coastal ihthyophauna at Sevastopol region (Rudneva I.I. ed). 360 p. (Moscow, GEOS, 2016) ( in Russ)
- Mikraykov V. R., Silkina N. I., Mikraykov D. V. The influence of anthropogenic pollution on immunological and biochemical mechanisms of homeostasis in the Black Sea fish species, Marine Biology, 37(2), 141 (2011) (in Russ).
- Pravdin I. F. Manual Book for fish study. 376 p. (Moscow, Pishevaya promyshlennost, 1966) ( in Russ)
- Stalnaya I. D. Method of the determination of dien conjugation of unsaturated fatty acids. Current methods in biochemistry, 62 ( Moscow, Medicina, 1977) ( in Russ)
- Stalnaya I. D., Garishvili T. G. Method of th determination of malonic aldehyde used tiobarbituric acid Current methods in biochemistry, 66 ( Moscow, Medicina, 1977) ( in Russ)
- Karnauhov V. N., Fedorov G. G. Methods of the determination of carotenoids content and vitamin A in the animals tissues. Methodological recommendations, 15 ( Pushino, 1982) ( in Russ)
- Lakin G. F. Biometry, 352 p. (Moscow, Vysshaya shkola, 1990) ( in Russ)
- Hernandez-Aguilar S. B., Zenteno-Savin T., De-Ando-Montanez J. A., Mendez-Rodriguez L. C. Temporal variation in oxidative stress indicators in liver of totoaba (Totoaba macdonaldi) Perciformes: Sciaenidae. Marine Bio. Ass. United Kingdom., 98 (4), 833 (2018).
- Hsu Ch-Y., Chin Y-Ch., Hsu W-L., Chan Y-P. Age-related markers assayed at different developmental stages of the annual fish Nothobranchius rachovii, J. Gerontology, 2008, 63A (12), 1267 (2008).
- Martinez-Alvarez A. E., Morales A., Sanz A. Antioxidant defenses in fish: Biotic and abiotic factors, Rev. Fish Biol. Fish, 15, 75 (2005).
- Otto D. M. E., Moon T. W. Endogenous antioxidant systems of two teleost fish, the rainbow trout and the T.W. black bullhead, and the effect of age, Fish Physiol. Biochem., 15, 349 (1996).
- Rudneva I. I., Skuratovskaya E. N., Kuzminova N. S., Kovyrshina T. B. Age composition and antioxidant enzyme activities in blood of Black Sea teleosts, Comparative Biochemistry and Physiology. Part C Toxicology and Pharmacology, 151, 229 (2010).
- Sanz A., Hidalgo M. C., Morales A. E., Cillero C., Domezain A., Domezain J., Garcia-Gallego M. Evolution of antioxidant defenses and lipid peroxidation with age in the sturgeon Acipenser naccarii, Proceedings of the 4th International Symposium on Sturgeon, July 8- 13, Oshkosh, WI, 80 (2001).
- Monteiro L. R., Isidro E. J., Lopes H. D. Mercury content in relation to sex, age and growth in two scorpionfish Helicolenus dactilopterus and Pontinus huhlit from Azorean waters, Water, air and soil pollution, 56, 359 (1991).
- Farkis A., Salanki J., Speziar A. Age- and size-specificpatternsof heavy metals in the organs of freshwater fish Abramis brama L. populating a low-contaminated sites, Water Research. 37 (5), 959 (2002).
- Linde A. R., Sanxhez-Galan S., Izquierdo I. J., Arribas P., Maranon E., Garcia-Vazquez E. Brown trout as biomonitor of heavy metal pollution: effect of age on the reliability of the assessment, Ecotoxicology and Environmental Safety, 40 (1-2), 120 (1998).
- Eggas E. A., Falls C. J., Dauterman W. C. Study of gender, strain and age differences in mouse liver glutathione-S-transferase, Comparative Biochem. Physiol. Part C: Pharmacology, Toxicology and Endocrinology, 110 (1), 35 (1995).
- Fujita Sh., Kitagawa H., Ishzawa H., Suzuki T., Kitani K. Age-associated alterations in hepatic glutathione-S-transferase activities, Biochemical Pharmacology., 34 (21), 3891 (1985).
- Novoa-Valinas V. C., Perez-Lopez M., Melgar-Riol M. Hepatic glutathione-S-transferase from lamprey (Petromyzom marinus): purification and characterization, Biochemical Systematics and Ecology., 32, (2), 169 (2004).

