THE IMPORTANCE OF PRENATAL PASSIVE SMOKING FOR THE DEVELOPMENT OF CENTRAL RESPIRATORY REGULATION MECHANISM IN NEWBORN RATS IN VITRO
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 7 (73), №1, 2021
Publication text (PDF):Download
UDK: [612.64.014.46.+612.216.014.46+612.284]:57.0898
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Bolychevsky S. E., Orenburg State Medical University, Orenburg, Russia
Zinchenko E. A., Orenburg State Medical University, Orenburg, Russia
Miroshnichenko I. V., Orenburg State Medical University, Orenburg, Russia
TYPE:Article
DOI:https://doi.org/10.37279/2413-1725-2021-7-1-26-35
PAGES:from 26 to 35
STATUS:Published
LANGUAGE:Russian
KEYWORDS: newborn rats, respiratory center, in vitro, passive smoking, brain stem-spinal cord preparations, hypoxia, hypercapnia.
ABSTRACT (ENGLISH):
In the prenatal period, neural networks undergo the most significant morphological changes and subsequent functional transformations. The influence of a combination of factors of passive tobacco smoking to the development of the central mechanisms of respiratory control in the prenatal period remains unexplored. The present study was devoted to the study of the prenatal effect of passive smoking factors on the functioning of the central mechanisms of respiratory control in newborn rat. The study was carried out on 107 isolated brain stem-spinal cord preparations of the brain of newborn white outbred rats in vitro. Passive smoking was modeled by fumigating experimental animals with cigarette smoke. To simulate the hypercapnic effect, the bulbospinal preparations were perfused for 10 minutes with a solution of artificial cerebrospinal fluid with a saturated gas mixture, consisting of 10 % CO2 and 90 % O2; to simulate hypoxic exposure, the preparations were irrigated with a solution of artificial cerebrospinal fluid with a saturated gas mixture for 20 minutes 5 % CO2 and 95 % N2. As a result of the study, it was found that in newborn rats that underwent prenatal passive smoking, there is a high frequency of generation of inspiratory discharges, a shift in the spectral power density peaks of respiratory discharges in both ranges towards low frequencies, a decrease in their power, a decrease in the amplitude and a shorter duration of inspiratory discharges. in comparison with intact animals. A feature of the reaction to hypoxia in newborn rats who have undergone prenatal passive smoking is a late formation of the hypoxic depression of respiratory rhythm, reaction to hypercapnia characterized by no reduction in duration respiratory cycle. Thus performed by us research shows that prenatal secondhand smoke affects the mechanism of formation of the respiratory rhythm and pattern and also modifies the respiratory response to change in the partial tension of respiratory gases in cerebrospinal fluid in vitro.
ВВЕДЕНИЕ
Пренатальный и ранний постнатальный периоды развития респираторной нейронной сети у млекопитающих отличается быстрыми существенными процессами структурного и функционального развития. Процессы развития отличаются значительной степенью чувствительности к влиянию факторов внешней среды, что может предопределять характер функционирования как отдельных систем, так и организма в целом [1]. В пренатальном периоде нейронные сети претерпевают наиболее существенные морфологические изменения и следующие за ними функциональные преобразования. Организм матери предотвращает влияние многих факторов окружающей среды на эмбрион и плод. Однако ряд факторов среды антропогенного происхождения могут существенно влиять на развитие организма плода [1]. Одним из часто встречающихся вредоносных факторов антропогенного происхождения, с которым встречаются беременные женщины, являются компоненты табачного дыма, определяемые, как «пассивное курение» [1]. Изучение влияния на развитие в пренатальном периоде респираторной нейронной сети хронического введения никотина беременным осуществляется достаточно интенсивно [2, 3]. В то же время остается практически не изученным влияние комбинации факторов пассивного табакокурения на формирование в пренатальном периоде центральных механизмов регуляции дыхания. Значение данного направления исследования является очень важным для понимания патогенеза симптома внезапной младенческой смертности, так как известно, что пассивное курение увеличивает риск его возникновения [4]. В связи с этим настоящее исследование было посвящено изучению пренатального фумигационного влияния факторов пассивного курения на функционирование центральных механизмов регуляции дыхания у новорожденных крыс in vitro.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на 107 изолированных бульбоспинальных препаратах (БСП) мозга новорожденных белых беспородных крыс в условиях in vitro. Препараты были получены из мозга 107 новорождённых крыс в возрасте одних суток. Экспериментальную группу составили 57 БСП. В экспериментах использовались крысы после самопроизвольного рождения.
После датирования беременности крысы помещались в вентилируемую (95 м3/час) камеру объемом 0,374 м3. В течение всего срока беременности
(1–20 сутки) производилась фумигация экспериментальной группы (ПК) животных сигаретным дымом в течение 8 часов в сутки по одной сигарете через каждые 60 минут 5 дней в неделю. Концентрация твёрдых взвешенных частиц в воздухе в активную фазу составляла 1 мг/м3. Контрольная группа животных (НК) помещалась в другую вентилируемую камеру, при этом фумигации дымо-воздушной смесью не проводилось.
БСП были получены по методике, описанной Suzue T. в 1984 году [5]. По окончании препаровки препарат помещался в регистрационную камеру объемом 3 мл. Перфузию препарата в камере проводили со скоростью 3 мл/мин. Электрическая потенциалы отводились с помощью всасывающего электрода с вентральных корешков сегментов С3–С4. Для моделирования гиперкапнического воздействия бульбоспинальные препараты мозга новорождённых крыс в течении 10 минут перфузировались раствором искусственной цереброспинальной жидкости (ЦСЖ), насыщенной газовой смесью, состоящей из 10 % СО2 и 90 % О2, рН 6,9–7,0. Электрическую активность БСП начинали регистрировать за 5 минут перед гиперкапническим воздействием и продолжали до его прекращения (в течение 10 минут). Исследование выполнено на 21 БСП, экспериментальную группу составили 12 препаратов полученных от 12 новорождённых крыс (0–1 сутки). Для моделирования гипоксического воздействия бульбоспинальные препараты мозга новорождённых крыс в течение 20 минут орошались раствором искусственной цереброспинальной жидкости, насыщенной газовой смесью 5 % СО2 в азоте, рН раствора поддерживался на уровне 7,3–7,4, после чего препараты в течение 15 минут орошались искусственной ЦСЖ насыщенной смесью газов исходного состава (5 % СО2 в кислороде). Электрическую активность БСП начинали регистрировать за 5 минут до гипоксического воздействия, затем в течение всего периода гипоксии и 15 минут после возвращения к исходному составу газов (отмыву). Исследование выполнено на 38 БСП, экспериментальную группу составили 21 препарат мозга, полученные от 21 новорождённой крысы (0–1 сутки).
При обработке нейрограмм измерялись продолжительность цикла респираторной активности (с), продолжительность (с) и амплитуда инспираторных разрядов (мкВ). Спектральный анализ разрядов производился с использованием алгоритма быстрого преобразования Фурье. В спектрограммах респираторных разрядов выделялись максимальные пики в низко- (1–10 Гц) и среднечастотном (10–50 Гц) диапазонах. Для описания пиков спектра респираторных разрядов использовались следующие параметры: частота пика (Гц) и спектральная плотность мощности (СПМ) пика (относительные единицы). Показатели спектральных характеристик рассчитывались на основании данных, полученных от 10 спектрограмм последовательных инспираторных разрядов.
Анализ статистических различий производился с помощью t–теста Стьюдента для средних величин. Различия считались достоверными при р<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование параметров респираторной активности бульбоспинальных препаратов мозга новорожденных крыс, полученных от контрольной и экспериментальной групп самок выявило значительные изменения спектральных и частотно-временных характеристик респираторной частоты и паттерна.
При анализе амплитудно-временных параметров респираторных разрядов бульбоспинальных препаратов мозга новорожденных крыс было отмечено, что значения амплитуды и продолжительности инспираторных разрядов препаратов группы пассивного курения меньше аналогичных показателей в контрольной группе в среднем на 16,1 % (p<0,05) и 10,9 % соответственно (таблица). Продолжительность респираторного цикла у бульбоспинальных препаратов мозга группы пассивного курения была на 15,3 % меньше, чем в контрольной (p<0,05).
При спектральном анализе выявлено меньшее значение спектральной плотности мощности в низкочастотном (1–10 Гц) и среднечастотном (11–50 Гц) диапазонах спектра инспираторных разрядов С3-С4 бульбоспинальных препаратов мозга новорожденных крыс опытной группы по сравнению с контрольной группой: 16,3 % и 33,4 % соответственно (p<0,05) (таблица). Частота низкочастотного пика осцилляций в экспериментальной группе была меньше, чем в контрольной на 11,2 % (p<0,05) (таблица), частота среднечастотного пика – на 14,3 % (p<0,05).
Анализ параметров электрической активности бульбоспинальных препаратов мозга новорождённых крыс показал наличие значительных различий в реакции респираторной нейронной сети продолговатого мозга на гиперкапническую стимуляцию между контрольной группой и группой пассивного курения.
Реакция бульбоспинальных препаратов мозга новорождённых крыс принадлежавших самкам контрольной группы на гиперкапническое воздействие характеризовалось уменьшением продолжительности респираторного цикла на 12 % относительно исходных значений параметра (13,9 и 12,2 с. соответственно) и амплитуды инспираторных разрядов на 10,8 % относительно исходных значений параметра (60,15 и 53,7 мкВ соответственно) (рис. 1). В спектре инспираторных разрядов бульбоспинальных препаратов мозга новорожденных крысят контрольной группы гиперкапническое воздействие вызывало изменение соотношения мощностей низкочастотного и среднечастотного компонентов спектра инспираторного разряда на 16,9 % относительно исходных значений параметра (1,29 и 1,1 о.е. соответственно) за счет снижения мощности низкочастотного пика осцилляций на 16,9 % относительно исходных значений параметра (3,41 и 2,78 о.е. соответственно).
Таблица
Изменение параметров респираторной активности бульбоспинальных препаратов на фоне воздействия пассивного курения в нормокапнических условиях (М ± σ) n=107
| Параметры инспираторной активности | Группа ПК | Группа НК |
| Мощность низкочастотного пика (МНЧ), о.е. | 4,09±0,23 | 4,88±0,31* |
| Частота низкочастотного пика, Гц. | 5,29±0,26 | 5,95±0,32* |
| Мощность среднечастотного пика (МСЧ), о.е. | 2,91±0,17 | 4,37±0,76* |
| Частота среднечастотного пика, Гц. | 15,87±0,63 | 18,52±1,31* |
| Соотношение МНЧ/МСЧ | 1,49±0,07 | 1,41±0,08 |
| Амплитуда инспираторного разряда, мкв. | 45,13±2,12 | 53,79±2,86* |
| Продолжительность инспираторного разряда (Тр), с. | 0,95±0,03 | 1,04±0,04* |
| Коэффициент вариабельности Тр, о.е. | 0,19±0,01 | 0,21±0,01 |
| Продолжительность респираторного цикла (ПРЦ), с. | 15,34±0,72 | 17,75±1,17* |
| Коэффициент вариабельности ПРЦ, о.е. | 0,19±0,01 | 0,19±0,01 |
Примечание: * – достоверность различий параметров, p<0,05
У бульбоспинальных препаратов мозга новорожденных крыс опытной группы на фоне гиперкапнического воздействия также происходило изменение соотношения мощностей в спектре инспираторного разряда на 22,6 % относительно фоновых значений параметра (1,19 и 0,92 о.е. соответственно), причём так же как и в контрольной группе за счёт снижения мощности низкочастотного пика осцилляций относительно исходных значений параметра на 18,3 % (4,36 и 3,56 о.е. соответственно). Снижение амплитуды инспираторных разрядов было менее выражено, чем в контроле, но осталось достоверным (48,5 и 44,5 мкв. соответственно). Реакция на гиперкапнию бульбоспинальных препаратов мозга новорождённых крыс группы пассивного курения отличалась от реакции в контрольной группе отсутствием сокращения продолжительности респираторного цикла (рис. 1) и существенным смещением пика низкочастотного диапазона в сторону большей частоты (4,49 и 5,7 Гц. соответственно).
В нашем исследовании у бульбоспинальных препаратов мозга новорожденных крыс контрольной группы (0–1 сутки) не удалось четко выделить фазу аугментации в гипоксических условиях. В исследовании были использованы препараты мозга, полученные от новорожденных крыс в первые сутки после рождения, в этот период фаза аугментации в условиях гипоксии или слабо выражена или отсутствует вовсе [6].
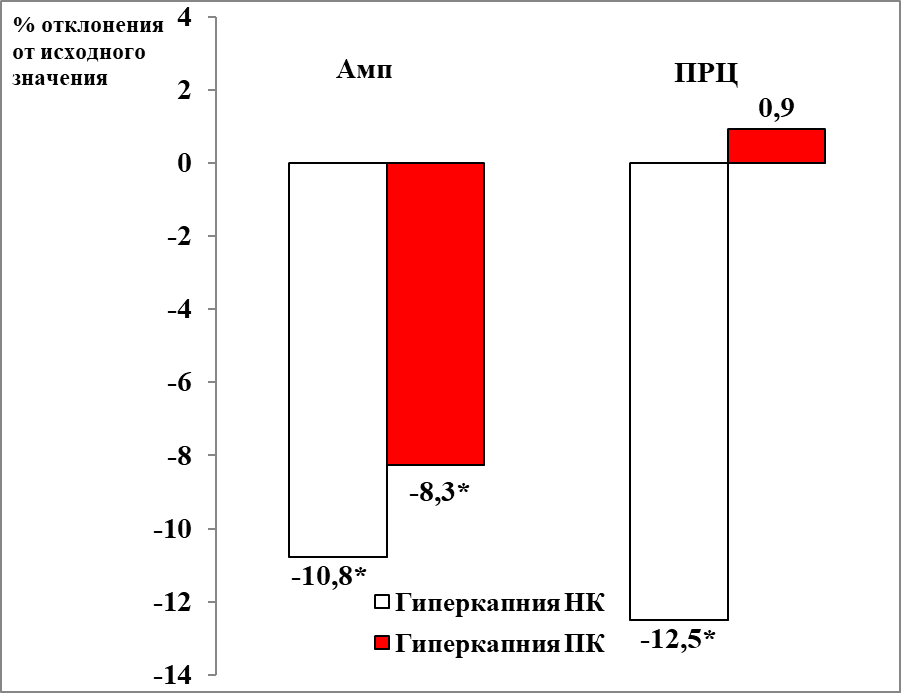
Рис. 1 Изменение амплитудно-временных параметров респираторной активности, регистрируемой с вентральных корешков С3-С4 БСП новорождённых крыс групп ПК и НК при гиперкапническом воздействии.
Примечание: * – достоверность различий параметров, p < 0,05
Депрессия респираторного ритма бульбоспинальных препаратов мозга новорождённых крыс контрольной группы достигала достоверной выраженности на 5 минуте в условиях гипоксии (рис. 2). Восстановление респираторного ритма до исходного уровня после прекращения гипоксического воздействия происходило через 10 минут. Одновременно с увеличением продолжительности респираторного цикла происходило значимое увеличение амплитуды инспираторных разрядов (рис. 2), которая не восстанавливалась до исходных значений в течение всего периода восстановления после гипоксического воздействия (15 минут). У препаратов контрольной группы на 10 минуте гипоксического воздействия достоверно уменьшалась продолжительность инспираторных разрядов (рис. 2), которая восстанавливалась через 10 минут после прекращения гипоксического воздействия. Достоверное увеличение соотношения мощности низкочастотных и среднечастотных осцилляций в контрольной группе наблюдалось на 15 минуте гипоксического воздействия, эти изменения сохранялись в течение первых 10 минут периода восстановления.
В группе пассивного курения, также как и в контрольной группе, у большинства бульбоспинальных препаратов на фоне гипоксического воздействия не удалось выделить фазу аугментации. При оценке влияния пренатального пассивного курения на динамику развития гипоксической депрессии респираторного ритма было отмечено, что значимое увеличение продолжительности респираторного цикла в группе пассивного курения происходило позже, чем в контрольной группе (на 10 минуте воздействия) (рис. 2). При этом динамика восстановления респираторного ритма после гипоксического воздействия остается аналогичной той, что наблюдалась в контроле. У бульбоспинальных препаратов мозга новорожденных крыс группы пассивного курения достоверное увеличение амплитуды инспираторных разрядов происходило на 10 минуте гипоксического воздействия, в отличие от контрольной группы (рис. 2). Особенностью динамики изменения амплитуды инспираторных разрядов при гипоксическом воздействии в группе пассивного курения является не только более позднее развитие фазы увеличения, но и то, что в период восстановления она возвращается к исходному уровню на 10 минуте, а в контрольной группе оставалась повышенной до конца эксперимента (рис. 2).
В отличие от препаратов контрольной группы, в группе пассивного курения уменьшение продолжительности инспираторных разрядов и увеличение соотношения мощностей осцилляций низко- и среднечастотного диапазона наступало раньше – на 5 и 10 минуте гипоксического воздействия соответственно (рис. 2). После прекращения гипоксического воздействия в течение 15 минут оба этих параметра не пришли к исходному значению в обеих группах.
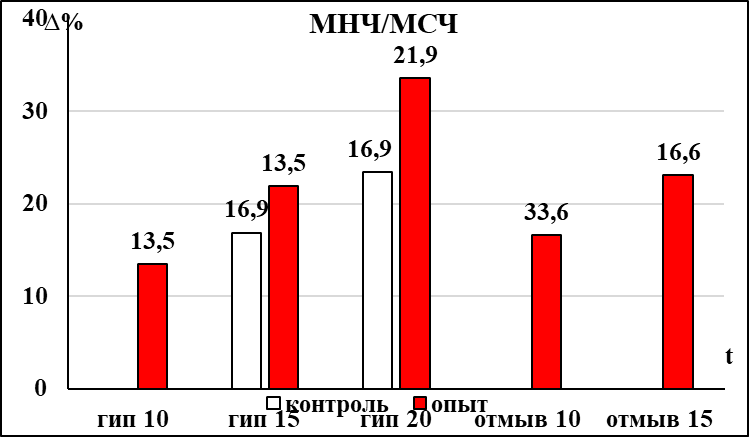
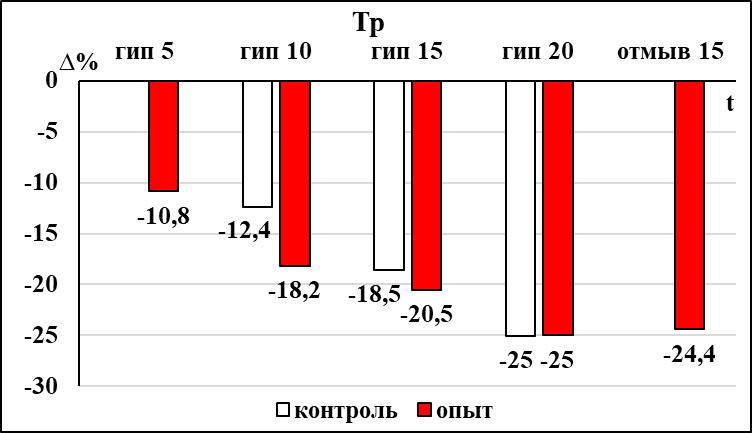
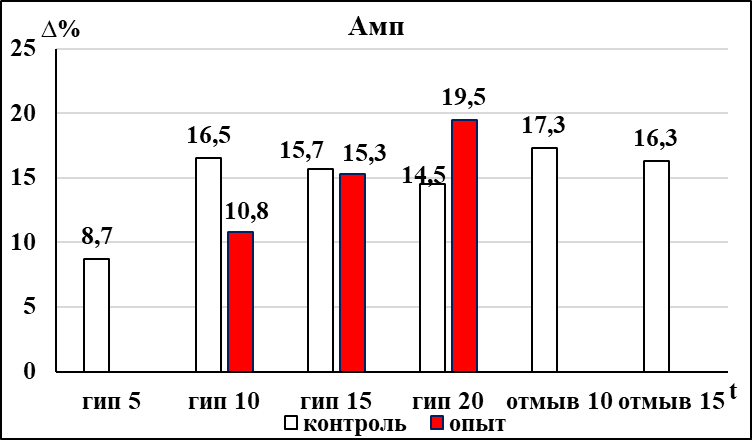
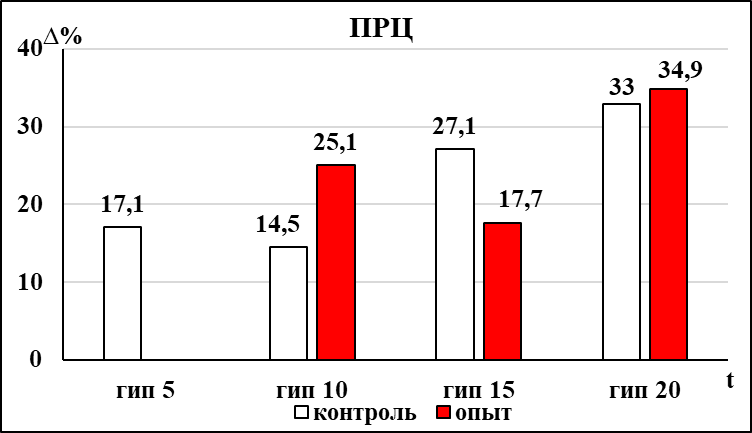
Рис. 2 Статистически значимые изменения параметров респираторной активности, регистрируемой с вентральных корешков С3-С4 БСП новорождённых крыс групп ПК и НК в условиях гипоксии.
Примечание: * – достоверность различий параметров, p < 0,05.
В результате проведённого исследования было установлено, что у новорождённых крыс, перенесших пренатальное пассивное курение наблюдается большая частота генерации инспираторных разрядов, смещение пиков спектральной плотности мощности респираторных разрядов обоих диапазонов в сторону низких частот, уменьшение их мощности, снижение амплитуды и меньшая продолжительность инспираторных разрядов в сравнении с интактными животными. Подобные изменения респираторного ритма и паттерна могут быть следствием модифицирующего влияния факторов пренатального пассивного курения, в частности никотина, на формирование структуры респираторных нейронных сетей, а также изменения свойств синаптического взаимодействия центральных респираторных нейронов [1, 7].
В данном исследовании показано, что особенностью реакции на гипоксию у новорождённых крыс, перенесших пренатальное пассивное курение, является позднее формирование фазы гипоксической депрессии респираторного ритма. В настоящее время накоплено достаточно много сведений о влиянии пренатального воздействия никотина на реакцию центральной респираторной нейронной системы на гипоксию у новорождённых, хотя они зачастую противоречивы [8, 9]. Существует мнение, что влияние табачного дыма может отличаться от действия никотина [10]. Так, например угарный газ СО, компонент табачного дыма, может приводить к фетальной гипоксии [11]. Таким образом обнаруженное нами изменение реакции на гипоксию у новорождённых крыс, перенесших пренатальное пассивное курение, заключающееся в более позднем наступлении фазы респираторной депрессии можно объяснить модифицирующим влиянием компонентов табачного дыма, вызывающих фетальную гемическую гипоксию, что может вызывать адаптацию дыхательного центра к низкому содержанию кислорода и снизить его чувствительность к изменению напряжения кислорода в ликворе в раннем постнатальном периоде. На ряду с этим нами установлено, что реакция на гиперкапнию бульбоспинальных препаратов мозга новорождённых крыс, перенесших пренатальное пассивное курение, отличалась отсутствием сокращения продолжительности респираторного цикла, что согласуется с более ранними исследованиями, в которых указано на снижение чувствительности дыхательного центра к изменению концентрации СО2 в ликворе, а так же к изменению его рН, вызванное пренатальным воздействием никотина [4, 2, 12].
ЗАКЛЮЧЕНИЕ
Таким образом, выполненное нами исследование показывает, что пренатальное пассивное курение влияет на механизм формирования респираторного ритма и паттерна, а также модифицирует респираторный ответ на изменение парциального напряжения дыхательных газов в ликворе in vitro, что может быть следствием модифицирующего влияния компонентов табачного дыма на развивающиеся нейронные структуры, вовлечённые в процесс центральной регуляции респирации.
REFERENCES
- Jaiswal S. J., Buls Wollman L., Harrison C. M., Pilarski J. Q., Fregosi R. F., Developmental nicotine exposure enhances inhibitory synaptic transmission in motor neurons and interneurons critical for normal breathing, Developmental neurobiology. (2015).
- Huang Y. H., Brown A. R., Cross S. J., Cruz J., A.Rice J., Stuti, F. Ralph, J. Influence of prenatal nicotine exposure on development of the ventilatory response to hypoxia and hypercapnia in neonatal rats, Appl Physiol., 109, 149 (2010).
- Huang Z. G., Griffioen K. J., Wang X, Dergacheva O., Kamendi H., Gorini C., Bouairi E., Mendelowitz D. Differential control of central cardiorespiratory interactions by hypercapnia and the effect of prenatal nicotine, J Neurosci., 26(1), 21 (2006).
- Eugenín J., Otarola M., Bravo E., Coddou C. Prenatal to early postnatal nicotine exposure impairs central chemoreception and modifies breathing pattern in mouse neonates: a probable link to sudden infant death syndrome, Neurosci., 28(51), 13907 (2008).
- Suzue T. Respiratory rhythm generation in the in vitro brain stem-spinal cord preparation of the neonatal rat, J Physiol., 354, 173 (1984).
- Bissonnette J. M. Mechanisms regulating hypoxic respiratory depression during fetal and postnatal life, Physiol Regul Integr Comp Physiol., 278(6), R1391 (2000).
- Powell G. L. Gaddy J., Xu F., Fregosi R., Levin R. B. Developmental nicotine exposure disrupts dendritic arborization patterns of hypoglossalmotoneurons in the neonatal rat, Dev Neurobiol., 76(10), 1125 (2016).
- Cheung E., Wong N., Mortola J. P. Compliance of the respiratory system in newborn and adult rats after gestation in hypoxia, J. Comp. Physiol., 170(3), 193 (2000).
- Hu H., Brahmbhatt A., Upadhyaya R., Vega D., Hill A. A. Prenatal nicotine exposure alters the response of the mouse in vitro respiratory rhythm to hypoxia, Respir Physiol Neurobiol., 181(2), 234 (2012).
- Pendlebury J. D., Wilson R. J., Bano S., Lumb K. J., Schneider J. M., Hasan S. U. Respiratory control in neonatal rats exposed to prenatal cigarette smoke, American journal of respiratory and critical care medicine., 177(11), 1255 (2008).
- Ekblad M., Korkeila J., Lehtonen L. Smoking during pregnancy affects fo et. al brain development, ActaPaediatr., 104(1), 12 (2015).
- Porzionato A., Macchi V., De Caro R. Central and peripheral chemoreceptors in sudden infant death syndrome, J Physiol., 596(15), 3007 (2018).

