FREQUENCY-AMPLITUDE CHARACTERISTICS OF THE TOTAL BIOPOTENTIALS OF THE CA3 ZONE OF THE HIPPOCAMPUS UNDER THE ACTION OF COBALT AND NICKEL SALICYLATE
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 7 (73), №3, 2021
Publication text (PDF):Download
UDK: 615.212.3:591.044
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Khusainov D. R., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Chuyan E. N., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Korenyuk I. I., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Ablyakimova V. L. V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
TYPE:Article
DOI:https://doi.org/10.37279/2413-1725-2021-7-3-239-249
PAGES:from 239 to 249
STATUS:Published
LANGUAGE:Russian
KEYWORDS: cobalt salicylate, nickel salicylate, bioelectrogenesis, hippocampus.
ABSTRACT (ENGLISH):
The neurotropic effects of cobalt and nickel salicylate were studied during perfusion of rat hippocampal sections with solutions of these salts at concentrations of 10-2 M,
10-3 M, 10-4 M and 10-6 M. The results of this study convincingly demonstrate that the formation of complex salts of acetylsalicylic acid with divalent metals cobalt and nickel leads to changes in neurotropic effects with varying degrees of severity. In the case of nickel salicylate, there is a decrease in the severity of the depressing neurotropic effect compared with acetylsalicylic and salicylic acids [16]. And in the case of cobalt salicylate at a concentration of 10-4 M, an activation effect is manifested. We believe that this is due to the influence of the whole complexon, since a high degree of stability is shown for cobalt salicylate, especially in an aqueous solution [10]. And this salt should remain fairly stable. In this regard, it is natural to assume that cobalt salicylate is capable of triggering other processes compared to acids and, perhaps, the mechanism of its action is less strongly associated with the COX system. The observed activation effect may be associated with a direct stimulating effect on the nerve cell and/or the result of synchronization of excitation in neural networks. It should be noted that the neurotropic effects of cobalt salicylate revealed in this work coincide in their orientation with the effect of this salt on the functioning of neurons of the subcaryngeal ganglia complex of the grape snail [10]. This indicates the uniformity of the mechanisms of influence of this salt on the nervous tissue of invertebrates and vertebrates.
For nickel salicylate, only a weakening of the inhibitory effect is shown in comparison with the precursor acids, perhaps the stability constant of this salt is not high and its noticeable dissociation occurs. As a result, the released residues of acetylsalicylic acid will block COX, which will trigger a mechanism of neurotropic influence close to the effects of salt solutions, the effects of which were described earlier [16]. The contribution of nickel ions will be insignificant, because its mass fraction in the salt molecule is small. From the position of ionic mechanisms, we believe that the inhibition of the generation of total biopotentials by the studied salts is most likely associated with the suppression of the incoming sodium current. And the stimulating effect of cobalt salicylate in a concentration of 10-4 M, on the contrary, with its stimulation (relief). Also, the described effects can be realized as a result of modulation of synaptic interaction in neural networks. Elucidation of these biophysical mechanisms is a priority task of our further research. And also, the most important question remains open about the possible change in the effects of these salts with different injections of substances into the body: oral, intramuscular, intravenous, etc.
ВВЕДЕНИЕ
В середине 90-х годов у аспирина была обнаружена способность оказывать антидепрессантное действие, что моментально привлекло внимание научного сообщества [1]. В дальнейших исследованиях [2–4] были получены убедительные доказательства антидепрессантного и анксиолитического действия этого препарата и его производных. Показано, что антидепрессантное влияние аспирина связано с его противовоспалительным действием [5]. Основным «камнем преткновения» является тот факт, что аспирин оказывает заметное андидепрессантное воздействие в больших дозах или при длительном применении в привычных терапевтических [6]. В связи с этим ведется широкий поиск новых перспективных соединений и особое внимание уделяется различным модификациям молекул родоначальниц [7]. Вне всякого сомнения, любое психоактивное действие имеет прямое или опосредованное влияние на нервную систему и ее структурные элементы.
МАТЕРИАЛЫ И МЕТОДЫ
Для приготовления in vitro препаратов переживающих срезов гиппокампа использовались лабораторные крысы линии Wistar возрастом 14–16 месяцев. После декапитации мозг животного извлекался и помещался в охлажденный (4° С) раствор искусственной цереброспинальной жидкости (aCSF) следующего состава (в мМ): NaCl 126, KCl 3.5, CaCl2 2.0, MgCl2 1.3, NaHCO3 25, NaH2PO4 1.2, глюкоза 11 (pH 7.4), насыщенный кислородом (95 %) и углекислым газом (5 %). Далее удалялся мозжечок и приготавливались на микротоме Ci 7000 SMZ-2 Campden Instruments горизонтальные срезы гиппокампа толщиной 400 мкм. Полученные срезы рассекались на две полусферы и готовые препараты помещаются в оксигенированный (95 % O2/5 % CO2) раствор aCSF, где выдерживаются при комнатной температуре (20–22 °С) около часа перед непосредственным использованием в эксперименте.
Для регистрации биопотенциалов препарат размещалсяв специализированной ванночкес непрерывным потоком (2 мл/мин) оксигенируемого раствора CSF. Непосредственная регистрация внеклеточных суммарных биопотенциалов осуществлялась с помощью металлического (хлор-серебряного) электрода соединенного с усилителем Model 2400 A-MSystem, оцифровка сигнала – аналогово-цифровым преобразователем CED 1401 Micro3. Температура омывающего раствора поддерживалась на уровне 37 0С термоконтроллером
ТС-324С. Внеклеточная сетевая активность регистрировалась в СА3 области гиппокампа. В целом методически эксперимент соответствовал общепринятым подходам [8], но мы подвергли анализу наиболее выразительные (по сути, гигантские деполяризующие потенциалы), разделив их на пять амплитудных категорий: 20–40 мкВ, 41–60 мкВ, 61–80 мкВ, 81–100 мкВ и 100+ мкВ.
Исследуемые соли перфузировались в концентрациях 10-2 М, 10-3 М, 10-4 М и
10-6 М, непосредственно перфузия раствором вещества длилась 10 минут, далее следовало тридцатиминутное отмывание. Для каждой концентрации каждой соли использовано 8 полусфер переживающих срезов гиппокампа. Запись и анализ нейрограмм осуществлялись с помощью программного пакета Spike2. Статистический анализ осуществлялся с использованием критерия Тьюки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В настоящем исследовании при внеклеточном отведении регистрировались суммарные биопотенциалы СА3 зоны гиппокампа крыс при перфузии срезов растворами салицилатов кобальта и никеля в трех концентрациях 10-2 М, 10-3 М,
10-4 М и 10-6 М. В самом начале описания результатов исследования отметим, что при перфузии срезов раствором солей в концентрации 10-2 М наблюдалось существенное угнетение суммарных биопотенциалов с полным исчезновением диапазона амплитуд, указанного в разделе «Материалы и методы». В связи с этим, в разделе результатов мы более не будем уделять внимание описанию эффектов этой концентрации.
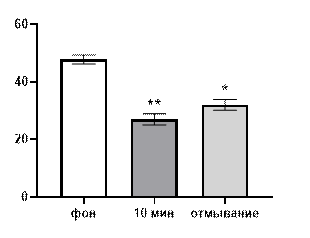
Начнем рассмотрение полученных результатов с описания эффектов салицилата кобальта. В концентрации 10-3 М указанная соль выраженно подавляла генерацию биопотенциалов, вызывая значительной снижение их средней амплитуды (рис. 1 А) от 46±1,56 мкВ до 29,6±1,92 мкВ (р≤0,01) через 10 минут от начала перфузии. После 30 минут отмывания средняя амплитуда биопотенциалов не восстанавливалась и составляла 34±1,87 мкВ (р≤0,01).
 |
 |
| А | Б |
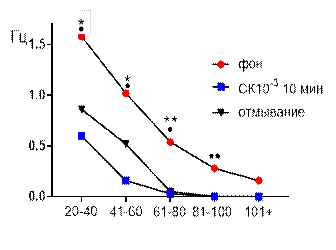
Рис. 1. Значение средней амплитуды (А) и частотно-амплитудное распределение (Б) суммарных биопотенциалов СА3 зоны гиппокампа при перфузии среза раствором салицилата кобальта в концентрации 10-3 М.
Примечания: * – отличия показателя от фонового уровня при р≤0,05, ** – отличия показателя от фонового уровня при р≤0,01, • – отличия показателя от его значения после 30-ти минутного отмывания при р≤0,05, •• – отличия показателя от его значения после 30-ти минутного отмывания при р≤0,01, СК10-3 10 мин – значение показателя на десятой минуте перфузии среза раствором салицилата кобольта в концентрации 10-3 М, отмывание – значение показателя после 30-ти минутного отмывания.
При рассмотрении частотно амплитудных характеристик биопотенциалов видно, что в фоне выделяются пять типов потенциалов с амплитудой 20–40 мкВ, 41–60 мкВ, 61–80 мкВ, 81–100 мкВ и более 100 мкВ (рис. 1 Б). Частоты этих потенциалов распределились следующим образом: 1,58±0,2 Гц, 1,02±0,2 Гц, 0,54±0,08 Гц, 0,28±0,051 Гц, 0,16±0,04 Гц. Через 10 минут перфузии активность среза существенно подавляется и полностью исчезали суммарные биопотенциалы с амплитудой более 80 мкВ. Сохранившийся амплитудный диапазон существенно снижался по частотной характеристике в отношении фоновых значений. Так, биопотенциалы с амплитудой 61–80 мкВ генерировались с частотой 0,03±0,018 Гц (р≤0,01), с амплитудой 41–60 мкВ – 0,16±0,05 Гц (р≤0,05), с амплитудой 20–40 мкВ – 0,6±0,11 Гц (р≤0,05).
При отмывании наблюдалось лишь частичное восстановление, при котором на 30 минуте амплитудные и частотные показатели биоэлектрической активности не достигали достоверного уровня отличий от перфузионных значений.
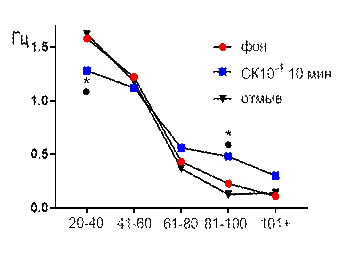
В концентрации салицилата кобальта 10-4 М к десятой минуте перфузии наблюдалось увеличение средней амплитуды суммарных биопотенциалов от 44,2±1,84 мкВ до 52,4±1,24 мкВ (р≤0,05, рис. 2 А). В частотно-амплитудном распределении суммарных потенциалов происходило снижение вклада низкоамплитудных и увеличение доли высокоамплитудных. Частота генерации биопотенциалов диапазона 20–40 мкВ снижалась от 1,58±0,31 Гц до 1,28±0,12 Гц (р≤0,05); диапазона 81–100 мкВ увеличивалась от 0,22±0,07 Гц до 0,48±0,12 Гц (р≤0,05) к 10-той минуте от начала перфузии (рис. 2 Б). После 30 минут отмывания все показатели биоэлектрической активности возвращались к фоновому уровню.
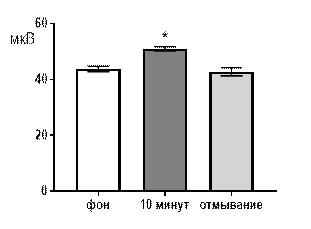 |
 |
| А | Б |
Рис. 2. Значение средней амплитуды (А) и частотно-амплитудное распределение (Б) суммарных биопотенциалов СА3 зоны гиппокампа при перфузии среза раствором салицилата кобальта в концентрации 10-4 М.
Примечания: СК10-4 10 мин – значение показателя на десятой минуте перфузии среза раствором салицилата кобальта в концентрации 10-4 М; остальные обозначения те же, что и на рис. 1.
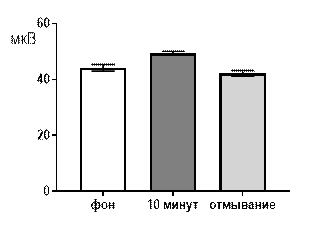
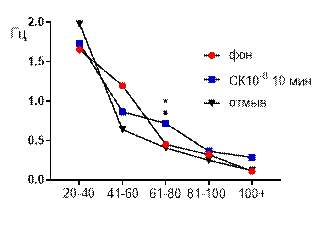
Салицилат кобальта в концентрации 10-6 М не вызывал достоверных изменений средней амплитуды суммарных биопотенциалов гиппокампа СА3 зоны (рис. 3 А) и практически не изменял частотно амплитудную характеристику распределения суммарных биопотенциалов, за исключением диапазона 61–80 мкВ (рис. 3 Б). Суммарные биопотенциалы указанного амплитудного диапазона к десятой минуте перфузии среза раствором салицилата кобальта (10-6 М) начинали генерироваться с возросшей частотой: от 0,32±0,2 Гц до 0,72±0,3 Гц (р≤0,05).
После 30 минут отмывания все показатели биоэлектрической активности возвращались к фоновому уровню.
Нейротропные эффекты салицилата никиля.
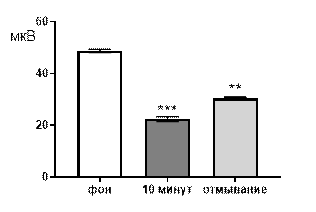
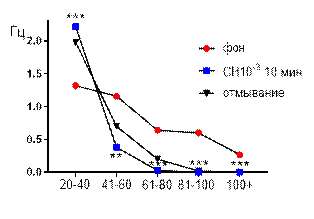
Итак, в концентрации 10-3 М салицилат никиля, в целом, вызывал угнетение суммарной биоэлектрической активности гиппокампа крыс с возрастанием выраженности низкоамплитудного диапазона (рис. 4 А, Б). К десятой минуте перфузии происходило выраженное снижение средней амплитуды суммарных биопотенциалов от 50,5±1,4 мкВ до 24,6±1,3 мкВ (р≤0,001, рис. 4 А), суммарные потенциалы с амплитудой более 80 мкВ полностью подавлялись. Сохранившиеся амплитудные диапазоны изменяли частотную характеристику следующим образом: 61–80 мкВ – от 0,64±0,1 Гц до 0,028±0,017 Гц (р≤0,001); 41–60 мкВ – от 1,16±0,2 Гц до 0,38±0,08 Гц (р≤0,01); диапазон 20–40 мкВ, наоборот, возрастал от 1,32±0,2 Гц до 2,23±0,54 Гц (р≤0,001, рис. 4 Б).
 |
 |
| А | Б |
Рис. 3 Значение средней амплитуды (А) и частотно-амплитудное распределение (Б) суммарных биопотенциалов СА3 зоны гиппокампа при перфузии среза раствором салицилата кобальта в концентрации 10-6 М.
Примечания: СК10-6 10 мин – значение показателя на десятой минуте перфузии среза раствором салицилата кобальта в концентрации 10-6 М; остальные обозначения те же, что и на рис. 1.
После 30 минутного отмывания генерация биопотенциалов демонстрировала картину, совпадающую с таковой, которая наблюдалась на 10-той минуте перфузии салицилата никеля.
 |
 |
| А | Б |
Рис. 4. Значение средней амплитуды (А) и частотно-амплитудное распределение (Б) суммарных биопотенциалов СА3 зоны гиппокампа при перфузии среза раствором салицилата никеля в концентрации 10-3 М.
Примечания: СН10-3 10 мин – значение показателя на десятой минуте перфузии среза раствором салицилата никеля в концентрации 10-3 М, *** – отличия показателя от фонового уровня при р≤0,001; остальные обозначения те же, что и на рис. 1.
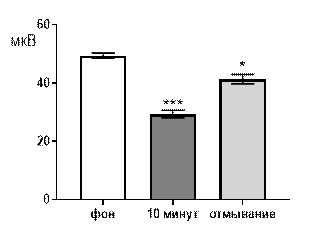
При перфузии срезов раствором салицилата никеля в концентрации 10-4 М угнетающее действие сохранялось, но становилось менее выраженным. Так через 10 минут перфузии средняя амплитуда суммарных потенциалов снижалась от 20,8±1,8 мкВ до 33,1±2,24 при р≤0,001. После 30 минут отмывания амплитуда возрастала до 43,2±1,53 мкВ, но не отличалась от перфузионного значения и оставалась достоверно меньшей по сравнению с фоном при р≤0,05 (рис. 5 А).
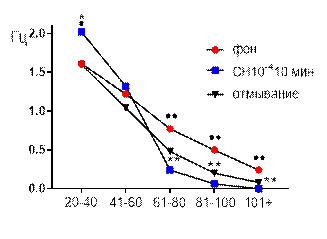
Частотно-амплитудное распределение суммарных биопотенциалов СА3 зоны гиппокампа при перфузии среза раствором салицилата никеля в концентрации
10-4 М также демонстрировало существенное угнетающее действие примененного химического агента. К десятой минуте перфузии исчезали потенциалы наибольшего амплитудного диапазона 101+, частота генерации потенциалов двух диапазонов
61–80 мкВ и 81–100 мкВ снижалась от 0,77±0,09 Гц до 0,48±0,11 Гц (р≤0,01) и от 0,5±0,06 Гц до 0,2±0,08 Гц (р≤0,01), соответственно (рис. 5 Б). Частота генерации потенциалов амплитудного диапазона 41–60 мкВ существенно не изменялась, а частота потенциалов 20–40 мкВ возрастала от 1,61±0,1 Гц до 2,02±0,28 Гц (р≤0,05).
 |
 |
| А | Б |
Рис. 5. Значение средней амплитуды (А) и частотно-амплитудное распределение (Б) суммарных биопотенциалов СА3 зоны гиппокампа при перфузии среза раствором салицилата никеля в концентрации 10-4 М.
Примечания: СН10-4 10 мин – значение показателя на десятой минуте перфузии среза раствором салицилата никеля в концентрации 10-4 М; остальные обозначения те же, что и на рис. 1.
После 30-ти минутного отмывания средняя амплитуда биопотенциалов оставалась сниженной, частотные характеристики потенциалов амплитудных диапазонов 20–40 мкВ и 41–60 мкВ не отличались от фоновых значений, а диапазонов 61–80 мкВ, 81–100 мкВ и 101+ мкВ сохранялись на достоверно более низком уровне по сравнению с фоном при р≤0,01 (рис. 5 Б).
При перфузии срезов раствором салицилата никеля в концентрации 10-6 М угнетающее действие, все еще, проявлялось достаточно выраженно (рис. 6 А, Б). Так, через 10 минут перфузии средняя амплитуда суммарных потенциалов составляла 38,1±2,7 мкВ при р≤0,01 по сравнению с фоновым значением 49,7±1,9 мкВ. После отмывания средняя амплитуда суммарных потенциалов составляла 48,4±2,6 мкВ и не достигался достоверный уровень отличий как от фоновых значений, так и от перфузионных (рис. 6 А).
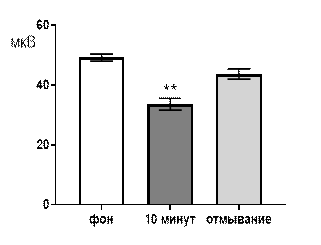 |
 |
| А | Б |
Рис. 6. Значение средней амплитуды (А) и частотно-амплитудное распределение (Б) суммарных биопотенциалов СА3 зоны гиппокампа при перфузии среза раствором салицилата никеля в концентрации 10-6 М.
Примечания: СН10-6 10 мин – значение показателя на десятой минуте перфузии среза раствором салицилата никеля в концентрации 10-6 М; остальные обозначения те же, что и на рис. 1.
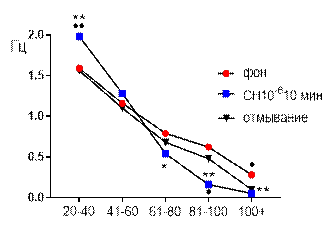
Частотно-амплитудное (рис. 6 Б) распределение суммарных биопотенциалов СА3 зоны гиппокампа при перфузии среза раствором салицилата никеля в концентрации 10-6 М выглядело следующим образом: к 10 минуте перфузии частота потенциаловамплитудного диапазона 20–40 мкВ возрастала от 1,59±0,1 Гц до 1,98±0,15 Гц (р≤0,01); 41–60 мкВ – не отличалась от фоновых значений; 61–80 мкВ – снижалась от 0,79±0,05 Гц до 0,54±0,15 Гц (р≤0,05); 81–100 – от 0,62±0,08 Гц до 0,16±0,05 Гц (р≤0,01) и 101+ – от 0,28±0,03 Гц до 0,1±0,02 Гц (р≤0,01).
Результаты настоящего исследования убедительно демонстрируют, что образование комплексных солей ацетилсалициловой кислоты с двухвалентными металлами кобальтом и никелем приводит к изменению нейротропных эффектов с разной степенью выраженности. В случае салицилата никеля наблюдается снижение выраженности угнетающего нейротропного эффекта по сравнению с ацетилсалициловой и салициловой кислотами [16]. А в случае с салицилатом кобальта в концентрации 10-4 М проявляется активационный эффект. Считаем, что это связано с влиянием всего комплексона, т.к. для салицилата кобальта показана высокая степень устойчивости, особенно в водном растворе [10]. И эта соль должна оставаться достаточно стабильной. В связи с этим закономерно предполагать, что салицилат кобальта способен запускать иные процессы по сравнению с кислотами и, возможно, механизм его действия связан с системой ЦОГ менее выраженно. Наблюдаемый активационный эффект может быть связан с непосредственным стимуляционным влиянием на нервную клетку и/или результатом синхронизации возбуждения в нейронных сетях.
Следует отметить, что выявленные в настоящей работе нейротропные эффекты салицилата кобальта по своей направленности совпадают с влиянием этой соли на функционирование нейронов подглоточного комплекса ганглиев виноградной улитки [10]. Это указывает на однотипность механизмов влияния указанной соли на нервную ткань беспозвоночных и позвоночных животных.
Для салицилата никеля показано лишь ослабление угнетающего действия по сравнению с кислотами предшественницами, возможно, константа устойчивости этой соли не высока и происходит ее заметная диссоциация. В результате чего высвободившиеся остатки ацетилсалициловой кислоты будут блокировать ЦОГ, что запустит механизм нейротропного влияния близкий к воздействию растворов солей, эффекты которых описаны ранее [16]. Вклад ионов никеля будет незначительным, т.к. его массовая доля в молекуле соли мала.
С позиции ионных механизмов считаем, что угнетение исследованными солями генерации суммарных биопотенциалов наиболее вероятносвязано с подавлениемвходящего натриевого тока. А стимулирующий эффект салицилата кобальта в концентрации 10-4 М, напротив, с его стимуляцией (облегчением). Также, описанные эффекты могут реализовываться в результате модуляции синаптического взаимодействия в нейронных сетях. Выяснение этих биофизических механизмов является приоритетной задачей наших дальнейших исследований. А также, остается открытым важнейший вопрос о возможном изменении эффектов этих солей при различном вводе веществ в организм: пероральном, внутримышечном, внутривенном и т.д.
ЗАКЛЮЧЕНИЕ
Салицилат никеля оказывает однонаправленное угнетающее действие на сетевой биоэлектрогенез нейронов гиппокампа крыс с прямопропорциональным возрастанием эффекта при увеличении его концентрации.
Салицилат кобальта в высоких концентрациях оказывает угнетающее воздействие, а в диапазоне около 10-4 М способен активировать (синхронизировать) биоэлектрогенез нейронов гиппокампа крыс.
Работа выполнена на оборудовании ЦКП ФГАОУ ВО «КФУ им. В. И. Вернадского» «Экспериментальная физиология и биофизика» в рамках гранта РФФИ № 20-33-70142.
REFERENCES
- Ketterer M. W., Brymer J., Rhoads K., Kraft P., & Lovallo W. R. Is aspirin, as used for antithrombosis, an emotion-modulating agent?, Journal of psychosomatic research, 40, 1 (1996).
- Brunello N., Alboni S., Capone G. Acetylsalicylic acid accelerates the antidepressant effect of fluoxetine in the chronic escape deficit model of depression, International clinical psychopharmacology, 21, 4 (2006).
- Almeida O. P., Flicker L., Yeap B. B. [et al.] Aspirin decreases the risk of depression in older men with high plasma homocysteine, Translational psychiatry, 2, 8 (2012).
- Guan X., Shao F., Xie X. [et al.] Effects of aspirin on immobile behavior and endocrine and immune changes in the forced swimming test: comparison to fluoxetine and imipramine, Pharmacology Biochemistry and Behavior, 124 (2014).
- Bayram F., Reis R., Tunçer B. & Sipahi H. The Importance of the Structural Similarity of Drugs Used for Depression and Inflammation, Two Comorbid Diseases, Current topics in medicinal chemistry, 18, 16 (2018).
- Alekhine E. K. Aspirin: the new life of an old medicine, Soros Educational Journal, 5, 7 (1999).
- Sokolik J., Tumova I., Blahova M. [et al.] Anti-inflammatory activities of copper (II) and zinc (II) 3,6-dimetylsalicylates and their equimolar mixture, ActaFacult. Farm. Univ. Comenianae, 53 (2006).
- Kurmashova E. D., Gataulina E. D., Zefirov A. L. et al. The effect of homocysteine and its derivatives on spontaneous network activity in the hippocampus of newborn baby rats, Russian Physiol. I. M. Sechenov Journal, 105, 10 (2019).
- Guide to immunopharmacology: Per. sangl. / Edited by M. M. Deila, J. K. Formena, 332 p. (M.: Medicine. – 1998).
- Korenyuk I. I., Husainov D. R., Shulgin V. F. Effects of salicylic acid and its salts on electrical activity of neurons of helix albescens, Neurophysiology, 37 (2005).
- Cheretaev I. V., Korenyuk I. I., Khusainov D. R., Gamma T. V., Kolotilova O. I., Nozdrachev A. D. ATP-dependent and calcium mechanisms of the effects of salicylates on electrical potentials in neurons in the mollusk Helix Albescens, Neuroscience and behavioral physiology, 46, 6 (2016).
- Mashkovsky M. D. Medicinal products: 16 ed. in 2 t., 1216 p. (M.: New Wave Publishing House, 2020).
- Hadley K. B., Ryan A. S., Forsyth S., Gautier S., & Salem N. The essentiality of arachidonic acid in infant development, Nutrients, 8, 4 (2016).
- Hatem Tallima, Rashika El Ridi Arachidonic acid: Physiological roles and potential health benefits, A review Journal of Advanced Research, In press, corrected proof, Available online 24 November 2017.
- John Colombo D., Shaddy Jill, Elizabeth H. Kerling [et. al] Docosahexaenoic acid (DHA) and arachidonic acid (ARA) balance in developmental outcomes, Prostaglandins, Leukotrienes and Essential atty Acids (PLEFA), 121, 6 (2017).
- Khusainov D. R., Korenyuk I. I., Ablyakimova V. L. Frequency-amplitude characteristics of the total biopotentials of the hippocamp ca3 zone under the influence of acetylcalicinic and salicylic acids, IOP Conf. Ser.: Earth Environ. Sci, 853 (2021). 012023.

