SILVER SORPTION DYNAMICS BY NATURAL ZEOLITES
ДИНАМИКА СОРБЦИИ СЕРЕБРА ПРИРОДНЫМИ ЦЕОЛИТАМИ
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №3, 2024
Publication text (PDF): Download
UDK: 544.723. 622.772
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Belova T. P., Research Geotechnological Center of Far Eastern Branch of Russian Academy of Sciences (RGC FEB RAS), Petropavlovsk-Kamchatsky, Russian Federation
Khizhko Z. I., Research Geotechnological Center of Far Eastern Branch of Russian Academy of Sciences (RGC FEB RAS), Petropavlovsk-Kamchatsky, Russian Federation
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-3-306-314
PAGES:from 306 to 314
STATUS:Published
LANGUAGE:Russian
KEYWORDS: silver, sorption capacity, zeolite tuff, dynamic sorption, desorption.
ABSTRACT (ENGLISH):
The present work provides data on sorption of silver ions in concentrations ranging from 10 to 20 mg/l from nitrate solutions. The zeolite tuff sorption properties from the Seredochnoe deposit in Khabarovsk Krai were investigated by the down flow solution method through a column with a fixed sorbent bed. The elution curves method was employed to ascertain the operational mode of the column and its dynamic response. Based on the elution curves, the practical maximum sorption capacity and the capacity before breakthrough for silver ions at the outlet of the sorption column were calculated. The Thomas model calculations revealed that for sorption from a silver nitrate solution with a concentration of 10 mg/l KTh, the sorption capacity was 2.50 and 3.09 ml/mg-min for the 1SD and 2SD columns, respectively. The maximum equilibrium sorption capacity in the first and second columns was found to be 0.63 mg/g. The capacity before breakthrough was calculated to be 0.45 mg/g. Upon doubling the concentration of the stock solution (column 8SD), KTh, 0.725 ml/mg⋅min, the maximum sorption capacity increased to 0.98 mg/g, while the capacity before breakthrough exhibited a value of 0.77 mg/g.
The following data were obtained when calculating KAB kinetic coefficients (ml/mg∙min): when sorption from solution with silver content of 10 mg/l, the KAB values were 2.48 and 3.07 ml/mg∙min, while at sorption from solution with silver content of 20 mg/l, the KAB was equal to 0.69 ml/mg-min. The theoretical sorption capacity in the first case is 0.67 mg/g, while in the second case it is 1.08 mg/g.
The values of the parameters calculated using the Thomas model and the Adams-Bohart model indicate that both models adequately describe the sorption of silver ions from nitrate solutions in the concentration range of 10–20 mg/l.
It is recommended that desorption be carried out with 0.1-0.2 n nitric acid. Under these conditions, concentrates with silver ions content of 22.52 mg/l were obtained using 0.1 n acid. Upon desorption with 0.2 n acid, the silver content was 25.23 mg/l and 105 mg/l. The concentration coefficient for one sorption–desorption cycle was found to be in the range of 2.25–5.25 units.
ВВЕДЕНИЕ
Промышленные сточные воды, как правило, содержат значительные количества ионов различных металлов. Сточные воды предприятий, сбрасываемые в открытые водоемы без очистки, способствуют загрязнению окружающей среды. Известно, что многие металлы, накапливаясь в растениях и почве, представляют угрозу здоровью людей и животных. Кроме этого, в районах горно-перерабатывающих предприятий потеря ценного сырья со сточными водами понижает рентабельность производства. Большой научный и практический интерес представляет извлечение ионов металлов из промышленных сточных вод. Одним из таких металлов является серебро. Серебро широко используется в качестве сырья в различных отраслях промышленности благодаря своим превосходным пластичным свойствам, электро- и теплопроводности, светочувствительности и антимикробным свойствам. Со сточными водами таких предприятий теряется большое количество серебра и из-за его токсичности, способности накапливаться в живых организмах, важно удалять серебро из сточных вод. Серебро относится ко второму классу опасности, ПДК (Ag) для питьевой воды составляет 0,05 мг/л.
Наиболее часто применяемые технологии выделения серебра – осаждение, электролиз, экстракция растворителем, ионный обмен с использованием синтетических смол и смол, способных к хелатообразованию. Эти методы могут быть эффективно использованы в больших масштабах, когда концентрация серебра достаточно высока [1]. Для очистки сточных вод, содержание серебра в которых невелико, целесообразно применять сорбционный метод. Существует огромное количество сорбционных материалов, но стремление современных промышленных предприятий минимизировать затраты на очистку сточных вод вынуждает их обращать внимание на использование недорогих сорбентов. В последние годы использование природных цеолитов [2–4] для борьбы с загрязнением сточных вод ионами тяжелых металлов возросло. Насыщенные серебром цеолитовые туфы можно использовать для поглощения галогенид-ионов, в том числе и иодид-ионов из загрязненных вод, что на сегодняшний день актуально, о чем имеются сведения в открытой печати [5, 6]. Кроме того, цеолиты, содержащие серебро, являются эффективными катализаторами в химическом синтезе.
Целью настоящей работы является определение сорбционных характеристик природных цеолитов по отношению к серебру в динамическом режиме, установление параметров десорбции и регенерации сорбентов.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали цеолитовый туф Середочного месторождения (СМ) Хабаровского края, состоящего из гейландита и клиноптилолита. Ранее нами [2] был описан детальный состав данного цеолитового туфа и изучена его устойчивость в агрессивных средах.
В качестве сорбционной колонны использовали лабораторную бюретку на 25 мл (ГОСТ 20292-74, 2 класс) с внутренним диаметром 10 мм, высота слоя сорбента, в зависимости материала, составляла 12–14 см, элюирование проводили методом нисходящего потока, объемную скорость потока поддерживали на уровне 1,0 мл/мин. Десорбцию осуществляли также в динамическом режиме 0,1 н и 0,2 н азотной кислотой.
Содержание ионов серебра и вытесняемых катионов в элюатах определяли с помощью эмиссионного спектрометра параллельного действия с индуктивно-связанной плазмой ICPE-9000 («Shimadzu», Япония). Градуировочные образцы были изготовлены из мультистандарта (MultiElement Standard IV, Германия). Для приготовления модельных растворов была взята навеска нитрата серебра AgNO3 марки ч.д.а. Контроль рН проводили с использованием иономера «SevenCompact» фирмы «Mettler-ToledoInstrument (Shanghai) Co. Ltd» с универсальным электродом с точностью не хуже, чем ± 0,03 ед. рН.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Описание динамики сорбции серебра на колоннах с неподвижным слоем сорбента проводили с помощью кривых проскока [7–9], которые характеризуют динамический отклик сорбционной колонны. Это необходимо для успешного проектирования и эксплуатации промышленной сорбционной колонны, когда требуется прогнозировать ее профиль «концентрация – время (объем)». В зависимости от скорости потока, высоты поглощающего слоя, состава раствора, рН, концентрации поглощаемого иона форма отклика будет изменяться. Установлено, что при сорбции натуральными цеолитами в динамическом режиме наиболее приемлемой является линейная скорость потока на уровне 1,2–1,5 см/мин при условии высоты поглощающего слоя 12–14 см. В отличие от статического режима сорбции емкость сорбента в динамическом режиме выше, так как в динамике сохраняется постоянный большой градиент концентрации на границе раздела фаз, в то время как в статике происходит постоянное уменьшение концентрации компонента в растворе вплоть до равновесной.
Модель Томаса – одна из наиболее общих и широко используемых моделей в теории производительности колонн [7–9]. Она основана на предположении, что процесс следует ленгмюровской кинетике адсорбции-десорбции без осевой дисперсии. Таким образом, движущая сила сорбции подчиняется кинетике обратимой реакции второго порядка. Основными преимуществами этой модели являются простота применения и адекватная последовательность в прогнозировании кривых проскока в различных условиях эксплуатации. Уравнение модели имеет следующий вид:
, (1)
![]()
![]()
где С0 – концентрация сорбата на входе в колонну, мг/мл;
Сt – концентрация сорбата на выходе из колонны, мг/мл;
KTh – константа скорости Томаса, мл∙/мг·мин;
q0 – равновесная емкость адсорбента (мг/г);
М – масса загрузки колонны, г;
Q – объемная скорость потока (мл/мин);
V – объем раствора, прошедшего через колонну, мл.
Уравнение (1) имеет вид линейной зависимости в координатах от V. Учитывая, что , логарифмическая форма уравнения Томаса может быть представлена в координатах , чему соответствует уравнение (2):
![]()
![]()
![]()
![]()
![]()
![]()
. (2)
![]()
![]()
Модель Адамса-Бохарта [7, 9, 10] в основном используется для расчетов на начальном участке выходной кривой и описывается уравнением:
, (3)
![]()
![]()
где KAB – кинетический коэффициент Адамса-Бохарта, мл/мг∙мин;
Z – высота слоя сорбента в колонке, см;
No – концентрация насыщения, мг/мл;
U – линейная скорость, рассчитанная путем деления объемной скорости потока на площадь сечения колонки, см /мин.
Логарифмический вид уравнения (3):
, (4)
![]()
![]()
Расчет параметров уравнения Адамса-Бохарта проводили путем построения зависимости от t методом линейной регрессии.
![]()
![]()
На графике (рис. 1) представлены зависимости в координатах уравнения (2). По уравнениям линий тренда рассчитаны величины констант скорости сорбции Томаса (KTh, мл/ мг·мин) и максимальной равновесной емкости сорбента (q0, мг/г). Высокие значения коэффициентов корреляции R2 на уровне 0,967–0,996 свидетельствуют о применимости модели Томаса для описания сорбции ионов серебра из модельных растворов с использованием цеолитового туфа СМ.
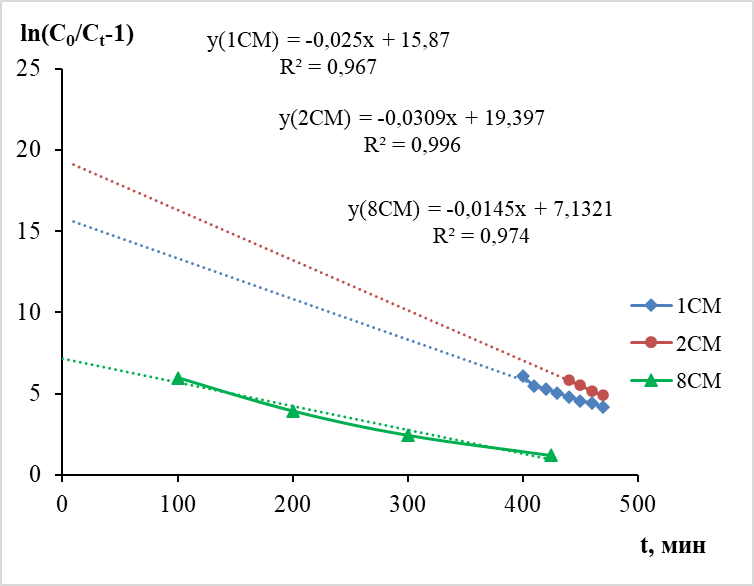
Рис. 1. Зависимость от времени согласно модели Томаса (уравнение 2), высота слоя сорбента 12 см, скорость потока 1мл/мин.
![]()
![]()
Установлено, что при сорбции из раствора нитрата серебра с концентрацией 10 мг/л KTh равняется 2,50 и 3,09 мл/мг·мин для колонок 1СМ и 2СМ соответственно. Максимальная равновесная сорбционная емкость при этом оказалась одинаковой и в первой, и во второй колонках и составила 0,63 мг/г. Емкость до проскока составляет 0,45 мг/г. При повышении концентрации исходного раствора в два раза (колонка 8СМ) KTh, = 0,725 мл/ мг мин, максимальная сорбционная емкость повышается до 0,98 мг/г, а емкость до проскока имеет величину 0,77 мг/г.
На графике (рис. 2) представлены зависимости в координатах уравнения Адамса-Бохарта (уравнение 4). При расчете кинетических коэффициентов КАВ (мл/мг∙мин) и концентрации насыщения N0 по уравнениям линий тренда получены следующие данные: при сорбции из раствора с содержанием серебра на уровне 10 мг/л КАВ имеет значения 2,48 и 3,07 мл/мг∙мин, при сорбции из раствора с содержанием серебра 20 мг/л КАВ равен 0,69 мл/мг·мин. Теоретическая сорбционная емкость в первом случае имеет величину 0,67 мг/г, а во втором –1,08 мг/г.
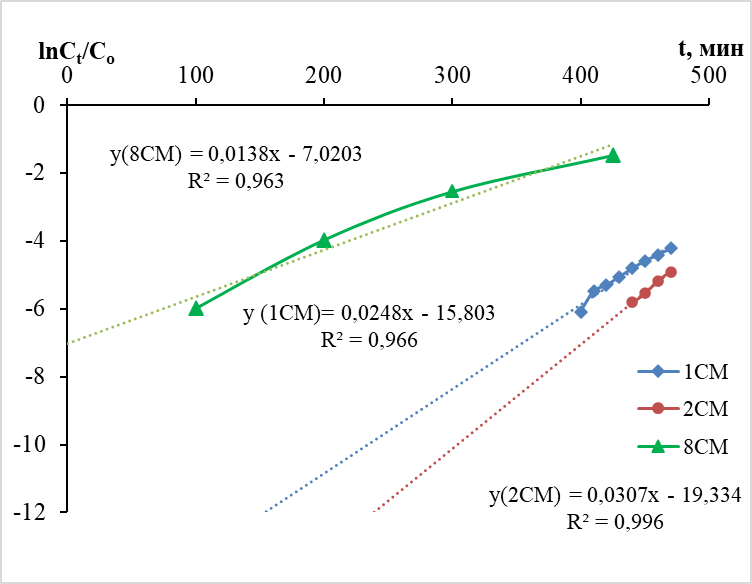
Рис. 2. Зависимость от времени согласно модели Адамса-Бохарта (уравнение 4), высота слоя сорбента 12 см; скорость потока 1 мл/мин.
![]()
![]()
Сопоставляя значения параметров, рассчитанных по модели Томаса и модели Адамса-Бохарта, можно сделать вывод, что обе модели адекватно описывают сорбцию ионов серебра из нитратных растворов диапазоне концентраций
10–20 мг/л.
Десорбцию проводили в двух вариантах – 0,1 н и 0,2 н азотной кислотой. Результаты представлены на графике (рис. 3).
Извлечение серебра из сорбента СМ происходит интенсивно. Через 7,5 колоночных объемов концентрация серебра достигает максимума равного 36,7 мг/л при десорбции 0,1 н кислотой колонки 1СМ и через 5 колоночных объемов при десорбции 0,2 н кислотой 2СМ, максимальная концентрация при этом составляет 52,2 мг/л. Во втором случае пик более узкий, следовательно, можно выделить концентрат меньшего объема. Критерием для выделения концентрата мы установили концентрацию серебра на выходе из колонки равную концентрации исходного раствора при сорбции. При десорбции 0,1 н кислотой объем концентрата составил 175 мл с содержанием серебра 22,52 мг/л, извлечение составило 80 %. При десорбции 0,2 н кислотой колонки 2СМ объем концентрата составил 125 мл с содержанием серебра 25,23 мг/л, извлечение составило 69,3 %. Десорбцию колонки, насыщенной ионами серебра при сорбции из раствора с содержанием основного компонента 20 мг/л, проводили 0,2 н азотной кислотой. Максимальная концентрация серебра в элюате достигла 243 мг/л. Выделенный концентрат в объеме 150 мл имел содержание серебра на уровне 105 мг/л. Коэффициент концентрирования – 5,25. Также получены низко концентрированные растворы. В первом случае 325 мл с содержанием серебра 5,28 мг/л, во втором – 375 мл с содержанием 2,37 мг/л. Низко концентрированные растворы могут быть объединены с исходным раствором и направлены на повторную сорбцию. Суммарное извлечение серебра из сорбента приближается к 100 %.
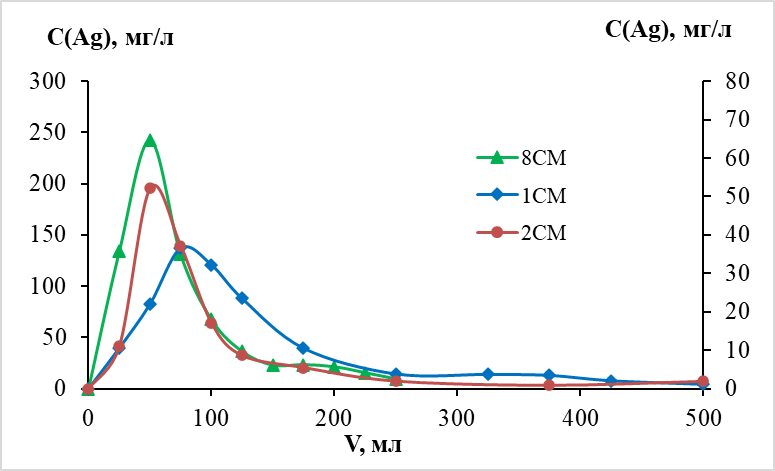
Рис. 3. Десорбция серебра из колонок с сорбентами Середочного (СМ): 1СМ десорбция 0,1 н азотной кислотой; 2СМ и 8СМ десорбция 0,2 н азотной кислотой. Содержание серебра в растворах при десорбции 8СМ отражаются по основной оси, при десорбции 1СМ и 2СМ – по вспомогательной.
ЗАКЛЮЧЕНИЕ
Цеолиты Середочного месторождения Хабаровского края рекомендуется использовать для извлечения серебра из загрязненных вод различного происхождения в динамическом режиме.
Установлено, что сорбция серебра в динамическом режиме удовлетворительно описывается моделями Томаса и Адамса-Бохарта. Различия в значениях кинетических коэффициентов не превышают величину погрешности методики экспериментального исследования.
Показано, что десорбцию необходимо проводить 0,1–0,2 н азотной кислотой. Десорбция проходит практически полностью. За один цикл сорбции–десорбции коэффициент концентрирования составляет от 2,25 до 5,25 ед. в зависимости от концентрации серебра в растворе, использованном для насыщения колонок.
- Wajima, T., Removal of Ag(I) from aqueous solution by japanese natural clinoptilolite, Advances in Chemical Engineering and Science, 6 (4), 470 (2016). DOI: 10.4236/aces.2016.64042.
- Belova T.P., Khizhko Z.I., Stabitity of natural zeolites in sorption of gold from model solutions at different pH values, Scientific Notes of V.I. Vernadsky Crimean Federal University. Biology. Chemistry, 9 (2), 251 (2023). (in Russ.). DOI: 10.29039/2413-1725-2023-9-2-251-258.
- Inglezakis V., Kudarova A., Guney A., Kunayat N., Tauanov Zh., Efficient mercury removal from water by using modified natural zeolites and comparison to commercial adsorbents, Sustainable Chemistry and Pharmacy, 32, 101017 (2023). DOI: 10.1016/j.scp.2023.101017.
- Abdollahi T., Towfight J., Rezaei-Vahidian H., Sorption of cesium and strontium ions by natural zeolite and management of produced secondary waste, Environmental Technology and Innovation, 17, 100592 (2020). DOI: 10.1016/j.eti.2019.100592.
- Afandiyeva N.T., Maharramov A.M., Chyragov F.M., Sorption of silver (I) ions from aqueous solutions using the synthetic sorbent, Proceedings of Universities. Applied Chemistry and Biotechnology, 12 (1), 30 (2022). (in Russ). DOI: 10.21285/2227-2925-2022-12-1-30-37.
- Chernookaya E.V., Sivkova V.A., Rotmanov K.V., Kinetics of sorption of silver ions on a synthetic NaX zeolite. Sorption and chromatography processes, 21 (5), 717 (2021). (in Russ). DOI: 10.17308/sorpchrom.2021.21/3778.
- Alifkhanova L.M. k., Petrova Yu.S., Bosenko S.N., Neudachina L.K., Pestov A.V., Choice of optimal conditions for the dynamic concentration of silver(I) ions from complex solutions with sulfoethylated polyaminostyrenes, Russian Journal of Inorganic Chemistry, 66 (4), 540 (2021). (in Russ). DOI: 10.31857/S0044457X21040036.
- El-Naggar M.R., Ibrahim H.A. and El-Kamash A.M., Sorptive removal of cesium and cobalt ions in a fixed bed column using Lewatit S100 cation exchange resin, Arab Journal of Nuclear Science and Applications, 47 (2), 77 (2014).
- Belova T.P., Adsorption of iron nickel, copper and cobalt ions from solutions of bacterial-chemical leaching of cobalt-copper-nickel ore, Mining Inf. Anal. Bull (Scientific and Technical Journal), S46, 87 (2020). (in Russ). DOI: 10.25018/0236-1493-2020-12-46-87-98.
- Han R., Ding D., Xu Y., Zou W., Wang Yu., Li Y., Zou L., Use of rice husk for the adsorption of congo red from aqueous solution in column mode, Bioresource Technology, 99, 2938 (2008)

