MACROZOBENTHOS IN THE EPIPHYTON OF ALGAE CYSTOSEIRA CRINITA DUBY, 1830 NEAR THE COAST OF CRIMEA AND THE CAUCASUS (BLACK SEA)
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 6 (72), №3, 2020
Publication text (PDF):Download
UDK: 591.524.1:582.272(262.5)
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Makarov M. V., A. O. Kovalevsky Institute of Biology of the Southern Seas of RAS, Sevastopol, Russia
Kopiy V. G., A. O. Kovalevsky Institute of Biology of the Southern Seas of RAS, Sevastopol, Russia
Bondarenko L. V., A. O. Kovalevsky Institute of Biology of the Southern Seas of RAS, Sevastopol, Russia
Viter T. V., A. O. Kovalevsky Institute of Biology of the Southern Seas of RAS, Sevastopol, Russia
Podzorova D. V., A. O. Kovalevsky Institute of Biology of the Southern Seas of RAS, Sevastopol, Russia
TYPE:Article
DOI:https://doi.org/10.37279/2413-1725-2020-6-3-97-116
PAGES:from 97 to 116
STATUS:Published
LANGUAGE:Russian
KEYWORDS: epiphyton Cystoseira crinita, macrozoobenthos, communities, coasts of Crimea and Caucasus, biodiversity, trophic structure.
ABSTRACT (ENGLISH):
The article provides summarized data of species composition, abundance, biomass, occurrence and trophic structure of invertebrate macrozoobenthos associated with red-book algae Сystoseira crinitа Duby, 1830 in the coastal waters of the Crimea (Cape Tarkhankut, Kruglaia Bay, Simeiz, “Cape Martyan” Reserve, Dvuyakornaya Bay) and the Caucasus (in the area of “Utrish Nature Reserve”) in August-September 2012–2017 at the depth of 1, 3 and 5 m. A total of 46 samples were taken (42 quantitative and 4 qualitative). In the area of Utrish, such studies were carried out for the first time. In the algae communities of the Black Sea coast of Crimea and the Caucasus 56 species belonging to the types Annelida, Platyhelminthes, Mollusca and Arthropoda were identified. Ten species are common to all areas. The abundance and biomass near the Caucasus coast were 1432 ind. kg-1 and 9,52 g∙kg-1, near the coast of Crimea these values varied from 2506 to 6085 ind. kg-1 and from 23,9 to 43 g∙kg-1 respectively. Mollusks and crustaceans dominated in values of abundance, mollusks dominated in values of biomass. The highest quantitative indicators were recorded in the waters of Simeiz, the lowest – in the area of the “Utrish” Nature Reserve. Molluscs, in particular, Mytilaster lineatus Gmelin, 1791, make a significant contribution to the formation of macrozoobenthos abundance in the Simeiz area, while in the water area of Utrish the peaks of abundance have been defined due to crustaceans Ericthonius difformis M.-Edwards, 1830 and Ampithoe ramondi Audouin, 1826. Gastropods Rissoa splendida Eichwald, 1830, Bittium reticulatum (da Costa, 1778) and bivalve M. lineatus make the greatest contribution to the biomass of macrozoobenthos both in the waters of Simeiz and in the Utrish Reserve area. The high abundance and biomass of these molluscs allow them to form a macrozoobenthos nucleus in the studied water areas. Comparison of species composition of macrozoobenthos by the Chekanovsky-Sörensen community index showed high fauna similarity in all areas (the coefficient ranged from 0,4 to 0,76), as they are bound by the same biotope. The fauna of the Kruglaya Bay and Cape Tarkhankut are the most similar to each other. The areas in Dvuyakornaya Bay and Cape Martyan are the least similar to each other. The results of the cluster analysis confirm that the most similar areas in terms of presence/absence of species are Kruglaya Bay and Cape Tarkhankut, and also Dvuyakornaya Bay and Utrish area. The functional abundance index determined the communities of gastropod molluscs R. splendida (in the Tarkhankut, Simeiz and Utrish areas), B. reticulatum (in Kruglaya Bay) and bivalve M. lineatus (in Cape Martian and Dvuyakornaya Bay). It has been shown that the R. splendidа communities are more attracted to open coasts. In the R. splendida community from 16 to 25 species have been recorded in different areas, in the M. lineatus community in the water areas of the Cape Martian and Dvuyakornaya Bay (only quantitative samples were taken into calculation) 16 and 17 species were identified, in the B. reticulatum community – 25. In the majority of communities the guiding species were predominated. Their proportion was between from 32 to 56 % of the total number of species. Characteristic species dominate only near Utrish. Their share is 36 %. The number of rare species in communities varies from 3 to 9. The dominance-diversity curves indicate a more stable state of the epiphyton community in the water areas adjacent to the Utrish Reserve and Kruglaya Bay. Shannon index values also indicate high biodiversity in the studied water areas. The maximum Shannon Index value in terms of abundance was recorded in the B. reticulatum community (2,66) in Kruglaia Bay and a high value in terms of biomass (2,34) was marked in the R. splendida community in the Simeiz area. Five trophic groups have been identified. Phyto- and polyphages dominate by the number of species. Phyto- and sestonophages dominate in values of abundance, phytophages – in values of biomass.
ВВЕДЕНИЕ
Заросли водорослей являются одним из основных прибрежных биоценозов морских и пресноводных водоемов. В Чёрном море массовыми средообразующими видами таких сообществ являются бурые водоросли Cystoseira crinitа Duby, 1830 и С. barbata (Stackhouse) C. Agardh, 1820, занесённые в Красную книгу Чёрного моря [1, 2]. Макрофиты – особенный компонент биоценозов, выполняющий функцию субстрата и биотического компонента одновременно. На их талломах поселяются эпифитные водоросли, сессильные и эррантные животные – панцирные, двустворчатые и брюхоногие моллюски, мшанки, губки, полихеты, ракообразные [3, 4]. Исследования эпифитона цистозиры в Чёрном море начались в начале XX века. С. А. Зернов выделил в самостоятельные биоценозы макрозообентос в зарослях зостеры и филлофоры, а население цистозиры включил в биоценоз скал, поскольку места произрастания этих водорослей ограничиваются твёрдым субстратом [5]. Первый количественный анализ животного населения цистозиры провёл В. А. Водяницкий [6]. В дальнейшем разные исследователи изучали фаунистистический состав, биологию и экологию компонентов зарослевых сообществ [7–17]. В последнее время нами накоплен материал по эпифитону цистозиры у берегов Крыма и Кавказа, причём у побережья Утриша исследования проведены впервые.
Цель работы – обобщение и сравнительный анализ данных по видовому составу, численности и биомассе и макрозообентоса, обитающего в зарослях С. crinitа крымского и кавказского побережий Чёрного моря в настоящее время (по материалам бентосных съемок 2012–2017 гг.). Полученные данные могут быть использованы в дальнейшем для изучения макрозообентоса зарослей макрофитов донных сообществ мелководья, в функционировании которых немалую роль играет гидродинамическое и антропогенное воздействие.
МАТЕРИАЛЫ И МЕТОДЫ
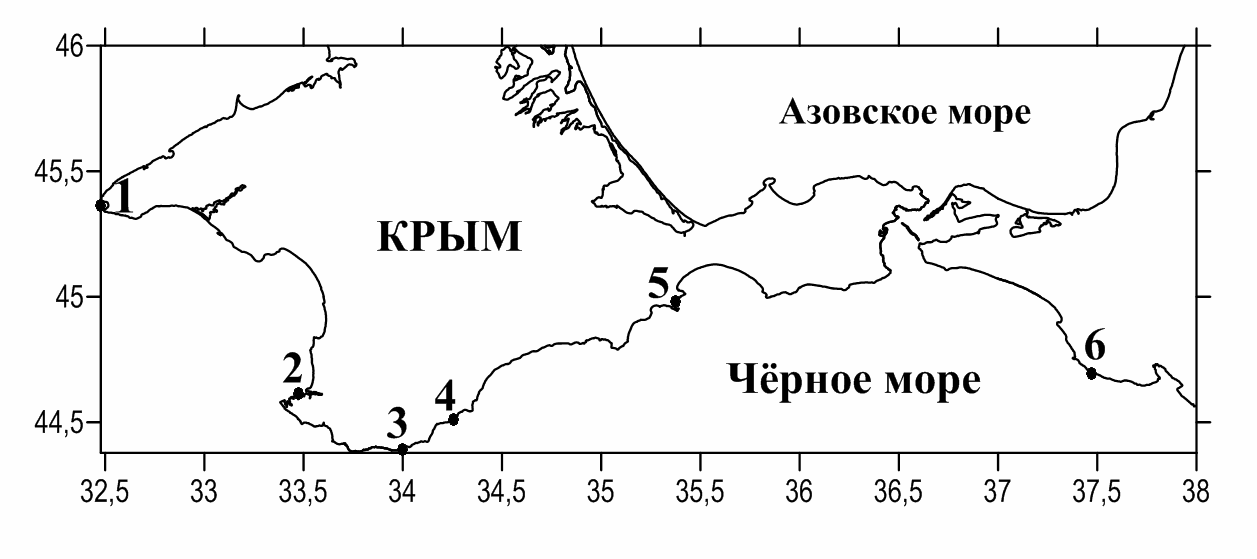
Пробы собраны в 5 различных районах Крыма и в районе Кавказа (рис. 1).
Рис. 1. Схема районов отбора проб (1 – мыс Тарханкут, 2 – бухта Круглая,
3 – побережье Симеиза, 4 – мыс Мартьян, 5 – Двуякорная бухта, 6 – Утриш).
В акватории бухты Двуякорная в сентябре 2012 г. взяты 4 качественные пробы. В августе–сентябре 2013–2017 гг. отобраны 42 количественные пробы на глубинах 1, 3 и 5 м в двух повторностях: у побережья Крыма в каждом районе взято по 6 проб, у берегов Кавказа (Утриш) – 12. Всего 46 проб. Материал собирали с помощью мешка из мельничного газа, которым накрывали таллом цистозиры и срезали его ножом у подошвы, затем делали смыв с водорослей через сито диаметром ячей 0,5 мм и отбирали макрозообентос. Цистозиру выкладывали на фильтровальную бумагу, обсушивали и взвешивали на электронных весах типа «Sartorius» с точностью до 0,1 г, животных фиксировали 4 % раствором нейтрализованного формалина. Пробы разбирали по таксономическим группам и идентифицировали до вида, подсчитывали количество особей, взвешивали на торсионных весах с точностью до 0,001 г, затем рассчитывали численность (экз.), биомассу (г) каждого вида на единицу веса водорослей (кг) и встречаемость (%). По литературным данным определяли трофическую структуру сообщества [18–21]. Номенклатуру видов приводили в соответствие с мировым реестром World Register of Marine Species [22]. Сообщества выделяли по индексу функционального обилия [23]:
где N – численность, экз.∙кг-1, B – биомасса макрозообентоса, г∙кг-1.
Доминирование вида по ИФО свидетельствует об образовании одноимённого сообщества. ИФО – интегрированный показатель, включающий в себя не только биомассу, но и численность.
Для сравнения видового состава эпифитона водорослей C. crinita исследуемых районов использовали матрицу сходства видов в сообществах по коэффициенту Чекановского – Сёренсена:
где a – число общих видов, b и c – число видов в сравниваемых списках [24].
Также применяли кластерный анализ по наличию/отсутствию видов в программе PRIMER-6. Состояние сообществ оценивали с помощью кривых доминирования-разнообразия, где ось абсцисс – ранжированный ряд видов от наиболее многочисленного к наименее многочисленному, а ось ординат – численность видов [25]. Оценку видового разнообразия проводили с помощью индекса Шеннона [26]. Расчёт выполняли в приложении Diverse пакета PRIMER-5 (использован логарифм по основанию 2).
Характеристика районов исследования.
Акватория мыса Тарханкут локализуется на северо-западе Крыма и входит в состав природного парка регионального значения «Тарханкутский». Она находится вдали от промышленных районов, поэтому испытывает сравнительно небольшую антропогенную нагрузку и может характеризоваться как относительно чистая [27]. Побережье Тарханкута открытое, в основном обрывистое, сложенное твёрдыми грунтами, благоприятствующими развитию зарослей цистозиры.
Бухта Круглая – одна из многочисленных бухт, расположенных в юго-западном Крыму в пределах Севастополя. Она подвержена антропогенной и рекреационной нагрузке. У входных мысов бухты располагаются подводные каменистые гряды, к которым приурочены заросли цистозиры.
Акватория, прилегающая к посёлку Симеиз, расположенном на Южном берегу Крыма, характеризуется открытым каменистым побережьем. Дно возле берега крупногалечное с валунами, на которых произрастает цистозира.
Акватория природного заповедника «Мыс Мартьян» также расположена в пределах Южного берега Крыма в 30 км восточнее Симеиза. Характеризуется каменистым (галечно-валунным) открытым побережьем и минимальной антропогенной нагрузкой. Донная растительность представлена густыми зарослями цистозиры с большим количеством эпифитов, наиболее обильными на глубине
3–5 м [28].
Бухта Двуякорная находится в юго-восточном Крыму, западнее г. Феодосия, между мысом Ильи и полуостровом Киик-Атлама. Её берега преимущественно возвышенные и обрывистые. Дно бухты сложено глинистыми породами со скалистыми включениями, на которых растут водоросли.
Государственный природный заповедник «Утриш» локализуется в предгорьях Кавказа, у черноморского побережья Краснодарского края на Абраусском полуострове между Анапой и Новороссийском. Береговая зона заповедника представляет собой чередование выпуклых и вогнутых участков – обрывистых клифов с узкими абразионными пляжами шириной 5–10 м и широкими аккумулятивными пляжами шириной до 200 м [29]. Основу донной растительности северокавказского региона составляет формация Cystoseireta – группа ассоциаций, эдификаторами которой являются два вида бурой водоросли цистозиры C. barbata и C. crinita [30]. В диапазоне глубин 2–12 м встреченные сообщества принадлежат к ассоциации с доминированием C. crinita и C. barbata. Основным доминантом первого яруса почти по всей глубине была C. crinita. Этот макрофит имеет наибольшую биомассу в сообществах на глубине до 12 м. Встречается на глубинах от 0.5 до 14 м [31].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В исследуемых районах обнаружено 43 вида макрозообентоса, из них 9 видов относятся к типу Annelida, представители типа Platyhelminthes фигурируют в подсчётах как один вид, 11 видов Mollusca (2 вида Bivalvia, в том числе представители семейства Cardiidae и 9 видов Gastropoda), 22 вида Arthropoda. С учётом качественных проб вдоль побережья Крыма обнаружено 47 видов, у берегов Кавказа – 28 видов, что, вероятно, связано с разным количеством отобранных проб. Количество видов в исследуемых районах колеблется от 16 до 39. Всего в зарослевых сообществах черноморского побережья Крыма и Кавказа обнаружено 56 видов (табл. 1).
Таблица 1
Видовой состав, средняя численность (N, экз. кг-1) и средняя биомасса (В, г∙кг-1) макрозообентоса в эпифитоне водорослей C. crinitа у берегов Крыма и Кавказа
|
Таксоны |
Тарханкут |
Круглая |
Симеиз |
Мартьян |
Двуякор-ная |
Утриш |
|
N B |
N B |
N B |
N B |
N B |
N B |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
ANNELIDA |
||||||
|
Alitta succinea (Leuckart, 1847) |
0 0 |
0-226 0-0,677 |
0 0 |
0 0 |
0 0 |
0 0 |
|
Hediste diversicolor (O.F. Müller, 1776) |
0 0 |
0-113 0-0,113 |
0 0 |
0 0 |
0 0 |
0 0 |
|
Namanereis pontica (Bobretzky, 1872) |
0 0 |
0 0 |
0 0 |
0 0 |
0 0 |
0-14 0-0,004 |
|
Nereis zonata Malmgren, 1867 |
0 0 |
0 0 |
0 0 |
0 0 |
0 0 |
0-604 0-0,162 |
|
Nereis sp. |
0-20 0-0,001 |
0 0 |
0 0 |
0-28 0-0,02 |
0 0 |
0 0 |
|
Perinereis cultrifera (Grube, 1840) |
0 0 |
0 0 |
0 0 |
0 0 |
0 0 |
0-224 0-0,062 |
|
Platynereis dumerilii (Audouin&Milne Edwards, 1833) |
0 0 |
0 0 |
0 0 |
0 0 |
0 0 |
0-508 0-0,044 |
|
Polyophtalmus pictus (Dujardin, 1839) |
0 0 |
0-24 0,024 |
0-34 0-0,121 |
0 0 |
0 0 |
0 0 |
|
PLATYHELMINTHES |
0 0 |
0 0 |
0 0 |
0 0 |
0 0 |
0-6 0-0,001 |
|
MOLLUSCA |
||||||
|
Mytilaster lineatus Gmelin, 1791 |
21-233 0,04-3,42 |
90-1173 0,09-1,17 |
2058-5202 2,57-11,72 |
248-4672 0,56-38,33 |
0-8000 0-4,85 |
0-800 0-15,55 |
|
Cardiidae gen. sp. |
0 0 |
0 0 |
0 0 |
0 0 |
0-38 0-0,04 |
0 0 |
|
Bittium reticulatum (da Costa, 1778) |
362-865 3,46-6,62 |
331-2752 4,56-43,17 |
40-2675 0,28-35,39 |
0-640 0-0,372 |
38-2175 0,28-1,83 |
0-71 0-0,92 |
|
Hydrobia acuta (Draparnaud, 1805) |
0-5 0-0,03 |
0 0 |
0 0 |
0 0 |
0 0 |
0 0 |
|
Rissoa membranacea (J. Adams, 1800) |
0 0 |
0 0 |
0 0 |
0 0 |
+ |
0 0 |
|
R. parva (da Costa, 1778) |
0-20 0-0,02 |
0-24 0-0,02 |
0 0 |
0 0 |
0-67 0-0,01 |
0-8 0-0,01 |
|
R. splendida Eichwald, 1830 |
723-3333 11,29-25,99 |
83-826 3,66-9,86 |
161-1878 3,04-44,59 |
0-971 0-26,63 |
0-767 0-28,67 |
0-1635 0-69,51 |
|
R. venusta Philippi, 1844 |
0 0 |
0 0 |
0-29 0-0,03 |
0 0 |
0 0 |
0 0 |
|
Rissoa sp. |
0 0 |
0 0 |
0 0 |
0 0 |
0-38 0-0,04 |
0 0 |
|
Stremophala adriatica Philippi, 1844 |
0 0 |
0-23 0-1,74 |
0 0 |
0-37 0-0,04 |
+ |
0-23 0-0,92 |
|
S. divaricata Linnaeus, 1758 |
0 0 |
0 0 |
0 0 |
0 0 |
+ |
0 0 |
|
Tricolia pullus Linnaeus, 1758 |
0-178 0-3,66 |
41-275 0.04-7,61 |
145-517 2,76-22,38 |
0-147 0-6,17 |
75-400 0,08-4,53 |
0-59 0-0,03 |
|
Tritia neritea Linnaeus, 1758 |
0 0 |
0 0 |
0 0 |
0 0 |
+ |
0 0 |
|
T. pellucidа (Risso, 1826) |
0-21 0-1,22 |
0 0 |
0 0 |
0 0 |
0 0 |
0 0 |
|
ARTHROPODA |
||||||
|
Apherusa bispinosa (Bate, 1857) |
0-5 0-0,001 |
0-92 0-0,015 |
0-276 0-0,041 |
0-110 0-0,008 |
0-133 0-0,125 |
0-36 0-0,007 |
|
Amphibalanus improvisus Darwin, 1854 |
0 0 |
0 0 |
0-13 0-0,118 |
0 0 |
0 0 |
0 0 |
|
Amphitholina cuniculus (Stebbing, 1874) |
0 0 |
0 0 |
0 0 |
0 0 |
0 0 |
0-8 0-0,001 |
|
Ampithoe gammaroides (Spence Bate, 1856) |
0 0 |
0 0 |
0 0 |
0 0 |
+ |
0 0 |
|
A. ramondi Audouin, 1826 |
0-35 0-0,083 |
47-780 0,07-0,193 |
0-339 0-0,064 |
0-735 0-0,133 |
0-231 0-0,038 |
0-1017 0-0,172 |
|
Apohyale perieri (Lucas, 1849) |
0 0 |
0 0 |
0 0 |
0 0 |
+ |
0-191 0-0,051 |
|
Biancolina algicola Della Valle, 1893 |
0-5 0-0,25 |
0-138 0-0,004 |
0-138 0-0,018 |
0-20 0-0,002 |
0 0 |
0 0 |
|
Caprella acantifera (Czernjavski,1868) |
0-40 0-0,06 |
50-534 0,07-0,072 |
0-554 0-0,75 |
0-42 0-0,06 |
0-67 0-0,033 |
0-540 0-0,057 |
|
C. danilevskyi Czernjavski, 1868 |
0 0 |
0 0 |
0 0 |
0-35 0-0,018 |
0 0 |
0-69 0-0,016 |
|
Clibanarius erythropus Latreille, 1818 |
0 0 |
0 0 |
0 0 |
0-14 0-0,168 |
0 0 |
0 0 |
|
Chondrochelia savignyi (Kroyer, 1842) |
65-160 0-0,083 |
15-47 0,001-0,012 |
0-21 0-0,002 |
0 0 |
0-192 0-0,093 |
0-8 0-0,001 |
|
Cymadusa crassicornis (Costa, 1853) |
0 0 |
0 0 |
0 0 |
0 0 |
0 0 |
0-34 0-0,028 |
|
Decapoda gen. sp. |
0 0 |
0 0 |
0 0 |
0-20 0-0,012 |
0 0 |
0 0 |
|
Dexamine spinosa (Montagu, 1813) |
0-17 0-0,001 |
0-45 0-0,007 |
0 0 |
0 0 |
0-1337 0-0,033 |
0 0 |
|
D. thea Boeck, 1861 |
0 0 |
0 0 |
0 0 |
0 0 |
+ |
0 0 |
|
Dynamene bidentata (Adams, 1800) |
0 0 |
0-47 0-0,045 |
0-54 0-0,032 |
0 0 |
0 0 |
0-31 0-0,06 |
|
Ericthonius difformis M.-Edwards, 1830 |
0-65 0-0,032 |
0-105 0-0,02 |
0-357 0-0,034 |
45-3993 0,005-0,331 |
0 0 |
24-1843 0,001-0,086 |
|
Hippolyte leptocerus (Heller, 1863) |
0 0 |
0 0 |
0 0 |
0 0 |
0-13 0-1,54 |
0 0 |
|
Hyale sp. |
0 0 |
0 0 |
0 0 |
0-29 0-0,017 |
0 0 |
0 0 |
|
Idotea ostroumovi Sowinsky, 1895 |
0 0 |
0 0 |
0 0 |
0 0 |
+ |
0 0 |
|
Liocarcinus holsatus (Fabricius, 1798) |
0 0 |
0 0 |
0 0 |
0 0 |
+ |
0 0 |
|
Macropodia longirostris (Fabricius, 1775) |
0 0 |
0 0 |
0 0 |
0 0 |
+ |
0 0 |
|
Melita palmata (Montagu, 1804) |
0 0 |
0 0 |
0 0 |
0 0 |
+ |
0 0 |
|
Mesopodopsis slabberi (Van Beneden, 1861) |
0 0 |
0 0 |
0 0 |
0 0 |
0 0 |
0-23 0-0,054 |
|
Microdeutopus gryllotalpa A. Costa, 1953 |
0 0 |
0 0 |
0-156 0-0,018 |
0 0 |
0 0 |
0-477 0-0,048 |
|
Nototropis guttatus Costa, 1853 |
0 0 |
0 0 |
0 0 |
0 0 |
0 0 |
0-6 0-0,001 |
|
Orchestia mediterranea Costa, 1853 |
0 0 |
0 0 |
0 0 |
0 0 |
+ |
0 0 |
|
Pleonexes helleri (Karaman, 1975) |
0 0 |
0 0 |
0 0 |
0 0 |
0-200 0-0,02 |
0-309 0-0,056 |
|
Phtisica marina Slabber, 1769 |
0 0 |
0 0 |
0 0 |
0 0 |
+ |
0 0 |
|
Jassa ocia (Bate, 1862) |
0 0 |
0 0 |
0 0 |
0-111 0-0,006 |
0 0 |
0-56 0-0,004 |
|
Stenothoe monoculoides (Montagu,1815) |
0-40 0-0,012 |
0-120 0-0,02 |
0-138 0-0,007 |
0-40 0-0,004 |
0-100 0-0,005 |
0-32 0-0,003 |
|
Stenosoma capito (Rathke, 1837) |
0 0 |
0 0 |
0-34 0-1,1 |
0 0 |
0-38 0-0,011 |
0 0 |
|
Tritaeta gibbosa (Spence Bate, 1862) |
0 0 |
0 0 |
0 0 |
0 0 |
+ |
0 0 |
|
Всего |
2504 28,7 |
2869 27,3 |
6110 43 |
4196 23,9 |
4855 34,7 |
1431 9,5 |
Выделено 10 общих, типичных для зарослевых сообществ, видов. Коэффициент общности видов Чекановского – Сёренсена для районов исследования варьирует от 0,4 до 0,76 (табл. 2).
Таблица 2
Коэффициент общности видов макрозообентоса в эпифитоне C. crinita у побережий Крыма и Кавказа
|
Бухта Круглая |
Симеиз |
Мыс Мартьян |
Бухта Двуякорная |
Мыс Тарханкут |
Утриш |
|
|
Бухта Круглая |
– |
0,74 |
0,59 |
0,49 |
0,76 |
0,61 |
|
Симеиз |
0,74 |
– |
0,63 |
0,53 |
0,67 |
0,53 |
|
Мыс Мартьян |
0,59 |
0,63 |
– |
0,4 |
0,63 |
0,5 |
|
Бухта Двуякорная |
0,49 |
0,53 |
0,4 |
– |
0,51 |
0,57 |
|
Мыс Тарханкут |
0,76 |
0,67 |
0,63 |
0,51 |
– |
0,55 |
|
Утриш |
0,61 |
0,53 |
0,5 |
0,57 |
0,55 |
– |
Сходство фаун большинства районов относительно высокое (более 0,5). Наиболее сходны между собой по составу фауны акватории бухты Круглой и мыса Тарханкут. Эти районы, согласно естественноисторическому районированию Чёрного моря, относятся к одному Евпаторийско-Севастопольскому району [32]. Наименее сходны между собой районы бухты Двуякорная и мыса Мартьян.
Результаты кластерного анализа подтверждают, что наиболее сходными районами по наличию/отсутствию видов являются бухта Круглая и мыс Тарханкут, а также бухта Двуякорная и район Утриша (рис. 2).
Рис. 2. Дендрограмма видового сходства исследованных районов.
Показатель численности эпифитона цистозиры по полигонам варьирует от 1432 (Утриш) до 6085 экз.∙кг-1 (акватория Симеиза). Существенный вклад в формирование данного показателя в районе Симеиза вносят моллюски, в частности, M. lineatus (3580 экз.∙кг-1), в то время как в акватории Утриша пики численности выявлены за счет бокоплавов E. difformis (309 экз. кг-1) и A. ramondi (270 экз.∙кг-1). Следует отметить, что по плотности поселения эриктониус занимает одно из первых мест среди бокоплавов в эпифитоне цистозиры. В некоторые сезоны количество рачков достигало более 13 тыс. экз.∙кг-1 массы водорослей [33]. A. bispinosa, A. ramondi, C. acantifera и Ch. savignyi обнаружены во всех исследуемых районах, B. algicola встречена более чем на 60 % станций. Высокая плотность поселения этих бокоплавов на цистозире связана с тем, что по характеру питания они относятся к растительно-детритоядным формам, в составе пищи – макро- и микрофиты, детрит. Кроме того, они используют ткани цистозиры для построения трубок.
Моллюски M. lineatus, B. reticulatum, R. splendida и T. pullus обнаружены нами во всех акваториях. Высокая плотность митилястера отмечена в районе Симеиза и в б. Двуякорная. Как было показано ранее, этот вид доминирует по численности в зарослях цистозиры в юго-восточном Крыму: акваториях Карадага и мыса Киик-Атлама [6, 7]. Двустворчатый моллюск M. lineatus преобладает и на твёрдых субстратах [34].
В районах Тарханкута и б. Круглой доминируют брюхоногие моллюски R. splendida и B. reticulatum соответственно. Это эврибионтные и массовые виды в Чёрном море [21]. У берегов Крыма R. splendida была многочисленной в
1950–1970-х годах, однако затем её обилие резко сократилось и лишь в последние годы снова стало восстанавливаться [10, 14].
Полихеты в зарослях водорослей встречены эпизодично и не достигали высоких значений численности. Большинство отмеченных видов принадлежит семейству Nereididae Blainville, 1818. Наибольшее количество видов и численность зарегистрированы в акватории Утриша: 4 вида при средней численности
174 экз.∙кг-1. Наибольшая численность отмечена у P. dumerilii и N. zonata
(67 и 80 экз.∙кг-1 соответственно). Эти виды характерны для зарослевых сообществ Средиземноморского бассейна [35]. Как показано ранее, низкие показатели видового богатства и численности полихет типичны для зарослевых сообществ [35, 36]. Кроме того, невысокие показатели видового состава и численности полихет в исследуемых акваториях, могут быть связаны с тем, что сбор материала осуществляли в первой половине дня, тогда как численность полихет в биотопе водорослей возрастает в вечернее время суток [35, 37].
Минимальный показатель биомассы в исследуемых районах зафиксирован также в районе Утриша (9,52 г∙кг-1), а максимальный – у побережья Симеиза
(43 г∙кг-1). Наибольший вклад в биомассу макрозообентоса в акватории Утриша вносит брюхоногий моллюск R. splendida (7,37 г∙кг-1, что составляет более 75 % общей биомассы), в районе Симеиза – моллюски R. splendida (15,9 г∙кг-1), B. reticulatum (9.9 г∙кг-1) и T. pullus (9,7 г∙кг-1). Высокие показатели численности и биомассы этих моллюсков позволяют им формировать ядро макрозообентоса. Эти виды-доминанты заметно преобладают по численности и биомассе во всех районах, кроме побережья Утриша, где они немного уступают по численности ракообразным E. difformis и A. ramondi, однако значительно опережают их по биомассе.
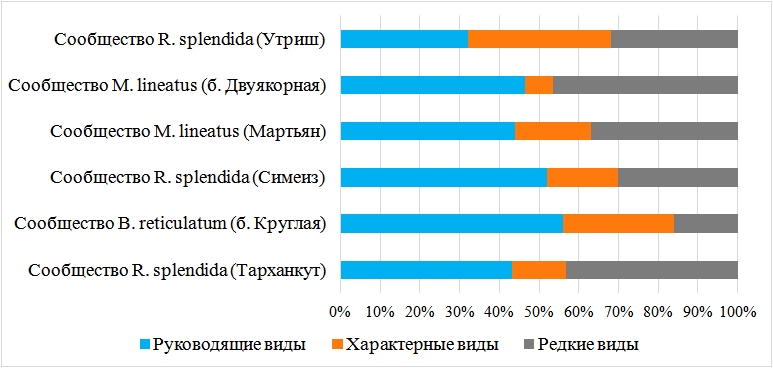
Использование индекса функционального обилия позволило выделить три сообщества в зарослях цистозиры: R. splendida (в районах Тарханкута, Симеиза и Утриша), M. lineatus (в акваториях м. Мартьян и бухты Двуякорной), в бухте Круглой отмечено сообщество B. reticulatum. По частоте встречаемости выделяется 3 группы: руководящие – виды, встречающиеся более, чем на 50 % станций данного сообщества; характерные – на 25–50 % станций и редкие – менее, чем на 25 % станций [38] (рис. 3).
В большинстве сообществ преобладают руководящие виды. Их доля составила от 32 до 56 % от всего количества видов. Только в сообществе R. splendida на Утрише доминируют характерные виды, их доля составила 36 %. Количество редких видов в сообществах варьирует от 3 до 9.
В сообществах R. splendida разных районов зарегистрировано от 16 до 25 видов, среди которых преобладают ракообразные (более 50 %). Видовой состав районов достаточно сходен, индекс Чекановского – Сёренсена варьировал от 0,53 до 0,67, отмечено 10 общих видов. К руководящим отнесены от 7 до 9 видов, к характерным – от 2 до 10, к редким – от 5 до 9. Численность макрозообентоса в данных сообществах составила от 1432 до 6085 экз∙кг-1, биомасса – от 9,5 до 43 г∙кг-1. Наибольшие показатели численности и биомассы отмечены в акватории Симеиза. Основной вклад в формирование этих показателей вносят моллюски (более 90 % общей численности и биомассы). Сообщества R. splendida в эпифитоне цистозиры больше тяготеют к открытым побережьям.
Рис. 3. Структура сравнительной встречаемости видов макробентоса в сообществах эпифитона цистозиры.
Для сообществ M. lineatus в акваториях м. Мартьян и б. Двуякорной (учитывались только количественные пробы) отмечены 16 и 17 видов, среди которых также преобладают ракообразные (более 56 %). Отмечено низкое сходство видового состава районов. Коэффициент общности Чекановского-Сёренсена составил 0,4. Выявлено по 7 руководящих видов, 1 и 3 характерных, 6 и 7 редких. Отмечены относительно близкие показатели численности и биомассы – 4196 и 4854 экз. ∙кг-1; 23,85 и 34,75 г∙кг-1 соответственно.
В сообществе B. reticulatum обнаружено 18 видов макрозообентоса. На долю ракообразных приходится 50 %, моллюсков – 33 %, полихет – 17 %. Следует отметить, что полихеты A. succinea и H. diversicolor обнаружены нами только в данном сообществе. Отмечены 10 руководящих видов, 5 характерных, 3 редких. Средняя численность макрозообентоса составила 2869 экз.∙кг-1, биомасса – 27,3 г∙кг-1. Основной вклад в формирование этих показателей внесли моллюски (более 75 % общей численности и более 98 % общей биомассы макрозообентоса сообщества).
Поскольку индекс сходства видов для большинства районов составил более 0,5, можно предположить, что это связано с одинаковым биотопом.
Видовое разнообразие сообществ оценивали по индексу Шеннона, рассчитанному по численности и биомассе. Максимальный показатель индекса Шеннона по численности (2,66) отмечен у сообщества B. reticulatum в бухте Круглая, по биомассе (2,34) у сообщества R. splendida в районе Симеиза. В остальных районах данный показатель близок к 2. Чем больше видовое разнообразие сообщества, тем в более благоприятных условиях оно находится. В ненарушенных экосистемах биоразнообразие обычно находится в пределах 2–5 бит/особь.
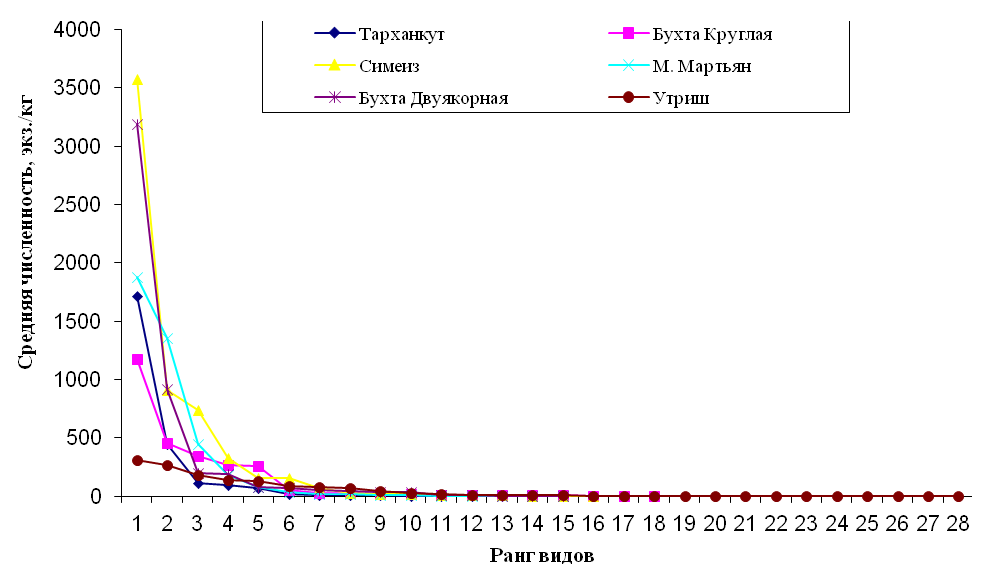
Кривую доминирования-разнообразия применяли для оценки состояния сообществ: чем круче падает кривая, тем меньше общее разнообразие и сильнее доминирование одного или нескольких видов в сообществе (рис. 4).
Рис. 4. Доминирование-разнообразие макрозообентоса в зарослях цистозиры у берегов Крыма и Кавказа на глубинах 1–5 м.
Полученные кривые позволяют сделать вывод о благоприятных условиях существования эпифитонного сообщества в акватории, прилежащей к заповеднику «Утриш». У берегов Крыма таким районом можно назвать акваторию бухты Круглая.
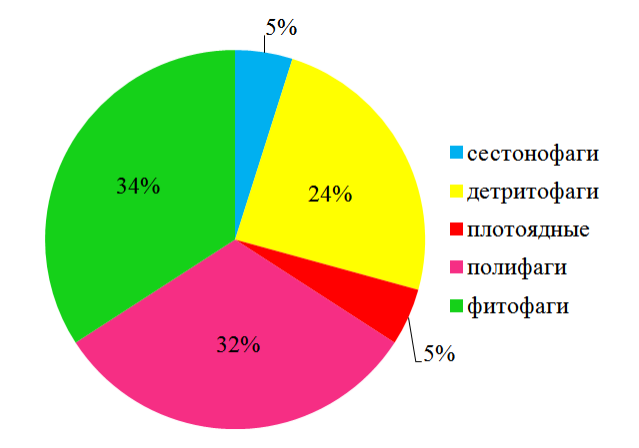
В трофической структуре сообществ выделено 5 групп. По количеству видов преобладают фитофаги – 14 видов и полифаги – 13 видов (рис. 5).
К полифагам в эпифитоне цистозиры относятся преимущественно ракообразные и полихеты, а к фитофагам – гастроподы и некоторые ракообразные. Высокий процент фитофагов характерен для биотопа цистозиры, так как во многом пищевые предпочтения определяют характер местообитания вида.
Рис. 5. Трофическая структура макрозообентоса в эпифитоне C. crinitа по количеству видов.
По численности доминируют сестоно- и фитофаги (рис. 6).
Рис. 6. Трофическая структура макрозообентоса в эпифитоне C. crinitа по численности.
Большая доля сестонофагов определяется высокой численностью двустворчатого моллюска-фильтратора M. lineatus. Это может свидетельствовать о наличии значительного количества органики в исследованных акваториях [39].
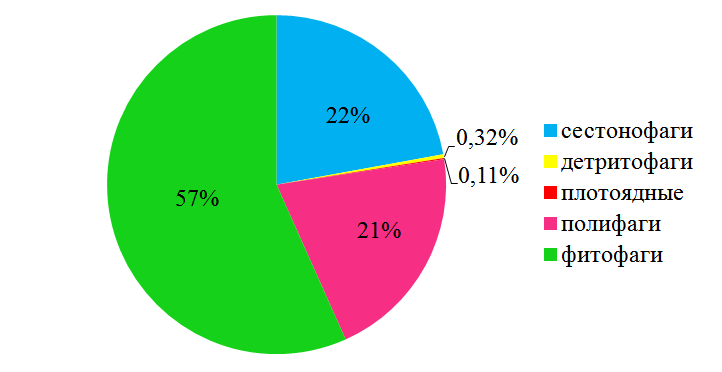
По биомассе преобладают фитофаги (57 %), в основном за счёт R. splendida (рис. 7).
Рис. 7. Трофическая структура макрозообентоса в эпифитоне C. crinitа по биомассе.
Доли сестонофагов и полифагов почти в два раза меньше. Сестонофаги представлены молодью митилястера, полифаги – полихетами и ракообразными
ЗАКЛЮЧЕНИЕ
- В эпифитоне водоросли Cystoseira crinita у берегов Крыма и Кавказа обнаружено 56 видов макрозообентоса. Численность и биомасса видов у берегов Кавказа составили 1432 экз.∙кг-1 и 9,52 г∙кг-1, у берегов Крыма эти показатели варьировали от 2506 до 6085 экз.∙кг-1 и от 23,9 до 43 г∙кг-1 соответственно. Коэффициент общности видов Чекановского-Сёренсена, указывающий на сходство видового состава эпифитона в районах исследования, изменялся от 0,4 до 0,76.
- Выделены сообщества Rissoa splendida (в районах Тарханкута, Симеиза и Утриша), Bittium reticulatum (в бухте Круглой) и Mytilaster lineatus (в акватории мыса Мартьян и бухты Двуякорной).
- Сообщества B. reticulatum в бухте Круглая и R. splendida в районе Утриша находятся в более благоприятных условиях существования.
- Трофическая структура представлена 5 группами. По количеству видов преобладают фито- и полифаги. По численности доминируют фито- и сестонофаги, по биомассе – фитофаги.
REFERENCES
- Kalugina-Gutnik A. A. Phytobenthos of the Black sea, 248 p. (Kiev: Naukova dumka, 1975).
- Black Sea Red Data Book, Ed. by H. J. Dumont, 413 p. (New York: United Nations Office for Project Services, 1999).
- Makkaveeva E. B. Biocenosis of Cystoseira barbata Ag. (Wor.) of coastal area of the Balck Sea, Trudy Sevastopolskoy biologicheskoy stancii, 12, 169 (1959).
- Zernov S. A. To question about research of the Black Sea life, Zapiski imperatorskoy akademii nauk, 32 (1), 300 p.
- Vodyanickiy V. A. Report about work of Novorosisk biological station by name pfof. V. M. Arnoldi at 1927, Gidrobiologicheskiy zhurnal, 7 (3-4), 90 (1928).
- Kiselyova G. A. Species composition and dynamics of macrozoobenthos in association algaes of Karadag nature reserve, Ekosistemy, ih optimizaciya i ohrana, 20, 57 (2009).
- Kiselyova G. A., Dikiy E. A., Zakleckiy A. A., Podzorova D. V. Biodiversity of macrozoobenthos in association algaes (South-east coast, cape Kiik-Atlama), Bioraznobrazie i ustoychivoe razvitie: II mezhd. nauch-prakt. konf., Abstracts, 181 (Simferopol, 2012).
- Kiselyova G. A., Zakleckiy A. A., Shirinskaya S. E. Macrozoobenthos in association Cystoseira of coastal sublittoral and islands Skaly-Korabli in Opuk nature reserve, Geopolitika i ekodinamika regionov, 1, 613 (2014).
- Kolesnikova E. A., Mazlumyan S. A. Dynamics of distribution epiphyton of coastal overgrown Cystoseira in Omega bay (Sevastopol area), Akvatoriya i berega Sevastopolya: ekosystemnie processy i uslugi obcchestvu, red. E. V. Pavlova, N. V. Shadrin, Sevastopol: Akvavita, 221 (1999).
- Makarov M. V. Long-term changes of abundance and biomass Mollusca in overgrown Cystoseira sp. in Kruglaya bay, Ozernie ekosistemy: biologicheskie process, antropogennaya transformaciya, kachestvo vody: V Mezhd. nauch. konf., Abstract, 235 (Minsk, 2016).
- Makarov M. V. Modern state of macrozoobenthos in overgrown algae Cystoseira crinita Duby, 1830 along Crimean coast (the Black sea), Sovremenniye rybohozyaystvennie i ekologichaskiye problemy Azovo-Chernomorskogo regiona: IX mezhd. nauch.-prakt. konf.: Abstracts, 92 (Kerch, 2017).
- Makarov M. V., Viter T. V. Macrozoobenthos in epiphyton of algaes Cystoseira crinita Duby, 1830 in aquatorium of State nature reserve Utrish (the Black sea), Ekosistemy, 15 (45), 106 (2018).
- Makkaveeva E. B. Epiphyton and biocenosis of overgrown shelf macrophyts, Biologiya shelfa:II Vsesoyuz. konf.: Abstracts, 73 (Kiev, 1978).
- Makkaveeva E. B. Invertabrates of overgrown macrophyts of the Black Sea, 229 p. (Kiev: Naukova dumka, 1979).
- Makkaveeva E. B., Musihina G. B., Prosviriv Yu. V., Serenko I. V., Povchun A. S. Features pf the distribution of crustaceans and polychaetes on cystoseira in the coastal zone of the Black Sea, Ekologiya morya, 44, 42 (1993).
- Reznichenko O. G. Fauna of overgrown cystoseira of the Black Sea, Trudy instituta okeanologii, 23, 185 (1957).
- Smolyar R. I. Biocenosis of cystoseira of north-east Black Sea bays in conditions of oil pollution: Abstract. dis. … Cand. biol. science. Odessa, 1978. 25 p.
- Greze I. I. Amphipods of the Black Sea and its biology, 156 p. (Kev: Naukova dumka, 1977).
- Davitashvili L. Sh. Directory at ecology of marine bivalvies, 351 p. (Moskva: Nauka, 1966).
- Kiselyova M. I. Polychaets of the Black and Azov Seas, 409 p. (Apatity:izd-vo Kolskogo nauchogo centra RAN, 2004).
- Chukhchin V. D. Ecology of the Black Sea gastropods, 176 p. (Kiev: Naukova dumka, 1984).
- World Register of Marine Species. WoRMS. Editorial Board, 2020. Available from http://www.marinespecies.org at VIZ. doi: 10/14284/170.
- Malcev V. I. About possibility of use functional abundance indicator for structure investigations of zoocenosis, Gidrobiologicheskiy zhurnal, 26 (1), 87 (1990).
- Dulepov V. I., Leskoba O. A., Mayorov I. S. System ecology: tutorial, 251 p. (Vladivostok: Izd. VGUES, 2004).
- Whittaker R. H. Dominance and diversity in land plant communities, Science, 147, 250 (1965).
- Wilhm J. L., Dorris T. C. Species diversity of benthic macroinvertebrates in a stream reciving domestic and oil refinery efflements, American middland Naturalis, 76 (2), 427 (1966).
- Kovalyova M. A., Boltacheva N. A., Makarov M. V., Bondarenko L. V. The macrozoobenthos of rocks of the upper sublittoral of the Tarkhankut peninsula (Crimea, the Black Sea), Bulleten Moskovskogo obcchestva ispytateley prirody. Otd. Biol., 121 (1), 35 (2016).
- Belich T. V., Sadogurskiy S. E., Sadogurskaya S. A. Revision of macrophyts flora in reserve “Cape Martyan”, Trudy Karadagskoy nauchnoy stancii im. T. I. Vyazemskogo – prirodnogo zapovednika RAN, 3 (7), 3 (2018).
- Kuharev I. L., Krohmal I. L., Krohmal A. G., Byhalova A. N. Characteristic of reserve area. State nature reserve “Utrish”, Atlas. Nauchnie Trudy, 2, 12 (2013).
- Maksimova O. V., Luchina N. P. The current state of macrophytobenthos near the coast of the North Caucasus: the reaction of phytals to the eutrophication of the Black Sea basin, Kompleksnie issledovaniya severo-vostochnoy chasti Chernogo morya, red.: A. G. Zacepin, M. V. Flint, 297 (Moskva: Nauka, 2002).
- Simakova U. V., Smirnov I. A., Shabalin N. V., Papunov V. G. Communities of macroalgaes of reserve “Utrish”, Nauchnie issledovaniya na zapovednih territoriyah: Vseros. nauch. konf., Abstracts, 47 (Simferopol, 2017).
- Vodyanickiy V. A. About natural-historical zoning of the Black Sea and, in particular, near Crimean coast, Trudy Sevastopolskoy biologicheskoy stancii, 7, 249 (1949).
- Makkaveeva E. B. To biology and seasonal fluctuations of abundance of some amphipods of the Black Sea, Trudy Sevastopolskoy biologicheskoy stancii, 13, 120 (1960).
- Makarov M. V., Kovalyova M. A. The structure of taxon of molluscs on natural hard substrates in aquatorium of Crimean reserve areas, Ekosystemy, 9 (39), 20 (2017).
- Makkaveeva E. B. Overgrown biocenoses of the Mediterranean Sea, Trudy Sevastopolskoy biologicheskoy stancii, 16, 201 (1963).
- Makkaveeva E. B. Overgrown biocenoses of the Adriatic Sea, Trudy Sevastopolskoy biologicheskoy stancii, 18, 39 (1964).
- Milovidova N. Yu. Bottom biocenosis of Novorossiysk bay, Raspredelenie benthosa i biologiya donnih zhivotnih v yuzhnih moryah, red. V. A. Vodyanickiy i dr., 75 (Kiev: Naukova dumka, 1966).
- Vorobyov V. P. Benthos of the Sea of Azov, Trudy Azovo-Chernomorskogo nauchno-issledovatelskogo instituta morskogo rybnogo hozyaystva, 13, 195 (1949).
- Finenko G. A. Role of detritus in feeding of bivalvies Mytilus galloprovincialis Lam., Ekologiya morya, 28, 64 (1988).