INDICATORS OF THE CARDIOVASCULAR SYSTEM OF RATS UNDER THE ACTION OF ACETYLSALICYLIC ACID AND ITS COMPLEX COMPOUNDS WITH METALS
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 7 (73), №3, 2021
Publication text (PDF):Download
UDK: 57.084.1
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Chuyan E. N., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Mironyuk I. S., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Biryukova E. A., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Pridatkо A. I., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Ravaeva M. Yu., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Grishina T. V., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Asanova E. R., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Asanova A. R. V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
TYPE:Article
DOI:https://doi.org/10.37279/2413-1725-2021-7-3-271-288
PAGES:from 271 to 288
STATUS:Published
LANGUAGE:Russian
KEYWORDS: acetylsalicylic acid, coordination compounds of acetylsalicylates, indicators of the cardiorespiratory system, heart rate, blood pressure, heart electrocardiogram.
ABSTRACT (ENGLISH):
The effect of acetylsalicylic acid (ASA) and its complex compounds with the metals lithium (Li+), potassium (K+), magnesium (Mg2+) and calcium (Ca2+) with a single intraperitoneal injection at doses of 5, 10 and 20 mg/kg on cardiovascular system (CVS) of rats (blood pressure, heart rate, indicators of heart electrocardiogram). The structure-effect analysis showed that the coordination compounds of ASA, in which, in addition to the ligand with bioactive properties, a metal-microelement is present, caused multidirectional changes in the CVS indices. Those changes depended both on the metal included in the compound and on the dose of the administered substance.
The study was carried out on the basis of the Center for collective use of scientific equipment “Experimental Physiology and Biophysics” (Department of Human and Animal Physiology and Biophysics, V.I. Vernadsky Crimean Federal University).
The research of the biological effect of the acetylsalicylic acid, SLi+, SK+, SMg2+, SCa2+ was carried out during their intraperitoneal injection into rats in doses of 5, 10 and 20 mg/kg. Simultaneously the following characteristics of all the groups’ animals were registered: heart rate (HR), systolic blood pressure (SBP) and diastolic blood pressure (DBP) and electrocardiogram indicators. The pulse pressure (PP) was calculated on the basis of the SBP and DBP indices difference. BP, HR and RR of the rats were registered with the help of the system NIBP200A («Biopac Systems, Inc.», USA).
The experimental data obtained in our studies confirm the literature data, which show that in the process of complexation there is not only an increase or decrease in certain effects that are characteristic of precursor molecules-salicylates, but also the appearance of new properties of derived substances. Тhe obtained data confirm the cardiotropic effectiveness of new coordination compounds, show the dose dependence of these effects and open up the prospects for further studies of their biological action when used repeatedly in chronic experiments.
ВВЕДЕНИЕ
В последнее время внедрение в фармацевтическую практику новых технологий получения высокоактивных лекарственных средств позволило достичь некоторого прогресса в различных областях медицины, в том числе в лечении заболеваний сердечно-сосудистой системы (ССС). Отчасти этого удалось добиться благодаря поиску и созданию новых эффективных соединений с применением комплексообразования с металлами – технологии, позволившей увеличивать и модифицировать биологическую активность уже известных медицинских препаратов.
В наших предыдущих исследованиях показано, что салицилаты металлов, имеющие в составе помимо ацетилсалициловой кислоты (АСК), комплексообразователи, в роли которых выступают катионы металлов кобальта (Co2+), цинка (Zn2+), марганца (Mn2+) и никеля (Ni2+), обладают не только более выраженными, но, зачастую, и качественно новыми по сравнению с АСК кардиотропными эффектами. При этом выраженность развивающегося эффекта зависит не столько от действующей дозы тестируемых соединений, но, в большей степени, от входящего в комплексное соединение с АСК биметалла. В связи с этим перспективным является создание других координационных соединений с металлами различной валентности [1–3].
В связи с этим целью настоящего исследования явилось исследование влияния АСК и салицилатов лития (Li+), калия (К+), магния (Mg2+) и кальция (Са2+) в дозах 5, 10 и 20 мг/кг на показатели ССС крыс.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось на базе Центра коллективного пользования научным оборудованием «Экспериментальная физиология и биофизика» кафедры физиологии человека и животных и биофизики КФУ имени В. И. Вернадского.
Для эксперимента отбирали здоровых половозрелых самцов лабораторных крыс массой 180–250 г. линии Вистар (возраст 26 недель), прошедших карантин не менее 14 дней. Животных содержали в стандартных условиях вивария при температуре 18–22 оС на подстиле «Рехофикс МК 2000» (на основе початков кукурузы) с естественным 12-часовым свето-темновым циклом, свободным доступом к воде (ГОСТ 33215-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур») и полноценному гранулированному корму ГОСТ Р-50258-92. Протокол исследования соответствовал этическим принципам и нормам проведения биомедицинских исследований с участием животных и одобрен этическим комитетом по биоэтике ФГАОУ ВО «Крымский федеральный университет им. В. И. Вернадского» (протокол № 3 от 23. 03. 2021)
Экспериментальные исследования проводились на 160 крысах, характеризующихся средней двигательной активностью и низкой эмоциональностью в тесте «открытого поля» [4], которые составляют большинство в популяции, и поэтому у них развивается наиболее типичная реакция на действие различных факторов [5], в том числе и химических соединений.
Тестируемые вещества были получены на кафедре общей и неорганической химии факультета биологии и химии Института биохимических технологий, экологии и фармации ФГАОУ «Крымский федеральный университет им. В. И. Вернадского» под руководством проф. Гусева А. Н. (химическая чистота составляла не менее 98,0 %) [6].
Исследования кардиотропных эффектов АСК и ее соединений с металлами лития, калия, магния и кальция проводили в дозах 5, 10 и 20 мг/кг. Обоснование выбора тестируемых доз приведено в нашей предыдущей работе [7].
Для исследования животных после предварительного отбора разделили на 16 групп по 10 крыс в каждой.
1 группа – контрольная (К) – животные, которым производились внутрибрюшинные инъекции физиологического раствора (NaCl, 0,9 %), объем 0,2 мл;
2–4 группы – животные, которым производились внутрибрюшинные инъекции АСК в дозах 5, 10 и 20 мг/кг, объем 0,2 мл;
5–7 группы – животные, которым производились внутрибрюшинные инъекции салицилата лития (СLi+) в дозах 5, 10 и 20 мг/кг, объем 0,2 мл;
8–10 группы – животные, которым производились внутрибрюшинные инъекции салицилата калия (СК+) в дозах 5, 10 и 20 мг/кг, объем 0,2 мл;
11–13 группы – животные, которым производились внутрибрюшинные инъекции салицилата магния (СMg2+) в дозах 5, 10 и 20 мг/кг, объем 0,2 мл;
14–16 группы животные, которым производились внутрибрюшинные инъекции салицилата кальция (ССа2+) в дозах 5,10 и 20 мг/кг, объем 0,2 мл.
Биоскрининг тестируемых салицилатов проводился через 20 минут после внутрибрюшинного введения соединений в указанных дозах, поскольку в этот период наблюдается максимальная их концентрация в крови [8].
У животных всех групп с помощью системы NIBP200A («Biopac Systems, Inc.», США) регистрировали следующие показатели ССС: частоту сердечных сокращений (ЧСС); систолическое артериальное давление (САД); диастолическое артериальное давление (ДАД). После регистрации рассчитывали пульсовое артериальное давление (ПАД; разница показателей САД и ДАД).
Для оценки реакции сердца у крыс регистрировали ЭКГ во II стандартном отведении в течение 5 минут на компьютерном полиграфе «Biopac MP-150» («Biopac Systems, Inc.», США) в условиях ингаляционного изофлуранового наркоза. Временные значения интервалов ЭКГ указывали в секундах.
Методика исследования и анализа показателей ССС у животных подробно описана в нашей предыдущей работе [7, 9].
Статистическую обработку экспериментальных данных проводили с помощью программ «Statistica 8.0» (StatSoft, США) и «Microsoft Excel 2016». Осуществляли проверку распределения данных на нормальность с помощью критерия Колмогорова-Смирнова. Поскольку распределение данных у большинства исследуемых групп не соответствовало закону нормального распределения, значимость различий между группами оценивали с помощью непараметрического U-критерия Манна – Уитни. Различия считались достоверными при p < 0,05.
Расчет коэффициента эффективности (КЭ) биологического действия соединений АСК с металлами по сравнению с молекулой предшественницей (АСК) проводился по формуле [7]: КЭ = (АСмет. – АСК)/АСК, где АСмет. – показатели, зарегистрированные у животных при введении салицилатов металлов (средние значения измерений в 3–6 группах); АСК – показатели, зарегистрированные у животных при введении ацетилсалициловой кислоты (средние значения измерений во 2 группе).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изменение артериального давления у крыс после введения тестируемых соединений.
Как показали проведенные исследования, у животных контрольной группы при введении физиологического раствора исследуемые показатели АД находились в пределах физиологической нормы: САД – 113,18±0,76 мм рт. ст.;
ДАД – 72,79±1,52 мм рт. ст.; ПАД – 39,82±1,80 мм рт. ст., что согласуется с результатами наших и других экспериментальных исследований [7, 10–12].
При введении животным АСК в дозах 5 и 10 мг/кг не было отмечено статистически значимых (р>0,05) изменений показателей АД, однако увеличение дозы данного вещества до 20 мг/кг привело к достоверному увеличению САД на 8,60 % (p≤0,05) на фоне снижения ДАД на 13,14 % (p≤0,05), и, как следствие – к выраженному увеличению ПАД на 52,61 % (p≤0,05) по отношению к значениям этих показателей в контрольной группе крыс (рис. 1), что согласуется с нашими данными ранее опубликованных исследований [7].
При этом значение САД после введения АСК дозе 20 мг/кг было на 9,52 % (p≤0,05) и на 4,98 % (p≤0,05) выше по сравнению с таковым, регистрируемым при введении животным АСК в дозах 5 и 10 мг/кг соответственно. Значение ДАД у животных, которым вводили АСК в дозе 20 мг/кг, напротив, оказалось на 12,40 % (p≤0,05) ниже относительно такового при использовании АСК в дозе 10 мг/кг, а ПАД достоверно выше относительно значения этого показателя при использовании АСК 5 мг/кг на 49,67 % (p≤0,05) и АСК 10 мг/кг на 42,70 % (p≤0,05).
Анализ «структура-эффект» показал, что координационные соединения АСК, в которых помимо лиганда, обладающего биоактивными свойствами, присутствует металл-микроэлемент вызвали два типа изменений компонентов АД.
Первый из них характерен для животных, которым вводили салицилат Li (СLi+). При введении животным СLi+ в дозе 5 мг/кг статистически значимых изменений САД не наблюдалось (р>0,05), однако, в отличие от АСК, произошло снижение ДАД на 12,68 % (р≤0,05) на фоне увеличения ПАД на 15,80 % (р≤0,05) по отношению к значениям этих показателей в контрольной группе животных
(см. рис. 1). При этом ДАД оказалось на 8,97 % (р≤0,05) ниже такового у крыс, получавших АСК в той же дозе, а ПАД, напротив, выше на 13,57 % (р≤0,05), о чем свидетельствует КЭ (рис. 2 – Б, В).
При увеличении дозы тестируемого соединения до 10 мг/кг отмечено статистически значимое увеличение САД на 7,22 % (р≤0,05) относительно значений этого показателя в контрольной группе животных, при этом изменение ДАД и ПАД не носили статистически значимого характера (р>0,05) (см. рис. 1).
После введения СLi+ в дозе 20 мг/кг зарегистрировано однонаправленное увеличение САД и ДАД в среднем на 9,59 % (р≤0,05) относительно значений этих показателей в контрольной группе крыс (см. рис. 1 – А, Б). При этом введение СLi+ в дозе 20 мг/кг привело к статистически значимому увеличению ДАД на 26,43 % (р≤0,05) на фоне снижения ПАД на 27,49 % (p≤0,05) относительно значений у крыс, получавших АСК. Подтверждением этому является КЭ, который составил для ДАД +0,26 и ПАД – -0,27 (см. рис. 2 – Б, В).
Второй тип реакций АД, заключающийся в снижении всех его компонентов, развивался у крыс на введение остальных салицилатов во всех тестируемых дозах. Так, в отличие от АСК и СLi+, после введения животным СК+ во всех тестируемых дозах отмечалось статистически значимое снижение всех компонентов АД, как по отношению к значениям в контрольной группе (см. рис. 1), так и у животных, получавших АСК, о чем свидетельствуют отрицательные КЭ (см. рис. 2).
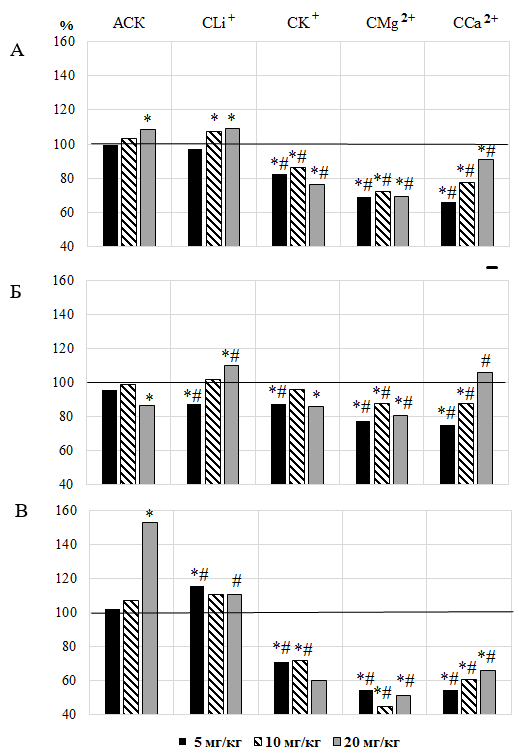 |
Рис. 1. Изменение систолического (А), диастолического (Б) и пульсового (В) артериального давления у животных после введения им ацетилсалициловой кислоты (АСК) и салицилатов лития (СLi+), калия (СK+), магния (СMg2+) и кальция (СCa2+) в дозах 5, 10 и 20 мг/кг (в % относительно значений в контрольной группе животных, принятых за 100 %).
Примечания: * – уровень достоверности различий по критерию Манна-Уитни относительно значений показателей в контроле; # – уровень достоверности различий по критерию Манна-Уитни относительно значений показателей в группе животных, которым вводили ацетилсалициловую кислоту (АСК).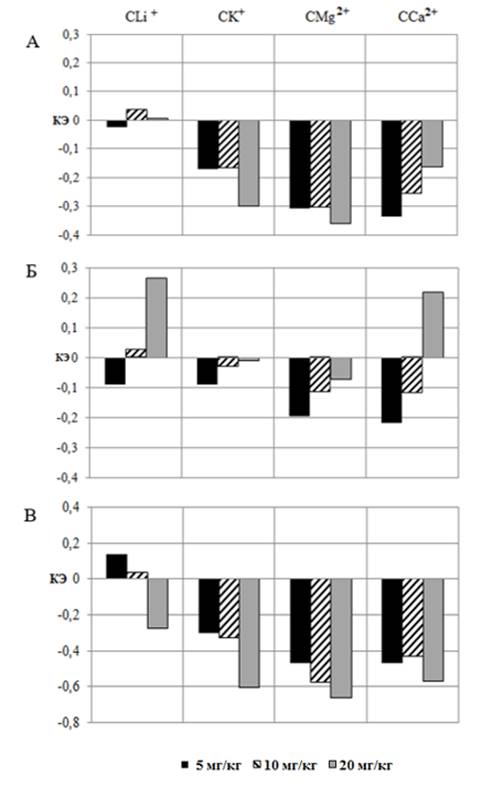
Рис. 2. Коэффициент эффективности (КЭ) показателей систолического (А), диастолического (Б) и пульсового (В) артериального давления при введении животным салицилатов лития (СLi+), калия (СK+), магния (СMg2+) и кальция (СCa2+) в дозах 5, 10 и 20 мг/кг в сравнении со значениями этих показателей у животных при введении АСК в тех же дозах.
При введении животным СMg2+ в тестируемых дозах происходили изменения показателей АД у крыс, причем, отличные как от АСК, так и от СLi+, что выражалось в достоверном снижении САД, ДАД и ПАД, как относительно значений этих показателей в контрольной группе, так и у животных, получавших инъекции АСК (см. рис. 1, 2). Так, при введении животным СMg2+ в дозе 5 мг/кг зарегистрировано достоверное снижение САД на 31,18 % (р≤0,05), ДАД на 22,75 % (p≤0,05), ПАД на 45,58 % (р≤0,05) по отношению к значениям данного показателя в контрольной группе животных (см. рис. 1). При увеличении дозы СMg2+ до 10 мг/кг также наблюдалось статистически значимое снижение значений САД на 27,69 % (р≤0,05), ДАД на 12,22 % (p≤0,05) и, как следствие – выраженное снижение значений ПАД на 54,93 % (р≤0,05) относительно значений исследуемых показателей у животных контрольной группы (см. рис. 1). При введение данного вещества в дозе 20 мг/кг отмечено статистически значимое снижение значений показателей АД относительно значений этих показателей в контрольной группе животных (см. рис. 1).
Наблюдались и достоверные различия между значениями показателей АД при введении СMg2+ и АСК в дозах 5, 10 и 20 мг/кг (см. рис. 2). При этом САД, ДАД и ПАД оказались ниже таковых у крыс, получавших АСК в тестируемых дозах, о чем свидетельствует отрицательный КЭ (рис. 2).
При введении животным CСa2+ произошли дозозависимые изменения со стороны АД, причем наиболее выраженные в дозе 5 мг/кг. Так, после однократного введения животным CСa2+ в дозе 5 мг/кг наблюдалось статистически значимое снижение значений САД на 34,26 % (р≤0,05) и 33,71 % (р≤0,05), ДАД на 24,98 % (р≤0,05) и на 21,80 % (р≤0,05), и как следствие – выраженное снижение значений ПАД на 45,59 % (р≤0,05) и на 46,64 % (р≤0,05), как относительно значений исследуемых показателей у животных контрольной группы, так у животных, получавших инъекции АСК, что подтверждается отрицательным КЭ (см. рис. 1 – А, Б, В). При введении тестируемого соединения в дозе 10 мг/кг отмечено также статистически значимое снижение всех компонентов АД, как по отношению к значениям в контрольной группе, так и у животных, получавших АСК (см. рис. 1, рис. 2). Однако при увеличении дозы CСa2+ до 20 мг/кг на фоне снижения САД на 8,85 % (p≤0,05) и ПАД на 34,15 % (p≤0,05) относительно значений в контроле зарегистрирована тенденция к увеличению ДАД (р>0,05) (см. рис. 1).
Зарегистрировано достоверное снижение САД на 16,07 % (р≤0,05) и ПАД на 56,85 % (р≤0,05) относительно значений, зарегистрированных в группе животных, получавших инъекции АСК в этой же дозе (см. рис. 1 – А, В), что отражено в отрицательном значении КЭ (см. рис. 2 – А, В). Однако при сравнении эффективности CСa2+ с эталонным веществом обращает на себя внимание реакция на тестируемое соединение со стороны ДАД, которое повысилось относительно значений у крыс, которым вводили АСК на 21,69 % (p≤0,05), о чем свидетельствует и положительный КЭ (см. рис. 2 – В).
Следует отметить, что изменение ДАД у животных, которым вводили CСa2+ имело дозовую зависимость. При этом ДАД у животных при введении CСa2+ в дозе 20 мг/кг было на 40,91 % (p≤0,05) больше по сравнению с таковой у крыс при введении того же соединения в дозе 5 мг/кг.
Таким образом, соединения АСК с металлами лития, калия, магния и кальция вызывают разнонаправленные изменения показателей артериального давления, которые зависели как от металла, входящего в состав соединения, так и от дозы вводимого вещества. В частности, нами выделено два типа реакций ССС животных со стороны изменений АД: первый тип развивался у группы животных, получавших СLi+ во всех тестируемых дозах и проявлялся в увеличении показателей АД, а второй тип – у крыс на введение салицилатов калия, магния и кальция во всех тестируемых дозах и заключался в снижении всех компонентов АД, за исключением ДАД у животных после введения CСa2+ в дозе 20 мг/кг.
Изменение частоты сердечных сокращений у крыс после введения тестируемых соединений.
У животных контрольной группы при введении физиологического раствора ЧСС составила 401,84±4,63 ударов в минуту, что согласуется с результатами наших и других экспериментальных исследований [7, 10–12].
Под влиянием АСК в дозах 5, 10 и 20 мг/кг у крыс зарегистрировано снижение ЧСС в среднем на 17,61 % (p≤0,05) относительно значений в контрольной группе крыс, которое не зависело от дозы (рис. 3 – А).
Аналогично АСК, после введения CK+, CMg2+, CCa2+ во всех исследуемых дозах и CLi+ в дозе 5 мг/кг наблюдалось статистически значимое снижение значений ЧСС, наиболее выраженное после введения CMg2+ в дозе 20 мг/кг на 27,52 % (p≤0,05) относительно значений в контроле (см. рис. 3 – А) и на 12,84 % (p≤0,05) относительно сердечного ритма у животных, получавших АСК, подтверждением чему является отрицательный КЭ (см. рис. 3 – Б). Исключение составили животные, которым вводили CLi+ в дозах 10 и 20 мг/кг, у которых наблюдалась тенденция к снижению ЧСС относительно значений в контроле (р>0,05). Однако у крыс этих групп значения данного показателя достоверно превышали таковые у животных, которым вводили АСК в тех же дозах в среднем на 12,96 % (p≤0,05), о чем свидетельствует положительный КЭ (см. рис. 3).
Изменение показателей ЭКГ под влиянием тестируемых соединений.
Регистрация ЭКГ у животных контрольной группы позволила определить длительность комплекса QRS – 0,04±0,02 сек., интервала QT– 0,09±0,01 сек., что согласуется с результатами наших и других экспериментальных исследований [8, 9].
Однократное внутрибрюшинное введение АСК во всех дозах привело к увеличению длительности комплекса QRS в среднем на 25,00 % (p≤0,001)
(рис. 4 – А), что согласуется с результатами наших предыдущих исследований [9].
В отличие от АСК, салицилаты СLi+, CK+, CMg2+, CCa2+ существенно снижали длительность данного комплекса, как относительно контроля, так и группы животных, получавших АСК (рис. 4 – А). Наиболее выраженное уменьшение длительности комплекса QRS наблюдали после введения крысам CMg2+ в дозе 20 мг/кг – на 75,00 % (p≤0,05) относительно контрольных значений и на 80,00 % (p≤0,05), относительно значений, зарегистрированных в группе животных, получавших АСК.
| А | 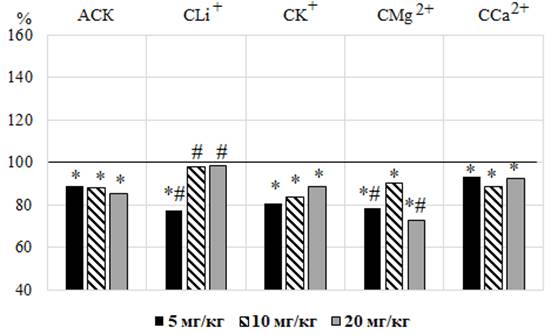 |
| Б | 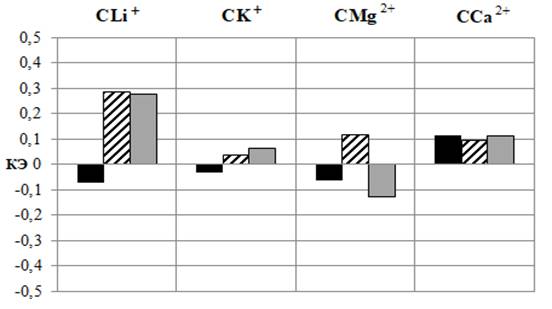 |
Рис. 3. Изменение частоты сердечных сокращений у животных после введения им ацетилсалициловой кислоты (АСК) и салицилатов лития (СLi+), калия (СK+), магния (СMg2+) и кальция (СCa2+) в дозах 5, 10 и 20 мг/кг, выраженное в % относительно значений в контрольной группе животных, принятых за 100 % (А) и коэффициента эффективности (КЭ) в сравнении со значениями этого показателя у животных при введении ацетилсалициловой кислоты (Б).
Примечание: обозначения те же, что на рис. 1.
| А | 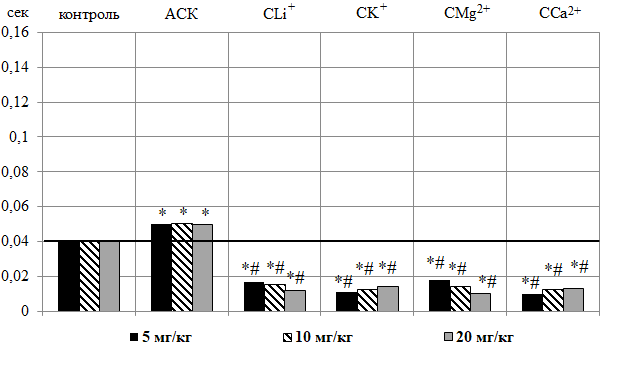 |
| Б | 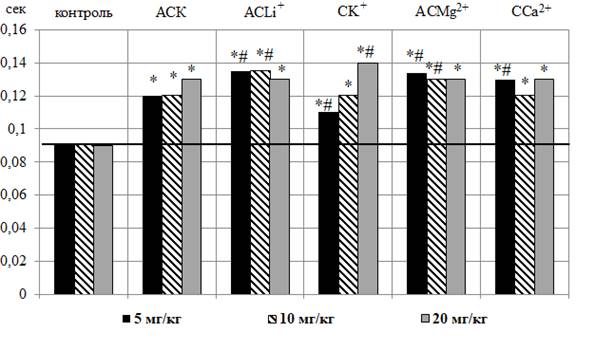 |
Рис. 4. Изменение длительности комплекса QRS (А) и интервала QT (Б) в секундах на электрокардиограмме животных при введении ацетилсалициловой кислоты (АСК) и салицилатов лития (CLi+), калия (CK+), магния (CMg2+) и кальция (CCa2+) в дозах 5, 10, 20 мг/кг.
Примечание: те же, что на рис. 1.
Анализ длительности интервала QT продемонстрировал рост данного показателя у животных после введения АСК во всех тестируемых дозах относительно контроля (рис. 4 – Б).
Аналогичные изменения интервала QТ наблюдались и у животных после введения им салицилатов CLi+, CK+, CMg2+ и CCa2+ во всех исследуемых дозах. Необходимо отметить, что удлинение интервала QТ на ЭКГ крыс после введения им CLi+ (5 и 10 мг/кг), CK+ (5 и 20 мг/кг), CMg2+ (5 и 10 мг/кг) и CCa2+ (5 мг/кг) выражено в достоверно большей степени, чем у животных, которым вводили АСК. Наиболее выраженное увеличение длительности данного интервала наблюдалось у животных после введения CK+ в дозе 20 мг/кг на 55,55 % (p≤0,05) относительно значений в контроле и на 7,69 % (p≤0,05) относительно значений данного показателя у животных, получавших АСК (см. рис. 4 – Б).
Таким образом, АСК привела к однонаправленному увеличению длительностей комплекса QRS и интервала QT относительно значений этих показателей у животных контрольной группы. После введения животным салицилатов CLi+, CK+, CMg2+ и CCa2+ во всех исследуемых дозах наблюдалось статистически значимое уменьшение длительности комплекса QRS относительно значений этого показателя в контроле, однако его существенное удлинение по сравнению с ЭКГ крыс, которым вводили АСК. Длительности интервала QТ после введения животным салицилатов CLi+, CK+, CMg2+, CCa2+ во всех исследуемых дозах увеличивалась аналогично с АСК.
Как показали проведенные исследования, однократное внутрибрюшинное введение крысам АСК оказывало влияние на АД только в дозе 20 мг/кг, вызывая повышение САД на фоне снижения ДАД, что согласуется с данными наших исследований [7] и результатами экспериментов, в которых АСК также не вызывала значимых влияний на АД [13, 14].
Увеличение САД было характерно и для СLi+, которое в дозе вещества 20 мг/кг, в отличие от АСК, сопровождалось достоверным увеличением ДАД. Таким образом, СLi+ при увеличении дозы обладает гипертезивным эффектом, более выраженным, чем АСК в той же дозе.
Напротив, введение СК+, СMg2+ и ССа2+ во всех дозах вызывало снижение АД у экспериментальных животных, что свидетельствует о гипотензивном действии этих соединений и подтверждается данными других исследований. В частности, известно, что магний увеличивает продукцию простагландина Е, образуя кооперативную связь с калием, действует как естественный блокатор кальциевых каналов и вызывает эндотелий-зависимую вазодилатацию и снижение АД [15].
В клиническом исследовании показано, что пероральный прием добавок калия достоверно снижает как САД, так и ДАД (на 5,9 и 3,4 мм рт. ст., соответственно) [16]. Метаанализ 19 исследований (586 человек, из них 412 – с артериальной гипертензией) показал связь между выраженностью гипотензивного эффекта и длительностью приема калия. Было продемонстрировано снижение АД в среднем на 5,9/3,4 мм рт. ст. при использовании таблетированных препаратов калия [17], в связи с чем рекомендовано увеличение потребления калия у пациентов без высокого риска развития гиперкалиемии с целью профилактики и лечения артериальной гипертензии [18].
Важно отметить, что Ca2+ снижает активность ренин-ангиотензиновой системы и оптимизирует натрий-калиевый баланс, что, в свою очередь, может быть потенциальным механизмом снижения АД [19]. Причем, одним из важных эффектов кальций-зависимых рецепторов – это регуляция сосудистого тонуса и АД, которое осуществляется через модуляции гомеостаза кальция. Показано, что стимуляция этих рецепторов вызывает продукцию оксида азота, являющегося мощным вазодилататором.
Таким образом, в наших исследованиях координационные соединения АСК, в которых помимо лиганда, обладающего биоактивными свойствами, присутствует металл-микроэлемент вызвали разнонаправленные изменения компонентов АД у животных экспериментальных групп.
Результаты анализа изменения ЧСС свидетельствуют о том, что введение животным АСК в тестируемых дозах оказывает отрицательный хронотропный эффект, что может быть связано со способностью АСК ингибировать простагландины (PGF2 и PGE2) клетками гладкой мускулатуры кровеносных сосудов и увеличением вагусных влияний на сердце [20].
Введение крысам CLi+ в дозе 5 мг/кг и CK+, CMg2+, CCa2+ во всех исследуемых дозах привело к уменьшению ЧСС, т.е. отрицательному хронотропному эффекту, свойственному АСК. Однако при введении салицилата лития в дозах 10 и 20 мг/кг наблюдалась лишь тенденция к снижению ЧСС относительно значений этого показателя в контроле (р>0,05).
Объективно оценить механизмы изменения ЧСС у лабораторных животных под влиянием АСК и ее производных возможно в результате анализа ЭКГ, который позволяет получить представление об интегральных характеристиках деятельности ССС и межсистемных механизмах регуляции, в связи с чем является значимым в экспериментальной физиологии, патофизиологии, клинических и доклинических исследованиях и имеет широкие перспективы, как при оценке эффективности различных лекарственных препаратов, так и фармакологической безопасности и кардиотоксичности новосинтезированных химических соединений.
Анализ продолжительности комплекса QRS, имеющего ведущее значение для оценки функции миокарда и отражающего время и характер распространения деполяризации по миокарду желудочков [21], показал, что после введения животным АСК во всех исследуемых дозах отмечено статистически значимое увеличение длительности комплекса QRS относительно значений этого показателя в контрольной группе животных. Необходимо отметить, что удлинение данного комплекса на ЭКГ крыс этой группы наблюдалось на 0,01 секунды (на 25 %) по сравнению с контролем, тогда как, согласно данным литературы, увеличение длительности QRS на 40 % и более является маркером межжелудочковой и/или внутрижелудочковой десинхронизации [22], независимым предиктором желудочковых аритмий [23], а, следовательно, кардиальных заболеваний [24]. Поэтому можно предположить, что изменение продолжительности комплекса QRS у животных при введении АСК связано со снижением ЧСС [25].
Противоположная реакция изменения длительности комплекса QRS, выражающаяся в его укорочении, наблюдалась после введения животным салицилатов лития, калия, магния и кальция во всех исследуемых дозах. Причины укорочения комплекса QRS на ЭКГ к настоящему моменту до конца не исследованы. Имеются лишь данные, что укорочение данного комплекса ЭКГ может быть свидетельством ускоренной деполяризации миокарда и, следовательно, трансмуральной активации, что может вызвать электрическую нестабильность миокарда [26, 27].
Анализ длительности интервала QT (электрическая систола сердца), который отражает сумму процессов деполяризации и последующей реполяризации миокарда желудочков [21] показал, что после введения крысам АСК и салицилатов лития, калия, магния и кальция во всех исследуемых дозах наблюдалось статистически значимое увеличение длительности интервала QT относительно контроля.
Следует отметить, что в последние годы растет интерес исследователей и клиницистов к влиянию лекарственных препаратов на интервал QT, поскольку сильное укорочение или удлинение интервала QT свидетельствует о нарушении синхронизации процесса реполяризации, что является сильным аритмогенным фактором, приводящим к возникновению желудочковых аритмий [28]. Удлинение электрической систолы желудочков в том числе может наблюдаться при отравлении лекарствами и веществами, оказывающими кардиотоксическое действие и замедляющими процессы реполяризации [29].
Длительность интервала QT не является постоянной величиной и носит нелинейный обратно пропорциональный характер изменению ЧСС, поэтому удлинение этого интервала у крыс под влиянием исследуемых салицилатов может быть связано с отрицательным хронотропным эффектом. При этом в литературе подробно описано удлинение интервала QT с последующим развитием брадикардии под действием разных лекарственных препаратов. Механизмом этого явления считают пролонгирование фазы реполяризации, которая индуцирует ранние постдеполяризации и пространственную дисперсию рефрактерности [30].
Полученные данные подтверждают кардиотропную эффективность новых координационных соединений, показывают дозовую зависимость этих эффектов и открывают перспективность дальнейших исследований их биологического действия.
ЗАКЛЮЧЕНИЕ
- Анализ «структура-эффект» показал, что координационные соединения АСК, в которых помимо лиганда, обладающего биоактивными свойствами, присутствует металл-микроэлемент вызывают разнонаправленные изменения показателей ССС, что зависит как от металла, входящего в состав соединения, так и от дозы вводимого вещества.
- Соединения АСК с металлами лития, калия, магния и кальция вызывают два типа изменений показателей артериального давления: первый развивается у животных, которым вводили СLi+ во всех тестируемых дозах и проявляется в увеличении показателей артериального давления; второй – у крыс после введения салицилатов калия, магния и кальция во всех тестируемых дозах и заключается в снижении всех компонентов АД, за исключением ДАД у животных после введения CСa2+ в дозе 20 мг/кг.
- Введение крысам CLi+ в дозах 10 и 20 мг/кг вызывает тенденцию, а CLi+ в дозе 5 мг/кг, CK+, CMg2+ и CCa2+ во всех исследуемых дозах приводит к уменьшению ЧСС, т.е. отрицательному хронотропному эффекту, свойственному АСК.
- АСК приводит к однонаправленному увеличению длительностей комплекса QRS и интервала QT на ЭКГ животных относительно значений этих показателей у животных контрольной группы. После введения животным салицилатов CLi+, CK+, CMg2+ и CCa2+ во всех исследуемых дозах наблюдается статистически значимое уменьшение длительности комплекса QRS относительно значений этого показателя в контроле, однако его существенное удлинение по сравнению с ЭКГ крыс, которым вводили АСК. Длительность интервала QТ после введения животным салицилатов CLi+, CK+, CMg2+, CCa2+ во всех исследуемых дозах увеличилась аналогично с АСК.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-33-70142 на экспериментальном оборудовании центра коллективного пользования научным оборудованием «Экспериментальная физиология и биофизика» кафедры физиологии человека и животных и биофизики Таврической академии (структурное подразделение) ФГАОУВО «Крымский федеральный университет им. В. И. Вернадского».
REFERENCES
- Alekhin E., Aspirin: New life of an old drug, Soros educational journal, 5(7), 85, 90 (1990).
- Grigorieva A., Optimization of the pharmacotherapeutic activity of biometals during complexation with NSAIDs, Trace elements in medicine, 2(1), 17, 22 (2000).
- Sokolik J., Tumova I., Blahova M., Anti-inflammatory activities of copper (II) and zinc (II) 3,6-dimetylsalicylates and their equimolar mixture, Acta Facult. Farm. Univ.comenianae, 53(1), 224, 228 (2006).
- Hall C. S. Emotional behavior in the rat. III. The relationship between emotionality and ambulatory activity, Journal of Comparative Psychology, 22(3), 345 (1936) Doi 10.1037/h0059253.
- Chuyan E., Temuryants N. A., Moskovchuk O. B., Physiological mechanisms of biological effects of low-intensity emis, Simferopol: PE “Elyino”, 448 p. (2003).
- Gusev A., Baluda Y., Braga E., Kryukova M., Kiskin M., Chuyan E., Ravaeva M., Cheretaev I., Linert W. Mn (II), Co (II), Ni (II) and Zn salicylates: Synthesis, structure and biological properties studies. Inorganica Chimica Acta, 528: Article120606, (2021); doi: 10, 1016/j.ica.2021.120606.
- Chuyan E., Mironyuk I. S., Ravaeva M. Yu., Cheretaev I. V., Grishina T. V., Ablaeva R. N. Dose-dependent cardiotropic effects of acetylsalicylates, Scientific notes of the Crimean Federal University named after V. I. Vernadsky. Biology. Chemistry, 6(72), 4, 175 (2020). Doi 10.37279 / 2413-1725-2020-6-4-175-196.
- Khabriev R. Guidelines for experimental (preclinical) study of new pharmacological substances, 832 p. (M.: Medicine, 2005).
- Mironyuk I., Biryukova E. A., Chuyan E. N., Asanova A. R., Changes in ECG indices in rats under the influence of acetylsalicylic acid and its complex compounds with metals, Crimean Journal of Experimental and Clinical Medicine, 11(3), 25 (2021).
- Kurkin D. The effect of anesthesia with chloral hydrate on the survival of animals during ligation of the common carotid arteries, Modern problems of science and education, 1, 23 (2017).
- Beresneva O., Parastaeva M. M., Shved N. V., Ivanova G. T., Kucher A. G., Kayukov I. G., Smirnov A. V., The combined effect of age and reduction in the mass of active nephrons on myocardial remodeling in rats. Nephrology. 19(4), 100 (2015).
- Shlyakhto E., Galagudza M. M., Blokhin I. O., Tsyrlin V. A, Syrensky A. V., Egorova E. I., Nifontov E. M., Anti-totemic and antiarrhythmic action of the angiotensin-converting enzyme inhibitor zofenopril in acute myocardial ischemia in experiment, Arterial hypertension 12(3), 237 (2006). https://doi.org/10.18705/1607-419X-2006-12-3-237-242
- Tauseef M., Sharma K., Fahim M., Aspirin restores normal baroreflex function in hypercholesterolemic rats by its antioxidative action., J. Pharmacol, 556(1-3), 136 (2007). https://doi.org/10.1016/j.ejphar.2006.11.029.
- Tjonahen E., Resolvin E., Siegelman J., Elangovan S., Percarpio K., Hong S., Arita M., Serhan C., Identification and anti-inflammatory actions: pivotal role of human 5-lipoxygenase in resolvin E series biosynthesis., Chem. Biol, 13(11), 1193 (2006). https://doi.org/10.1016/j.chembiol.2006.09.011.
- Houston M. C., Harper K. J., Potassium, magnesium, and calcium: their role in both the cause and treatment of hypertension, J Clin Hypertens (Greenwich), 10(7), 2, 2 (2008).
- D’Elia L., Barba G., Cappuccio F. P., Strazzullo P. Potassium intake,stroke, and cardiovascular disease a meta-analysis of prospective studies, J Am Coll Cardiol., 57, 1210 (2011).
- Cappucio F., Mc Gregor G. Does potassium supplementation lower blood pressure? A meta-analysis of published trials. J Hypertens., 9, 456 (1991).
- Canadian Hypertension Education Program Guidelines for pressure Measurement, Diagnosis, Assessment of Risk, prevention and Treatment of Hypertension, Canadian J Cardiol., 32, 569 (2016).
- Gromova O. A. Znachenie deficita kal’cija v pediatrii i puti ee korrekcii, Voprosy sovremennoj pediatrii, 2, 83 (2007).
- Shi X., Ding M., Dong Z., Chen F., Ye J., Wang S., Leonard S. S., Castranova V., Vallyathan V. Antioxidant properties of aspirin: characterization of the ability of aspirin to inhibit silica-induced lipid peroxidation, DNA damage, NF-κB activation, and TNF-α production, Molecular and cellular biochemistry, 199(1-2), 93 (1999). Doi:1023/a:1006934612368.
- Carll A., Lust R., Hazari M. Whole and particle-free diesel exhausts differentially affect cardiac electrophysiology, blood pressure, and autonomic balance in heart failure–prone rats, Toxicological sciences, 128(2), 490 (2012).
- Dhingra R., B. Ho Nam, Benjamin E. J. et al., Cross-sectional relations of electrocardiographic QRS duration to left ventricular dimensions The Framingham Heart Study, J Am Coll Cardiol, 45, 685 (2005).
- Kashani A., Barold S. Significance of QRS Complex Duration in Patients With Heart Failure, J Am Coll Cardiol, 46, 2183 (2005).
- Williams B. The Year in Hypertension, J Am Coll Cardiol, 51, 1803 (2008).
- Childers R., Holmes A., Kocherginsky M. et al., Features of an exceptionally narrow QRS data set, Journal of Electrocardiology, 41, 501 (2008).
- Wolpert C., Veltmann C., Gussak I. et al. Is a narrow and tall QRS complex an ECG marker for sudden death?, Heart Rhythm, 5, 1339 (2008).
- Wellens H. J. Early repolarization revisited, N Engl J Med., 358, 2063 (2008).
- Rjabykina G. V., Sobolev A. V. Holterovskoe i bifunkcional’noe monitorirovanie JeKG i arterial’nogo davlenija, 320 s. (M.: ID «MEDPRAKTIKA-M», 2010).
- Kirkina N. Ju., Vol’negina A. S. Sindrom udlinennogo intervala QT, Klinicheskaja medicina i farmakologija, 4(1), 2 (2018). Doi: 10.12737/article_5acdfe57eee926.15410183.
- Vorobev L. ECG analysis of the q-tc interval from the position of the physiologicality of heart rates, Medical and Diagnostic Center «Vicom-med», 1, 10 (2019). doi: 10.17513/srms.1059.



