PHYSIOLOGICAL ACTIVITY OF AUTOPHAGY IN RESTRICTING CALORIE INTAKE AMONG MEN
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 7 (73), №3, 2021
Publication text (PDF):Download
UDK: 613.24-055.1
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Tkhakushinov I. A., Maikop State Technological University, Maykop, Russia
Lysenkov S. P., Maikop State Technological University, Maykop, Russia
TYPE:Article
DOI:https://doi.org/10.37279/2413-1725-2021-7-3-220-229
PAGES:from 220 to 229
STATUS:Published
LANGUAGE:Russian
KEYWORDS: autophagy, men, Beclin-1, calorie restriction, cholesterol, body composition.
ABSTRACT (ENGLISH):
In a group of healthy men of different ages (18–75 years old), the level of autophagy marker – Beclin-1 in the initial state and after a course (on the 12th day) of limited (800–1200 kcal) calorie restriction (CR) was studied by the enzyme immunodetection. Body composition was determined using impedansometry. The degree of autophagy activation was assessed by the “delta” value – the difference between the initial concentration and after CR. Normally, men showed significant variability in the level of Beclin-1 from 6.14 to 844.78 pg / ml. As a result of the CR course, there was a significant decrease in body weight, soft lean, fat and muscle mass (p<0.0001), as well as intracellular water (p<0.006). As a result of the course of CR in the entire group, an increase of 2.0 times (p<0.01) in the concentration of Beclin-1 was noted. At the same time, positive correlations were revealed in the entire study group between weight, body mass index (r = 0.46 and r = 0.48, respectively, p<0.05), fat mass (r = 0.62; p<0,01). The same patterns were observed in middle-aged people. A direct correlation was found in obese individuals between the level of Beclin-1 and the content of fat mass. In the group of young people, positive correlations between the Beclin-1 delta and the delta of individual body composition indicators were revealed: muscle (r = 0.96; p<0.05), soft lean (r = 0.96; p<0.05) weight and total water (r = 0.96; p<0.05). The loss of these body components was accompanied by a parallel decrease in the activity of Beclin-1. In old age, fat loss occurred in parallel with an increase in Beclin-1 activity (r = -0.87; p<0.05), directly correlated with HDL (r = 0.94; p<0.01) and inversely correlated with LDL (r = -0.99; p<0.01) and total cholesterol (r = -0.98; p<0.01). In young people, the opposite pattern was observed. Each age group had its own characteristics in the ratios of the studied parameters.
ВВЕДЕНИЕ
Аутофагия имеет важное значение для выживания и приспособления организма. Механизмы аутофагии направлены на удаление цитотоксических соединений или поврежденных структур, такие, как редокс-активные белковые агрегаты, либо поврежденные митохондрии [1]. Многими авторами признается положительный эффект активации аутофагии на клеточном и организменном уровне [2]. Однако, по мере накопления знаний о механизмах аутофагии это мнение разделяют не все авторы.
В настоящее время отсутствуют специфические молекулярные соединения, применимые для модуляции аутофагии у людей. Эта ситуация наблюдается на фоне достаточно большого экспериментального материала [3–5], выполненного на различных моделях и химических соединениях.
Арсенал экспериментальных терапевтических средств огромен, однако существует ряд препятствий для внедрения их в клиническую практику. Использование препаратов для лечения различных заболеваний могут оказывать ряд непредсказуемых эффектов на процесс аутофагии. К примеру, применяемый активатор аутофагии – рапамицин одновременно ингибирует клеточный рост и пролиферацию [6, 4]. Таких примеров можно привести множество. Сложность архитектуры тканей человека создает проблему специфичности модуляторов аутофагии. В силу разнообразия функций и биохимизма различных клеток и тканей в организме включаются саногенетические реакции, сопровождающиеся в одних клетках и тканях активацией, а в других – ингибированием процесса аутофагии. Это большое препятствие, которое очень трудно преодолеть различными фармакологическими воздействиями. С этих позиций представляют интерес разработка и изучение физиологических и относительно универсальных способов модуляции аутофагии, основанных на собственных физиологических механизмах саногенеза у человека. Одним из таких подходов является ограничение калорийности питания [7]. Большинство исследований выполнены на экспериментальных моделях и чаще всего на животных [8–10]. Однако эти методы требуют тщательного изучения различных аспектов аутофагии, ее механизмов, гендерных особенностей, физиологических способов модуляции и коррекции у человека.
Цель исследования: выявить возможные закономерности между процессами активации аутофагии и ограничением калорийности питания у мужчин.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании принимали участие 20 мужчин разной массой тела (от 68,6 до 198 кг) и возраста (от 30 до 69 лет). Обследование проводилось на базе клиники ООО «Центр здоровье» в г. Майкопе. Ограничение калорийности питания (ОКП) в течение суток составляла 800–1200 ккал. Были проведены антропометрические исследования, общеклинический и биохимический анализ крови (общий холестерин – ОХ, липопротеиды высокой плотности – ЛПВП, липопротеиды низкой плотности – ЛПНП, триглицериды – ТГ). Определение показателей состава тела (мышечной массы – М.М., тощей массы – Т.М., жировой массы – Ж.М., общей воды тела – ОВТ, внеклеточной воды – Внек. В., внутриклеточной воды – Внут. В.) проводили импедансометрическим способом на аппарате Medi Ld (France) c помощью программного обеспечения EIS-ESTECK (США). Индекс массы тела (ИМТ) рассчитывался по коэффициенту Кетле: отношение массы тела (кг) к росту (м2). Для анализа активности процессов аутофагии был выбран белок Beclin-1 (беклин-1), так как является наиболее информативным маркером аутофагии [10]. Исследование беклина-1 в сыворотке крови проводили методом ИФА на аппарате «CLARIOstarplus» BMG LABTECH (Germany) при помощи тест-наборов «Cloud-Clone Corp» (USA). Забор крови осуществлялся утром натощак при поступлении и на 12 сутки. Концентрация фермента выражалась в пг/мл.
Следуя рекомендациям ВОЗ, обследуемые были разделены на 3 возрастные группы: молодой возраст от 18–44 (n=4), средний возраст от 44 до 60 лет (n=8) и пожилой возраст от 60 до 75 лет (n=5).
Анализ цифровых данных проводился с использованием программного обеспечения IBM SPSSStatistics (26.0). Для характеристики статистического ряда использовалась описательная статистика (процентили 5 %–95 %) с вычислением медианы, среднего значения, ошибки средней, минимального и максимального значения. Для сравнения средних значений использовали непараметрический U-критерий Манна-Уитни, параметрический t-критерий Стьюдента. В целях выявления связей между исследуемыми параметрами использовался корреляционный анализ Пирсона. Связь считалась достоверной при p<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исходный уровень Beclin-1 у здоровых мужчин разных возрастов значительно варьировал в пределах 6,14–844,78 пг/мл. В связи с этим в анализ были включены значения, лежащие в межпроцентильном интервале 5 %–95 % (до ОКП n=17; после ОКП n=18).
Сравнительный анализ среднестатистических уровней беклина-1 показал достоверный рост маркера после временного ограничения калорийности питания (табл. 1).
Таблица 1
Сравнение концентрации беклина до- и после ОКП
| Исследуемые группы | М ср. | σ | m0 | Медиана | Min | Max | P |
| 1. До КОП (n=17) | 48,8 | 38,2 | 9,2 | 35,5 | 9,8 | 141,7 | P1-2=0,01* |
| 2. После КОП (n=18) | 101,9 | 89,8 | 21,2 | 70,6 | 33,68 | 377,3 |
Примечание: * – использовался U-критерий Манна-Уитни
Активность фермента в среднем во всей группе повысилась в 2 раза. При этом морфометрические показатели состава тела по ряду параметров также изменились (табл. 2): снизилась общая масса тела, жировая, тощая масса, содержание внутриклеточной воды.
Таблица 2
Изменение состава тела мужчин в результате проведения курса ОКП
| Состав тела до и после | М ср., кг | σ | m0 | Достоверность по t-критерию Стьюдента | |||
| I | II | I | II | I | II | ||
| 1.Вес (n=20) | 110,6 | 101,0 | 31,8 | 30,5 | 7,1 | 6,8 | P <0,0001 |
| 2. Мышечная масса (n=20) | 20,2 | 19,7 | 1,8 | 1,8 | 0,4 | 0,4 | P <0,0001 |
| 3. Тощая масса (n=16) | 66,3 | 64,5 | 6,0 | 6,0 | 1,5 | 1,5 | P <0,0001 |
| 4. Жировая масса (n=16) | 38,2 | 34,2 | 31,0 | 29,3 | 7,7 | 7,3 | P <0,0001 |
| 5. Общая вода (n=16) | 48,5 | 45,3 | 4,3 | 7,6 | 1,1 | 1,9 | P <0,3 |
| 6. Внеклеточная вода (n=16) | 19,2 | 19,2 | 2,8 | 3,4 | 0,7 | 0,8 | P <0,2 |
| 7. Внутриклеточная вода (n=16) | 29,4 | 28,0 | 3,0 | 3,0 | 0,8 | 1,0 | P <0,006 |
Примечание: I – исходные показатели; II – показатели после проведения ОКП.
Проведенный корреляционный анализ между концентрацией беклина и компонентами состава тела выявил ряд достоверных корреляционных связей.
Таблица 3
Корреляционный анализ между концентрацией беклина-1 и показателями состава тела в зависимости от возраста после ОКП у мужчин
| Исследуемые группы/ возраст | Вес | ИМТ | М. М. | Т. М. | Ж. М. | ОВТ | Внек. В. | Внут. В. | |
| 1. Вся группа | n1=17 | 0,02 | -0,03 | 0,21 | 0,21 | -0,1 | 0,21 | 0,11 | 0,2 |
| n2=18 | 0,46* | 0,48* | 0,2 | 0,2 | 0,62** | 0,37 | 0,2 | 0,05 | |
| 2. Молодой | n1=4 | 0,0 | -0,12 | 0,39 | 0,39 | -0,02 | 0,39 | 0,49 | 0,27 |
| n2=6 | 0,68 | 0,69 | -0,36 | -0,35 | -0,74 | -0,35 | 0,11 | -0,32 | |
| 3. Средний | n1=8 | 0,19 | 0,2 | -0,02 | -0,02 | 0,35 | -0,02 | 0,2 | -0,2 |
| n2=7 | 0,75* | 0,78* | 0,001 | 0,001 | 0,78* | 0,46 | 0,12 | -0,09 | |
| 4. Пожилой | n1=5 | 0,32 | 0,24 | 0,76 | 0,76 | -0,02 | 0,76 | 0,22 | 0,84* |
| n2=5 | 0,88* | 0,82* | 0,8 | 0,8 | 0,79 | 0,8 | 0,72 | 0,46 | |
Примечание: *достоверность – p <0,05; **достоверность – p <0,01; n1 – до ОКП; n2 – после ОКП; ИМТ – индекс массы тела; М.М. – мышечная масса, Т.М. – тощая масса,
Ж.М. – жировая масса, ОВТ – общая вода тела, Внек. В. – внеклеточная вода,
Внут. В. – внутриклеточная вода.
В исходном состоянии выявляется прямая корреляционная связь у пожилых между исходным уровнем беклина и содержанием внутриклеточной воды (табл. 3). Дальнейший корреляционный анализ выявил наличие прямых корреляционных связей между концентрацией беклина-1 после ОКП и весом, индексом массы тела, жировой массой (табл. 3) во всей группе. В молодом возрасте указанные связи не выявлялись, однако в средне-пожилом возрасте их достоверность по исследуемым параметрам оказалась значительно выше (p<0,01), чем во всей группе. Другими словами, степень активации беклина-1 у мужчин находилась в прямой зависимости от общей массы тела и жировой массы, которые регистрировались после ОКП. В то же время, мы не зафиксировали наличие корреляционной связи между возрастом и уровнем беклина-1 до ОКП (r= -0,25; p>0,05) и после ОКП (r= -0,23; p<0,5) во всей исследуемой группе.
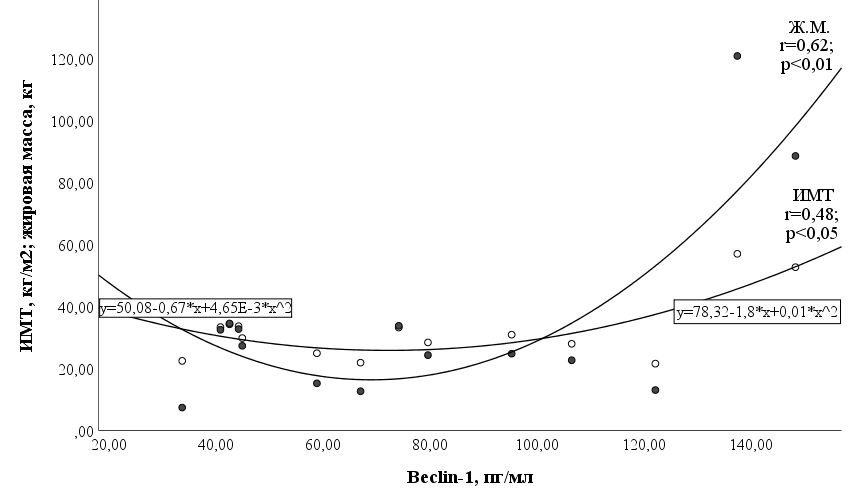
Для подтверждения этого заключения был проведен аналогичный корреляционный анализ у лиц с исходно нормальным весом и у лиц с ожирением. Как и предполагалось, была выявлена высокая корреляционная зависимость (табл. 4) между концентрацией беклина-1 и содержанием жировой массы после ОКП (рис.1).
Таблица 4
Корреляционный анализ между концентрацией беклина-1 и показателями состава тела в зависимости от массы тела после ОКП у мужчин
| Исследуемые группы/ возраст |
Коэффициент корреляции | |||||||
| Вес | ИМТ | М. М. | Т. М. | Ж. М. | ОВТ | Внек. В. | Внут. В. | |
| 1. Нормальный вес (n=7) | 0,02 | -0,09 | -0,03 | -0,03 | 0,13 | 0,5 | -0,16 | 0,12 |
| 2.Ожирение (n=11) | 0,43 | 0,45 | 0,38 | 0,38 | 0,82* | 0,38 | 0,36 | -0,07 |
Примечание: *достоверность – p<0,05; ИМТ – индекс массы тела; М.М. – мышечная масса, Т.М. – тощая масса, Ж.М. – жировая масса, ОВТ – общая вода тела, Внек. В. – внеклеточная вода, Внут. В. – внутриклеточная вода.
Рис. 1. График корреляционной зависимости между жировой массой (Ж. М.), индексом массы тела (ИМТ) и беклином-1 после ОКП.
В связи с выявленными корреляционными связями между содержанием жировой массы и уровнем беклина-1 определенный интерес представлял дальнейший анализ связей с показателями липидного спектра после ОКП. Оказалось, что изменения концентрации основных компонентов липидного обмена происходило вне зависимости от уровня маркера после ОКП.
Очень важным показателем, характеризующим степень активации беклина-1, является разница (дельта) между исходными показателями беклина-1 до- и после ОКП. Исходные показатели были приняты за 100 %.
Анализ показателей дельты в различных возрастных группах не выявил статистической разницы между ними (табл. 5).
Таблица 5
Сравнение дельты концентрации беклина (в % от исходного) до- и после ОКП в зависимости от возраста
| Исследуемые группы/возраст | М ср. | σ | m0 | Медиана | Min | Max | P |
| 1.Молодой (n=4) | 164,75 | 234,98 | 117,5 | 123,5 | -40 | 452 | P1-2=0,78
P1-3=0,81 P2-3=0,61 |
| 2.Средний (n=8) | 222,13 | 358,99 | 126,92 | 66,5 | -35 | 987 | |
| 3.Пожилой (n=5) | 129,2 | 191,13 | 85,47 | 66,0 | -17 | 462 |
По средним значениям наиболее высокую активность беклин-1 проявлял в среднем возрасте, однако из-за неоднородности выборки эти различия оказались не достоверными.
Аналогичным образом не было подтверждено различие в реакции беклина-1 у лиц с нормальным весом и ожирением (89,6±46,9 пг/мл и 219,5±92,9 пг/мл соответственно; p<0,4; Мср±mо), хотя и в этом случае средние значения концентрации беклина-1 оказались значительно выше в группе с ожирением.
Корреляционный анализ между показателями дельты концентрации беклина-1 и дельтами показателей состава тела (табл. 6) выявил наличие прямой зависимости от мышечной, тощей массой (r=0,96; p<0,05), жировой массы (r=0,96; p<0,05) и содержанием общей воды (r=0,96; p<0,05) в молодом возрасте и обратной зависимости между дельтой беклина-1 и дельтой жировой массы у пожилых (r=-0,87; p<0,05).
Таким образом, прослеживаются возрастные особенности взаимосвязей между потерей отдельных компонентов состава тела и активностью беклина-1. Наиболее отчетливо они выявляются в молодом возрасте, в то время как в пожилом эти взаимосвязи с жировой массой меняются на противоположные.
Анализ взаимосвязей показателей дельты с показателями дельты состава тела не выявил достоверных закономерностей у лиц с нормальным весом и ожирением.
Таблица 6
Корреляционный анализ между дельтами концентрации беклина-1 и показателями состава тела в зависимости от возраста
| Исследуемые группы/ возраст |
Коэффициент корреляции | |||||||
| Вес | ИМТ | М. М. | Т. М. | Ж. М. | ОВТ | Внек. В. | Внут. В. | |
| 1.Вся группа (n=17) | -0,2 | -0,33 | -0,18 | -0,18 | -0,24 | 0,09 | -0,01 | -0,08 |
| 2.Молодой (n=4) | 0,27 | 0,27 | 0,96* | 0,96* | 0,07 | 0,96* | 0,86 | -0,66 |
| 3.Средний (n=8) | -0,28 | -0,58 | -0,57 | -0,57 | -0,23 | 0,13 | -0,22 | -0,02 |
| 4.Пожилой (n=5) | -0,5 | -0,5 | -0,79 | -0,79 | -0,87* | -0,79 | -0,05 | -0,23 |
Примечание: *достоверность – p <0,05; ИМТ – индекс массы тела; М.М. – мышечная масса, Т.М. – тощая масса, Ж.М. – жировая масса, ОВТ – общая вода тела, Внек. В. – внеклеточная вода, Внут. В. – внутриклеточная вода.
Интересные данные были получены при анализе корреляционных связей между показателями дельты концентраций беклина-1 и дельтами различных показателей липидного обмена (табл. 7). Если в пожилом возрасте эти изменения носили физиологическую направленность и характеризовались достоверной прямой связью с ЛПВП (p<0,01) и обратной с ЛПНП и холестерином (p<0,01), то в молодом возрасте картина менялась на противоположную: выявлялась обратная связь с ЛПВП (p<0,05) и прямая – с ЛПНП (p<0,05).
Таблица 7
Корреляционный анализ между дельтами концентрации беклина-1 и показателями липидного спектра в зависимости от возраста у мужчин
| Возрастные группы/возраст | Коэффициент корреляции | |||
| ЛПНП | ЛПВП | Общий холестерин | Триглицериды | |
| 1. Вся группа (n=17) | 0,18 | 0,02 | 0,21 | 0,19 |
| 2. Молодой (n=4) | 0,94* | -0,91* | 0,59 | -0,32 |
| 3. Средний (n=8) | 0,44 | -0,41 | 0,5 | 0,46 |
| 4. Пожилой (n=5) | -0,99* | 0,94** | -0,98** | -0,33 |
Примечание: *достоверность – p <0,05; **достоверность – p <0,01
ЗАКЛЮЧЕНИЕ
Таким образом, проведенное исследование показало, что исходный уровень беклина-1 у мужчин разного возраста и массы характеризуется большой вариабельностью.
Показано, что ограничение калорийности питания характеризовался увеличением во всей группе активности беклина-1, что подтверждалось статистически. Кроме того, рост концентрации беклина-1 находился в прямой зависимости от массы тела и жировой массы в средне-пожилом возрасте. В молодом возрасте таких связей не выявлялось. Можно предположить, что основным источником повышения концентрации беклина-1 в группе средне-пожилого возраста является жировая и мышечная масса. Имеющиеся в литературе данные говорят о том, что мышцы имеют огромные резервы для активации процесса аутофагии и, соответственно, роста ее биохимических компонентов [11]. Жировая масса в этом аспекте, особенно в условиях дефицита энергетических ресурсов по активности не уступает мышечной массе [12].
Установлено, что у молодых мужчин степень активации аутофагии определялась ее активностью в мышцах. Однако для пожилого возраста степень активации процесса находилась в обратной зависимости от количества потерянной жировой массы. Эти реакции у пожилых сопровождаются снижением уровня холестерина, ЛПНП и повышением ЛПВП. В то же время, реакцию липидного обмена у молодых обследованных объяснить пока сложно. Возможно, что активация аутофагии у молодых мужчин сопровождается потреблением ЛПВП и, соответственно, ростом ЛПНП. В литературе имеются сведения о том, что повышение активности аутофагии сопровождается увеличением количества фагосом, требующих для построения своих мембран исходных материалов: жирных кислот, липидов и холестерина [13].
Можно считать доказанным, что ограничение калорийности питания является эффективным физиологическим фактором активации процесса аутофагии у мужчин, что обосновывает применение ОКП в оздоровительных программах. Для сохранения оптимального соотношения активности аутофагии и мышечной массы во время ОКП необходимо обеспечивать адекватные физические нагрузки. Перспективность исследования заключается в выявлении физиологических факторов, влияющих на процесс аутофагии у человека.
REFERENCES
- Green D. R., Galluzzi L., Kreemer G. Mitochondria and the Autophagy–Inflammation–Cell Death Axis in Organismal Aging. Science. 333, 1109 (2011).
- Lu N., Li X., Tan R., An J., Cai Z., Hu X., Wang F., Wang H., Lu C., Lu H. HIF-1α/Beclin-1-Mediated Autophagy Is Involved in Neuroprotection Induced by Hypoxic Preconditioning. Journal of Molecular Neuroscience. 66, 238 (2018).
- He, Bassik M. C., Moresi V., Sun K., Wei Y., Zou Z., An Z., Loh J., Fisher J., Sun Q., KorsmeyerS., Packer M., May H. I., Hill J. A., Virgin H. W., Gilpin C., Xiao G., Bassel-Duby R., Scherer P. E., Levine B. Exercise-induced BCL2-regulated autophagy is required for muscle glucose homeostasis. Nature. 481, 511 (2012).
- Liu K., Shi N., Sun Y., Zhang T., Sun X. Therapeutic effects of rapamycin on MPTP-induced Parkinsonism in mice. Neurochemical Research. 38, 201 (2013).
- Noda N. N., Inagaki F. Mechanisms of autophagy. Annual Review of Biophysics. 44, 101 (2015).
- Laplante M, Sabatini D. mTOR signaling in growth control and disease. 149, 274 (2012).
- Chung K. W., Chung H. Y. The effects of calorie restriction on autophagy: role on aging intervention. 11, 2923 (2019).
- Finckenberg P., Eriksson O., Baumann M., Merasto S., Lalowski M. M., Levijoki J., Haasio K., Kyto V., Muller D. N., Luft F. C., Oresic M., Mervaala E. Caloric restriction ameliorates angiotensin ii–induced mitochondrial remodeling and cardiac hypertrophy. 59, 76 (2011).
- LuL., Ma Q., Wang J., Li L. Y., Han S. L., Limbu S. M., Li D. L., Chen L. Q., Zhang M. L., DuZ. U. Fasting enhances cold resistance in fish through stimulating lipid catabolism and autophagy. The journal of Physiology. 597, 1585 (2019).
- Zhang K., Shi P., An T., Wang Q., Wanf J., Li Z., Duan W., Li C., Guo Y. Food restriction-induced autophagy modulates degradation of mutant SOD1 in an amyotrophic lateral sclerosis mouse model.Brain Research. 1519, 112 (2013).
- Brandt, Gunnarsson T. P., Bangsbo J., Pilegaard H. Exercise and exercise training-induced increase in autophagy markers in human skeletal muscle. Physiological Reports. 6, 7 (2018).
- Ferhat, Funai K., Boudina S. Autophagy in adipose tissue physiology and pathophysiology. Antioxidants and redox signaling. 36 (2019).
- Mizushima, Komatsu M. Autophagy: renovation of cells and tissues. Cell. 147, 728 (2011).