CHANGES IN THE INDEX OF DEPRESSION IN LOW-, MEDIUM- AND HIGHLY DEPRESSED RATS DEPENDING ON THE DURATION OF MONOAMINE OXIDASE-B BLOCKADE
ИЗМЕНЕНИЕ ИНДЕКСА ДЕПРЕССИВНОСТИ У НИЗКО-, СРЕДНЕ- И ВЫСОКОДЕПРЕССИВНЫХ КРЫС В ЗАВИСИМОСТИ ОТ ДЛИТЕЛЬНОСТИ БЛОКАДЫ МОНОАМИНОКСИДАЗЫ-В
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №4, 2024
Publication text (PDF):Download
UDK 616-091.8:599.323
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Khusainov D. R., Institute of Biochemical Technologies, Ecology and Pharmacy (structural division) of the V. I. Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
Tumanyants K. N., Institute of Biochemical Technologies, Ecology and Pharmacy (structural division) of the V. I. Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
Aidinov I. D., Institute of Biochemical Technologies, Ecology and Pharmacy (structural division) of the V. I. Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
Ivanova V. R., Institute of Biochemical Technologies, Ecology and Pharmacy (structural division) of the V. I. Vernadsky Crimean Federal University, Simferopol, Republic of Crimea, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-4-217-229
PAGES:from 217 to 229
STATUS:Published
LANGUAGE:Russian
KEYWORDS: depression, selegiline, monoamine oxidase, dopamine.
ABSTRACT (ENGLISH):
To date, the scientific community has generally acknowledged the undeniable role of dopamine in the regulation of a wide variety of behavioural and psychoemotional manifestations and functions. Thus, the dopaminergic theory of schizophrenia has been formed [1, 2]; participation in the pathogenesis of Parkinson’s [3] and Alzheimer’s [4] diseases and in the manifestation of psychosis [5] is noted. Also, anxiolytic [6] and antidepressant effects [7, 8] have been observed when central dopamine concentration increases, including under conditions of monoamine oxidase blockade. At the same time, the issues related to the involvement of the dopaminergic system in the formation of the initial level of psychoemotional characteristics of animals and humans remain open and debatable; studies on the effects of monoamine oxidase blockade are also promising [9, 10]. We believe that the time before the test is relevant and may have an impact on the parameters recorded. For the above considerations, a working hypothesis was proposed: the effect of monoamine oxidase blockade will be maximised in animals with high levels of depression and will depend on the time interval after blocker administration. Within the framework of this hypothesis, in the present work, we elucidated the dependence of the effect of monoamine oxidase-B (MAO-B) blockade on the initial level of depressiveness of rats and the time from the blocker administration to the beginning of animal testing.
The study was conducted in 2 separate stages: selection and experimental (main) and was carried out in the period from 2021 to 2023. A total of 183 Wistar rats (Branch of SIC ‘Kurchatov Institute’ – JINR – ‘Rappolovo’) aged 7.5–8 months were tested at the selection stage, from which 44 male rats with the level of depressivity index (DI) 0.36±0.012, hereinafter referred to as ‘low level of depressivity’, were selected; 44 male rats with an ID of 0.51±0.007, hereafter ‘medium level of depressiveness’ and 44 male rats with an ID of 0.82±0.022, hereafter ‘high level of depressiveness’.
The ID was calculated according to the formula (t-total — ta)/t-total, where t-total is the time of testing in the Porsolt test (5 min), ta is the time of active swimming. The semantic approach of this calculation is quite simple: the longer the animal is in the state of active swimming, the lower the level of depression. Consequently, if ta= t-total, the ID is minimal and equal to zero and, conversely, if ta= 0, the ID is maximal and equal to one.
The selected animals within each group of the corresponding level of depression were divided into 4 subgroups of 11 animals each: one subgroup received intraperitoneal injection of the MAO-B blocker selegiline at a dose of 2.5 mg/kg (0.2 ml solution volume) 1 hour before testing, the second subgroup – 2 hours before testing, the third subgroup – 3 hours before testing; and one subgroup was a control subgroup, whose animals received intraperitoneal injection of physiological solution. It should be noted that initially three control subgroups were allocated and animals were tested 1 hour, 2 hours and 3 hours after physiological solution injection. And according to the result no significant differences were found between these control subgroups, the ID of the animals was essentially identical. Therefore, we abandoned such a ‘triplicity’ of control and formed one control subgroup, rats of which were placed in the Porsolt test one hour after the injection of physiological solution.
Statistical analysis of all arrays was carried out in the GraphPadPrism 8.0 programme using descriptive statistics, the Shapiro-Wilk criterion, the variance of arrays was compared using the Barlet criterion, and for multiple comparisons the analysis of variance and the Tukey test were used.
It was found out that in low-depressed animals a single blockade of central monoamine oxidase-B by selegiline does not cause significant changes in the level of depression. In moderately depressed animals ID during MAO-B blockade: control – 0.55±0.008; 1 hour after selegiline administration – 0.49±0.018; after 2 hours – 0.49±0.016; after 3 hours – 0.42±0.016 at p<0.001 in comparison with the control level and at p<0.05 in comparison with ID after 1 and 2 hours of MAO-B blockade. In highly depressed rats, the ID in control was 0.81±0.023; 1 hour after selegiline administration, 0.71±0.011 at p<0.05 compared to control; 2 hours later, 0.65±0.019 at p<0.0001 and 3 hours later, 0.56±0.017 at p<0.0001 compared to control levels. Also, the ID of rats after three-hour MAO-B blockade was significantly lower than the values of the group of rats with one-hour duration of blockade at p<0.0001 and compared to two-hour duration of MAO-B blockade at p<0.01.
The hypothesis put forward by us (see introduction) was fully confirmed: it was found that the effect of MAO-B blockade has a significant dependence on the duration of blockade and is also related to the initial level of depression.
ВВЕДЕНИЕ
К настоящему времени в научном сообществе общепризнанным является мнение о неоспоримой роли дофамина в регуляции самых разнообразных поведенческих и психоэмоциональных проявлений и функций. Так, сформирована дофаминергическая теория шизофрении [1, 2]; отмечается участие в патогенезе болезни Паркинсона [3] и Альцгеймера [4] и в проявлении психозов [5]. Также, при увеличении концентрации центрального дофамина, в том числе в условиях блокады моноаминоксидазы, отмечаются анксиолитический [6] и противодепрессантный эффекты [7, 8]. При этом, остаются открытыми и дискуссионными вопросы, которые связаны с вовлеченностью дофаминергической системы в формирование изначального уровеня психоэмоциональных характеристик животных и человека, перспективны и исследования по изучению эффектов блокады моноаминоксидазы [9, 10]. Обращает на себя внимание и тот фак, что в различных исследованиях тестирование животных начинается через отличающееся время после введения блокаторов моноаминоксидазы – 1–3 часа, что связано с периодом полураспада селегилина – 90 минут [11]. В тоже время, еще в работах Borbe H. указывалось, что максимальная блокада МАО-В (порядка 88 %) наблюдается по истечении 120 минут после введения селегилина [12]. Мы считаем, что время до начала тестирования имеет значение и может оказать влияние на регистрируемые параметры. По указанным соображениям мы выдвинули рабочую гипотезу: эффект блокады моноаминоксидазы будет максимально выраженным у животных с высоким уровнем депрессивности, тревожности и т.д., и, как минимум, количественная составляющая эффекта будет зависеть от временного интервала после введения блокатора. В рамках этой гипотезы в настоящей работе мы выясняли зависимость эффекта блокады моноаминоксидазы-В (МАО-В) от изначального уровня депрессивности крыс и времени от введения блокатора до начала тестирования животных.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось в 2 отдельных этапа: отборочный и экспериментальный (основной) и выполнено в период с 2021 по 2023 годы. Суммарно на отборочном этапе было протестировано 183 крысы линии Wistar (Филиал НИЦ «Курчатовский институт» – ПИЯФ – ПЛЖ «Рапполово») возрастом 7,5–8 месяцев, из которых отобраны 44 крысы-самца с уровнем индекса депрессивности (ИД) 0,36±0,012, далее «низкий уровень депрессивности»; 44 крысы-самца с ИД 0,51±0,007 – «средний уровень депрессивности» и 44 крысы-самца с ИД 0,82±0,022 – «высокий уровень депрессивности».
ИД рассчитывался по формуле (tобщее–tа)/tобщее, где tобщее – время тестирования в тесте Порсолта (5 мин), tа – суммарное время активного плавания. Смысловой подход такого расчета достаточно простой: чем дольше животное находится в состояния активного плавания, тем меньше уровень депрессивности. Следовательно, если tа=tобщее, то ИД минимален и равен нулю и, наоборот, если tа= 0, то ИД максимален и равен единице.
Отобранные животные внутри каждой группы соответствующего уровня депрессивности разделялись на 4 подгруппы по 11 особей: одной подгруппе на основном этапе осуществлялось внутрибрюшинное введение блокатора МАО-В селегилина в дозе 2,5 мг/кг (объем раствора 0,2 мл) за 1 час до тестирования, второй подгруппе – за 2 часа до тестирования, третьей подгруппе – за 3 часа до тестирования (рис. 1); и одна подгруппа являлась контрольной, животным которой внутрибрюшинно вводили физиологический раствор. Следует отметить, что первоначально было выделено три контрольные подгруппы и тестирование животных проводилось через 1 час, 2 часа и 3 часа после введения физиологического раствора. И по результату не обнаружились значимые отличия между этими контрольными подгруппами, ИД животных был, по сути, идентичным. Поэтому от такой «тройственности» контроля мы отказались и формировали одну контрольную подгруппу, крысы которой помещались в тест Порсолта через час после инъекции физиологического раствора.
Отметим, что между отборочным и основным этапами животные сформированных подгрупп находились в условиях вивария 10 дней, указанный промежуток времени считается приемлемым для социальной адаптации крыс.
Рис. 1. Схема экспериментального этапа.
В один исследовательский цикл тестировались 4 подгруппы низкодепрессивных животных (сентябрь – октябрь 2021 года), во второй (сентябрь – октябрь 2022 года) – 4 подгруппы среднедепрессивных и в третий (сентябрь – октябрь 2023 года) – 4 подгруппы высокодепрессивных животных.
Все этапы исследования проводились с соблюдением идентичности условий содержания животных, проводимых манипуляций и т.д. Крысы содержались в условиях вивария с длиной светового дня 12 часов, при температуре 20–24 0С, доступности питьевых растворов, корма (сухой корм ООО «Белгородские корма» ГОСТ 23469-2019), поддерживаемым вентилированием воздуха, для подстила в клетках использовался стандартизированный посуточный кукурузный подстил для грызунов от ООО «Зилубаг», животные обитали в стандартных клетках по 7 особей. Также, при манипуляциях с крысами соблюдались требования стерильности растворов, дозаторов, химической посуды и всех других использованных элементов. Для внутрибрюшинных инъекций использовали одноразовые шприцы по одному на каждую крысу. Также и по остальным критериям содержание животных и экспериментальные мероприятия с ними соответствовали установленным биоэтическим требованиям.
Из вивария в лабораторию этологии животные каждой группы переносились в 10.00, на протяжении часа они оставлялись в покое для адаптации к условиям лаборатории. В 11.00 начиналось введение селегилина и затем, с учетом временных интервалов (1, 2 и 3 часа после введения селегилина), тестирование животных в установке «тест Порсолта». Тестирование в тесте Порсолта полностью соответствовало классическому подходу: за день до основного тестирование 15 минут в установке температура воды 24 0С, в день тестирования – длительность 5 мин, температура воды 24 0С. Визуально схема экспериментального этапа представлена на рисунке 1.
Статистический анализ всех массивов осуществлялся в программе GraphPadPrism 8.0 c использованием описательной статистики, критерия Шапиро-Уилка, дисперсия массивов сравнивалась с помощью критерия Барлета, для множественного сравнения применялся дисперсионный анализ и критерий Тьюки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В настоящей работе изучалось изменение ИД в зависимости от длительности блокады МАО-В селигилином у крыс с изначально различным уровнем данного показателя: 0,32±0,13 у.е. – «низкий уровень депрессивности»; 0,56±0,007 у.е. – «средний уровень депрессивности» и 0,78±0,03 у.е. – «высокий уровень депрессивности». В связи с отмеченным, именно в такой последовательности и будут изложены результаты предложенного исследования. Первоначально укажем на то, что для каждого уровня депрессивности из 44 отобранных крыс (подробнее описано в методике) были сформированы четыре подгруппы, фоновые показатели которых подвергнуты статистическому анализу по критериям Шапиро-Уилка, Барлета и Тьюки. В результате нормальное распределение подтвердилось для всех групп во всех уровнях изначальной депрессивности, как по значениям времени активного плавания (tа), так и по ИД. Также, применение критерия Барлета показало однородность дисперсии (tа, ИД) и дисперсионный анализ с применением критерия Тьюки межгрупповых отличий не выявил (рис. 2).
Следовательно, животные всех групп в рамках своего изначального уровня депрессивности характеризовались однородностью, которая необходима для нивелирования артефакта «стартовых» отличий.
Итак, у животных с изначально низким уровнем ИД блокада центральной МАО-В селегилином в дозе 2,5 мг/кг не вызывала достоверных изменений уровня депрессивности (рис. 3). В контрольной группе у низкодепрессивных крыс ИД равнялся 0,36±0,021, спустя 1 час после введения селегилина ИД составлял 0,35±0,016, через 2 часа – 0,33±0,018, а через 3 часа – 0,30±0,029; без значимых отличий, как от контрольных значений, так и от значений ИД экспериментальных групп друг от друга.
Второй группой крыс, у которых исследовалась динамика ИД выступили животные с изначально средним уровнем депрессивности. Изменение ИД в зависимости от длительности блокады МАО-В селегилином у среднедепрессивных крыс представлена на рисунке 4. Видно, что достоверные изменения ИД выявлены только через 3 часа после введения селегилина. Рассмотрим всю динамику ИД у животных этой группы при блокаде МАО-В: контроль – 0,55±0,008; через 1 час после введения селегилина – 0,49±0,018; через 2 часа – 0,49±0,016; через 3 часа – 0,42±0,016 при р<0,001 по сравнению с контрольным уровнем и при р<0,05 по сравнению с ИД через 1 и 2 часа блокады МАО-В (рис. 4).
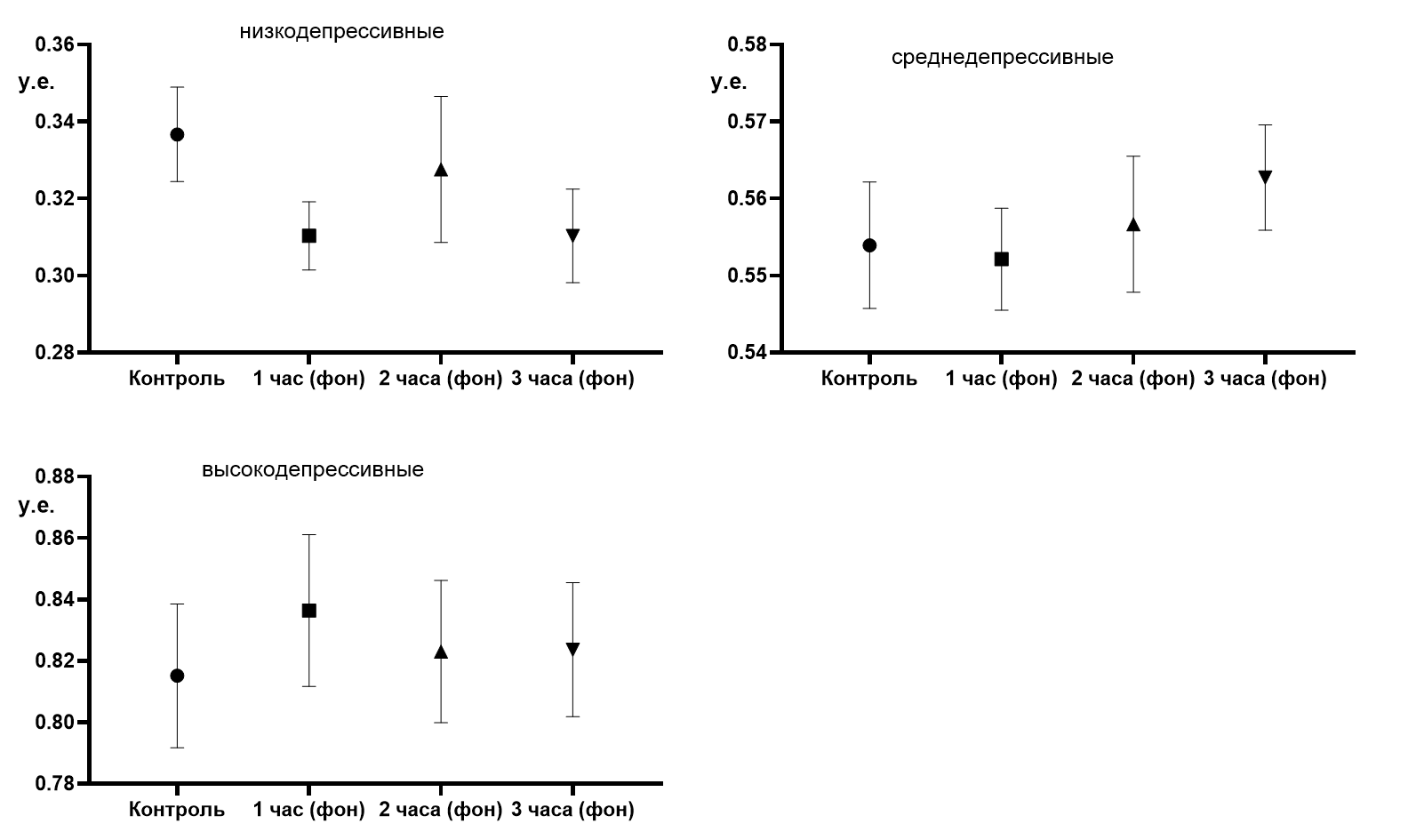
Рис. 2. Распределение фоновых значений индекса депрессивности в четырех группах в соответствующих уровнях изначальной депрессивности.
Примечания: контроль – значение индекса депрессивности в контрольной группе; 1 час (фон) – фоновые значения индекса депрессивности в группе крыс, у которых запланировано тестирование через 1 час после введения селегилина; 2 часа (фон) – через 2 часа после введения селегилина; 3 часа (фон) – через 3 часа после введения селегилина.
Третьей группой крыс, у которых исследовалась динамика ИД были животные с изначально высоким уровнем депрессивности. Изменение ИД в зависимости от блокады МАО-В селегилином у высокодепрессивных крыс представлено на рисунке 3. Из этого рисунка видно, что достоверные изменения ИД выявлены через 2 и 3 часа после введения селегилина. Рассмотрим всю динамику ИД у животных этой группы при блокаде МАО-В: контроль – 0,81±0,023; через 1 час после введения селегилина – 0,71±0,011 при р≤0,05 по сравнению с контролем; через 2 часа – 0,65±0,019 при р≤0,0001 и через 3 часа – 0,56±0,017 при р≤0,0001 по сравнению с контрольным уровнем (рис. 5). Также, ИД крыс после трехчасовой блокады МАО-В был достоверно ниже значений группы крыс с часовой длительностью блокады при р≤0,0001 и по сравнению с двухчасовой длительностью блокады МАО-В при р≤0,01.
Статистический анализ не выявил достоверных отличий ИД всех подгрупп у низкодепрессивных крыс ни от контрольного уровня, ни от уровня друг друга. Следовательно, у низкодепрессивных крыс блокада МАО-В не вызывает значимых изменений ИД. Возможно, у животных этой группы центральные элементы дофаминергической системы находятся в повышенном функциональном состоянии, обеспечивая изначально высокий уровень концентрации центрального дофамина. В следствии чего, его дальнейшее повышение в результате блокады МАО-В не вызывает значимого эффекта, т.к. подавляющее количество дофаминергических рецепторов и так уже связаны со своим естественным агонистом – дофамином.
Рис. 3. Показатели индекса депрессивности у низкодепрессивных крыс при различной длительности блокады МАО-В.
Примечания: фон – усредненные фоновые показатели трех групп крыс; 1 час – значение индекса депрессивности через 60 минут после введения (блокады МАО-В) селегилина; 2 часа – значение индекса депрессивности через 120 минут после введения (блокады МАО-В) селегилина; 3 часа – значение индекса депрессивности через 180 минут после введения (блокады МАО-В) селегилина.
У среднедепрессивных крыс достоверные отличия ИД при блокаде МАО-В наблюдаются только через три часа после введения селегилина, что мы связываем с постепенным накоплением дофамина, т.к. медиатор не расщепляется ферментом и значимое его накопление достигается при более длительной блокаде МАО-В, на что указывается и в литературных источниках [12].
Как мы и предполагали ИД у высокодепрессивных крыс оказался наиболее чувствителен к блокаде МАО-В селегилином и продемонстрировал достоверное снижение по сравнению с фоновым уровнем уже через 1 час после введения блокатора и этот эффект линейно усиливался пропорционально длительности блокады. Вероятно, у высокодепрессивных крыс изначальная концентрация центрального дофамина выраженно низкая и блокада МАО-В, приводящая к ее приросту, начинает значимо проявляться на более ранних этапах – уже через час блокады. Важно отметить, что ИД высокодепрессивных крыс при блокаде МАО-В не снижается до малых значений, а лишь приближается к среднему уровню, составляя через три часа блокады 0,56±0,017. Т.к., скорее всего, важна не только концентрация центрального дофамина, но и количество дофаминовых рецепторов, выраженность и значимость синаптических связей и т.д.
Рис. 4. Показатели индекса депрессивности у среднедепрессивных крыс при различной длительности блокады МАО-В.
Примечания: **** – отличия от фоновых значений при р≤0,0001; ● – отличия от значений ИД при длительности блокады МАО-В 1 час с уровнем значимости р<0,05; Δ – отличия от значений ИД при длительности блокады МАО-В 2 часа с уровнем значимости р<0,05; остальные обозначения, как и на рис. 3.
Рис. 5. Показатели индекса депрессивности у высокодепрессивных крыс при различной длительности блокады МАО-В.
Примечания: * – отличия от фоновых значений при р≤0,05; ●●●● – отличия от значений ИД при длительности блокады МАО-В 1 час с уровнем значимости р<0,0001; ΔΔ – отличия от значений ИД при длительности блокады МАО-В 2 часа с уровнем значимости р<0,01; остальные обозначения, как и на рис. 3.
Отметим, что в использованной дозе селегилина (2,5 мк/кг) значимо блокируется МАО-В, что приводит к повышению концентрации дофамина в стриатуме [13] и в области прилежащего ядра [14]. В силу чего, совершенно закономерно предполагать стимулирование мотивационного поведения, системы стремления к вознаграждению. И в исследованиях других авторов отмечается положительный эффект стимулирования дофаминергической системы на мотивационную сферу при депрессивных расстройствах [14, 15]. И в самых недавних исследованиях показано значимое увеличение содержания дофамина при использовании селигилина и эта активность проявляется, даже, у его метаболита [16]. Для селегилина обнаружена модулирующее влияние на активность гиппокампа и синаптическую пластичность, что также может лежать в основе психоэмоциональных эффектов и, в том числе, антидепрессантного 17]. Кроме того, в указанной дозе, селегилин способен блокировать и МАО-А (примерно 20 %) [12], что приводит к приросту содержания серотонина и наложению его эффекта на влияние дофамина. Вопросу о специфике влияния селегилина внимание более подробно уделено в нашей предыдущей публикации [6], и мы считаем, что важна не только доза, но и длительность блокады: при большей ее продолжительности усиливаются все эффекты, в том числе и «сопутствующие». Поэтому ИД может снижаться по факту непосредственного влияния блокады моноаминоксидазы на психоэмоциональную сферу, но и, в том числе, за счет активации двигательной активности крыс, например, при стимуляции стриатума. Но стимуляция двигательной активности, по крайней мере при однократном введении селигилина, как указывается в работах других авторов, наблюдается на уровне тенденции [18], либо, вообще, не наблюдается и, даже, немного снижается [19]. В том числе, в наших предыдущих работах мы не наблюдали усиление двигательной активности крыс в тестах открытое поле и крестообразный приподнятый лабиринт [6, 20].
ЗАКЛЮЧЕНИЕ
Выдвинутая нами гипотеза (см. введение) полностью подтвердилась: выяснено, что эффект блокады МАО-В имеет значимую зависимость от длительности блокады, а также связан с изначальным уровнем депрессивности. У низкодепрессивных крыс достоверных отличий ИД при блокаде МАО-В от контрольного уровня не выявлено; у среднедепрессивных крыс уже проявляются достоверные отличия ИД при блокаде МАО-В, но только через три часа после введения селегилина; а у высокодепрессивных животных – через 1, 2 и 3 часа блокады МАО-В. Предположительно в линейке от низкодепрессивных к высокодепрессивным крысам фоновый уровень активности дофаминергической системы снижается, а значит эффект повышения концентрации центрального дофамина в результате блокады МАО-В становиться более заметным.
Работа выполнена на оборудовании ЦКП «Экспериментальная физиология и биофизика» в рамках инициативной темы № АААА-А21-121011990099-6.
- Seeman P. Schizophrenia and dopamine receptors. Eur Neuropsychopharmacol., 23(9), 999 (2013). doi: 10.1016/j.euroneuro.2013.06.005. Epub 2013 Jul 13. PMID: 23860356.
- Gründer G., Cumming P. «The Dopamine Hypothesis of Schizophrenia». The Neurobiology of Schizophrenia. Elsevier, 109 (2016). doi:10.1016/b978-0-12-801829-3.00015-x
- Zhou Z. D., Yi L. X., Wang D. Q. et al. Role of dopamine in the pathophysiology of Parkinson’s disease. Transl Neurodegener, 12, 44 (2023). https://doi.org/10.1186/s40035-023-00378-6
- Ceyzériat K., Gloria Y., Tsartsalis S., Fossey C., Cailly T., Fabis F., Millet P., Tournier B. B. Alterations in dopamine system and in its connectivity with serotonin in a rat model of Alzheimer’s disease. Brain Commun. 10, 3(2), fcab029 (2021) doi: 10.1093/braincomms/fcab029. PMID: 34286270; PMCID: PMC8287930.
- Iasevoli F., Avagliano C., D’Ambrosio L., Barone A., Ciccarelli M., De Simone G., Mazza B., Vellucci L., de Bartolomeis A. Dopamine Dynamics and Neurobiology of Non-Response to Antipsychotics, Relevance for Treatment Resistant Schizophrenia: A Systematic Review and Critical Appraisal. Biomedicines., 14, 11(3), 895 (2023) doi: 10.3390/biomedicines11030895. PMID: 36979877; PMCID: PMC10046109.
- Khusainov D. R., Lukyantseva A. N., Tribrat N. S. [et al.] Six-day dynamics of anxiety index of highly anxious female rats under MAO-in blockade, Siberian Journal of Life Sciences and Agriculture., 15, 6, 29 (2023). DOI 10.12731/2658-6649-2023-15-6-958. EDN QEVHQN
- Schulz D., Henn F. A., Petri D. and Huston J. P. “Rats bred for helplessness exhibit positive reinforcement learning deficits which are not alleviated by an antidepressant dose of the MAO-B inhibitor deprenyl”, Neuroscience, 329, 83 (2016).
- Finberg J. P., Rabey J. M. Inhibitors of MAO-A and MAO-B in Psychiatry and Neurology. Front Pharmacol. 18, 7, 340 (2016) doi: 10.3389/fphar.2016.00340. PMID: 27803666; PMCID: PMC5067815.
- Tábi T., Vécsei L., Youdim M. B., Riederer P., Szökő É. Selegiline: a molecule with innovative potential. J Neural Transm (Vienna). 127(5), 831 (2020) doi: 10.1007/s00702-019-02082-0. Epub 2019 Sep 27. PMID: 31562557; PMCID: PMC7242272.
- Rossano F., Caiazza C., Sobrino A., Solini N., Vellucci A., Zotti N., Fornaro M., Gillman K., Cattaneo C. I., Van den Eynde V., Birkenhager T. K., Ruhé H. G., Stahl S., Iasevoli F., de Bartolomeis A. Efficacy and safety of selegiline across different psychiatric disorders: A systematic review and meta-analysis of oral and transdermal formulations. Eur Neuropsychopharmacol. 72, 60 (2023) doi: 10.1016/j.euroneuro.2023.03.012. Epub 2023 Apr 21. PMID: 37087864.
- Mahmood I. Clinical pharmacokinetics and pharmacodynamics of selegiline, Clinical pharmacokinetics. 33, 2, 91 (1997).
- Borbe H. O., Niebch G., Nickel B. Kinetic evaluation of MAO-B-activity following oral administration of selegiline and desmethyl-selegiline in the rat, Journal of Neural Transmission, Amine Oxidases and Their Impact on Neurobiology / P. Riederer and M. B. H. Youdim (eds.) // Proceedings of the 4th International Amine Oxidases Workshop, Wurzburg, Federal Republic of Germany, July 7-10, 131 (Springer-Verlag, Wien – New York, 1990). DOI: 10.1007/978-3-7091-9113-2_18
- Heikkila R. E., Terleckyj I., Sieber B. A. Monoamine oxidase and the bioactivation of MPTP and related neurotoxins: relevance to DATATOP / Journal of Neural Transmission / Amine Oxidases and Their Impact on Neurobiology / P. Riederer and M. B. H. Youdim (eds.) // Proceedings of the 4th International Amine Oxidases Workshop, Wurzburg, Federal Republic of Germany, July 7-10, 217 (Springer-Verlag, Wien – New York, 1990). DOI: 10.1007/978-3-7091-9113-2_32
- Yohn S. E., Reynolds S., Tripodi G., Correa M., Salamone J. D., The monoamine-oxidase B inhibitor deprenyl increases selection of high-effort activity in rats tested on a progressive ratio/chow feeding choice procedure: Implications for treating motivational dysfunctions, Behav Brain Res., 16, 342, 27 (2018). doi: 10.1016/j.bbr.2017.12.039
- Pardo M., López-Cruz L., San Miguel N., Salamone J. D., Correa M. Selection of sucrose concentration depends on the effort required to obtain it: studies using tetrabenazine, D1, D2, and D3 receptor antagonists, Psychopharmacology (Berl)., 232(13), 23, 77 (2015). doi: 10.1007/s00213-015-3872-7
- Harsing LG. Jr, Timar J., Miklya I. Striking Neurochemical and Behavioral Differences in the Mode of Action of Selegiline and Rasagiline. Int J Mol Sci., 28, 24(17), 13334 (2023) doi: 10.3390/ijms241713334. PMID: 37686140; PMCID: PMC10487936.
- Ishikawa T., Okano M., Minami A., Tsunekawa H., Satoyoshi H., Tsukamoto Y., Takahata K., Muraoka S. Selegiline ameliorates depression-like behaviors in rodents and modulates hippocampal dopaminergic transmission and synaptic plasticity. Behav Brain Res., 359, 353 (2019) doi: 10.1016/j.bbr.2018.10.032. Epub 2018 Oct 22. PMID: 30359642.
- Shimazu, S., Minami, A., Kusumoto, H., & Yoneda, F. Antidepressant-like effects of selegiline in the forced swim test. European neuropsychopharmacology, 15(5), 563 (2005).
- Nowakowska E., Kus K., Chodera A., & Rybakowski J. Investigating potential anxiolytic, antidepressant and memory enhancing activity of deprenyl. J Physiol Pharmacol, 52(4 Pt 2), 863 (2001).
- Birukova Elena & Khusainov Denis & Chajka Andrew & Tribrat Natalia & Dzhemalyadinova Zera & Dmitrenko Natalia & Chornobay Svitlana. Participation of dopaminergic system in the dynamics of behavioral reactions of aging rats of both sexes under daily testing in the open field. BIO Web of Conferences. 30, 06003 (2021). 10.1051/bioconf/20213006003.

