CHANGES IN THE TOTAL BIOELECTROGENESIS OF NEURONS IN VARIOUS ZONES OF THE RAT HIPPOCAMPUS DURING THEIR PERFUSION WITH ACETYLSALICYLIC ACID SOLUTION
ИЗМЕНЕНИЕ СУММАРНОГО БИОЭЛЕКТРОГЕНЕЗА НЕЙРОНОВ
РАЗЛИЧНЫХ ЗОН ГИППОКАМПА КРЫС ПРИ ИХ ПЕРФУЗИИ РАСТВОРОМ АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №2, 2024
Publication text (PDF):Download
UDK: 612.822:615.212.3
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Khusainov D. R., Federal V.I. Vernadsky Crimean University, Simferopol, Russia
Tribrat N. S., Federal V.I. Vernadsky Crimean University, Simferopol, Russia
Chuyan E. N., Federal V.I. Vernadsky Crimean University, Simferopol, Russia
Tumanyants K. N., Federal V.I. Vernadsky Crimean University, Simferopol, Russia
Lazaryan N. A., Federal V.I. Vernadsky Crimean University, Simferopol, Russia
Bukov Yu. A., Federal V.I. Vernadsky Crimean University, Simferopol, Russia
Ablyakimova V. L. MB UDO «Raduga», Simferopol, Republic of Crimea, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-2-223-231
PAGES:from 223 to 231
STATUS:Published
LANGUAGE:Russian
KEYWORDS: acetylsalicylic acid, hippocampus, biopotentials.
ABSTRACT (ENGLISH):
The preparation of the surviving sections of the rat brain and the composition of the solutions corresponded to the generally accepted methodology. To register the biopotentials, the drug was placed in a specialized bath with a continuous flow (2 ml/min) of an oxygenated aCSF solution. The direct registration of extracellular total biopotentials was carried out using a Model 2400 A-M System amplifier, and the digitization of the signal was carried out with an analog–to-digital converter CED 1401 Micro3. The temperature of the washing solution was maintained at 370 With a thermal controller TC-324C. Extracellular network activity was recorded in the zones CA1, CA3 and CA4 of the rat hippocampus. The results of the study demonstrate the same type of inhibitory neurotropic effect of acetylsalicylic acid in all studied areas of the rat hippocampus. In the CA1 zone, perfusion of the slice with acetylsalicylic acid solution at a concentration of 10-3 M caused a decrease in the average amplitude of total extracellular potentials from 51.92±1.91 MV to 22.86±1.48 MV (p≤0.001); in the CA3 zone – from 61.60±2.68 MV to 25.02±1.54 MV (p≤0.001); in the CA4 zone – from 50.94±1.84 MV to 24.15±1.51 MV (p≤0.001). The indicator of the frequency-amplitude distribution of biopotentials also changed unidirectionally: in all zones, only a low-amplitude spectrum of biopotentials in the range of 20–40 MV or less was recorded.
The results of this study convincingly demonstrate the unidirectional depressing neurotropic effect of acetylsalicylic acid, which is realized in zones CA1, CA3 and CA4. The effect of acetylsalicylic acid, of course, had quantitative differences depending on the hippocampal zone, but not qualitative. Also, the results of the neurotropic effects of acetylsalicylic acid obtained on mammalian neurons, in their depressing orientation, coincide with those previously obtained on the nervous system of invertebrates [1, 2].
Another interesting aspect of the work is the following fact: the use of acetylsalicylic acid affects the arachidonic acid cycle by blocking cyclooxygenases. At the same time, in high concentrations (about 10-3 M), aspirin blocks two types of the enzyme cyclooxygenase-1 and cyclooxygenase-2 [6]. Therefore, the observed effects may be due to the blockade of cyclooxygenases. We also believe that suppression of ATP synthesis plays an important role in the neurotropic effects of acetylsalicylic acid [2]. Consequently, the results obtained can also be interpreted as the effect of pronounced blockade of cyclooxygenases and ATP synthesis. This assumption is based on literary sources, in which the authors point to the importance of the arachadic acid system in the functioning of neurons and neural networks [7–9]. In addition, it is well known that the hippocampus is involved in providing higher cognitive functions, including memory processes, and the dentate gyrus plays an important role [10]. Therefore, it becomes interesting to investigate the effects of acetylsalicylic acid in the DG region, which is planned by us in subsequent works.
Let us present our considerations concerning a possible biophysical mechanism that inhibits the neurotropic effect of acetylsalicylic acid. We consider two options to be the most likely: the first is the suppression of NMDA–dependent processes and the second is the activation of GABA-dependent chlorine conduction. The described assumption is a working hypothesis for our further research.
ВВЕДЕНИЕ
В наших предыдущих исследованиях на нервной системе беспозвоночных было показано, что салицилаты оказывают угнетающее влияние на биоэлектрогенез идентифицированных нейронов моллюска [1, 2]. Также высказывалось мнение о возможности торможения синаптической передачи под влиянием салициловой кислоты и, возможно, ацетилсалициловой кислоты. Наши исследования и предположения находили отражение и в работах других авторов. Так, в конце прошлого столетия М. Дейл и Дж. Формен констатировали факт снижения скорости проведения по нервным отросткам в периферических отделах нервной системы под влиянием аспирина [3].
В недавних исследованиях нами было показано угнетающее влияние некоторых салицилатов на суммарный биоэлектрогенез нейронов гиппокампа [4]. При этом, в гиппокампе выделяют целый ряд зон и закономерно возникает вопрос о специфике влияния ацетилсалициловой кислоты на нервные клетки различных зон гиппокампа.
В связи с указанным в настоящем исследовании мы изучали эффекты ацетилсалициловой кислоты на биоэлектрогенез нейронов зон СА1, СА3 и СА4 гиппокампа крыс.
МАТЕРИАЛЫ И МЕТОДЫ
Для приготовления in vitro препаратов переживающих срезов гиппокампа использовались лабораторные крысы линии Wistar возрастом 6–8 месяцев. После декапитации мозг животного извлекался и помещался в охлажденный (4° С) раствор искусственной цереброспинальной жидкости (aCSF) следующего состава (в мМ): NaCl 126, KCl 3.5, CaCl2 2.0, MgCl2 1.3, NaHCO3 25, NaH2PO4 1.2, глюкоза 11 (pH 7.4), насыщенный кислородом (95 %) и углекислым газом (5 %). Далее удалялся мозжечок и приготавливались на микротоме Ci 7000 SMZ-2 Campden Instruments горизонтальные срезы гиппокампа толщиной 400 мкм. Полученные срезы рассекались на две полусферы и готовые препараты помещаются в оксигенированный (95 % O2/5 % CO2) раствор aCSF, где выдерживаются при комнатной температуре (20–22° С) около часа перед непосредственным использованием в эксперименте.
Для регистрации биопотенциалов препарат размещался в специализированной ванночке с непрерывным потоком (2 мл/мин) оксигенируемого раствора aCSF. Непосредственная регистрация внеклеточных суммарных биопотенциалов осуществлялась с помощью усилителя Model 2400 A-M System, оцифровка сигнала – аналогово-цифровым преобразователем CED 1401 Micro3. Температура омывающего раствора поддерживалась на уровне 370 С термоконтроллером
ТС-324С. Внеклеточная сетевая активность регистрировалась в зонах СА1, СА3 и СА4 гиппокампа крыс.
Следует сказать, что при определении зон гиппокампа мы пользовались общим принципом картирования и, в частности, представленным Gordon R. (рис. 1).
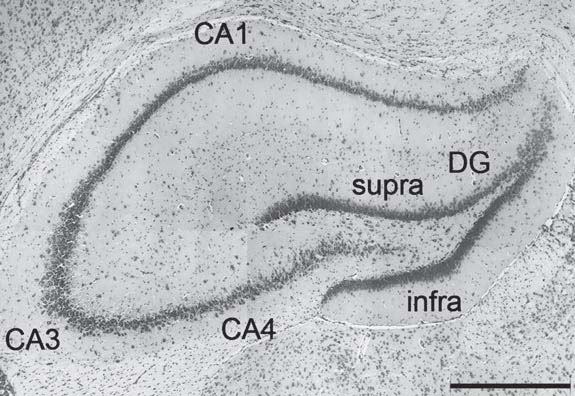
Рис. 1. Микрофотография сечения гиппокампа мозга крысы по Gordon R., 2017 [5].
Примечания: «supra» и «infra» обозначают верхнюю и нижнюю пирамидальные лопасти зубчатой фасции (извилины, DG); СА1, СА3, СА4 – обозначения полей (зон) гиппокампа; масштаб 500 мкм.
Ацетилсалициловая кислота (Merсk) перфузировалась в концентрации 10-3 М, непосредственно перфузия раствором кислоты длилась 10 минут, далее следовало тридцатиминутное отмывание. Запись суммарной внеклеточной активности для каждой из зон записывалась от 20 полусфер переживающих срезов гиппокампа. Запись и анализ нейрограмм осуществлялись с помощью программного пакета Spike2 8.10а. Для частотно-амплитудного анализа потенциалы были разделены на пять диапазонов 20–40 мкВ, 41–60 мкВ, 61–80 мкВ, 81–100 мкВ и более 100 мкВ (101+). Статистический анализ осуществлялся с использованием критерия Шапиро-Уилка и Т-критерия Стьюдента для зависимых выборок при попарном сравнении и критерия Тьюки при множественном сравнении.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В настоящем исследовании при внеклеточном отведении регистрировались суммарные биопотенциалы нервных клеток гиппокампа крыс в зонах СА1, СА3 и СА4 при перфузии срезов растворами ацетилсалициловой кислоты в концентрации 10-3 М.
Начнем рассмотрение полученных результатов с описания эффектов ацетилсалициловой кислоты при отведении биопотенциалов от зоны СА1.
На рисунке 2 представлены два фрагмента нейрограмм суммарных биопотенциалов нейронов гиппокампа крысы зоны СА1. Из представленных отрезков записи суммарной гальванической активности нервных клеток гиппокампа крысы в области СА1 внеклеточным электродом четко видно, что в условиях перфузии среза раствором аспирина в концентрации 10-3 М последняя серьезно подавляется. По сути, остаются только низкоамплитудные потенциалы.
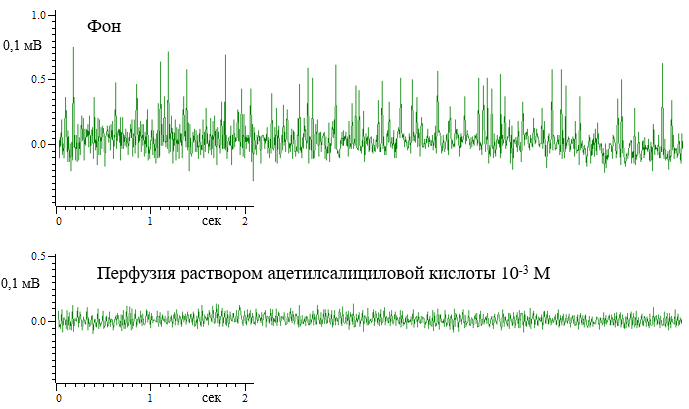
Рис. 2. Отрезки нейрограммы суммарных биопотенциалов нервных клеток СА1 зоны гиппокампа в фоне и при перфузии среза раствором ацетилсалициловой кислоты в концентрации 10-3 М.
Представим частотно-амплитудный анализ суммарных внеклеточных биопотенциалов зоны СА1 при перфузии срезов раствором ацетилсалициловой кислоты в концентрации 10-3 М. Итак, указанная кислота выраженно подавляла генерацию биопотенциалов, вызывая значительное снижение их средней амплитуды (рис. 3 А) от 51,92±1,91 мкВ до 22,86±1,48 мкВ (р≤0,001) через 10 минут от начала перфузии. После 30 минут отмывания средняя амплитуда биопотенциалов частично восстанавливалась до 36,36±2,46 мкВ (р≤0,01), но все еще оставалась достоверно меньшей по сравнению с фоновым показателем.
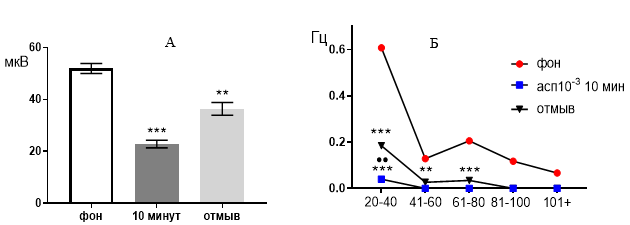
Рис. 3. Значение средней амплитуды (А) и частотно-амплитудное распределение (Б) суммарных биопотенциалов нервных клеток зоны СА1 при перфузии среза гиппокампа раствором ацетилсалициловой кислоты в концентрации 10-3 М.
Примечания: ** – отличия показателя от фонового уровня при р≤0,01, *** – отличия показателя от фонового уровня при р≤0,001, •• – отличия показателя от его значения после 30-ти минутного отмывания при р≤0,01, асп10-3 10 мин – значение показателя на десятой минуте перфузии среза раствором ацетилсалициловой кислоты в концентрации 10-3 М, отмыв – значение показателя после 30-ти минутного отмывания.
При рассмотрении частотно амплитудных характеристик биопотенциалов видно, что в фоне выделяются все пять типов потенциалов с амплитудой 20–40 мкВ, 41–60 мкВ, 61–80 мкВ, 81–100 мкВ и более 100 мкВ (рис. 3 Б). Частоты этих потенциалов распределились следующим образом: 0,60±0,0083 Гц, 0,12±0,0056 Гц, 0,20±0,012 Гц, 0,11±0,0052 Гц, 0,06±0,0024 Гц. Через 10 минут перфузии активность среза существенно подавляется и оставались только биопотенциалы с наименьшей амплитудой 20–40 мкВ, а их частота снижалась до 0,040±0,003 Гц (р≤0,001).
Эффекты ацетилсалициловой кислоты при отведении биопотенциалов от зоны СА3 практически ничем не отличались от обнаруженных в зоне СА1.
В концентрации 10-3 М ацетилсалициловая кислота подавляла генерацию биопотенциалов, вызывая значительное снижение средней амплитуды (рис. 4 А) от 61,60±2,68 мкВ до 25,02±1,54 мкВ (р≤0,001) через 10 минут от начала перфузии. После 30 минут отмывания средняя амплитуда биопотенциалов частично восстанавливалась до 37,86±2,38 мкВ (р≤0,01).
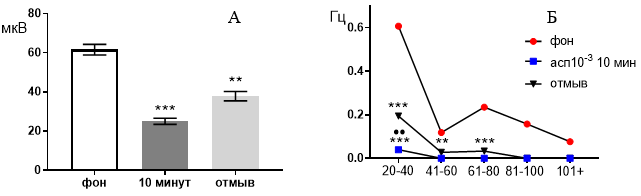
Рис. 4. Значение средней амплитуды (А) и частотно-амплитудное распределение (Б) суммарных биопотенциалов нервных клеток зоны СА3 при перфузии среза гиппокампа раствором ацетилсалициловой кислоты в концентрации 10-3 М.
Примечания: обозначения, что и на рисунке 3.
Частотно амплитудные характеристики биопотенциалов в фоне распределились следующим образом: 0,62±0,0081 Гц, 0,11±0,0052 Гц, 0,23±0,018 Гц, 0,15±0,0054 Гц, 0,07±0,0024 Гц (рис. 4 Б). Через 10 минут перфузии активность среза существенно подавляется и оставались только биопотенциалы с наименьшей амплитудой
20–40 мкВ, а их частота снижалась до 0,028±0,003 Гц (р≤0,001).
Эффекты ацетилсалициловой кислоты при отведении биопотенциалов от зоны СА4 качественно не отличались от обнаруженных в зонах СА1 и СА3.
В концентрации 10-3 М ацетилсалициловая кислота в зоне СА4 также, как и в двух предыдущих зонах подавляла генерацию биопотенциалов, вызывая значительное снижение средней амплитуды (рис. 5 А) от 50,94±1,84 мкВ до 24,15±1,51 мкВ (р≤0,001) через 10 минут от начала перфузии. После 30 минут отмывания средняя амплитуда биопотенциалов частично восстанавливалась до 37,54±2,23 мкВ (р≤0,01).
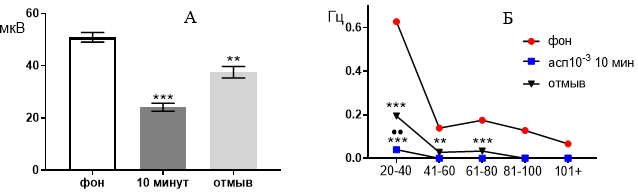
Рис. 5. Значение средней амплитуды (А) и частотно-амплитудное распределение (Б) суммарных биопотенциалов нервных клеток зоны СА4 при перфузии среза гиппокампа раствором ацетилсалициловой кислоты в концентрации 10-3 М.
Примечания: обозначения, что и на рисунке 3.
Частотно амплитудные характеристики биопотенциалов в фоне распределились следующим образом: 0,63±0,0078 Гц, 0,13±0,0057 Гц, 0,21±0,012 Гц, 0,12±0,0051 Гц, 0,06±0,0025 Гц (рис. 5 Б). Через 10 минут перфузии активность среза существенно подавляется и оставались только биопотенциалы с наименьшей амплитудой
20–40 мкВ, а их частота снижалась до 0,028±0,003 Гц (р≤0,001).
Отдельно следует указать на то, что при действии ацетилсалициловой кислоты в первую очередь подавляются (исчезают) суммарные биопотенциалы высокоамплитудного спектра от 60 мкВ и более. В случае внеклеточного отведения амплитуда потенциалов определяется количеством относительно синхронно активирующихся нейронов, а значит под действием кислоты их количество в единицу времени существенно сокращается.
Еще одним интересным аспектом работы выступает следующий факт: применение ацетилсалициловой кислоты влияет на цикл арахидоновой кислоты, осуществляя блокаду циклооксигеназ (ЦОГ). При этом, в высоких концентрациях (порядка 10-3 М) аспирин блокирует два типа фермента ЦОГ-1 и ЦОГ-2 [6]. Поэтому наблюдаемые эффекты могут быть обусловлены блокадой ЦОГ. Также, считаем, что немаловажную роль в нейротропных эффектах ацетилсалициловой кислоты играет подавление синтеза АТФ [2]. Следовательно, полученные результаты можно интерпретировать и как эффект выраженной блокады ЦОГ и синтеза АТФ. Такое предположение находит основания в литературных источниках, в которых авторы указывают на значимость системы арахадиновой кислоты в функционировании нейронов и нейронных сетей [7–9]. Кроме того, общеизвестно, что гиппокамп участвует в обеспечении высших когнитивных функций, в том числе процессах памяти и немаловажную роль играет зубчатая извилина [10]. Поэтому становится интересным исследовать эффекты влияния ацетилсалициловой кислоты в области DG, что планируется нами в последующих работах.
ЗАКЛЮЧЕНИЕ
Результаты настоящего исследования убедительно демонстрируют однонаправленный угнетающий нейротропный эффект ацетилсалициловой кислоты, который реализуется в зонах СА1, СА3 и СА4. Эффект ацетилсалициловой кислоты, конечно, имел количественные отличия в зависимости от зоны гиппокампа, но не качественные. Также, результаты нейротропного воздействия ацетилсалициловой кислоты, полученные на нейронах млекопитающих, по своей угнетающей направленности совпадают с ранее полученными на нервной системе беспозвоночных [1, 2].
Представим наши соображения, которые касаются возможного биофизического механизма эффектов ацетилсалициловой кислоты. Наиболее вероятными мы считаем два варианта, первый – это подавление НМДА-зависимых процессов и второй – активация ГАМК-зависимой хлорной проводимости. Описанное предположение является рабочей гипотезой для наших дальнейших исследований.
Работа выполнена на оборудовании ЦКП «Экспериментальная физиология и биофизика» в рамках темы № АААА-А21-121011990099-6.
- Korenyuk I. I., Husainov D. R., Shulgin V. F. Effects of salicylic acid and its salts on electrical activity of neurons of helix albescens, Neurophysiology, 37, 127 (2005).
- Cheretaev I. V., Korenyuk I. I., Khusainov D. R., Gamma T. V., Kolotilova O. I., Nozdrachev A. D. ATP-dependent And Calcium Mechanisms of the Effects of Salicylates on Electrical Potentials in Neurons in the Mollusk Helix Albescens, Neuroscience and behavioral physiology, 46, 6, 644 (2016).
- Handbook of immunopharmacology: Translated from English, Edited by M.M. Dale, J. K. Formen, 332 (M.: Medicine, 1998).
- Khusainov D. R., Korenyuk I. I., Ablyakimova V. L. Frequency-amplitude characteristics of the total biopotentials of the hippocamp CA3 zone under the influence of acetylcalicinic and salicylic acids, IOP Conference Series: Earth and Environmental Science, 853(1), 012023 (2021).
- Gordon R., Podolski I., Makarova E., Deev A., Mugantseva E., Khutsyan S., Sengpiel F., Murashev A., Vorobyov V. Morpho-functional analysis of intrahippocampal pathways involved in learning/memory mechanisms affected by intracerebral infusions of amyloid-beta 25-35 peptide and hydrated fullerene C60 in rats, J Alzheimers Dis, 58(3), 711 (2017).
- Mashkovsky M. D. Medicinal products: 16 ed. in 2 volumes, 1216 (M.: New Wave Publishing House, 2020).
- Hadley K. B., Ryan A. S., Forsyth S., Gautier S., & Salem N. The essentiality of arachidonic acid in infant development, Nutrients, 8(4), 216 (2006).
- Tallima H., El Ridi R. Arachidonic acid: Physiological roles and potential health benefits, A review. J Adv Res., 11, 33 (2017).
- Docosahexaenoic acid (DHA) and arachidonic acid (ARA) balance in developmental outcomes, D. John Colombo, Shaddy Jill, Elizabeth H. Kerling [et. al], Prostaglandins, Leukotrienes and Essential atty Acids (PLEFA), 121, 6, 52 (2017).
- Kitchigina V. F. Shubina L. V., Popova I. Yu. The role of the dentate gyrus in the implementation of the hippocampal functions: healthy brain, I. P. Pavlov journal of higher nervous activity, 72, 3, 317 (2022).

