A NEW APPROACH TO DETERMINING THE BIOCONTROLLING EFFICACY OF MICROMYCETE STRAINS ON THE EXAMPLE OF TRICHODERMA SP.
Новый подход к определению биоконтролирующей эффективности штаммов микромицетов на примере Trichoderma sp.
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №4, 2024
Publication text (PDF):Download
UDK 632.911.2
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Sidyakin A. I., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
Chmelyova S. I., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
Dzheldubaeva E. R., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
Tumanyants K. N., V. I. Vernadsky Crimean Federal University, Simferopol, Russia
Belousov V. V. V. I. Vernadsky Crimean Federal University, Simferopol, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-4-182-195
PAGES:from 182 to 195
STATUS:Published
LANGUAGE:Russian
KEYWORDS: micromycetes, Trichoderma, biological efficacy, phytopathogenic fungi.
ABSTRACT (ENGLISH):
The article describes a new modification of the approach to the study of the antagonistic activity of microorganisms on the example of Trichoderma longibrachiatum GF 2/6, J2 30 Brz and Za 3/19 GF and various phytopathogenic micromycetes. Based on the study of the antagonistic activity of twenty-one new strains of Trichoderma against fifteen strains of phytopathogenic fungi, using a modified method of perpendicular strokes and the use of Henderson-Tilton formulas to calculate the biological efficacy of the strain in suppressing pathogens, as well as the pathogen growth suppression index, new highly effective strains of Trichoderma were selected that suppress the growth of a wide range of pathogens of various mycoses of plants. It is shown that the biological efficacy and ability to inhibit the growth of colonies of phytopathogenic micromycetes of the genera Fusarium, Aspergillus, Penicillium, Alternaria in new strains of Trichoderma varies. Strains of Trichoderma Nos 1, 3, 5, 20, 21 except phytopathogens Fusarium sp. 81(1), Fusarium sp. MO 1-01a, Penicillium sp. 173(2), Aspergillus fumigatus, Aspergillus clavatus actively reduce the growth rate of colonies of Aspergillus fumigatus 97 (1). Trichoderma strains Nos 8, 10, 11, 12, 13 inhibits more effectively the growth of phytopathogens Fusarium sp. 84(2), Fusarium sp. 1-01-a, Fusarium sp. fragaria, Fusarium sp. 59 (2), Alternaria alternata , and, in addition to these phytopathogens, actively reduce the growth rate of colonies of Fusarium sporotrichioides BR — 1 — 1. Strains of Trichoderma Nos 8, 10, 11, 12, 13, inhibits more effectively the growth of phytopathogens Fusarium sp. 84(2), Fusarium sp. 1-01-a, Fusarium sp. fragaria, Fusarium sp. 59 (2), Alternaria alternata, and, in addition to these phytopathogens, actively reduce the growth rate of colonies of Fusarium sporotrichioides BR — 1 — 1.Thus, the paper proposes two options for assessing the antagonistic (biological, biocontrol) activity of Trichoderma strains: the index of change in the size of the phytopathogen colony of the control variant of its cultivation in the absence of Trichoderma, calculated on the first and fourth days of cultivation in order to select effectively suppressing strains of Trichoderma; the biological efficacy index allows to quantify the antagonism of individual strains of Trichoderma in order to select the most effective strain.
ВВЕДЕНИЕ
Грибы рода Trichoderma хорошо известны как широко применяемый в различных отраслях промышленности агент. Представители данного рода известны как продуценты различных гликозил-гидролаз (карбогидразы, гликозидазы), как источник антибактериальных соединений, используются в производстве биопрепаратов для защиты растений от болезней и стимуляции их роста и урожайности [1, 2]. Показано, что одним из факторов, который способствует их полезной биологической активности, связан с большим разнообразием метаболитов, которые они производят, которые позволяют растению противодействовать заболеванию с помощью компенсаторного усиленного вегетативного роста систем корней и побегов [3].
Наиболее широко используемыми видами в различных отраслях промышленности являются следующие виды: при производстве гликозил-гидролаз производственного назначения используются виды Trichoderma longibrachiatum Rifai, а в сельскохозяйственной биотехнологии в части защиты растений от фитопатогенов используют виды: Trichoderma harzianum Rifai (синоним – Trichoderma inhamatum Veerkamp & W. Gams); Trichoderma virens (Miller, Giddens & Foster) Arx; Trichoderma asperellum Samuels, Liechfeldt & Nirenberg; Trichoderma koningii Oudem; Trichoderma lignorum Harz (синонимы – Trichoderma glaucum E.V. Abbott; Trichoderma strictipile Bissett; Trichoderma viride Persoon) [4].
В результатате многолетней научно-исследовательской работы в НПО Биотехсоюз были получены штаммы Trichoderma longibrachiatum Rifai, обладающие биоконтролирующими свойствами в отношении ряда фитопатогенных микромицетов – возбудителей микозов сельскохозяйственных культур [5]. Штаммы Trichoderma longibrachiatum являются основой биопрепарата ТрихоПлант,, но в связи с поиском новых более эффективных штаммов триходермы, и развивающейся устойчивостью к ним штаммов фитопатогенных микроорганизмов, встает вопрос о поиске новых вариантов штаммов этого вида микромицетов, с повышенной биологической активностью в отношении подавления фитопатогенов, в связи с чем вопрос оценки антагонистической активности новых штаммов триходермы имеет как теоретическое так и практическое значение.
В связи с вышесказанным, целью настоящей работы являлось адаптация известного методического подхода оценки биологической эффективности штаммов микроорганизмов-антагониcтов на примере различных штаммов Trichoderma sp.
МАТЕРИАЛЫ И МЕТОДЫ
Определение биоконтролирующей эффективности, антагонистической активности и типа взаимодействия фитопатогенов и триходермы проводили предлагаемой модифицированной нами варианте метода параллельных штрихов (метод параллельных подсевов).
Подготовка культур. Для получения конидий или мицелиальной массы фитопатогены культивировали в течение 7–14 суток на поверхности скошенного картофельно-глюкозного агара (КГА) [6]. Экспериментальную часть по исследованию антагонизма и биоконтролирующих свойств триходермы в отношении патогенных микромицеты проводили так же с использованием среды КГА.
Суспензию конидий (или фрагментов мицелия) фитопатогенов (на третьи – пятые сутки спороношения) готовили путем смывов с поверхности скошенного КГА раствором содержащим 0,5 % NaCl, 0,01 % K2HPO4, 0,02 % KH2PO4, 0,01 % MgCl2×6Н2О, по 0,5 % глюкозы и сахарозы и 0,25 % полисорбата-80.
Полученной суспензией фрагментов мицелия и спор фитопатогенов с титром не менее 1,0 млн КОЕ/см3 смачивали полоски фильтровальной бумаги размерами 20×5 мм.
Штаммы Trichoderma для эксперимента так же выращивали на скошенном КГА-агаре в течение 5–7 суток. Конидии смывали используя тот же состав, что и для фитопатогенов. Для посева в чашки с фитопатогенами титр конидий штаммов триходермы доводили до 1–5 тыс. КОЕ/см3 (т.е. на три порядка меньше, чем используемые фитопатогены).
Методика проведения эксперимента. В чашку Петри (диаметр чашки – 9 см), на равном расстоянии от краев (1 см) и центра (3,5) чашки, по шаблону (рис. 1) на поверхность подсушенного картофельно-глюкозного агара помещали по три высечки из фильтровальной бумаги размерами 20,0×5,0 мм, смоченных споровой взвесью исследуемого фитопатогена с титром спор не менее 2×106 КОЕ/мл.
б
в
г
а
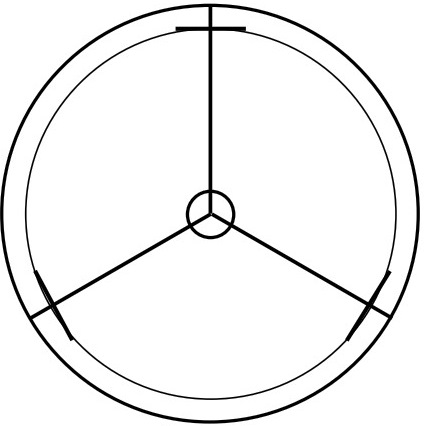
Рис. 1. Шаблон-схема используемая для определения антагонистической активности Trichoderma sp. в отношении фитопатогенных микромицетов: а – место размещения диска с диаметром 6 мм с суспензией конидий триходермы; б, в г , – места размещения полосок 20×5 мм с фитопатогенными микромицетами.
Т.к. в природной среде микробные культуры никогда не растут в виде монокультур, то в одну чашку помещали три разных фитопатогена. В центр чашки петри помещали диск, диаметром 6,0 мм, смоченный взвесью спор исследуемого штамма триходермы с титром спор не более 2×105 КОЕ/мл (опыт); или не помещали ничего (контроль). Повторность опытов пятикратная.
Культуры микромицетов. В эксперименте использовали штаммы Trichoderma собственной селекции полученные по оригинальной методике [7], и пятнадцать штаммов фитопатогенов – возбудителей микозов сельскохозяйственных культур из собственной коллекции фитопатогенных микромицетов, выделенных от растений с признаками тех или иных заболеваний: выделенных от растений с признаками тех или иных заболеваний: Fusarium sp. 84 (2), Fusarium sporotrichioides БР – 1 — 1, Fusarium sp. 1 — 01 – a, Fusarium sp. fragaria, Fusarium sp. 59 (2), Alternaria alternata, Fusarium sp. 81(1), Fusarium sp. MO 1-01a, Penicillium sp. 173(2), Aspergillus fumigatus, Aspergillus clavatus, Aspergillus fumigatus 97(1), Aspergillus flavus 2016, Aspergillus flavus R., Penicillium viridicatum.
Оценка биоконтролирующих и антагонистических свойств. После инокуляции чашки устанавливали в термостат, культивировали при 25 оС. Спустя одни и четверо суток замеряли диаметр колонии фитопатогена в двух взаимно перпендикулярных плоскостях и на основании того, что рост колонии фитопатогена изодиаметрален, а используемый инокулят – прямоугольный; то с помощью формулы площади эллипса по измеренным линейным размерам колонии фитопатогена рассчитывали его площадь колонии по формуле площади эллипса.
Антагонистическую (биологическую, биоконтролирующую) активность штаммов триходермы в отношении фитопатогенных микроорганизмов оценивали с использованием двух критериев: первый критерий – индекс изменения размеров (Ир) колонии фитопатогена на первые и четвертые сутки совместного культивирования, выраженная в процентах, относительно размеров колонии этого же фитопатогена в контроле – т.е. в отсутствии штамма триходермы (формула 1).
[1]
![]()
![]()
где: Ир – индекс изменения размеров колонии фитопатогена, Оп – площадь колонии фитопатогена в опытном варианте (т.е. при совместном с триходермой культивировании); К – площадь колонии фитопатогена в контрольном варианте (т.е. в отсутствии триходермы); 100 – коэффициент пересчета данный в проценты.
Показатель Ир рассчитывали для первых и четвертых суток совместного с триходермой (опыт), или без триходермы (контроль) варианта культивирования, что в дальнейшем позволило построить графики выражающие направленность изменения размеров колоний фитопатогенов, которые отражают направленность взаимоотношений триходерма-фитопатоген.
Второй использованный нами критерий – биологическая эффективность (BE) штамма триходермы т.е его способность подавлять рост колоний данного фитопатогена, которую определяли с использованием модифицированной формулы Хендерсона-Тилтона [8] (формула 2).
[2]
![]()
![]()
где: BE – (биологическая эффективность, %) показывает, на сколько процентов исследуемый штамм Trichoderma подавляет или задерживает рост колонии фитопатогена по сравнению с контролем; Ca – прирост колонии фитопатогена в контроле, на первые сутки учета; Cb – прирост колонии фитопатогена в контроле, на N-нные сутки учета; Ea – прирост колонии фитопатогена в опыте (при совместном культивировании с триходермой), на первые сутки учета; Eb – прирост колонии фитопатогена в опыте (при совместном культивировании с триходермой), на N-нные сутки учета; 1 и 100 – переводные коэффициенты.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как показали проведенные исследования фунгистатической активности новых штаммов Trichoderma sp. в отношении представителей рода Fusarium, Aspergillus и Penicillium, результаты которых представлены данными рисунков 2 и 3, штаммы Trichoderma №№ 1–6 подавляли рост колоний Fusarium sp. 81 (1), Penicillium sp. 173 (2), Aspergillus clavatus, Fusarium sp. MO 1 – 01a, Aspergillus fumigatus. Более эффективно подавляет рост перечисленных фитопатогенов штаммы Trichoderma №№ 1, 3, 5 которые кроме указанных фитопатогенов активно снижают скорость роста колоний Aspergillus fumigatus 97 (1). Наименьшую активность подавления изучаемых штаммов фитопатогенов по результатам наших опытов проявляли штаммы Trichoderma №2, 6, которые в отношении одного фитопатогена (Aspergillus fumigatus 97 (1)) оказались не эффективными (рис. 2).
Рис. 2. Изменение размеров (индекс прироста) колоний фитопатогенных микромицетов при совместном культивировании с новыми штаммами Trichoderma sp. №№1-6.
Как показывает анализ данных биологической эффективности вышеперечисленных штаммов Trichoderma sp. уровень биоконтролирующих свойств их довольно высокий – и находится в пределах от 48 до 98 % (табл. 1).
Наши исследования показывают, что в отношении Asp. fumigatus 97(1) штаммы Trichoderma sp. №№ 2–6 не оказывали биоконтролирующих свойств – т.е. не подавляли его рост. Индекс биологической эффективности указанных штаммов Trichoderma sp. в отношении Asp. fumigatus 97(1) составил от -11 – -12 % (штаммы Trichoderma sp. № 4 и № 5) до-20 – -21 % (штаммы Trichoderma sp. № 2 и № 6) (рис. 3, табл. 1).
Проведенные исследования фунгистатической активности новых штаммов Trichoderma sp. в отношении представителей родов Fusarium, Aspergillus и Penicillium, штаммы Trichoderma №№ 7–13 подавляли рост колоний Fusarium sp. 81 (1), Penicillium sp. 173 (2), Aspergillus clavatus, Fusarium sp. MO 1 – 01a, Aspergillus fumigatus. В отношении фитопатогена Aspergillus fumigatus 97 (1) все перечисленные штаммы оказались не эффективными. Анализ данных биологической эффективности вышеперечисленных штаммов Trichoderma sp. уровень биоконтролирующих свойств их довольно высокий – и находится в пределах от 46 до 98 %.
Таблица 1.
Биологическая эффективность (ВЕ) новых штаммов Trichoderma sp. в отношении подавления роста колоний фитопатогеных микромицетов, расчитанная по формуле Хендерсона-Тилтона
Рис. 3. Влияние новых штаммов Trichoderma sp. №№7–13 на изменение размеров колоний фитопатогенных микромицетов (индекс прироста) при совместном культивировании.
Наши исследования показывают, что в отношении Asp. fumigatus 97(1) штаммы Trichoderma sp. №№ 7–13 не оказывали биоконтролирующих свойств – т.е. не подавляли его рост. Индекс биологической эффективности указанных штаммов Trichoderma sp. в отношении Asp. fumigatus 97(1) составил от -11 – -14% (штаммы Trichoderma sp. № 12 и № 7, 13) до -20 – -37% (штаммы Trichoderma sp. № 9 и № 8).
Как показали проведенные исследования фунгистатической активности новых штаммов Trichoderma sp. в отношении представителей родов Fusarium, Aspergillus и Penicillium, штаммы Trichoderma №№ 14–21 подавляли рост колоний Fusarium sp. 81 (1), Penicillium sp. 173 (2), Aspergillus clavatus, Fusarium sp. MO 1 – 01a, Aspergillus fumigatus. Более эффективно подавляет рост перечисленных фитопатогенов штаммы Trichoderma №№ 20, 21 которые кроме указанных фитопатогенов активно снижают скорость роста колоний Aspergillus fumigatus 97 (1). Наименьшую активность подавления изучаемых штаммов фитопатогенов по результатам наших опытов проявляли штаммы Trichoderma №№ 14–19, которые в отношении одного фитопатогена оказались не эффективными: Aspergillus fumigatus 97 (1) (рис. 4).
Как показывает анализ данных биологической эффективности вышеперечисленных штаммов Trichoderma sp. уровень биоконтролирующих свойств их высокий – и находится в пределах от 48 до 98 % (табл. 1).
Наши исследования показывают, что в отношении Asp. fumigatus 97(1) штаммы Trichoderma sp. №№ 14–19 индекс биологической эффективности составил от -12 – -14 % (штаммы Trichoderma sp. № № 18,19) до -19 % (штаммы Trichoderma sp. №№14–17). Так же не эффективным в отношении подавления Fusarium sp. 81(1) оказался штамм Trichoderma sp. № 18 (индекс ВЕ равен -5 %).
Рис. 4. Изменение размеров (индекс прироста) колоний фитопатогенных микромицетов при совместном культивировании с новыми штаммами Trichoderma sp. №№14–21.
Как показали проведенные исследования фунгистатической активности новых штаммов Trichoderma sp. в отношении представителей рода Fusarium и Alternaria alternata, штаммы Trichoderma №№ 1–7 подавляли рост колоний Fusarium sp. 84 (2), Fusarium sp. 1 – 01 – a, Fusarium sp. fragaria, Fusarium sp. 59 (2) (рис. 5).
Рис. 5. Влияние новых штаммов Trichoderma sp. №№1–7 на изменение размеров (индекс прироста) колоний фитопатогенных микромицетов при совместном культивировании.
Более эффективно подавляет рост перечисленных фитопатогенов штаммы Trichoderma №№ 1–5, которые кроме указанных фитопатогенов активно снижают скорость роста колоний Fusarium sporotrichioides БР – 1 – 1 и Alternaria alternata. Наименьшую активность подавления изучаемых штаммов фитопатогенов по результатам наших опытов проявляли штаммы Trichoderma №№ 6, 7, которые в отношении двух фитопатогенов оказались не эффективными: Fusarium sporotrichioides БР – 1 – 1 и Alternaria alternata. Анализ данных биологической эффективности вышеперечисленных штаммов Trichoderma sp. уровень биоконтролирующих свойств их высокий – и находится в пределах от 62 до 98 %.
Как показали проведенные исследования фунгистатической активности новых штаммов Trichoderma sp. в отношении представителей рода Fusarium и Alternaria alternata, штаммы Trichoderma №№ 8–13 подавляли рост колоний Fusarium sp. 84 (2), Fusarium sp. 1 – 01 – a, Fusarium sp. fragaria, Fusarium sp. 59 (2), Alternaria alternata. Более эффективно подавляет рост перечисленных фитопатогенов штаммы Trichoderma №№ 8, 10, 11, 12, 13, которые кроме указанных фитопатогенов активно снижают скорость роста колоний Fusarium sporotrichioides БР – 1 – 1. Наименьшую активность подавления изучаемых штаммов фитопатогенов по результатам наших опытов проявлял штамм Trichoderma № 9, который в отношении одного фитопатогена оказался не эффективными: Fusarium sporotrichioides БР – 1 – 1 (рис. 6). Биологическая эффективности вышеперечисленных штаммов Trichoderma sp. и уровень ее биоконтролирующих свойств находится в пределах от 31 до 98 %. Наши исследования показывают, что в отношении Fusarium sporotrichioides БР-1-1 штамм Trichoderma sp. №9 не оказывал биоконтролирующих свойств – т.е. не подавлял его роста.
Рис. 6. Изменение размеров (индекс прироста) колоний фитопатогенных микромицетов при совместном культивировании с новыми штаммами Trichoderma sp. №№ 8–13.
Как показали проведенные исследования фунгистатической активности новых штаммов Trichoderma sp. в отношении представителей рода Fusarium и Alternaria alternata, штаммы Trichoderma №№ 14–19 подавляли рост колоний Fusarium sp. 84 (2), Fusarium sp. 1 – 01 – a, Fusarium sp. fragaria, Fusarium sp. 59 (2) и Alternaria alternata. Все перечисленные штаммы эффективно подавляют рост, указанных фитопатогенов (рис. 7). Как показывает анализ данных биологической эффективности вышеперечисленных штаммов Trichoderma sp. уровень биоконтролирующих свойств их высокий – и находится в пределах от 44 до 96 %.
Исследование фунгистатической активности новых штаммов Trichoderma sp. в отношении представителей рода Fusarium и Alternaria alternata, штаммы Trichoderma №№ 20, 21 подавляли рост колоний Fusarium sp. 84 (2), Fusarium sp. 1 – 01 – a, Fusarium sp. fragaria, Fusarium sp. 59 (2) и Alternaria alternata. Все перечисленные штаммы эффективно подавляют рост, указанных фитопатогенов (рис. 8). Как показывает анализ данных биологической эффективности вышеперечисленных штаммов Trichoderma sp. уровень их биоконтролирующих свойств находится в пределах от 43 до 99 %.
В отношении представителей рода Aspergillus и Penicillium viridicatum, штаммы Trichoderma №№ 1–7 подавляли рост колоний Aspergillus flavus R. В отношении изменения размеров колонии патогенного микромицета Penicillium viridicatum, штамм Trichoderma №1 практически не оказывал задерживающего действия: изменение площади колонии фитопатогена при совместном культивировании Trichoderma sp. №1 практически не изменяется. Но при этом, данный штамм Trichoderma проявляет довольно высокую биологическую эффективность – подавляет рост изучаемого штамма Penicillium viridicatum на 76 % относительно контроля. Биологическая эффективности вышеперечисленных штаммов Trichoderma sp. уровень биоконтролирующих свойств находится в пределах от 73 до 97 %.
Рис. 7. Влияние новых штаммов Trichoderma sp. №№14–19 на изменение размеров (индекс прироста) колоний фитопатогенных микромицетов при совместном культивировании.
Рис. 8. Влияние новых штаммов Trichoderma sp. №№1–7 на изменение размеров (индекс прироста) колоний фитопатогенных микромицетов при совместном культивировании.
Как показали проведенные исследования фунгистатической активности новых штаммов Trichoderma sp. в отношении представителей рода Aspergillus и Penicillium viridicatum, штаммы Trichoderma №№ 8–13 подавляли рост колоний Aspergillus flavus R., Aspergillus flavus 2016 (рис. 8).
Более эффективно подавляет рост перечисленных фитопатогенов штаммы Trichoderma №№ 8–12, которые кроме указанных фитопатогенов активно снижают скорость роста колоний Penicillium viridicatum. Наименьшую активность подавления изучаемых штаммов фитопатогенов по результатам наших опытов проявлял штамм Trichoderma № 13, который в отношении одного фитопатогена оказался не эффективными: Penicillium viridicatum (рис. 8). Биологическая эффективность вышеперечисленных штаммов Trichoderma sp. уровень биоконтролирующих свойств находится в пределах от 65 до 99 %.
Не эффективным оказался штамм Trichoderma sp. № 13 в отношении Pen. viridicatum. Индекс биологической эффективности Trichoderma sp. № 13 в отношении этого фитопатогена составил – 12 %).
Рис. 9. Изменение размеров (индекса прироста) колоний фитопатогенных микромицетов при совместном культивировании с новыми штаммами Trichoderma sp. №8–13.
Как показали проведенные исследования фунгистатической активности новых штаммов Trichoderma sp. в отношении представителей рода Aspergillus и Penicillium viridicatum, штаммы Trichoderma №№ 14–19 подавляли рост колоний Aspergillus flavus R., Aspergillus flavus 2016, Penicillium viridicatum. Все перечисленные штаммы эффективно подавляют рост, указанных фитопатогенов. Биологическая эффективность вышеперечисленных штаммов Trichoderma sp. уровень биоконтролирующих свойств находится в пределах от 61 до 98 %.
Таким образом, биологическая эффективность и способность подавлять рост колоний фитопатогенных микромицетов родов Fusarium, Aspergillus, Penicillium, Alternaria у новых штаммов триходермы различаются. Штаммы Trichoderma №№ 1, 3, 5, 20, 21 кроме фитопатогенов Fusarium sp. 81(1), Fusarium sp. MO 1-01a, Penicillium sp. 173(2), Aspergillus fumigatus, Aspergillus clavatus активно снижают скорость роста колоний Aspergillus fumigatus 97 (1). Более эффективно подавляет рост фитопатогенов Fusarium sp. 84(2), Fusarium sp. 1-01-a, Fusarium sp. fragaria, Fusarium sp. 59 (2), Alternaria alternata штаммы Trichoderma №№ 8, 10, 11, 12, 13, которые кроме указанных фитопатогенов активно снижают скорость роста колоний Fusarium sporotrichioides БР – 1 – 1. Также стоит отметить, по результатам данного исследования штаммы Trichoderma №№ 8–12, которые кроме таких фитопатогенов как Aspergillus flavus 2016, Aspergillus flavus R., активно снижают скорость роста колоний Penicillium viridicatum.
ЗАКЛЮЧЕНИЕ
- Предложено два варианта оценки антагонистической (биологической, биоконтролирующей) активности штаммов триходермы:
а). Индекс изменения (Ир) размеров колонии фитопатогена отоносительно контрольного варианта его выразщивания в отсутствии триходермы, расчитанный на первые и четвертые сутки культивирования дает возможность графически выразить направленность взаимодействия фитопатогенных микромицетов и триходермы, с целью отбора эффективно подавляющих штаммов триходермы.
б). Индекс биологической эффективности (ВЕ) позволяющий количественно оценить антагонизм отдельных штаммов триходермы с целью отбора наиболее эффективного штамма.
- Биологическая эффективность и способность подавлять рост колоний фитопатогенных микромицетов родов Fusarium, Aspergillus, Penicillium, Alternaria у новых штаммов триходермы различаются.
Работа выполнена на оборудовании ЦКП «Экспериментальная физиология и биофизика».
- Guo R., Li G., Zhang Z., Peng X. Structures and Biological Activities of Secondary Metabolites from Trichoderma harzianum, Mar Drugs., 20(11), 701 (2022).
- Kredics L., Jimenez G. L., Naeimi S., Czifra D., Urban P., Manczinger L. A challenge to mushroom growers: the green mould disease of cultivated champignons. In: Current research, technology and education topics in applied microbiology and micro-bial biotechnology, 295 (Mendez-Vilas A. (ed.). FORMA-TEX Publ.; 2010).
- Vinale F., Sivasithamparam K., Ghisalberti E.L., Ruocco M., Wood S., Lorito M. Trichoderma secondary metabolites that affect plant metabolism, Nat Prod Commun., 7(11), 1545 (2012).
- Peterson R., Nevalainen H. Trichoderma reesei RUT-C30—thirty years of strain improvement, Microbiology (Reading)., 158(Pt 1), 58 (2012).
- Sidyakin A. I., Filonenko V. A. Otsenka biologicheskoy effektivnosti (stimuliruyushchikh i biokontroliruyushchikh svoystv) biopreparata Trikhoplant, Perspektivy ispol’zovaniya innovatsionnykh form udobreniy, sredstv zashchity i regulyatorov rosta rasteniy v agrotekhnologiyakh sel’skokhozyaystvennykh kul’tur: Materialy dokladov uchastnikov 9-oy nauchno-prakticheskoy konferentsii «Anapa-2016». Pod red. akad. RAN VG Sycheva, 127 (M.: VNIIA Publ., 2016).
- GOST 12044-93. Semena sel’skokhozyaystvennykh kul’tur. Metody opredeleniya zarazhennosti boleznyami, V Sb. Semena sel’skokhozyaystvennykh kul’tur. Metody analiza: Sb. GOSTov., 162 (M.: IPK Izdatel’stvo standartov, M.: Standartinform, 2011).
- Lyagushina O. A., Sidyakin A. I. Biopreparat dlya stimulyatsii rosta rasteniy i ikh zashchity ot fitopatogenov na osnove shtammov Trichoderma, shtammy Trichoderma dlya ego proizvodstva (varianty), sposob polucheniya biopreparata na osnove takikh shtammov, Byul. № 35 19.06.2013. US 2004/0176249 A1, 09.09.2004. RU 2035145 C1, 20.05.1995. Opublikovano: 10.01.2017 Byul. № 1
- Metodicheskie ukazaniya po registratsionnym ispytaniyam fungitsidov v sel’skom khozyaystve/ Pod red.chlen.-korr. Rossel’khozakademii V. I. Dolzhenko, 378 (M.: Vserossiyskiy NII zashchity rasteniy (VIZR) Publ., 2009).

