OXIDATIVE STRESS AS A MOLECULAR BASIS FOR NEURODEGENERATIVE DISEASES AND ANTIOXIDANT THERAPY PATHWAYS
ОКИСЛИТЕЛЬНЫЙ СТРЕСС КАК МОЛЕКУЛЯРНАЯ ОСНОВА НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ И ПУТИ АНТИОКСИДАНТНОЙ ТЕРАПИИ
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №3, 2024
Publication text (PDF): Download
UDK: 577.121.7: 616-092.19:616.8:615.272
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Mikashinovich Z. I., FSBEI HE «Rostov State Medical University» Ministry of Health of the Russian Federation, Rostov-on-Don, Russian Federation
Telesmanich N. R., FSBEI HE «Rostov State Medical University» Ministry of Health of the Russian Federation, Rostov-on-Don, Russian Federation
Smirnova O. B., FSBEI HE «Rostov State Medical University» Ministry of Health of the Russian Federation, Rostov-on-Don, Russian Federation
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-3-106-127
PAGES:from 106 to 127
STATUS:Published
LANGUAGE:Russian
KEYWORDS: oxidative stress, reactive oxygen species, antioxidants, Parkinson’s disease, Alzheimer’s disease, autoimmune disorders, early diagnosis, stabilometry.
ABSTRACT (ENGLISH):
The review presents the results of clinical and experimental studies demonstrating the pathogenetic role of oxidative stress in the genesis of neurodegenerative diseases (NDD), obtained using a complex of clinical, laboratory and instrumental methods that reveal the role of oxidative stress and antioxidants in NDD. In the process of preparing the materials, sources from international and domestic databases were used: Scopus, Web of Science, Pub Medline, RSCI, mainly over the past 15 years (2010–2024).
Diseases of the nervous system that differ in etiology and clinical symptoms have common mechanisms associated with damage to biomolecules: improper protein stacking, their aggregation, and violation of the pro- and antioxidant balance. Increased formation of reactive oxygen species (ROS) induces mitoptosis, apoptosis, and ferroptosis, factors that lead to impaired functional activity of neuron structural units as the main element of the nervous system. Given the complexity of the pathogenesis of NDZ, a promising methodological approach is to calculate the leading factors of pathogenesis. Undoubtedly, this makes it possible to standardize diagnosis and therapy, and subsequently create clinical recommendations. The purpose of this work was to analyze the role of participants in oxidative stress in key stages of the inflammatory process underlying NDZ. Despite the fact that there is currently no unambiguous recognition of the effectiveness of antioxidant therapy, nevertheless, the use of antioxidants can be considered as the most important link in neuroprotection, which has a pathogenetic justification.
Metabolic correction in NDH can be divided into 3 groups: natural antioxidants, then endogenous oxidants coming from food, the 3rd group includes drugs of combination therapy and immunotherapy. Mexidol and selenoproteins have antihypoxic and antioxidant effects, which are realized at both the neuronal and vascular levels. Prospects for the development of effective metabolic drugs are associated with the restoration of mitochondrial dysfunction. Synchronization of the metabolic processes underlying the functioning of neuron structures will ensure neurogeneration, slow down neurodegenerative processes and increase life expectancy.
FDA-approved drugs such as acetylcholinesterase inhibitors (donepezil, rivastigmine), as well as levodopa for the treatment of PD, which cross the blood-brain barrier and restore dopamine levels in the substantia nigra, only alleviate symptoms and slow the progression of diseases for several years. New therapeutic approaches aimed at neuroregeneration, i.e. structural and functional restoration of the damaged nervous system through immunomodulation, inhibition of the formation of protein aggregates, disaggregation of improperly folded proteins and induction of autophagy, give hope that the process of degeneration of affected neurons may slow down, and the recovery rate and life expectancy will increase. Due to the complex nature of NDT, a multi-purpose treatment approach is recommended, as it can have additional positive effects.
ВВЕДЕНИЕ
По мнению ряда авторов, в настоящее время в экономически развитых странах неуклонно растет число пациентов с прогрессирующими заболеваниями нервной системы, которые в будущем станут преобладать над сердечно-сосудистыми и онкологическими заболеваниями. В первую очередь к ним относятся болезнь Альцгеймера (БА) и болезнь Паркинсона (БП), НДЗ, связанные с возрастом. К другим НДЗ относят, болезнь Хантингтона, рассеянный склероз, (РС), боковой амиотрофический склероз (БАС) и многие другие редкие состояния, такие как: прионные заболевания, заболевания двигательных нейронов, спиноцеребеллярная атаксия, спинальная мышечная атрофия, атаксия Фридрейха и синдром Леви. Все эти заболевания, как генетические, так и приобретенные, приводят к прогрессирующему ухудшению или даже полной утрате сенсорных, моторных и когнитивных функций [1–5].
Развивающаяся инвалидизация и социально-экономические последствия этих заболеваний определяют всё возрастающие усилия ученых во всем мире в решении проблемы замедления, а в идеале и предотвращения их прогрессирования [6, 7]. Учитывая сложность патогенеза НДЗ, перспективным является методологический подход вычисления ведущих факторов патогенеза. Несомненно, это позволяет стандартизировать диагностику и терапию, а в последующем создавать клинические рекомендации [8–10].
Целью данной работы было провести анализ роли участников оксидативного стресса в ключевых этапах воспалительного процесса, лежащего в основе НДЗ.
МАТЕРИАЛЫ И МЕТОДЫ
В обзоре освещены результаты клинических и экспериментальных исследований, полученные с использованием комплекса клинических, лабораторных и инструментальных методов, позволяющих выявить роль окислительного стресса и антиоксидантов в НДЗ. В процессе подготовки материалов использовались источники из международных и отечественных баз данных: Scopus, Web of Science, Pub Medline, РИНЦ, преимущественно за последние 15 лет (2010–2024г.г.).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Серия неудач, связанных с разработкой новых препаратов для лечения НДЗ и отсутствие реального успеха заставляют задуматься о существенном пересмотре взглядов на их патогенез, критерии диагностики, особенно ранней, и направленной терапии.
За последние 20 лет накоплен ряд противоречий и фактов, указывающих на поиск новых критериев и маркеров прогрессирования при РС, БП и БА. Укоренившиеся в клинической неврологии каноны диагностики подразумевают постановку топического, затем синдромального диагноза; вершиной диагностического процесса является постановка нозологического диагноза. На сегодняшний день общепризнано, что в основе развивающегося нейродегенеративного процесса лежит окислительный стресс. Важно подчеркнуть, что для головного мозга характерно интенсивное потребление кислорода, что и вызывает чрезмерное образование его активных форм (АФК). Продукция АФК может привести к серьезному повреждению клеток и тканей и способствовать хронизации воспаления, лежащего в основе НДЗ и других метаболических патологий. Их высокая реактивность приводит к усилению окислительного стресса, который способствует: гликозилированию и окислению белков, приводящее к потере их функции. Активные формы кислорода влияют на углеводы с образованием продуктов гликирования, участвующих в развитии нейродегенеративных заболеваний изменяют гетероциклические основания ДНК и РНК, в частности гуанин. Кроме того, нервные клетки особенно подвержены окислительному повреждению из-за высокого, содержания полиненасыщенных жирных кислот, предшественников простагландинов, и слабой антиоксидантной защиты. АФК в клетках головного мозга реагируют с ПНЖК клеточных мембран, вызывая их перекисное окисление (ПОЛ), что свидетельствует о противовоспалительной роли участников этого процесса. Повреждению также подвергаются молекулы ДНК при окислении или нитровании гуаниловых оснований [11–13]. В результате ПОЛ образуются относительно стабильные продукты, такие как малоновый диальдегид (МДА), 4-гидрокси-2-ноненаль (ГНЭ), акролеин и изопростан [14, 15].
Изменение текучести и проницаемости мембраны способствует массовому поступлению во внутриклеточную среду веществ, например, K+, Ca2+ и др., которые могут изменять мембранные белки, ферменты и рецепторы. Кроме того, оксид азота (NO), по-видимому, играет важную роль в неврологических расстройствах. Он имеет один неспаренный электрон, что делает его очень восприимчивым к другим молекулам. Попадая в кровоток, он окисляется с образованием нитритов и нитратов. Синтез NO регулируется синтазой оксида азота (NOS), которая в организме человека существует в трех формах: индуцибельная синтаза оксида азота (iNOS), нейрональная синтаза оксида азота (nNOS) и эндотелиальная синтаза оксида азота (eNOS). Количество NO, продуцируемое этими разными изоформами, проявляет различную физиологическую активность. В низких концентрациях NO, по-видимому, оказывает нейропротекторное действие: исследования на животных моделях показали, что ингибирование NOS коррелирует с возникновением и прогрессированием БП, а также со снижением апоптоза нейронов [16]. Тем не менее, NO в высоких концентрациях вызывает провоспалительный стимул с нейротоксическим эффектом [17].
В последнее время активно обсуждается роль повреждения митохондрий при НДЗ. Митохондриальная дисфункция приводит к увеличению продукции АФК, дефектам окислительного фосфорилирования, разрушению митохондрий (митоптоз) и играет ключевую роль в старении и патогенезе НДЗ, поскольку нейроны особенно уязвимы и восприимчивы к окислительному стрессу из-за высоких энергетических потребностей и высоких потребностей в кислороде [18].
Старение и стрессовые факторы
Старение и стрессовые факторы могут служить причиной начала нейродегенеративных болезней. Сообщается о снижении уровня антиоксидантов и увеличении ПОЛ у пожилых людей по сравнению с контрольной группой молодых людей [19, 20]. Кроме того, количество ПНЖК, особенно n-3 ПНЖК, в головном мозге уменьшается с возрастом. Содержание n-3 ПНЖК в старческом мозге в значительной степени зависит от поступления n-3 ПНЖК в течение жизни. Однако сниженная активность ключевых ферментов, участвующих в биосинтезе длинноцепочечных n-3 ПНЖК из пищевых предшественников, Δ6- и Δ5-десатураз, также обнаруживается в пожилом мозге. Нормальное старение связано со снижением антиоксидантной способности, повышенной скоростью ПОЛ и последующим снижением n-3 ПНЖК в ткани мозга, что приводит к изменению химического состава, структуры и функции стареющих клеток мозга. Несколько сообщений подтвердили возрастное ослабление ферментативной антиоксидантной защиты. Более того, вещества, реагирующие с гидропероксидом липидов и тиобарбитуровой кислотой, были идентифицированы как чувствительные маркеры нормального старения [21].
Следовательно, ПОЛ связано с развитием и прогрессированием НДЗ, а также с нормальным старением, участники которого способствуют формированию воспалительной реакции организма.
Начало НДЗ связано со снижением активности аутофагии, т.е. включения компонентов, таких как белки, органеллы и микробные захватчики, в аутофагосомы в результате генетической изменчивости, старения или образа жизни. Формирование и созревание аутофагосом зависит от доступных липидов и липид-связывающих белков, что указывает на важность липидов для обеспечения функциональной активности нервной ткани. Поскольку БA, БП и БАС обычно встречаются у пожилых людей и в первую очередь классифицируются как протеинопатии, это означает, что они связаны с агрегацией и отложением белков с неправильной укладкой, которые вызывают нейротоксичность через пути клеточного стресса [22, 23].
Имеющиеся данные показывают, что высокая частота НДЗ может быть частично связана с негативным влиянием повседневных факторов риска, включая стресс, отсутствие физических упражнений и нездоровое питание [24].
Различные по клинической симптоматике и этиологии НДЗ имеют как общие механизмы, так и особенности молекулярных повреждений, характеризующих специфику патологического процесса.
Болезнь Альцгеймера
Болезнь Альцгеймера (БА), поражающая мозг, характеризуется повышенным карбонилированием и нитрованием, которые, соответственно, вводят в белки монооксид углерода или одну, или несколько групп NO2 [25].
Имеются данные о том, что, помимо нарушений белкового обмена, нарушения липидного обмена, особенно фосфоинозитолов и сфинголипидов, также играют важную роль в нейродегенерации. Свойства липидов и эффекты в ЦНС напрямую определяются долей конкретных жирных кислот в их молекулярной структуре и, в частности, содержанием длинноцепочечных полиненасыщенных жирных кислот (ПНЖК). Выделяют три основных механизма воздействия ПНЖК на нервную систему: (1) модуляция физических свойств клеточной мембраны, (2) активность вторичного мессенджера и (3) регуляция экспрессии генов. Наличие ПНЖК в нейральных фосфолипидах благоприятно влияет на проницаемость и текучесть мембран, способствует эндо- и экзоцитозу, активности ионных каналов и мембраносвязанных белков, включая рецепторы нейромедиаторов [26].
АФК, продуцируемые микросомальным Cyt p-450, НАДФН-оксидазой и липоксигеназой атакуют липиды, белки и ДНК мозга, еще больше усиливая окислительный стресс. Окислительное повреждение липидов приводит к образованию продуктов ПОЛ, которые дополнительно атакуют липиды, белки и ДНК, нарушая работу мозга. ПОЛ может воздействовать на разные типы нейронов. В нейронах гиппокампа продукты ПОЛ связываются с β-амилоидным пептидом и образуют неправильно свернутый амилоидный β-пептид и сенильные бляшки амилоидного β, которые нарушают передачу сигналов и структуру нерва и вызывают БА.
БА – прогрессирующее нейродегенеративное заболевание, характеризующееся внеклеточным накоплением β-амилоида и нейрофибриллярных клубочков – сенильных бляшек, состоящих из тау-белка на поверхности нейронов, что нарушает передачу сигналов, структуру нервов и провоцируют развитие болезни. Внедрение β-амилоида в клеточные мембраны генерируют пероксид водорода, который запускает ПОЛ. В аутопсийных образцах головного мозга пациентов обнаруживаются повышенные уровни 12- и 15 липооксигеназы и 12- 15- гидроксиэйкозаеновых кислот [27, 28].
Углубленное изучение молекулярных механизмов развития выявило возможную связь между Apo-ε4 и болезнью Альцгеймера. Показано, что на ранних этапах заболевания в мозге обнаруживается снижение уровня сульфатидов из-за нарушения механизма их транспорта, опосредованного Apo-Е. Установлено влияние Аро- ε4 на рост амилоидных тяжей и ускорение гибели нейронов, например, нейронов гиппокампа.
Таким образом аллели Аро-Е определяют частоту возникновения болезни и подчеркивают сложность патогенеза, в котором тесно переплетаются активация ПОЛ и генетический полиморфизм АроЕ. Люди, гомозиготные по Аро- ε4 имеют в 16 раз большую вероятность развития болезни.
Болезнь Паркинсона
Болезнь Паркинсона (БП) – второе по распространенности нейродегенеративное заболевание в мире после болезни Альцгеймера. Паркенсонизм – это болезнь адренэргической системы мозга. К адренэргической системе мозга относят все нейронные популяции и мозговые структуры, медиатором которых являются дофамин и норадреналин. Этиопатогенез заболевания включает действие внешних факторов, возраст, наследственность. Молекулярной основой определенно можно считать окислительный стресс, эксайтотоксичность, митохондриальную дисфункцию и накопление белка α-синуклеина (α-syn), который в норме может выполнять функцию белка-шаперона. В патогенезе БП ПОЛ считается одним из важнейших индукторов воспаления, драйверов апоптоза, аутофагии и ферроптоза, в результате которых наблюдается гибель различных популяций нейронов. Главным источником АФК во многих клетках являются митохондрии [29].
Согласно ряду теорий, происходит накопление в течение жизни мутаций митохондриальных ДНК, возникших под действием АФК, и прежде всего О2.-. Митохондрии с поврежденными ДНК не могут обеспечить клетки достаточным количеством АТФ. Повышение НАДФ-трансгидрогеназы – важного элемента системы защиты от АФК, блокирует не только образование АТФ, но и высвобождение инсулина β-клетками, что нарушает структурно-функциональный мышечный аппарат, целостность нейронов, и способствует возникновению болезни. АФК действуют на проницаемость эндотелиального барьера, влияя на межклеточные и адгезивные контакты.
![]()
![]()
При БП аномально свернутая форма белка α-syn образует волокнистые массы, называемые тельцами Леви. Накопление этого белка приводит к недостаточной выработке дофамина в полосатом теле и может рассматриваться как биохимический маркер.
Установлено, что α-syn влияет на метаболизм ГАМК. Сама ГАМК регулирует процессы высвобождения α-syn из синаптических визикул. Повышенные уровни ГАМК вызывают активацию ГАМК β-рецепторов в глутаматэргических терминалах, что приводит к ингибированию Са++каналов, уменьшая высвобождение α-syn. Таким образом, секреция белка зависит от перекрестного взаимодействия ГАМКэргических нейронов с глутаматэргическими и являются Са++зависимыми. Установление этого факта важно для объяснения изменений метаболизма α-syn, входящего в гипотезу митохондриальной дисфункции как основы развития БП. Наличие хотя бы одного из компонентов может вызывать нарушение метаболизма α-syn и развитие БП. Перечисленные выше факторы могут быть включены в комплексное понятие «хроническое нейровоспаление», что является ведущей теорией в патогенезе БП. При этом заболевании обнаруживаются сдвиги во многих звеньях гуморально-гормональной системы организма, что может сопровождаться не только патологическими, но и компенсаторными изменениями в биохимических реакциях. Следует учитывать, что разные клинические формы синдрома паркинсонизма могут иметь различные патофизиологические и биохимические особенности, что позволяет считать это заболевание мультисистемным. Наряду с нейровоспалением обсуждается возможная роль активации иммунной системы в процессе нейродегенерации при Б.П. Полученные данные позволяют предполагать, что различия между стадиями можно устанавливать по уникальному профилю специфических антител. Более того, сочетанные изменения маркеров нейровоспаления, эндогенной интоксикации с продуктами ПОЛ, например, МДА, могут рассматриваться как потенциальные маркеры ранней диагностики заболевания, что является одной из наиболее нерешенных диагностических и прогностических задач [30, 31].
Боковой амиотрофический склероз
Боковой амиотрофический склероз – это НДЗ, характеризующееся прогрессирующей потерей моторных нейронов в ЦНС, что приводит к мышечной атрофии, параличу и смерти [32]. Генетические исследования показали, что при БАС наиболее распространенными мутантными генами являются SOD1 C9 orf 72, TARDBP и FUS. На сегодняшний день описано более 180 различных мутаций в гене SOD1, которые можно обнаружить в 10–20 % случаев семейного БАС и в 1–5 % случаев спорадического БАС [33]. Имеющиеся данные показывают, что окислительное повреждение нейронов способствует их дисфункции и дегенерации при БАС. В биологических жидкостях обнаружен высокий уровень продуктов ПОЛ, в частности, МДА, что подтверждает роль прооксидантного дисбаланса в патогенезе БАС [34].
Накопление другого промежуточного продукта – 4-гидроксинонеаля (HNE), который атакует ДНК, это сопровождается активацией апоптоза и модифицированием белков, что является одним из наиболее важных факторов риска, связанных с прогрессированием заболевания. Интересно отметить, что повышенный уровень альдегида (HNE) и, соответственно, модифицированных белков, наблюдается в двигательных нейронах спинного мозга. Следовательно, окислительный стресс лежит в основе молекулярных сдвигов при БАС [35, 36].
Подтверждением этого положения являются данные, указывающие на значимую патогенетическую роль мутаций в СОД1, которые приводят к изменениям в структуре и функций в двигательных нейронах [37, 38]. Мутирование СОД приводит к неправильно свернутым белковым цепям и формирует нейротоксические агрегаты в ядрах глиальных клеток спинного мозга, что способствует дегенерации нейронов [39, 40]. У мутанта SOD снижена ферментативная активность, что приводит к аномальной продукции АФК, следствием чего является изменение клеточной функции, апоптоз и, как последнее звено воспалительного процесса — некроз [41] (Рис. 1).
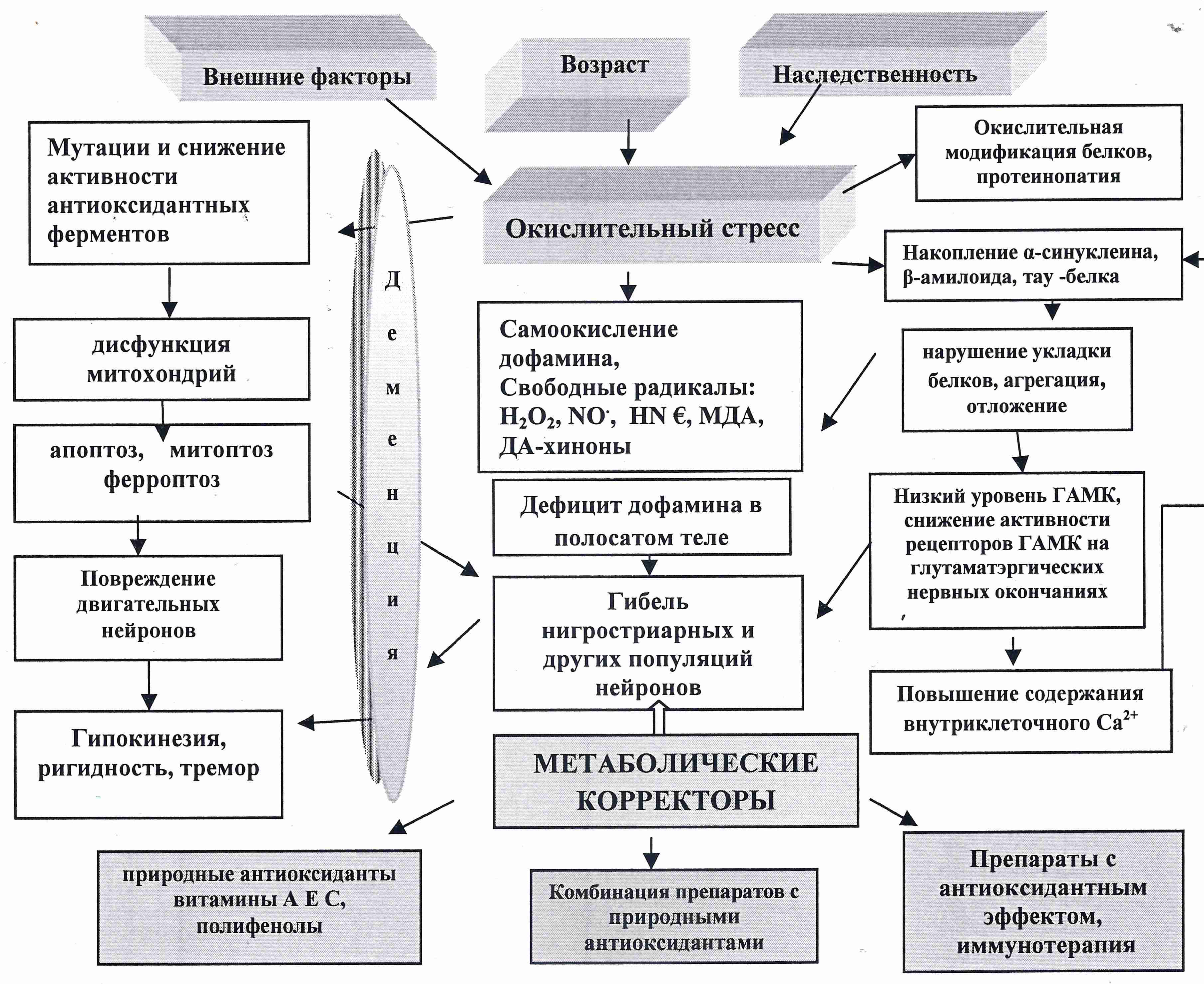
Рис. 1. Патогенетические мишени НДЗ и их коррекция антиоксидантами.
Метаболическая коррекция нейродегенеративных заболеваний
Как следует из приведенных выше данных на рисунке (Рис. 1), НДЗ имеют молекулярные блоки, такие как аномальное накопление агрегированных белков в результате их окислительной модификации, митохондриальную дисфункцию, нарушение лизосомальной деградации белков, накопление β-амилоида (БА), а также α-синуклеида на фоне дефицита дофамина в полосатом теле (БП). Различные по этиологии и клинической симптоматике, НДЗ имеют в патогенезе общие черты, связанные с окислительным повреждением биомолекул, неправильной укладкой белков, их агрегацией, нарушением про- и антиоксидантного баланса за счет накопления АФК. Эндогенная продукция АФК индуцируется накоплением железа в клетках мозга, действием липооксигеназы, миелопероксидазы, ангиотензина и НАДФН-оксидазы, т.е. факторов, ассоциирующихся с хроническим воспалением. В соответствии с этим, ингибирование или снижение интенсивности ПОЛ может замедлить или остановить прогрессирование дегенеративных процессов [42]. Однозначного ответа по поводу оценки эффективности влияния антиоксидантов на ведущие звенья патогенеза при НДЗ в настоящее время нет. Тем не менее, антиоксидантная терапия рассматривается как важнейшее звено нейропротекции.
Метаболическую коррекцию при НДЗ можно разделить на 3 группы.
Первая из них, природные антиоксиданты, защищающие действие АФК: витамины А, Е, С, богатые полифенолами продукты, например, фрукты, могут рассматриваться как потенциальные антиоксиданты.
Вторая – эндогенные антиоксиданты, поступающие с пищей соединения селена, меди, магния, флавоноиды, каротиноиды, которые помогают предотвратить или даже отсрочить начало БАС. Исследования влияния добавок витамина Е показали, что регулярное употребление витамина Е в течение более 10 лет связано с более низким риском смерти от БАС, а Ван и соавторы обнаружили тенденцию к снижению прогрессирования БАС [43].
К третьей группе корректирующих препаратов, можно отнести комбинированную терапию. После трех месяцев лечения витамином и рилузолом (500мг. 2 раза в день) в качестве стандартной лекарственной терапии при БАС, наблюдали снижение уровня МДА и повышение уровня глутатиона в плазме. Тем не менее, значительного влияния витамина Е на выживаемость пациентов с БАС не обнаружено [44]. В рандомизированном контролируемом исследовании (РКИ) комбинация метеонина, витамина Е и селена сопровождалась значительным увеличением выживаемости и увеличением активности глутатионредуктазы у пациентов с БАС через год.
Патогенетические мишени воздействия антиоксидантов
Вещества полифенольной природы воздействуют на множество терапевтических мишеней, что может быть полезным для профилактики и лечения начальных стадий НДЗ:
– вещества полифенольной природы антоцианы при НЗД способствуют выживаемости нейронов;
полифенолы, такие как куркумин, ресвератол, катехин и олеорупеин являются ингибиторами образования телец Леви [45];
– выявлено влияние каротиноидов на двигательную функцию при НДЗ;
– витамин Е представляет собой потенциальную терапевтическую мишень для модификации заболевания.
Защитные эффекты могут быть достигнуты за счет предотвращения окислительного стресса и ингибирования апоптоза. В этом плане перспективно применение препаратов антиоксидантного действия (митохондриально-направленных) в комплексной противовоспалительной терапии.
Наряду с антиоксидантной терапией необходимо отметить активно развивающуюся иммунотерапию, способствующую элиминации аберрантных белков (α-синуклеина, β-амилоида). Это направление открывает перспективы, и подчеркивает необходимость рассматривать прогрессирующее заболевание нервной системы с учетом различных факторов патогенеза, как. например, переплетение свободнорадикальных атак с протеинопатией, что важно для поиска новых направлений патогенетически обоснованной терапии НДЗ. Очевидно, что прогрессирующие заболевания нервной системы – это системная патология и терапевтические мероприятия должны затрагивать все уровни функционирования биосистемы, начиная с молекулярного, способного замедлить или остановить патологический процесс.
Мексидол, как антиоксидантный протектор НДЗ
Как считают Чуканова с соавторами [45], Стаховская [46], Щулькин [44] важное значение для терапии различных заболеваний нервной системы имеют препараты с нейротропным эффектом, позволяющие нейронам функционировать в условиях гипоксии. Из таких препаратов пациентам с ХИМ назначают производные ГАМК, препараты животного происхождения (актовегин, церебролизин, кортексин) мембраностабилизирующие препараты (церетон, глиатилин) препараты с антиоксидантным эффектом, кофакторы, витамины.
Одним из наиболее изученных и широко используемым в настоящее время препаратом антиоксидантного действия, является мексидол – 2-этил-6-метил-3-гидроксипиридина сукцинат. Наиболее важными фармакологическими эффектами мексидола являются его антиоксидантные, мембранотропные эффекты. Он также проявляет способность модулировать функционирование рецепторов и мембранно-связанных ферментов, а также восстанавливать нейромедиаторный баланс [46].
Ряд проведенных клинических исследований, посвященных изучению эффективности и безопасности мексидола в лечении пацинтов с острой ишемией мозга, доказал его клиническую эффективность. В экспериментальных исследованиях Ворониной [47] выявлено, что действие мексидола направлено на свободнорадикальное окисление в биомембранах и внутри клетки. Препарат ингибирует процессы ПОЛ, повышает активность супероксиддисмутазы и церулоплазмина. Кроме того, мексидол стимулирует энергосинтезирующую функцию митохондрий, повышая устойчивость клеток мозга к гипоксии и ишемии. В условиях гипоксии мексидол способствует усилению компенсаторной активации аэробного гликолиза и снижению степени угнетения окислительных процессов в цикле Кребса, что приводит к увеличению образования и активации энергосинтезирующих функций митохондрий. Было показано, что мексидол прерывает ишемический каскад, воздействуя на важнейшие этапы: расстройство синтеза энергии, глутаматную эксайтотоксичность и оксидативный стресс. Широкий спектр фармакологических эффектов мексидола реализуется как на нейрональном, так и на сосудистом уровнях. Снижает повышенный в мозге при патологии уровень оксида азота. Под воздействием мексидола происходит увеличение концентрации восстановленной формы глутатиона [48].
Дополнительным важным эффектом мексидола является его воздействие на мембраны нейрона, приводящее к снижению их возбудимости. Мексидол препятствует нарушению структурно-функционального состояния биомембран, транспорта нейромедиаторов и улучшению синаптической передачи. Препарат улучшает соотношение липид-белок, а также концентрацию в головном мозге дофамина. Наряду с этим имеются доказательства гиполипидемической активности мексидола. Показано, что прием мексидола сопровождается снижением уровня общего холестерина и ЛПНП [49].
Благодаря мультифакторному механизму действия и широкому спектру фармакологических эффектов – церебропротективного, противогипоксического, транквилизирующего, антистрессорного, ноотропного, вегетотропного, противосудорожного, а также положительно влияющего на кровоснабжение мозга, улучшению реологических и гемокоагуляционных свойств крови, лечение мексидолом приводит к стойкой компенсации хронической ишемии мозга. На фоне применения мексидола, у больных с ишемическим инсультом, происходило достоверное снижение уровня гидроперекисей липидов с одновременной нормализацией эндогенного антиоксидантного фона. Нейропсихологическое исследование в динамике показало, что курс лечения мексидолом оказывал положительное влияние на темп психической деятельности, внимание, зрительную память [46].
В проведенных исследованиях больных с хроническим ЦВЗ было выявлено, что применение мексидола приводит к улучшению состояния пациентов и уменьшению выраженности наиболее часто встречающихся клинических проявлений данной патологии. Максимальный терапевтический эффект мексидола наблюдается у больных с изначально повышенным содержанием продуктов ПОЛ и истощенной антиоксидантной защитой.
Показано, что лечение мексидолом актуально для превентивной коррекции когнитивных расстройств, поскольку он непосредственно влияет на патогенетические факторы их формирования [50]. Широкий спектр эффектов мексидола определяется его базисным политаргетным механизмом действия и мультимодальными свойствами. Мексидол обладает антиоксидантным, антигипоксическим и мембранотропным эффектами, способностью улучшать энергетический статус клетки и восстанавливать процессы в цикле Кребса, индуцировать митохондриогенез, подавлять аскорбатзависимое (неферментативное) и НАДФН2-зависимое перекисное окисление липидов, повышать активность Se-зависимой глутатионпероксидазы, снижать активность индуцибельной NO-синтазы и связывать супероксидный анион-радикал. Показано, что фрагмент молекулы мексидола, 2-этил6-метил-3-оксипиридин, при курсовом применении обладает способностью улучшать мнестические процессы и двигательные навыки у пожилых беспородных крыс. Таким образом, механизм действия мексидола, связанный с воздействием на ключевые, базисные процессы повреждения клеточных структур, в том числе при старении, предполагает его позитивное влияние на возрастные изменения и продолжительность жизни [51–56].
Применение селенопротеинов и коэнзима Q10 при НДЗ
Селенопротеины, такие как глутатионпероксидазы (GPx), играют важную роль в антиоксидантной защите. Селен является важным микроэлементом с очень узким рекомендуемым диетическим диапазоном. Рекомендуемая суточная доза селена составляет около 55 мкг/день, и ее можно комбинировать с определенным рационом питания. Селен в форме селеноцистеина является компонентом 25 классов селенопротеинов, включая GPx, селенопротеины P, W и R и тиоредоксины (TrxR). В качестве антиоксиданта он обеспечивает защиту от вызванного АФК повреждения клеток .
Основными селенопротеинами головного мозга являются P и GPx: первый из них был идентифицирован в сенильных бляшках и нейрофибриллярных клубках, что указывает на его важную роль в борьбе с окислительными повреждениями, GPx, который нейтрализует перекиси, экспрессируется нейронами и глиальными клетками.
Биосинтез селенопротеинов зависит от доступности селена. Таким образом, адекватное потребление селена может быть особенно важным для поддержания функции у пожилых людей [57].
Его концентрация в мозгу изменяется у больных болезнью Альцгеймера и рассеянным склерозом; следовательно, этот элемент может играть важную роль в защите от нейродегенерации Учитывая, что пожилые люди более подвержены дефициту селена из-за метаболических изменений, более низкой биодоступности и изменений в рационе в нескольких исследованиях была выдвинута гипотеза о возможности экзогенного поступления селена для предотвращения болезней, связанных со старением.
Коэнзим Q10
Коэнзим Q10 (CoQ10) (2,3-диметокси-5-метил-6-декапренил-1,4-бензохинон) представляет собой жирорастворимое соединение, также известное как CoQ10, витамин Q10, убидекаренон или убихинон. Эндогенное вещество вырабатывается митохондриями в дозах около 3–5 мг в сутки. Это один из основных элементов, участвующих в митохондриальном окислительном фосфорилировании, и действует как антиоксидант. Исследования in vitro показали, что CoQ10 легко проникает через гематоэнцефалический барьер.
Благодаря своим окислительным и антиоксидантным свойствам он является модулятором окислительно-восстановительного состояния клеток. CoQ10 находится во внутренней митохондриальной мембране и защищает клетки от апоптоза на морфологическом и молекулярном уровне Кроме того, как липофильный антиоксидант, он может удалять радикалы из мембран, цитозоля и плазмы.Кроме того, он играет важную роль в патогенезе БП. Фактически, уровень CoQ10 значительно ниже нормы в митохондриях нейронов и тромбоцитов у пациентов с БП. Исследования in vitro на фибробластах пациентов с БП показали, что прием CoQ10 восстанавливает активность электрон-транспортной цепи. О первых клинических исследованиях нейропротекторных эффектов CoQ10 были сообщения еще 1994: это исследование продемонстрировало связь между приемом CoQ10 в течение 16 месяцев (1200 мг в день) и снижением функционального спада (44 %) у пациентов с болезнью Паркинсона. Мюллер с соавторами подтвердили эти данные: 28 пациентов с БП продемонстрировали умеренное улучшение симптомов благодаря пероральному введению CoQ10 (360 мг в день) [58].
Антиоксидантный потенциал CoQ10 был дополнительно оценен в пилотном исследовании на пациентах с синдромом Ретта, тяжелым нарушением развития нервной системы, при котором индуцированный гипоксией окислительный стресс связан с патогенезом и прогрессированием заболевания. После 12-месячного приема CoQ10 (300 мг/день) наблюдалось значительное улучшение энергетического статуса эритроцитов, что свидетельствует об ослаблении окислительного стресса [59–64].
Многообещающие результаты были также получены в двойном слепом рандомизированном клиническом исследовании с участием пациентов с ремиттирующе-перемежающимся рассеянным склерозом. Экспериментальная группа принимала 500 мг CoQ10 в течение 12 недель и показала значительное снижение маркеров воспаления, таких как фактор некроза опухоли α (TNF-α), интерлейкин 6 (IL-6) и матриксная металлопротеиназа 9 (MMP-9).
Исследование группы соавторов выявило влияние CoQ10 и миметика miR-149-5p на miR-149-5p, MMPs и тирозингидроксилазу в моделях крысиной PD. Это взаимодействие стало основой для понимания того, как противодействовать нейродегенерации при БП. Исследование показало, что комбинация микроРНК миР-149 и CoQ10 способна предотвращать окислительное повреждение дофаминергических нейронов и улучшать двигательную функцию, вызванную инъекцией 6-гидроксипопамина, за счет уменьшения матрикса металлопротеиназы 2,9 на животной модели [64]. Перспективны разработки эффективных метаболических средств связаны с митохондриально-адресованными антиоксидантами: SkQ, в соответствии с представлениями о митохондриальной дисфункции. Показано, что SkQ соединения быстро восстанавливаются I и II комплексами дыхательной цепи, являются регулируемыми АО многократного действия. Известно, что митохондриальные АФК, индуцированные β-амилоидом, могут способствовать гиперфосфорилированию тау-белка. Митохондриально-адресованные АО предотвращают такие гиперфосфорилирования.
При изучении липидограммы, не смотря на отсутствие достоверных отличий снижения холестерина, выявлено достоверное снижение ЛПНП и триглицеридов.
Основные компоненты ферментативной антиоксидантной защиты включают супероксиддисмутазу, глутатионпероксидазу и редуктазу, глутамилтранспептидазу и каталазу, тогда как неферментативные эндогенные антиоксиданты включают глутатион (GSH), мочевую кислоту, убихинон, токоферол, ретинол, мелатонин и ядерный фактор эритроид 2, сопутствующий фактор 2.
Из-за сложной природы НЗД рекомендуется многоцелевой подход к лечению, так как он может оказывать дополнительные положительные эффекты. При рассмотрении роли перекисного окисления липидов в развитии и прогрессировании НДЗ необходимы дальнейшие исследования с применением антиоксидантных препаратов при различных формах НДЗ.
ЗАКЛЮЧЕНИЕ
Подводя итог вышесказанному, следует отметить, что фармакологическая регуляция образования АФК может рассматриваться в двух аспектах: прямым антирадикальным действием, т.е. непосредственным действием на АФК их связыванием или путем повышения действия активности ферментов АОЗ. Антиоксиданты блокируют индуцированный АФК апоптоз, ослабляют нарушения, связанные с гипоксией, снижают уровень токсических проявлений. В этом плане особенно привлекают внимание «физиологически совместимые» антиоксиданты. Это вещества, являющиеся сопрягающими редокс-факторами, поддерживающими показатели гомеостаза в экстремальной ситуации. Они способны в качестве составной части физиологической системы воздействовать на молекулярные мишени, синхронизируя метаболические реакции.
Препараты, одобренные FDA, такие как ингибиторы ацетилхолинэстеразы (донепезил, ривастигмин), а также леводопа для лечения БП, которые преодолевают гематоэнцефалический барьер и восстанавливают уровень дофамина в черной субстанции, только облегчают симптомы и замедляют прогрессирование заболеваний в течение нескольких лет. Новые терапевтические подходы, направленные на нейрорегенерацию, т.е. структурное и функциональное восстановление поврежденной нервной системы посредством иммуномодуляции, ингибирования образования белковых агрегатов, дезагрегации неправильно свернутых белков и индукции аутофагии, дают надежду на то, что процесс дегенерации пораженных нейронов может замедлиться, а скорость восстановления и продолжительность жизни увеличатся.
- Vorobyeva O. V. Oxidative stress associated with cerebrovascular dysfunction: possibilities of therapy, Farmateka, 5, 44 (2010).
- Gomazkov O.A. Cellular and molecular principles of brain aging, Successes of modern biology, 132(2), 141 (2012).
- Duma S. N. The possibilities of antioxidant therapy for asthenia and cognitive deficits in elderly patients with chronic cerebral ischemia, Therapeutic archive, 12, 100 (2013).
- Goncharova Z. A., Kolmakova T. S., Oksenjuk O. S., Morgul E. V., Gelpey M. A., Mutalieva Kh. M., Alpha-synuclein and oxidative stress enzymes as bio-markers of Parkinson’s disease, Neurochemistry, 34, 2, 99 (2017) https://doi.org/10.7868/S1027813317020066. (In Russ.)
- Mikashinovich Z. I., Telesmanich N. R., Smirnova O. B., Chernogubova E. A. Вiomarkers of oxidative stress and proteopathies in the diagnosis of neurodegenerative diseases, Molekular medicine, 2, 16 (2024) https://doi.org/10.29296/24999490-2024-02-03. (In Russ.)
- Taylor J. P, Jr. Brown H. R., Don Cleveland W., Taylor J. P. Neurodegenerative diseases: G-quadruplex poses quadruple threat, Nature, 507, 175 (2014).
- Goncharova Z. A., Kolmakova T .S., Oxenyuk O. S., Morgul E. V., Gelpey M. A., Kalmykova Yu. A., Smirnova O. B., Mutalieva H. M. Multi-parametric assessment of biochemical markers of blood in Parkinson’s disease, Practical medicine, 10, 87 (2018) Doi:10.32000/2072-1757-2018-10-87-91
- Efimova M. Yu., Ivanova N. E., Alekseeva T. M., Ivanov A. Yu., Tereshin A. E., Makarov A. O., Reshetnik D.A. Molecular biomarkers of cognitive impairment in ischemic stroke. Medical Bulletin of the North Caucasus, 14, 3, 567 (2019). https://doi.org/10.14300/mnnc.2019.14121
- Reed T. T. Lipid peroxidation and neurodegenerative disease, Free Radical.Biol. Med. 51, 1302 (2011) doi: 0.1016/j.freeradbiomed.2011.06.02732.
- Miller E., Markiewicz L., Kabzinski J., Odrobina D., Majsterek I., Miller E. et al. Potential of redox therapies in neurodegenerative disorders. Front Biosci (Elite Ed), 1, 9, (2), 214 (2017) doi: 10.2741/e797
- Litvinenko I. V. Fundamental and methodological aspects of the study of progressive diseases of the central nervous system, Bulletin of the National Society for the Study of Parkinson’s Disease and movement Disorders, 2, 127 (2022) DOI: 10.24412/2226-079X-2022-12449 2
- Domanskyi A., Parlato R., Oxidative Stress in Neurodegenerative Diseases. Antioxidants, 11, 3, 504 (2022). https://doi.org/10.3390/antiox11030504
- García-Sánchez A., Miranda-Díaz A. G., Cardona-Muñoz E. G. The Role of Oxidative Stress in Physiopathology and Pharmacological Treatment with Pro- and Antioxidant Properties in Chronic Diseases, Oxid Med Cell Longev, 20, 82, 145 (2020). doi: 10.1155/2020/2082145
- Miller E., Walczak A., Saluk J., Ponczek M. B., Majsterek I. Oxidative modification of patient’s plasma proteins and its role in pathogenesis of multiple sclerosis, Clinical Biochemistr, 45, 1-2, 26 (2012).
- Vilkov G. A., Smirnova O. B., Mezhova L. I. Correction of neuroimmune reactions by regulation of lipid peroxidation. Bulletin of Experimental Biology and Medicine. 116, 10, 364 (1993) (in Russian).
- Novikov V. E., Levchenkova O. S., Pozhilova Ye. V., Senerzhova E. V. The role of reactive oxygen species in cell physiology and pathology and their pharmacological regulation, Reviews on clinical pharmacological and drug therapy, 12, 4, 13 (2014).
- Steinert, J. R., Chernova T., Forsythe I. D. Nitric oxide signaling in brain function, dysfunction, and dementia, Neuroscientist, 16, 435 (2010). doi: 10.1177/1073858410366481
- Sidorova Y., Domanskyi A. Detecting Oxidative Stress Biomarkers in Neurodegenerative Disease Models and Patients, Methods Protoc, 3, 4, 66 (2020) doi: 10.3390/mps3040066
- Roberts R. A., Laskin D. L., Smith C. V., Robertson F. M., Allen E. M., Doorn J. A., Slikker W. Roberts R. A. Nitrative and oxidative stress in toxicology and disease, Toxicological sciences, 112, 1, 4 (2009).
- García-Sánchez A., Miranda-Díaz A. G., Cardona-Muñoz E. G. The Role of Oxidative Stress in Physiopathology and Pharmacological Treatment with Pro- and Antioxidant Properties in Chronic Diseases, Oxid Med Cell Longev, 23, 2082145 (2020) doi: 10.1155/2020/2082145.
- Gomazkov O. A. Cellular and molecular principles of brain aging, Uspekhi sovremennoi biologii, 132, 2, 141 (2012) (In Russ.).
- Kirova Yu. I., Shakova F. M., Germanova E. L., Romanova G. A., Voronina T. A. The effect of Mexidol on cerebral mitochondriogenesis at a young age and during aging, S. S. Korsakov Journal of Neurology and Psychiatr, 120, 1, 62 (2020). https://doi.org/10.17116/jnevro202012001162
- Levin O. S., Bogolepova A. N. Cognitive rehabilitation of patients with neurodegenerative diseases, Zhurnal nevrologii i psikhiatrii im. S.S. Korsakova, 120, 5, 110 (2020). doi: 10.17116/jnevro2020120051110 (in Russ)
- Janssens J., Kleinberger G., Wils H., Van Broeckhoven C., The role of mutant TAR DNA-binding protein 43 in amyotrophic lateral sclerosis and frontotemporal lobar degeneration, Biochem Soc Trans, 39, 4, 954. (2011) doi: https://doi.org/10.1042/BST0390954
- Ivonina N. A., Petrov K. B. The use of neurotropic therapy in young patients with postcovid syndrome, S. S. Korsakov Journal of Neurology and Psychiatry, 122, 3, 126 (2022). https://doi.org/10.17116/jnevro2022122031126
- Uddin M. S., Tewari D., Sharma G., Kabir M. T., Barreto G. E., Bin-Jumah M. N., Perveen A., Abdel-Daim M. M., Ashraf G. M. Molecular Mechanisms of ER Stress and UPR in the Pathogenesis of Alzheimer’s Disease, Mol. Neurobiol, 57, 2902 (2020). DOI: 10.2174/1568026620666200422105156
- Mondragón-Rodríguez S., Perry G., Zhu X., Boehm J. Amyloid beta and tau proteins as therapeutic targets for Alzheimer’s disease treatment: rethinking the current strategy, International Journal of Alzheimer’s Disease, 7, 630182 (2012).
- Ellis G., Fang E., Maheshwari M., Roltsch E., Holcomb L., Zimmer D., Martinez D., Murray I. V., Lipid oxidation and modification of amyloid-β (Aβ) in vitro and in vivo, Journal of Alzheimer’s Disease, 22, 2, 593 (2010).
- Savelieff M. G., Lee S., Liu Y., Lim M. H. Untangling amyloid-β, tau, and metals in Alzheimer’s disease, ACS Chemical Biology, 8, 856 (2013).
- Abramov A. Y., Berezhnov A. V., Fedotova E. I., Zinchenko V. P., Dolgacheva L. P. Interaction of misfolded proteins and mitochondria in neurodegenerative disorders, Biochemical Society Transactions, 45, 4, 1025 (2017). doi: ssmj.ru/en/2020/1/336.
- Goncharova Z. A., Kolmakova T. S., Oksenyuk O. S., Morgul E. V., Gelpey M. A., Vlasova N. D., Smirnova O. B., Mutalieva Н. M., Possible laboratory and instrumental markers of Parkinson’s disease Saratovskij nauchno-medicinskij zhurnal., 16, 1, 336 (2020). doi: ssmj.ru/en/2020/1/336
- Gros-Louis F., Gaspar C., Rouleau G. A. Genetics of familial and sporadic amyotrophic lateral sclerosis. Biochim. Biophys. Acta, 1762, 956 (2006).
- Hardiman O., Al-Chalabi A., Chio A., Corr E. M., Logroscino G., Robberecht W., Shaw P. J. Simmons Z., van den Berg L. H. Amyotrophic lateral sclerosis., Nat. Rev. Dis. Prim., 3, 1707 (2017). DOI: 10.1038/nrdp.2017.71
- Taylor J. P., Brown R. H. J., Cleveland D. W., Decoding ALS: From genes to mechanism, Nature, 539, 197 (2016). DOI: 10.1038/nature20413
- Rakhit R., Crow J. P., Lepock J. R., Kondejewsk L. H., Cashman N. R., Chakrabartty A., Monomeric Cu,Zn-superoxide dismutase is a common misfolding intermediate in the oxidation models of sporadic and familial amyotrophic lateral sclerosis, J. Biol. Chem., 279, 15499 (2004)
- Blasco H., Garcon G., Patin F., Veyrat-Durebex C., Boyer J., Devos D., Vourc’h P., Andres C. R., Corcia P. Panel of Oxidative Stress and Inflammatory Biomarkers in ALS: A Pilot Study, Can. J. Neurol. Sci., 44, 90 (2017). DOI: 10.1017/cjn.2016.284
- Rosen D. R., Siddique T., Patterson D., Figlewicz D. A., Sapp P., Hentati A., Donaldson D., Goto J., O’Regan J. P., Deng H. X., Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis, Nature, 362, 59 (1993).
- Zou Z., Zhou Z., Che C., Liu C., He R., Genetic epidemiology of amyotrophic lateral sclerosis: A systematic review and meta-analysis, J. Neurol. Neurosurg. Psychiatry., 88, 540, 193 (2017). DOI: 10.1136/jnnp-2016-315018
- Guareschi S., Cova E., Cereda C., Ceroni M., Donetti E., Bosco D. A., Trotti D., Pasinelli P., An over-oxidized form of superoxide dismutase found in sporadic amyotrophic lateral sclerosis with bulbar onset shares a toxic mechanism with mutant SOD1, Proc. Natl. Acad. Sci. USA, 109, 5074 (2012). DOI: 10.1136/jnnp-2016-315018
- Saccon R. A., Bunton-Stasyshyn R. K. A., Fisher E. M. C., Fratta P. Is SOD1 loss of function involved in amyotrophic lateral sclerosis, Brain, 136, 2342 (2013). DOI: 10.1093/brain/awt097
- Forsberg K., Andersen P. M., Marklund S. L, Brännström T. Glial nuclear aggregates of superoxide dismutase-1 are regularly present in patients with amyotrophic lateral sclerosis, Acta Neuropathol., 121, 62 (2011). DOI: 10.1007/s00401-011-0805-3
- Petrovic S., Medic D., Cvetkovic Z., Arsic A., Vucic V., Lipid Peroxidation and Antioxidant Supplementation in Neurodegenerative Diseases: A, Review of Human Studies. Antioxidants (Basel), 9, 11, 1128 (2020). DOI: 10.3390/antiox9111128.
- Shchulkin A. V. A modern concept of antihypoxic and antioxidant effects of mexidol, S. S. Korsakov Journal of Neurology and Psychiatry, 118, 12‑2, 87 (2018). (In Russ.) https://doi.org/10.17116/jnevro201811812287
- Wang M., Liu Z., Sun W., Yuan Y., Jiao B., Zhang X., Shen L., Jiang H., Xia K., Tang B. Association Between Vitamins and Amyotrophic Lateral Sclerosis: A Center-Based Survey in Mainland China. Front. Neurol., 11, 488 (2020) DOI: 10.3389/fneur.2020.00488
- Katasonov A. B., Anthocyanins for the prevention and treatment of neurodegenerative diseases, S. S. Korsakov Journal of Neurology and Psychiatry, 122, 4, 16 (2022) (In Russ.) https://doi.org/10.17116/jnevro202212204116
- Chukanova E. I., Chukanova A. S., Mamayeva Kh. I. The results of the study of the efficacy and safety of mexidol in patients with chronic cerebral ischemia, S. S. Korsakov Journal of Neurology and Psychiatry, 115, 2, 71 (2015). https://doi.org/10.17116/jnevro20151152171-74
- Stakhovskaya L. V., Shamalov N. A., Khasanova D. R., Mel’nikova E. V., Agafiina A. S., Golikov K. V., Bogdanov É. I., Yakupova A. A., Roshkovskaya L. V., Lukinykh L. V., Lokshtanova T. M., Poverennova I. E., Shchepankevich L. A. Results of a randomized double blind multicenter placebo-controlled, in parallel groups trial of the efficacy and safety of prolonged sequential therapy with mexidol in the acute and early recovery stages of hemispheric ischemic stroke (EPICA), S. S. Korsakov Journal of Neurology and Psychiatry, 117, 3‑2, 55 (2017) (In Russ.) https://doi.org/10.17116/jnevro20171173255-65
- Voronina T. A. Geroprotective effects of ethylmethylhydroxypyridine succinate in an experimental study. S. S. Korsakov Journal of Neurology and Psychiatry, 120, 4, 81 (2020) (In Russ.) https://doi.org/10.17116/jnevro202012004181
- Fedin A. I., Zakharov V. V., Tanashyan M. M., Chukanova E. I., Madzhidova E. N., Shchepankevich L. A., Ostroumova O. D. Results of an international multicenter, randomized, double-blind, placebo-controlled study assessing the efficacy and safety of sequential therapy with Mexidol and Mexidol FORTE 250 in patients with chronic brain isc hemia (MEMO), S. S. Korsakov Journal of Neurology and Psychiatry = Zhurnal nevrologii ipsikhiatrii imeni S. S. Korsakova, 121, 11, 7 (2021). (In Russ.). doi.org/10.17n6/jnevro202H2Hn7
- Levin O. S., Diagnosis and treatment of cognitive impairment and dementia in clinical practice, MEDpress-inform, 2021 (ICBN:978-5-907632-94-3).
- Karpov S. M., Morozova M. Yu., Muravyov K. A., Vyshlova I. A., Kantemirova F. S. Study of the efficacy and safety of sequential use of the drugs Mexidol and Mexidol FORTE 250 in the treatment of stroke, Zhurnal Nevrologii I Psikhiatrii imeni S. S. Korsakova, 122, 3‑2, 59 (2022). https://doi.org/10.17116/jnevro202212203259
- Zakharov V. V., Tkacheva O. N., Mkhitaryan E. A., Fedin A. I. Efficacy of Mexidol in patients with chronic brain ischemia and cognitive impairment of different age groups (results of sub-analysis of the international multicenter, randomized, double-blind, placebo-controlled study of sequential therapy in patients with chronic brain ischemia MEMO). S. S. Korsakov Journal of Neurology and Psychiatry = Zhurnal nevrologii i psikhiatrii imeni S. S. Korsakova, 122, 11, 2, 73 (2022). (In Russ.). DOI: 10.17116/jnevro202212211273
- Antipenko E. A., Shulyndin A. V., Belyakov K. M., Neurometabolic therapy of mild cognitive impairment in patients with chronic cerebral ischemia, S. S. Korsakov Journal of Neurology and Psychiatry, 124, 3, 42 (2024). (In Russ.) https://doi.org/10.17116/jnevro202412403142
- Shchepankevich L. A., Nikolaev Yu. A., Taneeva E. V., Pervuninskaya M. A., Shchepankevich M. S., The efficacy and safety study of Mexidol and Mexidol FORTE 250 in patients with chronic cerebral ischemia, S. S. Korsakov Journal of Neurology and Psychiatry. 121, 10, 32 (2021). (In Russ.) https://doi.org/10.17116/jnevro202112110132
- Kirova Yu. I., Shakova F. M., Germanova E. L., Romanova G. A., Voronina T. A. The effect of Mexidol on cerebral mitochondriogenesis at a young age and aging, Zhurnal nevrologii i psikhiatrii im S. S. Korsakova, 120, 1, 62 (2020). (In Russ.). DOI: 10.17116/jnevro202012001162
- Zhuravleva M. V., Shchukin I. A., Fidler M. S., Prokofiev A. B., Serebrova S. Yu., Vasyukova N. S., Demchenkova E. Yu., Arkhipov V. V. Efficacy and safety of ethylmethylhydroxypyridine succinate in patients with ischemic stroke, S. S. Korsakov Journal of Neurology and Psychiatry, 120, 12‑2, 60 (2020). (In Russ.) https://doi.org/10.17116/jnevro202012012260
- Steinbrenner H., and Sies H. Selenium homeostasis and antioxidant selenoproteins in brain: implications for disorders in the central nervoussystem, Arch. Biochem. Biophys. 536, 152 (2013). doi: 10.1016/j.abb.2013.02.021.
- Hanan S., El-Abhar Hanan M., Abd-El Gawad, Dalaal M., Abdallah and Hanan S., El-Abhar, Rotenone-induced Parkinson`s Like Disease: Modulating Role of Coenzyme Q10. Journal of Biological Sciences, 4, 8, 568 (2004). DOI: 10.3923/jbs.2004.568.574
- Ghasemloo E., Mostafavi H., Hosseini M., Forouzandeh M., Eskandari M., and Mousavi S. S., Neuroprotective effects of coenzyme Q10 in Parkinson’s model via a novel Q10/miR-149-5p/MMPs pathway, Metab. Brain Dis., 36, 2089 ( 2021)
- Javier F., Jiménez J. Coenzyme Q10 and Parkinsonian Syndromes: A Systematic Review, Journal of Personalized Medicine, 12, 6, 975 (2022). doi: 10.3390/jpm12060975
- Sandro Huenchuguala, Juan Segura-Aguilar, Targets to Search for New Pharmacological Treatment in Idiopathic Parkinson’s Disease According to the Single-Neuron Degeneration Model, Biomolecules, 14, 6, 673 (2024). doi: 3390/biom14060673, 14, 6, (673),(2024).
- Yubero-Serrano Elena M., Francisco M. Gutierrez-Mariscal, Antonio Garcia-Rios, Javier Delgado-Lista, Pablo Pérez-Martinez, Antonio Camargo, Francisco Perez-Jimenez, Jose Lopez-Miranda, Coenzyme Q10 as an antioxidant in the elderly, Aging, 165 (2020). doi:10.1016/B978-0-12-818698-5.00016-X
- Genova M.., Pich M. M., Biondi A., Bernacchia A., Falasca A., Bovina C., Formiggini G. Parenti, Castelli G., Lenaz G., Mitochondrial Production of Oxygen Radical Species and the Role of Coenzyme Q as an Antioxidant. Experimental Biology and Medicine, 5, 506 (2016). doi: 10.1177/15353702-0322805-14
- Di Pierro D., Ciaccio C., Sbardella D., Tundo G. R., Bernardini R., Curatolo P., Cinzia G., Coletta M., Marini S. Effects of oral administration of common antioxidant supplements on the energy metabolism of red blood cells. Attenuation of oxidative stressinduced changes in Rett syndrome erythrocytes by CoQ, Mol. Cell. Biochem, 463, 5, 101 (2020). doi: 10.1007/s11010-019-03633-5

