OPTIMIZATION OF NUTRITION MEDIA AND CONDITIONS FOR IN VITRO CULTIVATION OF EVERNIA PRUNASTRI (L.) ACH.
ОПТИМИЗАЦИЯ ПИТАТЕЛЬНЫХ СРЕД И УСЛОВИЙ КУЛЬТИВИРОВАНИЯ IN VITRO ЭВЕРНИИ СЛИВОВОЙ EVERNIA PRUNASTRI (L.) ACH.
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №3, 2024
Publication text (PDF): Download
UDK: (57.017.64+57.084.5):582.29
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Teplitskaya L. M., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia
Goncharov M. A., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia
Semenova E. F., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia; Sevastopol State University, Sevastopol, Russia
Chernyakov D. I., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia
Shatunova S. V., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russia
Kalaeva E. A., Voronezh State University, Voronez, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-3-219-229
PAGES:from 219 to 229
STATUS:Published
LANGUAGE:Russian
KEYWORDS: introduction, culture under controlled conditions, selection of nutrient media, Evernia prunastri, biologically active compounds.
ABSTRACT (ENGLISH):
The work investigated the optimization of nutrient media and in vitro cultivation conditions of the lichen E. prunastri. A study of the growth and development of the culture under controlled conditions revealed a number of patterns at the morphometric and biochemical level. To select optimal conditions for in vitro cultivation of natural isolates, it was adopted to use various variants of the Murashige-Skoog nutrient medium with the addition of alcohol extracts or aqueous decoctions of bark from plants on which the lichen grows naturally (oak, apple, sloe, pear). The growth parameters of E. prunastri isolates have been established. The influence of cultivation conditions on the development of lichen in vitro and the production of biologically active pharmacologically valuable substances was studied. The viability and level of biomass accumulation of E. prunastri isolates from various natural habitats on Hoagland’s medium varied significantly (3–13 times), which indicates the need to select a highly active producer. The size of lichen cells when grown in vitro in a liquid nutrient medium is higher than in natural conditions (by 20.0–38.5 %%). It has been shown that the best medium for the accumulation of biomass and biologically active compounds (lichen acids, chlorophyll) is the Murashige-Skoog variant with the addition of apple bark decoction when grown in diffused light
(1000–1500 lux) with a 16-hour photoperiod, temperature 18+1oC and humidity 90+5 %. The chemical analysis of the raw materials of cultivated and wild-growing lichen, as well as the resinoid (thick extract) based on it, indicates a similar qualitative and quantitative composition, which indicates the prospects of the biotechnology for their production. A comparative assessment of natural isolates of E. prunastri and determination of the possibilities of their cultivation in vitro in connection with the development of innovative lichen technology significantly expands the understanding of the biotechnological aspects of obtaining the “oak moss” resinoid (thick Evernia extract) for use in the perfumery, cosmetics, food and pharmaceutical industries as an odor fixer, aromatic and pigment flavoring agent, a source of biologically active pharmacologically effective compounds.
ВВЕДЕНИЕ
Лишайники с древних времен применяются в качестве лекарственных средств и включены в фармакопеи различных стран (Государственная Фармакопея Российской Федерации, Британская Фармакопея и др.). По современной классификации лишайники относятся к лекарственным растениям, содержащим простые фенолы С6-С1-ряда, оказывающие антисептическое, противоожоговое, регенерирующее действие [1]. В качестве лекарственного сырья для получения натриевой соли кислоты усниновой, имеющей флороглюциновую природу, используют собранные в течение года на почве или стволах различных деревьев и высушенные слоевища следующих видов лишайников: эверния мезоморфная (э. кустовидная) Evernia mesomorpha
Nyl. = E. thamnoides (Flot.) Arn., э. несоредиозная E. esorediosa (Muell. Arg.) Du Rietz., э. сливовая (лентец крупинчатый) E. prunastri Ach. – сем. Уснеевые Usneaceae.
Качество сырья официнальных видов лишайников в Российской Федерации регламентирует ФС 42-766-73, ГОСТ 13727-68, ГОСТ 21565-76 [2]. Сырье и извлечения из него применяют как возбуждающее аппетит, обволакивающее, противовоспалительное и гомеопатическое средство. Слоевища входят в состав грудных и желудочных сборов (чаев), биологически активных добавок к пище [3].
В настоящее время наиболее востребованным сырьем являются высушенные слоевища кустистых лишайников Лентеца крупинчатого или Эвернии сливовой E. prunastri Ach. (сем. Уснеевые Usneaceae). При этом популяции данного вида в Крыму ограничены и сборы этого растения существенно сокращают природные ресурсы [4]. Проведенный нами контент-анализ источников научной литературы и собственные исследования свидетельствуют о том, что из 15 фармакопейных видов на Крымском полуострове встречаются некоторые, относящиеся к 3 семействам: Parmeliaceae, Cladoniaceae, Usneaceae. Наиболее часто встречающимся видом является Evernia prunastri (на стволах дуба пушистого и клена Стевена, на коре сосны крымской и терна (син. терновник, слива колючая) [5].
Целью настоящего исследования явились сравнительная оценка природных изолятов Е. prunastri и определение возможностей их выращивания в культуре in vitro в связи с разработкой инновационной лихенотехнологии.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследования служили образцы «дубового мха» — Лентеца крупинчатого или Эвернии сливовой E. prunastri Ach. (сем. Уснеевые Usneaceae), собранные в естественных местообитаниях Крымского полуострова (рис. 1): Пионерское Симферопольского района (яблоня), окрестности Бахчисарая (терн), Сатера Алуштинского района (груша), окрестности Балаклавы (сосна), окрестности Белогорска (дуб).


Рис. 1. Лентец крупинчатый или Эверния сливовая Evernia prunastri Ach. (сем. Уснеевые Usneaceae), собранные в окрестностях Пионерского Симферопольского района Республики Крым.
После поверхностной обработки в парах этилового спирта фрагменты лишайника размером 1 см2 для первичного скрининга (индикации наличия или отсутствия посторонней микрофлоры, жизнеспособности и накопления биомассы) помещали в 10-кратной повторности на фильтровальную бумагу в чашках Петри в жидкую модифицированную среду Хогланда, содержащую только минеральные компоненты [6]. Влажность в процессе культивирования поддерживалась на уровне 90+5 % («влажная камера») при различных условиях освещенности: полной темноте, рассеянном свете (1000–1500 люкс) и естественном освещении (2500–3000 люкс); 16-часовом фотопериоде и температуре 18+1 °С. На следующем этапе высокоактивный изолят выращивали в 9 модификациях среды Мурасиге-Скуга (МС) [7]: МС (контроль); МС + отвар терна; МС+ спиртовый экстракт терна; МС + отвар дуба; МС + спиртовый экстракт дуба; МС + отвар яблони; МС + спиртовый экстракт яблони; МС + отвар груши; МС + спиртовый экстракт груши. Отвары и экстракты коры дуба, яблони, терна, груши готовили согласно Государственной Фармакопее РФ [8] и добавляли к основной среде в количестве 1 % (по объему).
Выделение ароматообразующих соединений осуществляли методами экстракции и дистилляции [9]. Для количественного определения эфирного масла и воска использовали методику, предложенную в European Pharmacopoeia [10].
Определение химического состава и пробоподготовку [11, 12] осуществляли общепринятыми методиками: обезжиренного остатка в аппаратах Сокслета – содержание жира [13]; титрования в аппарате Кьельдаля – содержание протеина [14]; содержание клетчатки – по Геннебергу и Штоману в модификации ЦИНАО [15]. Содержание воды, золы определяли по ГФ XV (2023), лишайниковых кислот с использованием в качестве экстрагента ацетона – по Касьяновой и Корчикову [16]. Все измерения проведены в пятикратных аналитических повторностях.
Для количественного определения хлорофилла и каротиноидов в сырье использовали спектрофотометрический метод. Для этого 5 г (точная навеска, степень измельчения – 0.5 мм) помещали в колбу вместимостью 100 мл и экстрагировали с 25 мл экстрагента: гексан х.ч. и этиловый спирт 95 % при перемешивании 1.5 ч. Затем фильтровали через бумажный фильтр. Отбирали 1 мл извлечения в мерную колбу на 25 мл и доводили раствором до метки. Определяли оптическую плотность на спектрофотометре СФ-104 (спектральный диапазон длин волн, нм 190–1100; видимый диапазон – вольфрамовая галогеновая лампа, УФ-диапазон – дейтериевая лампа) при длине волны 450 нм (для каротина) и 664 нм (для хлорофилла), в кювете с толщиной слоя 10 мм относительно экстрагента: гексана – для каротина, этилового спирта – для хлорофилла. В качестве раствора сравнения использовали воду очищенную [17–19].
Математическую обработку данных проводили с помощью статистической программы STATISTICA 10.0 при уровне значимости α<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как показал первичный скрининг эксплантов на среде Хогланда, в большинстве случаев не отмечено присутствие посторонней микрофлоры, что свидетельствует об эффективности применяемой нами поверхностной обработки при введении в культуру лишайника. Испытание первичных культур при различных условиях освещенности: полной темноте, рассеянном свете (1000–1500 люкс) и естественном освещении (2500–3000 люкс) свидетельствует, что при темновом режиме преимущественное развитие имел микобионт молочно-белого цвета, при естественном – фотобионт (фикобионт) темно-зеленого цвета. Оптимальным для сохранения соотношения бионтов in vitro явился режим при 1000–1500 люкс (рассеянный свет), о чем судили по сохранению культурой цвета, присущего природному слоевищу. Визуальная оценка помещенных в условия «влажной камеры» фрагментов слоевища показала, что их жизнеспособность варьировала как по повторностям, так и по образцам сбора исходного материала. При этом около половины эксплантов в течение недели увеличили свои размеры до 1,5–2,0 см2. Уровень накопления биомассы изолятами E. prunastri из различных природных местообитаний (рис. 2) существенно различался (в 3–13 раз), что согласуется с результатами наших предыдущих исследований [20].

Рис. 2. Динамика накопления биомассы на среде Хогланда при рассеянном свете изолятами E. prunastri из различных природных местообитаний:
I – окрестности Балаклавы (сосна); II – окрестности Белогорска (дуб); III – Сатера Алуштинского района (груша); IV – окрестности Бахчисарая (терн); V – Пионерское Симферопольского района (яблоня).
Ростовые показатели различных образцов в процессе выращивания (табл. 1) также изменялись: как правило, в первые 16 суток скорость роста была выше, а ростовой индекс ниже, чем за весь период культивирования (32 суток). Однако, степень выраженности указанных показателей в динамике развития культур была наибольшей у образцов №1 и №2 с минимальным уровнем накопления биомассы (20–60 мг). Поэтому для дальнейшего изучения был отобран образец № 5 – изолят с яблони (Пионерское Симферопольского района).
Морфометрический анализ слоевища на вариантах среды Мурасиге-Скуга в сравнении с E. prunastri, выросшей в природных условиях, и на среде Хогланда (рис. 3) показал, что размеры клеток при выращивании в жидкой питательной среде выше, чем в природных условиях (на 20,0–38,5 %%). Максимальными размерами они характеризовались на модифицированной среде Мурасиге-Скуга с добавлением отвара коры яблони, чему, по-видимому, способствовали биологически активные соединения этого производящего растения.
Таблица 1
Ростовые показатели изолятов E. prunastri на среде Хогланда
|
Номер образца |
Место сбора |
Продолжительность культивирования, сут |
Ростовой индекс (РИ) |
Скорость роста, мг/сут |
|
1 |
окрестности Балаклавы (сосна) |
16 |
14,00 |
0,88 |
|
1 |
окрестности Балаклавы (сосна) |
32 |
19,00 |
0,59 |
|
2 |
окрестности Белогорска (дуб) |
16 |
11,00 |
3,44 |
|
2 |
окрестности Белогорска (дуб) |
32 |
13,00 |
2,03 |
|
3 |
Сатера Алуштинского района (груша) |
16 |
8,33 |
7,81 |
|
3 |
Сатера Алуштинского района (груша) |
32 |
9,00 |
4,22 |
|
4 |
окрестности Бахчисарая (терн) |
16 |
8,50 |
10,63 |
|
4 |
окрестности Бахчисарая (терн) |
32 |
9,00 |
5,63 |
|
5 |
Пионерское Симферопольского района (яблоня) |
16 |
10,50 |
13,13 |
|
5 |
Пионерское Симферопольского района (яблоня) |
32 |
11,50 |
7,19 |
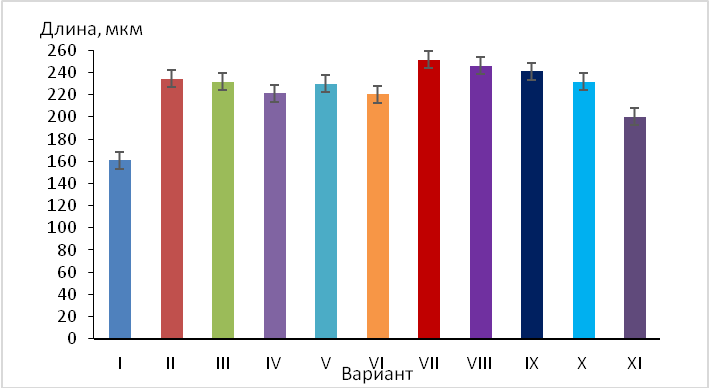
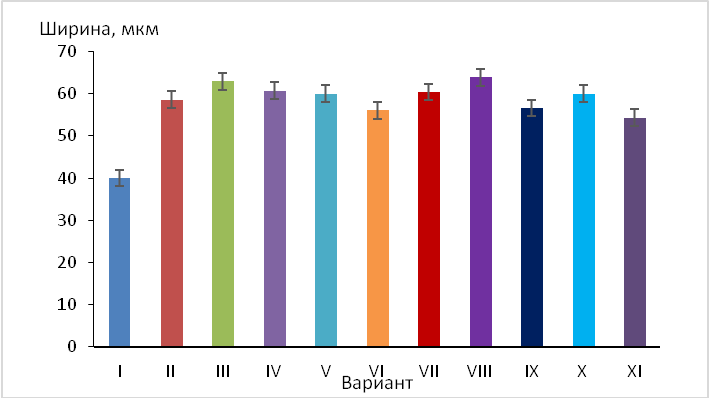
Рис. 3. Размеры клеток образца № 5 (изолята с яблони, Пионерское Симферопольского района) на вариантах среды Мурасиге-Скуга в сравнении с E. prunastri, выросшей в природных условиях, и на среде Хогланда:
I — Материнское слоевище в естественных условиях произрастания
II — Среда Мурасиге-Скуга
III — Среда Мурасиге-Скуга + отвар терна
IV — Среда Мурасиге-Скуга+ спиртовый экстракт терна
V — Среда Мурасиге-Скуга + отвар дуба
VI — Среда Мурасиге-Скуга + спиртовый экстракт дуба
VII — Среда Мурасиге-Скуга + отвар яблони
VIII — Среда Мурасиге-Скуга + спиртовый экстракт яблони
IX – Среда Мурасиге-Скуга + отвар груши
X — Среда Мурасиге-Скуга + спиртовый экстракт груши
XI – Среда Хогланда.
Проведенный сравнительный анализ воздушно-сухой биомассы E. prunastri, полученной в культуре in vitro, и выросшей в природных условиях, указывает на ее сходный качественный и количественный состав (табл. 2). При этом основные показатели резиноида (густого экстракта) E. prunastri («дубового мха») на основе этих видов растительного сырья также были близки (рис. 4). Полученные данные дополняют результаты наших исследований, приведенные ранее [4, 5, 20].
Таблица 2
Качественный и количественный состав E. prunastri, % от воздушно-сухой биомассы
|
Показатель |
Биомасса лишайника, полученная в культуре in vitro |
Биомасса лишайника, выросшего в природных условиях |
|
Лишайниковые кислоты |
5,37±0,32 |
5,60±0,34 |
|
Воск |
1,06±0,04 |
1,00±0,03 |
|
Эфирное масло |
0,05±0,01 |
0,05±0,01 |
|
Клетчатка |
11,93±3,02 |
9,51±2,08 |
|
Жир |
6,70±0,37 |
5,57±0,69 |
|
Протеин |
21,89±1,82 |
23,49±1,80 |
|
Хлорофилл, мг% |
7,89±1,69 |
4,31±1,06 |
|
Каротиноиды |
0,60±0,05 |
0,95±0,10 |
|
Зола |
12,46±1,20 |
9,28±1,03 |
|
Другие вещества |
30,43±2,07 |
32,22±2,15 |
|
Влажность |
10,51±1,00 |
12,34±1,89 |
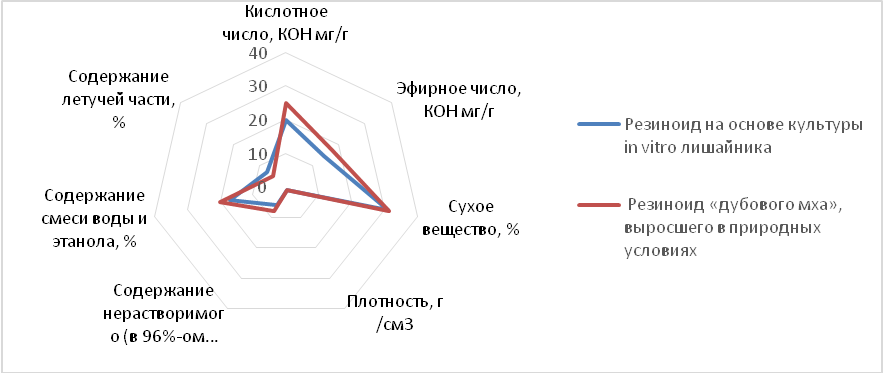
Рис. 4. Основные показатели резиноида (густого экстракта) E. prunastri, полученного на основе культуры in vitro в сравнении с резиноидом «дубового мха», выросшего в природных условиях.
Таким образом, сравнительная оценка природных изолятов Е. prunastri и определение возможностей их выращивания в культуре in vitro в связи с разработкой инновационной лихенотехнологии значительно расширяют представление о биотехнологических аспектах получения резиноида «дубового мха» (густого экстракта эвернии) для использования в парфюмерно-косметической, пищевой и фармацевтической промышленности в качестве фиксатора запаха, ароматического и пигментного корригента, источника биологически активных фармакологически эффективных соединений.
ЗАКЛЮЧЕНИЕ
- Жизнеспособность и уровень накопления биомассы изолятами E. prunastri из различных природных местообитаний на среде Хогланда существенно различались (в 3–13 раз), что указывает на необходимость отбора высокоактивного продуцента.
- Размеры клеток лишайника при выращивании in vitro в жидкой питательной среде выше, чем в природных условиях (на 20,0–38,5 %%).
- Проведенный сравнительный анализ сырья культивированного и дикорастущего лишайника, а также резиноида (густого экстракта) на его основе указывает на сходный качественный и количественный состав, что свидетельствует о перспективности биотехнологии их получения.
- Kurkin V. A. Pharmacognosy, 1239 p. (Samara: Ofort LLC; State Educational Institution of Higher Professional Education «SamGMU Roszdrava», 2007).
- Medicinal plant raw materials, 296 p. (M.: Standards Publishing House, 1980).
- Medicinal raw materials of plant and animal origin. Pharmacognosy, ed. G. P. Yakovlev, 845 p. (St. Petersburg: SpetsLit, 2006).
- Teplitskayа L. M., Kiriakidi E. P., Semyonova E. F., Goncharov M. A. State of research in lichen biotechnology, International Research Journal, 06 (108), 53 (2021). DOI: https://doi.org/10.23670/IRJ.2021.108.6.043
- Semenova E. F., Teplitskaya L. M., Goncharov M. A., Goncharov D. A. State and prospects of modern research in the biotechnology of lichens as medicinal raw materials, Bulletin of the State Nikitsky Botanical Garden, 140, 120 (2021).
- Andreev M. P., Gimelbrant D. E. Flora of lichens in Russia: Biology, ecology, diversity, distribution and methods of studying lichens, 392 p. (M.; St. Petersburg: Partnership of Scientific Publications KMK, 2014).
- Butenko R. G. Biology of cells of higher plants and biotechnology based on them, 159 р. (M.: FBK-Press, 1999).
- State Pharmacopoeia of the Russian Federation / Ministry of Health of the Russian Federation. XV ed. (Moscow, 2023). http://femb.ru/femb/pharmacopea.php
- Essential oils and their quality / V. S. Pashtetsky, L. A. Timasheva, O. A. Pekhova, I. L. Danilova, O. A. Serebryakova, 212 p. (Simferopol: IT “ARIAL”, 2021).
- European Pharmacopoeia. 10-е ed., Vol. I-III, Additions 10.1-10.8 (2019-2022).
- ISO 6497:2002. Animal feeding stuffs
- Starr C., McMillan B. Atoms and Elements, Human Biology, 11, 16 (2014).
- ISO 734-1:2006. Oilseed meals — Determination of oil content — Part 1: Extraction method 1 with hexane (or light petroleum)
- ISO 5983-1:2005. Animal feeding stuffs — Determination of nitrogen content and calculation of crude protein content – Part 1: Kjeldahl method
- Mashanov A. I., Velichko N. A., Tashlykova E. E. Bioconversion of plant raw materials, 223 p. (Krasnoyarsk state agrarian univ., 2014).
- Kasyanova A. P., Korchikov E. S. Using the microcrystallization method to assess the content of secondary metabolites of lichens, Samara Journal of Science, 11(4), 47 (2022). DOI: 10.55355/snv2022114106
- Ulyanovsky N. V., Kosyakov D. S., Bogolitsyn K. G. Development of express methods for analytical extraction of carotenoids from plant raw materials, Chemistry of plant raw materials, 4, 147 (2012).
- Karnjanawipagul P., Nittayanuntawech W., Rojsanga P., Suntornsuk L. Analysis of carotene in carrot by spectrophotometry, Mahidol University Journal of pharmaceutical science, 37(1-2), 8 (2010).
- Rahiman R., Mohd Ali M. A., Ab-Rahman M. S. Carotenoids concentration detection investigation: a review of current status and future trend, International Journal of bioscience, biochemistry and bioinformatics, 3(5), 446 (2013).
- Teplitskaya L. M., Semenova E. F., Kiriakidi E. P. Cyto- and histochemical studies of the lichen (L.) Ach. family Usneaceae in vitro culture, Plant biology and horticulture: theory, innovations, 159, 37 (2021). DOI: 10.36305/2712-7788-2021-2-159-37-47

