SYNTHESIS OF SELENIUM NANOPARTICLES STABILIZED WITH POLYVINYLPYRROLIDONE
СИНТЕЗ НАНОЧАСТИЦ СЕЛЕНА, СТАБИЛИЗИРОВАННЫХ ПОЛИВИНИЛПИРРОЛИДОНОМ
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №3, 2024
Publication text (PDF): Download
UDK: 541.64:532.77
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Panov D. A., V. I. Vernadsky Crimean Federal University, Simferopol, Crimea Republic, Russia
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-3-323-333
PAGES:from 323 to 333
STATUS:Published
LANGUAGE:Russian
KEYWORDS: nanoparticles, nanoselenium, cysteine, polymer stabilizers, polyvinylpyrrolidone, selenium-containing nanostructures.
ABSTRACT (ENGLISH):
In recent years, there has been an increase in publications devoted to the creation of new materials based on self-organized nanostructured composites of specified sizes and maintaining their stability for a long time. Nanosystems based on nanoselenium are of particular interest, as it is vital for humans and animals. However, in many regions of Russia, selenium deficiency is observed in agricultural soils. The least toxic and bioavailable is nanoscale selenium. Currently, the most widely used methods of chemical reduction of selenium ions in solutions using ascorbic acid, glucose, dithiourea and sulfur-containing amino acids. And high-molecular compounds are used as stabilizers, both natural (alginate, chitosan, arabinogalactan) and synthetic (polyethylene glycol, polyvinyl alcohol, polyvinylpyrrolidone). The aim of this work was the synthesis of self-organized selenium nanoparticles in a polyvinylpyrrolidone (PVP) matrix with different molecular weights. To establish the effect of the ratio of selenium–PVP components on the formation process, spectral and structural-morphological characteristics of selenium nanocomposites, as well as on their aggregative resistance to the environment.
Selenium nanoparticles were obtained by chemical reduction of sodium selenite with L-cysteine, in the presence of PVP grade «Kollidon® 30» (K-30) and grade «Kollidon® 90 F» (K-90). The viscometric method was used to determine the medium-viscosity molecular weights of two PVP samples (grades K-30 and K-90). The control of the aggregate stability of the obtained selenium nanoparticles was carried out by spectrophotometric and potentiometric methods.
As a result of this work, new bioactive systems based on selenium nanoparticles and a nonionic polymer – polyvinylpyrrolidone with different molecular weights were synthesized. The formation of selenium nanoparticles in the zero-valence state in aqueous solutions of PVP, which are sufficiently stable for 4–5 weeks, has been established by UV spectroscopy. It was found that the concentration and molecular weight of PVP do not significantly affect the structure and size of selenium nanoparticles, but affect the aggregate stability and «lifetime» of nanosystems.
ВВЕДЕНИЕ
В литературе последних лет наблюдается рост публикаций, посвящённых созданию новых материалов на основе самоорганизованных наноструктурированных композитов заданных размеров и в течение длительного времени сохраняющих свою стабильность. Особый интерес представляют наносистемы на основе наноселена, так как он жизненно важен для человека и животных. Недостаток селена в организме вызывает целый ряд заболеваний, в том числе: сердечно-сосудистые, желудочно-кишечные, бронхиальную астму; участвует в обмене жиров, белков, углеводов, стимулирует работу щитовидной железы, обладает противоопухолевой активностью. Селен входит в активные центры ферментов, системы антиоксидантной защиты организма, защищает организм от действия тяжелых и токсичных металлов (меди, свинца, кадмия, ртути и других) [1–4]. Селен, как и другие микроэлементы, поступает в организм с продуктами растительного и животного происхождения. Однако, во многих регионах России в почвах сельскохозяйственного назначения наблюдается дефицит селена, поэтому содержание его в растениях недостаточно [5–6]. Дефицит селена в организме восполняют, в основном, путем добавления в продукты питания биологически активные добавки, содержащие производные селена. Неорганические формы селена (селенит-, селенат-ионы) являются токсичными и могут вызвать негативные явления. Органические селеносодержащие соединения плохо растворимы и дороги [7–9]. Наименее токсичным и биодоступным является наноразмерный селен (20–70 нм). Наночастицы селена, согласно литературным данным, проявляют высокую антиоксидантную, антимутагенную активность, предотвращают раковые заболевания, замедляют развитие опухолей. Селеносодержащие наноструктуры находят применение в качестве средств доставки лекарств, антимикробного агента, в биотехнологии, медицинской диагностике, сельском хозяйстве и пищевой промышленности [10–15].
Анализ литературных данных выявил различные способы получения наноразмерного селена. Среди них методы лазерной абляции, ультразвукового и механического диспергирования. Однако аппаратура весьма дорога, что сдерживает широкое распространение этих методов [16]. В настоящее время наиболее распространены методы химического восстановления ионов селена в растворах. В качестве восстановителей часто используют аскорбиновую кислоту, глюкозу, тиомочевину, серосодержащие аминокислоты [17–19]. В этом случае образуются наночастицы селена размером 100–500 нм, обладающие сильно развитой межфазной поверхностью. Ввиду своей гидрофобности частицы метастабильны и быстро агрегируют в водных растворах. В связи с этим актуальными являются исследования, связанные с разработкой методов стабилизации, образующихся наночастиц. В качестве стабилизаторов используют высокомолекулярные соединения как природные (альгинат, хитозан, арабиногалактан), так и синтетические (полиэтиленгликоль, поливиниловый спирт, поливинилпирролидон) [20–25]. Адсорбция полимеров на поверхности наночастиц сопровождается формированием органической оболочки, которая снижает поверхностное натяжение растущих неорганических частиц, обеспечивая агрегативную устойчивость их по отношению к окружающей среде. Стабилизация наночастиц происходит за счет разных по природе нековалентных взаимодействий между полимерными цепями и поверхностью образующихся частиц. Такими взаимодействиями могут быть стерические, электростатические, гидрофобные и координационные связи [21–26]. Макромолекулы полимеров не только стабилизируют дисперсные системы, но и принимают непосредственное участие в их формировании, контролируют размер и форму растущих наносистем. Следует отметить, что средний размер наночастиц, образующихся в присутствии полимеров существенно меньше, чем в отсутствии. Так, например, наночастицы селена, получающиеся в результате восстановления селенит-ионов аминокислотой L-цистеином имеют размер частиц около 100 нм, а эти же частицы, полученные в присутствии полимерного стабилизатора – альгината натрия имеют, в основном, размер 24–34 нм (91 %) [18–22].
В настоящее время в медицине, биотехнологии и других областях науки и техники используют синтетический водорастворимый биологически активный полимер – поливинилпирролидон (ПВП). Поливинилпирролидон – нетоксичный, пленкообразующий полимер имеет высокую адсорбционную способность и склонность к комплексообразованию. Благодаря высокой биосовместимости и отсутствию токсичности, низкомолекулярные полимеры ПВП широко применяют для создания лекарственных препаратов, например, кровезаменители дезинтакционного действия. Согласно литературным данным, в ряде работ ПВП используют в качестве стабилизатора наночастиц металлов и неметаллов [21–27].
Целью данной работы был синтез самоорганизованных наночастиц селена в матрице поливинилпирролидона с разной молекулярной массой. Установление влияния соотношения компонентов селен–ПВП на процесс формирования, спектральные и структурно-морфологические характеристики нанокомпозитов селена, а также на их агрегативную устойчивость к окружающей среде.
МАТЕРИАЛЫ И МЕТОДЫ
Наночастицы селена получали путем химического восстановления селенита натрия (ч., Россия) аминокислотой L-цистеином (х.ч., «Synex Pharma», Китай), в присутствии синтетического водорастворимого биологически активного полимера – поливинилпирролидона марки «Kollidon® 30» (К-30, х.ч., «HAIHANG», Китай) и марки «Kollidon® 90 F» (К-90, х.ч., «BASF», Германия). Средневязкостные молекулярные массы (Мw) ПВП и вязкость нанокомпозитов селена определяли на вискозиметре Оствальда с диаметром капилляра 0,56 мм или 0,73 мм при температуре 23 ºС и атмосферном давлении. Повторность измерений составляла не менее трех раз и разница в расчетах не превышала 3 сек. Характеристические вязкости исходных образцов полимера определяли экстраполяционным методом из концентрационных зависимостей от приведенной вязкости. Средневязкостный молекулярные массы рассчитывали по уравнению Марка-Куна-Хаувинка [27]:
|
[η] = К·Мwα, |
(1) |
где [η] – характеристическая вязкость дл/г; К – и α константы; Мw – молекулярная масса.
Синтез селеносодержащих наносистем осуществляли следующим образом: в реакционную колбу помещали водный раствор ПВП (СПВП = 0,04–0,25 масс.%) и цистеин (Cys) (ТCys = 0,031 г/дл). Смесь перемешивали до полного растворения цистеина, затем добавляли селенит натрия (Т = 0,011 г/дл) и перемешивали в течение 20 мин. Концентрация нуль-валентного селена оставалась постоянной – СSe = 0,005 масс.%. В результате окислительно-восстановительной реакции селенит-иона с цистеином в присутствии стабилизатора ПВП образуется коллоидный раствор аморфного селена красно-оранжевого цвета. Раствор выдерживали в течение 2 суток. В этот период происходит упорядочивание структуры селеносодержащих наносистем и раствор приобретает устойчивый красный цвет. Электронные спектры поглощения индивидуальных веществ и наносистем селена регистрировали с помощью псевдо-двухлучевого сканирующего спектрофотометра Shimadzu UV-1280 (Япония) в рабочем диапазоне длин волн λ = 200–350 нм, в кварцевых кюветах с фотометрическим слоем 1 см при температуре 23 °С. Калибровку базовой линии проводили по дистиллированной воде.
Для изучения влияния концентрации и молекулярной массы ПВП на процесс формирования и структурные характеристики образующихся наносистем селена был выбран ряд растворов с различным массовым соотношением селен–ПВП (υ = 0,02; 0,04; 0,06; 0,08; 0,10; 0,12, где υ = СSe/CПВП – отношение массовой концентрации селена к массовой концентрации полимера). Растворы селеносодержащих наносистем сохраняли в закрытых колбах при комнатной температуре (23 °С и атмосферном давлении, вдали от прямых солнечных лучей). Контроль агрегативной устойчивости полученных наночастиц селена осуществляли спектрофотометрическим и потенциометрическим методами. Измерение рН проводили на иономере Экотест 2000-Т («Эконикс», Россия) с комбинированным стеклянным электродом «Эком-pH-ком» (ΔрН = ±0,01) при температуре 23±1 °С. Измерение рН и оптической абсорбции проводили два раза в неделю в течение двух месяцев.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Вискозиметрическим методом были определены характеристические вязкости двух образцов поливинилпирролидона (марки К-30 и К-90). Средневязкостные молекулярные массы рассчитывали по уравнению Марка-Куна-Хаувинка:
|
для образца К-30 [0,212] = 1,90∙10-4 ∙ Мw0,68 |
(2) |
|
для образца К-90 [1,526] = 1,90∙10-4 ∙ Мw0,68 |
(3) |
Экспериментальные исследования показали, что для образца ПВП (К-30) молекулярная масса равна Мw = 30 кДа и для образца ПВП (К-90) – Мw = 553 кДа.
При изучении физико-химических свойств наночастиц анализируются прежде всего оптические спектры абсорбции, так как они заключают в себе информацию о размере частиц, распределении их по размерам и степень агрегации. На рисунке 1 представлены оптические спектры в УФ области индивидуальных веществ (ПВП и цистеина), смеси ПВП и цистеина, а также селеносодержащей наносистемы, раствором сравнения служила дистиллированная вода.
В исследуемом диапазоне длин волн (λ = 240–350 нм) ПВП (Рис. 1, кривая 1), цистеин (Рис. 1, кривая 2), смесь (Рис. 1, кривая 3) практически не поглощают кванты света, в то время как в диапазоне 200–240 нм наблюдается резкий скачек абсорбции. При этом четко видно, что величина абсорбции для цистеина много меньше, чем для ПВП (Рис. 1, кривые 2 и 1), и для смеси цистеин-ПВП (Рис. 1, кривая 3). Таким образом, основной и значительный вклад в величину оптической абсорбции вносит, именно ПВП. На кривой 4 (Рис. 1), соответствующей селеносодержащей наноструктуре наблюдается увеличение оптической абсорбции в области λ = 240–260 нм, согласно литературным данным, эта область поглощения свидетельствует об образовании наночастиц селена в нуль-валентном состоянии с размером частиц 20–70 нм [20–23]. При изучении процессов самоорганизации наноструктур селена в присутствии ПВП различной концентрации и молекулярной массы были получены и проанализированы зависимости оптической плотности от длины волны для наносистем с разным массовым соотношением селен-полимер (υ = 0,02–0,12). Для всех исследованных наносистем наблюдается плато в интервале длин волн λ = 240–260 нм (Рис. 2).
Согласно полученным данным, для селеносодержащих наносистем в присутствии ПВП (К-30 и К-90) наблюдаются похожие по форме и величине оптические спектры, следовательно, молекулярная масса и концентрация ПВП не оказывает существенного влияния на размер и оптические свойства наночастиц селена, полученных в результате восстановления селенит-ионов цистеином.

Рис. 1. УФ-спектры индивидуальных веществ, смеси и селеносодержащей наносистемы.
1 – поливинилпирролидон;
2 – цистеин;
3 – смесь ПВП и цистеина;
4 – селеносодержащая наносистема.
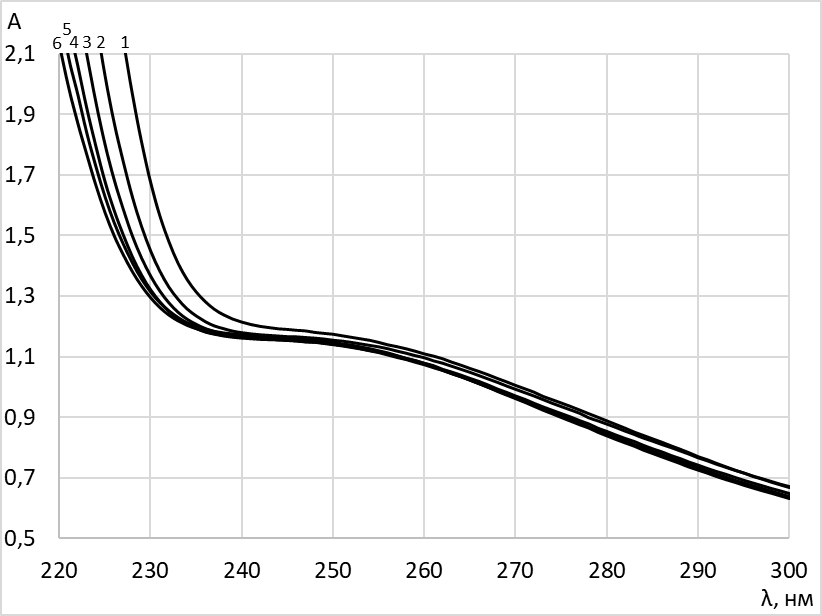
Рис. 2. УФ-спектры селеносодержащих наносистем
1 – селен–ПВП (υ = 0,02); 2 – селен–ПВП (υ = 0,04); 3 – селен–ПВП (υ = 0,06);
4 – селен–ПВП (υ = 0,08); 5 – селен–ПВП (υ = 0,10); 6 – селен–ПВП (υ = 0,12).
Для изучения влияния концентрации и молекулярной массы ПВП на агрегативную устойчивость наночастиц селена, был использован ряд растворов с различным массовым соотношением селен-ПВП (υ = 0,02–0,12), приготовленных ранее. Затем были измерены величины рН (Рис. 3) и оптической абсорбции через определенные промежутки времени в течение пяти недель.
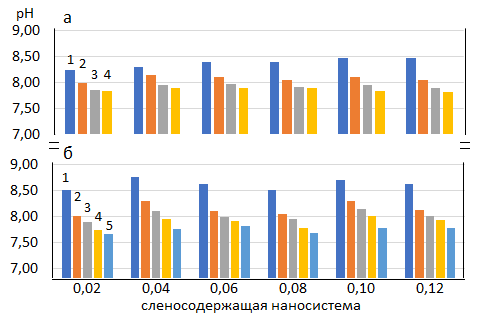
Рис. 3. рН селеносодержащих наносистем (селен-ПВП υ = 0,02–0,12).
а – селеносодержащие наносистемы с ПВП марки К-30, 1–4 – неделя;
б – селеносодержащие наносистемы с ПВП марки К-90, 1–5 – неделя.
Согласно полученным данным все системы обладают хорошей стабильностью на протяжении всего срока наблюдений, начиная со 2 недели наблюдений рН и оптическая абсорбция незначительно меняются в течение 4 недель в растворах, содержащих наносистемы с ПВП (К-30), а для ПВП (К-90) этот период составил 5 недель. Для наносистем с ПВП (К-30) изменение величины рН в течение всего периода наблюдений в среднем составило 0,5 единиц рН, а для наносистем с ПВП (К-90) – 0,8. Неопределенность полученных данных не превышала 0,1 единиц рН. По прошествии указанных сроков наблюдается выпадение частиц наноселена в осадок ввиду увеличения их размеров и агрегации, причем красная форма селена сохраняется. Таким образом экспериментально было установлено, что наноселен в матрице ПВП в интервале массовых соотношений υ = 0,02–0,12 образует устойчивые коллоидные растворы независимо от концентрации и молекулярной массы ПВП, так как в течение 4 недель для ПВП (К-30) и 5 недель для ПВП (К-90) не происходит никаких заметных изменений в системе (помутнение или образование осадка). Но для получения более агрегативно устойчивых селеносодержащих наноструктур необходимо использовать ПВП с большей молекулярной массой. Аналогичные результаты наблюдались в работах Остаевой Г. Ю. При изучении процессов восстановления ионов меди(II) трет-бутиламинобораном в разбавленных водных растворах ПВП с различной молекулярной массой обнаружено, что в исследуемых системах образуются наночастицы Cu2O одинакового размера независимо от молекулярной массы полимера, а для получения долгоживущих золей Cu2O необходимо использовать ПВП с большей молекулярной массой [28].
Наночастицы селена являются типичными лиофобными коллоидами с избытком поверхностной энергии и низкой агрегативной устойчивостью, поэтому для стабилизации использовали амфифильный полимер ПВП, который за счет физической адсорбции, обусловленной силами Ван-дер-Ваальса и дипольными взаимодействиями экранирует наночастицы, что предотвращает их рост и агрегацию. Согласно литературным данным, процесс образования наноструктур является достаточной сложным, протекающим в несколько стадий: 1 – образование наночастиц; 2 – адсорбция полимеров-стабилизаторов на их поверхности; 3 – упорядочивание полимерной матрицы и уплотнение наноструктуры. Что касается нашей системы, то 1 стадия восстановления селенит-ионов протекает достаточно быстро. В процессе прибавления селенита натрия к смеси ПВП и цистеина раствор окрашивается в оранжево-красный цвет в течение 15–30 сек [18]. 2 и 3 стадии – процессы адсорбции макромолекул и их взаимодействие с поверхностью наночастиц селена являются сложными и протекают во времени. Однако, какой из процессов будет оказывать наибольшее влияние на формирование селеносодержащих наноструктур сказать затруднительно [21–26]. На рисунке 3 представлена динамика изменения рН во время хранения растворов. Как видно из представленных данных по истечении первой недели во всех системах наблюдалось резкое падение значения рН, а далее изменения были незначительными, в пределах 0,2 единиц рН для наносистем с ПВП (К-30), и 0,4 для наносистем с ПВП (К-90). Скорость снижения рН для систем с ПВП различной молекулярной массой была близка. Следует отметить, что в связи с уплотнением полимерной матрицы на поверхности наночастиц коллоидные растворы в течение 1–2 дней приобретают красный цвет. Что касается величины оптической абсорбции она также меняется в течение 1 недели, а затем сохраняет стабильность в течение 4-5 недель, при этом, описанное ранее, плато в интервале длин волн λ = 240–260 нм остается постоянным.
Полученные биокомпозиты наноселена могут быть использованы при проведении научных и прикладных исследований в области биохимии, медицины, пищевой промышленности, препаратов сельскохозяйственного назначения и в производстве антимикробных средств.
ЗАКЛЮЧЕНИЕ
- Синтезированы новые биоактивные системы на основе наночастиц селена и неионогенного полимера – поливинилпирролидона с различной молекулярной массой.
- Методом УФ-спектроскопии установлено образование в водных растворах ПВП наночастиц селена в нуль-валентном состоянии, достаточно устойчивых в течение 4–5 недель.
- Установлено, что концентрация и молекулярная масса ПВП не оказывают значительного влияния на структуру и размер наночастиц селена, а влияют на агрегативную устойчивость и «время жизни» наносистем.
- Tretiak L. N. Specificity of selenium influence on human and animal’s organism (with regard to the problem of creation of seleniumcontaining food stuff). Bulletin of the Orenburg State University, 12, 136 (2007) (in Russ.).
- Golubkina N. A., Skalny A. V., Sokolov Ya. A. Selenium in medicine and ecology, 136 p. («KMK», Moscow, 2006). (in Russ.)
- Gromova O. A. Selenium – impressive results and prospects of use. Difficult patient, 14 (5), 25 (2007). (in Russ.).
- Skrypnic L., Chupakhina G. He influence of selenium and zinc on oxidative stability of celery cabbage. Bulletin of the I. Kant Russian State University. Ser. Natural sciences. 7, 73 (2007). (in Russ.).
- Golubkina N. A., Poluboyarinov P. A., Sindiryova V. A. Selenium in foods of plant origin. Problems in Nutrition. 86 (2), 63 (2017). (in Russ.).
- Golubkina N. A., Sindireva A. V., Zaitsev V. F. Nterigional variability of the human selenium status. South of Russia: ecology, development, 12 (1), 107 (2017). (in Russ.).
- Kokhan S. T., Fefelova E. V., Maksimenya M. V., Tereshkov P. P., Krivosheeva E. M., Pateyuk A. V., Shantanova L. N. Recovery and antioxidant selenium-containing immune defense funds in experimental giposelenoze. Fundamental research, 11 (4), 837 (2012). (in Russ.).
- Golubev W. I., Golubev N. W. Comparison of sodium selenite and selenate toxicity for saccharomyces complex. Problems in medical mycology, 9 (3), 34 (2007). (in Russ.).
- Bhattacharjee A., Basu A., Bhattacharya S. Selenium nanoparticles are less toxic than inorganic and organic selenium to mice in vivo, Nucleus, 62, 259 (2019). https://doi.org/10.1007/s13237-019-00303-1.
- Shurygina I. A., Shurygin M. G. Selenium nanocomposites – the prospects of application in oncology. Journal of new medical technologies, 27 (1), 81 (2020). https://doi.org/10.24411/1609-2163-2020-16517 (in Russ.).
- Skorinova K. D., Kuzmenko V. V., Vasilenko I. A. Research and development of new drug products, 9 (2), 33 (2020). https://doi.org/10.33380/2305-2066-2020-9-2-33-44. (in Russ.).
- Khurana A., Tekula S., Saifi M. A., Venkatesh P., Godugu C. Therapeutic applications of selenium nanoparticles, Biomed Pharmacother, 111, 802 (2019). https://doi.org/10.1016/j.biopha.2018.12.146.
- Shurygina I. A., Dremina N. N., Trukhan I. S., Shurygin M. G. Selenium in nanoform: toxicity and safety. Baikal Medical Journal, 1 (1), 24 (2022). https://doi.org/10.57256/2949-0715-2022-1-24-32. (in Russ.).
- Nayak V., Singh K., Singh A., Singh R. Potentialities of Selenium Nanoparticles in Biomedical Sciences. New J. Chem., 45, 2849 (2021). http://doi.org/10.1039/D0NJ05884J.
- Zhang J., Taylor E. W., Bennett K., Saad R., Rayman M. P. Association between regional selenium status and reported outcome of COVID-19 cases in China. Am J Clin Nutr., 111(6), 1297 (2020) doi: 10.1093/ajcn/nqaa095. PMID: 32342979; PMCID: PMC7197590.
- Tananaev I. G., Folmanis G. E., Fedotov M. A., Kovalenko L. V. Production of colloidal solutions of selenium by dispersion methods. Bulletin of the Far Eastern Branch of the Russian Academy of Sciences, 5 (201), 138 (2018). https://doi.org/10.25808/08697698.2018.201.5.020. (in Russ.).
- Makarov S. V., Molodtsov P. A., Dereven’kov I. A., Naidenko E. V. Interaction of sodium selenite with sodium hydroxymethanesulfinate and thiourea dioxide in aqueous solutions. News of universities. Chemistry and Chemical Technology Series, 64 (11), 65 (2021). https://doi.org/10.6060/ivkkt.20216411.6442. (in Russ.).
- Li Q., Chen T., Yang F., Liu J., Zheng W. Facile and controllable one-step fabrication of selenium nanoparticles assisted by l-cysteine. Materials Letters, 64 (5), 614 (2010). https://doi.org/10.1016/j.matlet.2009.12.019.
- Molodtsov P. A., Makarov S. V., Dereve’nkov I. A., Makarova A. S. Influence of proteins on the interaction between sodium selenite and sulfur-containing reductants. Izv. Vyssh. Uchebn. Zaved., Khim. Khim. Tekhnol., 65 (4), 56 (2022). https://doi.org/10.6060/ivkkt.20226504.6557. (in Russ.).
- Titova A. V., Borovikova L. N., Kipper A. I., Pisarev O. A. Stabilization of selenium nanoparticles by biologically active synthetic and natural polymers. In the collection: Science Week of SPbPU. Materials of the scientific conference with international participation. Institute of Physics, Nanotechnology and Telecommunications, 510 (216). (in Russ.).
- Valueva S. V., Borovikova L. N., Kutin A. A., Plyushchenko A. V. Effect of the nature of nanoparticles and biocompatible polymer stabilizers on the sizes and spectral characteristics of hybrid nanosystems. Russian Journal of Physical Chemistry A., 93 (2), 311 (2019). https://doi.org/10.1134/S0036024419020298. (in Russ.)
- Panov D. A. Selenium and sodium alginate nanocomposites producing and properties, Scientific Notes of V.I. Vernadsky Crimean Federal University. Biology. Chemistry, 3 (1), 91 (2017). (in Russ.).
- Panov D. A., Katsev A. M., Omelchenko A. V. Synthesis and properties of selenium nanoparticles in a natural polysaccharide matrix, Russian Journal of Bioorganic Chemistry, 49, 7, 1567 (2023). https://doi.org/10.1134/S1068162023070853.
- Lesnichaya M. V., Sukhov B. G. Synthesis of selenium sulfide nanoparticles in polysaccharide matrices of arabinogalactan and starch. Russian Nanotechnologies, 16 (2), 222 (2021). (in Russ.).
- Bai K., Hong B., He J., Huang W. Antioxidant Capacity and Hepatoprotective Role of Chitosan-Stabilized Selenium Nanoparticles in Concanavalin A-Induced Liver Injury in Mice. Nutrients., 12(3), 857. (2020) doi: 10.3390/nu12030857. PMID: 32210138; PMCID: PMC7146609.
- Suzdalev I. P. Nanotechnology: physico-chemistry of nanoclusters, nanostructures and nanomaterials, 592 p. (URSS, 2019). (in Russ.).
- Kirsh Yu. E. Poly-N-vinylpyrrolidone and other poly-N-vinylamides, 252 p. (Nauka, Moscow, 1998). (in Russ.).
- Ostaeva G. Y., Isaeva I. Y., Grushina V. V., Stuzhuk A. N., Odinokova I. V. Influence of the molecular mass of poly(n-vinylpyrrolidone) on formation of Cu2O nanoparticles during reduction of divalent copper ions with tert-butylamine borane in polymer solution. Polymer Science, Series B, 60 (4), 455 (2018). https://doi.org/10.1134/S1560090418040085. (in Russ.).

