METHODS FOR REGULATING THE PHYSICO-CHEMICAL PROPERTIES OF TITANIUM DIOXIDE
СПОСОБЫ РЕГУЛИРОВАНИЯ СОРБЦИОННЫХ И ФОТОКАТАЛИТИЧЕСКИХ СВОЙСТВ ДИОКСИДА ТИТАНА
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 10 (76), №4, 2024
Publication text (PDF):Download
UDK 544.478.1
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Vyatkina O. V., V.I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Milyukova O. A., V.I. Vernadsky Crimean Federal University, Simferopol, Crimea, Russian Federation
Kopylets T. A., Kazan (Volga region) Federal University, Kazan, Russian Federation
TYPE:Article
DOI:https://doi.org/10.29039/2413-1725-2024-10-4-251-258
PAGES:from 251 to 258
STATUS:Published
LANGUAGE:Russian
KEYWORDS: adsorption, titanium dioxide, doping, photocatalysis.
ABSTRACT (ENGLISH):
The article presents the results of the study of the adsorption ability and photocatalytic activity of materials based on TiO2 modified by such methods as: doping, ultrasonic dispersion and heat treatment. Doping was carried out by the molten salt method using iron as the doping element. TiO2 was heat treated with FeCl3 ∙ 6H2O
(0.5 wt% Fe) to introduce impurities into the crystal structure. The change in the properties of TiO2 upon calcination under the same conditions without the addition of Fe3+ was investigated. The effect of particle size on photocatalyst properties is exemplified by Fe-doped TiO2 samples before and after ultrasonic dispersion. The degree of adsorption of methyl orange dye was chosen as a parameter of the adsorption properties of the obtained materials. The photocatalytic activity was determined by the degree of degradation of methyl orange under the action of sunlight as well as UV radiation (λ=254 nm; 365 nm). Fe-doped TiO2 was found to exhibit absorption in the visible region of the spectrum (λ≈490 nm) by ultraviolet–visible spectroscopy.
It is shown that heat treatment improves the adsorption properties of TiO2 from 1 % to 38–39 %, irrespective of the introduction of the impurity element. Under the conditions of the present experiment, the degree of adsorption is also not affected by ultrasonic dispersion of the doped material. A decrease in the average particle size of TiO2 was observed during heat treatment, although ultrasonic dispersion resulted in nano-sized particles that did not exceed the sensitivity threshold of the laser diffraction analyser (up to 80 nm). In all samples, the primary particles increased in size with time due to coagulation in the liquid dispersion medium. Fe-doped TiO2 was found to have enhanced photocatalytic activity in the UV and under natural daylight. The maximum degree of photodegradation was recorded at 2 h exposure of the system of Fe-doped TiO2 and methyl orange solution to radiation at λ=254 nm, the value of the parameter was 36 % without taking into account adsorption. Upon additional ultrasonic dispersion, the doped photocatalyst decreased the photocatalytic ability under sunlight and UV radiation with λ=365 nm.
ВВЕДЕНИЕ
Благодаря своей относительно высокой каталитической способности, физической и химической стабильности и дешевизне диоксид титана (TiO2) находит широкое применение в качестве фотокатализатора для фотодеградации многих органических загрязнителей окружающей среды [1]. Диоксид титана является широкозонным полупроводником: ширины запрещенной зоны рутила, анатаза и брукита оцениваются равными ≈ 3,00, 3,21 и 3,13 эВ при комнатной температуре, соответственно [1]. По этой причине для эффективного воздействия на загрязнители необходимо облучать фотокатализатор ультрафиолетовым светом. Солнечный свет в зависимости от погодных условий содержит до 7 % УФ-волн, поэтому его невозможно напрямую использовать для эффективной активации TiO2. В течение долгого времени большое внимание уделяется регулированию физико-химических свойств диоксида титана, в том числе смещению диапазона поглощения в область видимого света, а, следовательно, увеличению возможностей использования этого соединения для решения экологических проблем. Поэтому целью работы было изучение возможностей регулирования физико-химических свойств диоксида титана.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования являлся диоксид титана (марка R-216, Китай) (образец I). Для проведения допирования был выбран метод расплавленных солей [2]. Были получены образцы для изучения влияния допирования ионами железа на фотокаталитическую активность TiO2. Навески по 5 г TiO2 перемешивали и растирали с предварительно растворенным в 1-2 каплях дистиллированной воды FeCl3∙6H2O (из расчета 0,5 масc. % Fe в образце TiO2), затем прокаливали в течение 1 часа при 700 °C в муфельной печи ПЛ-10/12,5 (образец II). Часть полученного материала была диспергирована в ультразвуковой ванне CODYSON CDS-300 с водой в качестве дисперсионной среды и высушена в сушильном шкафу в течение 1 часа при температуре до 240 °C (образец III). Для изучения влияния термообработки на физико-химические свойства TiO2 и исключения этого фактора при анализе эффекта допирования было проведено прокаливание исходного TiO2 в течение 1 часа при 700 °C в муфельной печи без добавления допирующего агента (образец IV). Характеристика образцов сведена в табл. 1.
Таблица 1
Характеристика образцов диоксида титана
|
Образец TiO2 |
Время прокаливания |
Содержание железа |
Ультразвуковая обработка |
|
Ⅰ |
‒ |
‒ |
‒ |
|
Ⅱ |
1 ч |
0,5 масс. % |
‒ |
|
Ⅲ |
1 ч |
0,5 масс. % |
1 час |
|
IV |
1 ч |
‒ |
‒ |
Образцы I‒IV исследовали методами ИК-спектроскопии (ИК-спектрометр Perkin Elmer Spectrum Two), УФ-спектроскопии (спектрофотометр Cintra 4040), размер частиц и фракционный состав определяли на лазерном дифракционном анализаторе гранулометрического состава Fritsch Analysette 22 MicroTec plus при диспергировании в воде.
Фотокаталитическую активность полученных материалов определяли по степени деградации красителя метилового оранжевого (МО) под действием солнечного света, а также излучения УФ-лампы VL-215.LC (λ=254 нм; 365 нм). Степень фотодеградации контролировали по изменению концентрации МО в системах фотоколориметрическим методом на фотометре «Эксперт-003» (λ=525 нм, l=10 мм). В 20 мл исходного раствора МО с концентрацией 60 мг/л (1,8∙10-4 моль/л) вносили 0,5 г фотокатализатора, суспендировали и оставляли под источником излучения на 1–2 ч. После центрифугирования (20 мин, 8000 об./мин) и фильтрования измеряли оптическую плотность конечного раствора. Фотокаталитическую деградацию красителя D (%) вычисляли по формуле (1):
D = ΔC/C0∙100%–A (1)
где: ΔС – изменение концентрации красителя, моль/л, С0 – начальная концентрация красителя, моль/л; A – степень адсорбции красителя, %.
![]()
Для определения степени адсорбции систему из раствора МО и исследуемого образца фотокатализатора, описанную выше, оставляли без доступа видимого света на 1 ч. После центрифугирования и фильтрования определяли оптическую плотность раствора. Концентрацию красителя вычисляли по калибровочной кривой. Степень адсорбции A (%) вычисляли по формуле (2):
A=ΔC/C0∙100% (2)
где: ΔС – изменение концентрации красителя, моль/л, С0 – начальная концентрация красителя, моль/л.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Структура образцов I, II, IV, а также наличие примесей в исходном TiO2 исследовались методом ИК-спектроскопии. Расшифровка основных полос поглощения в спектрах образцов представлена в виде табл. 2.
Таблица 2
Характеристические полосы ИК-спектров исследуемых образцов TiO2
|
Колебания связей |
Характеристические частоты |
Образец I |
Образец II |
Образец IV |
|
ν(OH) |
3600…3000 см-1 |
+ |
– |
– |
|
ν(C=O) |
1444 см-1 |
+ |
– |
– |
|
ν(Ti-O) |
1018 см-1 |
+ |
+ |
+ |
|
δ(OCO) |
885 см-1 |
+ |
– |
– |
|
ν(Ti-O-Ti) в TiO6 |
800…400 см-1 |
+ |
+ |
+ |
На ИК-спектре образца I обнаружены максимумы поглощения 1444 см-1 и 885 см-1, которые могут быть обусловлены существованием карбонатов титана на поверхности частиц: валентными колебаниями ν(C=O) и деформационными δ(OCO) соответственно [3]. Максимум поглощения 1018 см-1 соответствует колебаниям концевых связей Ti–O. Интенсивная полоса поглощения в диапазоне 800…400 см-1 обусловлена колебаниями мостиковых связей Ti–O–Ti октаэдра TiO6 [4].
После допирования из диоксида титана были, предположительно, удалены примеси карбонатов титана, так как на ИК-спектре исчезли полосы поглощения с максимумами 1444 см-1 и 885 см-1, также исчезла широкая полоса в области 3600…3000 см-1, характерная для колебаний ν(OH) воды. Кроме того, ИК-спектр диоксида титана, прокаленного при той же температуре в течение того же времени, но без добавления соли железа, совпадает с ИК-спектром допированного образца. Следовательно, изменения в ИК-спектре при допировании связаны с удалением примесей и обусловлены прокаливанием.
Основная полоса поглощения в диапазоне 1016…400 см-1 не была смещена и не характеризовалась появлением новых максимумов, следовательно, судить об изменениях в кристаллической решетке TiO2 по данным ИК-спектроскопии мы не можем. Поэтому для подтверждения факта допирования ионами железа образцы исследовали методом УФ-спектроскопии.
УФ-спектроскопией исходного TiO2 обнаружено ожидаемое поглощение в
УФ-области с максимумом 340 нм. Допированные образцы характеризуются появлением слабого поглощения в видимой области с локальным максимумом около 490 нм, максимум в 340 нм не смещен относительно исходного диоксида титана (Рис. 1).

Рис. 1. УФ-вид-спектр образца I и образца II.
УФ-спектроскопия показала, что ультразвуковое диспергирование допированного TiO2 не приводит к смещению полосы поглощения относительно недиспергированного образца (образцы II и III). Смещение полос также не происходит при прокаливании исходного диоксида титана при 700 ˚С в течение 1 ч, что коррелирует с отсутствием у образцов I и IV фотокаталитической активности на видимом свету.
Лазерный дифракционный анализ показал изменение фракционного состава и увеличение массовой доли частиц большего радиуса с течением времени, что обусловлено коагуляцией первичных частиц в жидкой дисперсионной среде (Рис. 2). Данное явление должно оказывать влияние на кинетику процессов, происходящих на поверхности частиц, что необходимо учитывать в будущих исследованиях.
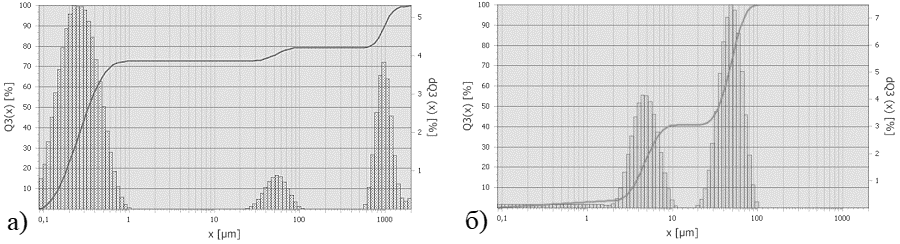
Рис. 2. Интегральное (Q3(x)) и дифференциальное (dQ3(x)) распределение частиц TiO2 по радиусам: а) через 1 мин, б) через 4 мин.
Результаты лазерного дифракционного анализа представлены в табл. 3. Следует отметить, что после ультразвуковой обработки (образец III) часть частиц имела значения размеров ниже предела обнаружения лазерного дифракционного анализатора, то есть менее 80 нм.
Таблица 3
Фракционный состав образцов TiO2
|
Образец |
Средний радиус фракции, мкм |
Массовая доля фракции, % |
|
I |
0,31 |
100 |
|
II |
0,23 |
71,67 |
|
48,69 |
28,33 |
|
|
III |
0,13 |
84,25 |
|
59,40 |
15,75 |
|
|
IV |
0,23 |
96,73 |
|
59,40 |
3,27 |
Для определения адсорбционной способности образцов была исследована степень обесцвечивания раствора МО при выдерживании с исследуемым материалом в темноте в течение часа. Данные по исследованию всех образцов сведены в табл. 4.
Таблица 4
Сравнение адсорбционных свойств образцов
|
Образец TiO2 |
Степень адсорбции, % |
|
|
I |
Исходный |
1,2 ± 0,7 |
|
II |
Прокаленный с 0,5 % Fe при 700˚C |
38 ± 1 |
|
III |
Диспергированный образец II |
38 ± 2 |
|
IV |
Прокаленный при 700 ˚C |
39 ± 2 |
Эксперимент показал, что прокаливание диоксида титана при 700 ˚С, независимо от внедрения примеси, улучшает адсорбционные свойства материала, а значимые различия по данному параметру между образцами II–IV отсутствуют.
Для определения фотокаталитической активности образцов была исследована степень фотодеградации МО при воздействии в течение 1 ч и 2 ч следующих видов излучения: естественного солнечного света, УФ-излучения с длиной волны 254 нм и 365 нм. Из общего значения обесцвечивания раствора был вычтен вклад адсорбции красителя на частицах TiO2. При этом в течение первого часа воздействия солнечного света обесцвечивание раствора МО происходит за счет адсорбции красителя на частицах катализатора, а степень фотодеградации не может быть определена. Данные по исследованию всех образцов сведены в табл. 5.
Таблица 5
Сравнение фотокаталитической активности образцов
|
Образец TiO2 |
Степень фотодеградации МО, % |
|||||
|
Дневной свет (2 ч) |
254 нм (1 ч) |
254 нм (2 ч) |
365 нм (1 ч) |
365 нм (2 ч) |
||
|
I |
Исходный |
4 ± 1 |
3 ± 1 |
5 ± 2 |
8 ± 2 |
11 ± 2 |
|
II |
Прокаленный с 0,5% Fe при 700˚C |
11 ± 3 |
31 ± 2 |
36 ± 1 |
14 ± 1 |
20 ± 3 |
|
III |
Диспергированный образец II |
9 ± 2 |
32 ± 2 |
35 ± 2 |
5 ± 2 |
11 ± 3 |
|
IV |
Прокаленный при 700˚C |
– |
11 ± 2 |
12 ± 2 |
6 ± 2 |
7 ± 2 |
Исследование показало, что исходный диоксид титана (образец I) малоэффективен как фотокатализатор. Прокаленный без добавления соли железа диоксид титана (образец IV) не обладает фотокаталитической активностью на дневном свету. Под действием на данный образец УФ-излучения, в случае обоих длин волн, степень фотодеградации не изменилась от одного к двум часам облучения.
Допированные образцы II и III по сравнению с недопированными образцами проявляют большую фотокаталитическую активность, в том числе при воздействии дневного света в течение двух часов. При этом ультразвуковое диспергирование допированного материала не влияет на способность к фотокатализу при действии коротковолнового УФ-излучения (λ=254 нм), но ухудшает фотоактивность при работе в более длинноволновой области (λ=365 нм), в том числе на солнечном свету. В дальнейших исследованиях целесообразно подробнее изучить влияние диспергирования на свойства материала, варьируя его продолжительность и прочие условия проведения.
ЗАКЛЮЧЕНИЕ
- Показано, что прокаливание диоксида титана при 700 ˚С с допирующим агентом, содержащим Fe3+, приводит к такому же повышению сорбционных свойств материала, что и прокаливание при этой температуре без добавления примесей. Таким образом, при использовании допированного данным методом диоксида титана более эффективная очистка воды от органического красителя происходит именно за счет фотокаталитического процесса.
- Обнаружено уменьшение среднего размера частиц TiO2 при прокаливании и диспергировании ультразвуком. Также обнаружено укрупнение частиц со временем вследствие коагуляции.
- Установлено усиление фотокаталитической активности диоксида титана в
УФ-области, а также на дневном солнечном свету после допирования. - Выявлено негативное влияние продолжительного (1 час) ультразвукового диспергирования на фотокаталитическую активность допированного диоксида титана в длинноволновом УФ-диапазоне (λ=365 нм).
- Armaković S. J., Savanović M. M. and Armaković S., Titanium Dioxide as the Most Used Photocatalyst for Water Purification: An Overview, Catalysts, 13(1), 26 (2023).
- Ghorbanpour M. and Feizi A. Iron-doped TiO2 Catalysts with Photocatalytic Activity, J. Water Environ. Nanotechnol, 4(1), 60 (2019).
- Bukov N. N., Kolokolov F. A., Kostyrina T. V. and Kuznetsova S. L., Physical research methods: vibrational spectroscopy. Textbook, 47 p. (Kuban State University, Krasnodar, 2008). (in Russ.).
- Qu Z.-W. and Kroes G.-J., Theoretical Study of the Electronic Structure and Stability of Titanium Dioxide Clusters (TiO2)n with n = 1–9, J. Phys. Chem. B., 110(18), 8998 (2006).

