BDNF-MEDIATED MECHANISM OF ANTI-STRESS EFFECT OF MELANOCORTINS
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 7 (73), №3, 2021
Publication text (PDF):Download
UDK: 616.45-001.1/.3:547.853.3:615.015
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Yasenyavskaya A. L., Astrakhan State Medical University, Astrakhan, Russia
Andreeva L. A., Institute of molecular genetics National research center “Kurchatov Institute” Moscow, Russia
Myasoedov N. F., Institute of molecular genetics National research center “Kurchatov Institute” Moscow, Russia
Bashkina O. A., Astrakhan State Medical University, Astrakhan, Russia
Samotrueva M. A., Astrakhan State Medical University, Astrakhan, Russia
TYPE: Article
DOI: https://doi.org/10.37279/2413-1725-2021-7-3-289-297
PAGES: from 289 to 297
STATUS: Published
LANGUAGE: Russian
KEYWORDS: melanocortins; neuropeptides; Semax, ACTH(4-7)-Pro-Gly-Pro, ACTH(6-9)-Pro-Gly-Pro, stress; Brain Derived Neurotrophic Factor, BDNF.
ABSTRACT (ENGLISH):
In recent years studies devoted to the study of the mechanisms of regulation of physiological and pathophysiological processes are of particular interest in connection with the active development of molecular medicine. Stress caused by various biological, social and technogenic factors is an integral part of modern human life and is a non-specific reaction of the body to various extreme influences. Despite the formation of adaptive mechanisms under stress in the form of generalized activation of the body, focusing of attention and memory, stress-induced analgesia, under conditions of intense and prolonged influence of a negative factor, the central nervous system loses its ability to adapt and the processes of neurogenesis are often disturbed as a result of distress. This fact explains the development of stress-induced pathological processes in the central nervous system, which emphasizes the relevance of the search and study of the mechanisms of action of pharmacological agents exhibiting stress-protective and neurotropic properties.
Melanocortins (N-terminal fragments of adrenocorticotropic hormone, fragments of proopiomelanocortin and their synthetic analogs) are characterized by pronounced neurometabolic, neuroregenerative and antistress activity. One of the possible mechanisms of action of melanocortins is the influence on the levels of expression in the central nervous system of neurotrophic factors that provide the main processes of regulation of homeostasis of the body. Brain Derived Neurotrophic Factor (BDNF) which is able to reduce the negative effects of hypoxic, toxic and stressful damage to brain cells, which is due to binding to tyrosine kinase B receptor and activation of the main metabolic cascades, is one of the effective regulatory proteins. Taking into account the fact that the question of the mechanisms of the stress-protective action of substances capable of protecting brain cells from the damaging effect of stress factors is relevant, the study of the effect of melanocortins on the level of neurotrophic factors is of scientific interest.
The study was carried out on 70 male white rats of 6 months of age. Sensory contact in the absence of physical contact with the subsequent formation of aggressive and submissive types of behavior was used as an experimental model of «social» stress. Laboratory animals, taking into account the gradation by types of behavior, were divided into groups: a group of control / intact animals; a group of rats exposed to «social» stress for 20 days; a group of individuals who received Semax (ACTH(4-7)-Pro-Gly-Pro) at a dose of 100 μg / kg / day intraperitoneally from the 1st day of stress exposure for a course of 20 days; a group of animals that received ACTH(6-9)-Pro-Gly-Pro at a dose of 100 μg/kg/day intraperitoneally from day 1 of stress exposure for a course of 20 days. The BDNF level in the blood serum of white rats was assessed by the enzyme-linked immunosorbent assay using ELISA Kit for Brain Derived Neurotrophic Factor (BDNF) (USA).
It was found that under conditions of «social» stress, a decrease in the level of BDNF was observed. The introduction of the studied melanocortins (ACTH(4-7)-Pro-Gly-Pro (Semax) and ACTH(6-9)-Pro-Gly-Pro) under conditions of induced «social» stress increases the concentration of BDNF in the blood serum of experimental animals. The study of the mechanisms of disturbances induced by experimental stress in various models showed that stress provokes the development of a depression-like state in rodents, which is accompanied by neuroplastic changes, including inhibition of neurogenesis in the hippocampus.
Currently a large amount of experimental data has been accumulated, indicating that a pathological stress response contributes to a decrease in the level of BDNF. Deficiency of BDNF plays an important role in the pathophysiology of stress, inducing impairments of neurogenesis associated with impaired neuroplasticity, as well as dysfunction of the hypothalamic-pituitary-adrenal and neurotransmitter serotonergic systems. The effectiveness of therapy with stress protectors and antidepressants is due to their effect on neurogenesis and neuronal plasticity.
Thus the fact of a decrease of BDNF under conditions of «social» stress established in the work and the positive effect of melanocortins (ACTH(4-7)-Pro-Gly-Pro (Semax) and ACTH(6-9)-Pro-Gly-Pro), contributing to the restoration of these parameters, indicates the effect of neuropeptides on the expression of BDNF and allows us to suggest a possible mechanism of the antistress effect. It should be noted that the serum level of brain neurotrophic factor can be considered as a biomarker of stress-induced disorders and affective disorders, as well as an indicator of the effectiveness of therapy with stress protectors. In addition, the level of BDNF in the blood serum can be considered as indicators of prognosis and evaluation of the effectiveness of therapy.
ВВЕДЕНИЕ
В последние годы в связи с активным развитием молекулярной медицины особый интерес представляют исследования, посвященные изучению механизмов регуляции физиологических и патофизиологических процессов. Неотъемлемой частью современной жизни человека является стресс, вызванный различными биологическими, социальными и техногенными факторами, представляющий собой неспецифическую реакцию организма на различные экстремальные воздействия [1–3]. Несмотря на формирование при стрессе адаптационных механизмов в виде генерализованной активации организма, фокусировки внимания и памяти, а также стресс-индуцированной анальгезии, при интенсивном и продолжительном влиянии негативного фактора, центральная нервная система теряет свою способность к адаптации и в результате дистресса нередко нарушаются процессы нейрогенеза [4]. Данный факт объясняет развитие стресс-индуцированных патологических процессов в ЦНС, что подчеркивает актуальность поиска и изучения механизмов действия фармакологических средств, проявляющих стресспротекторные и нейротропные свойства [5].
Выраженной нейрометаболической, нейрорегенеративной и антистрессорной активностью характеризуются пептиды семейства меланокортинов (N-концевых фрагментов адренокортикотропного гормона, ряда фрагментов проопиомеланокортина и их синтетических аналогов), что, наряду со способностью проникать через гематоэнцефалический барьер, делает соединения данного класса перспективными с точки зрения практического применения [6–11]. В качестве стресспротекторных средств особый интерес представляют меланокортины АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro, синтезированные в Институте молекулярной генетики Национального исследовательского центра «Курчатовский институт» [12, 13].
Одним из возможных механизмов действия меланокортинов является влияние на уровни экспрессии в ЦНС нейротрофических факторов, обеспечивающих основные процессы регуляции гомеостаза организма. Одним из эффективных регуляторных белков является нейротрофин Brain Derived Neurotrophic Factor (BDNF), который способен снижать негативные последствия гипоксического, токсического и стрессорного повреждения клеток головного мозга, что обусловлено связыванием с тирозинкиназным В-рецептором и активацией основных метаболических каскадов [14–16]. Доказано, что BDNF регулирует как процесс синаптической передачи в различных отделах головного мозга, так и развитие его структур в нео- и постнатальном периодах. Нейрометаболическое действие нейротрофина обусловлено запуском митоген-активированного протеинкиназного и фосфоинозитол-3-киназного сигнальных путей, определяющих активацию антиапоптотической экспрессии генов, от которых зависит «выживание» нейронов [17–19].
Принимая во внимание тот факт, что актуальным является вопрос о механизмах стресспротекторного действия веществ, способных защитить клетки головного мозга от повреждающего действия стресс-факторов, научный интерес представляет изучение влияния меланокортинов на уровень экспрессии нейротрофических факторов, что и определило цель данного исследования: изучить влияние меланокортинов на уровень экспрессии BDNF в сыворотке крови белых крыс в условиях «социального» стресса.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на 70 белых крысах-самцах 6-месячного возраста. Все манипуляции с животными проводили в соответствии с требованиями Директивы Европейского Парламента и Совета Европейского Союза по охране животных, используемых в научных целях (2010/63/EU); правилами, принятыми «Международной конвенцией по защите позвоночных животных, используемых для экспериментальных и научных целей» (Страсбург, 1986); Приказом Министерства здравоохранения Российской Федерации № 199н от 01.04.2016 «Об утверждении Правил лабораторной практики» и протоколом Этического комитета ФГБОУ ВО Астраханский ГМУ Минздрава России № 8 от 24. 11. 2015.
В качестве экспериментальной модели «социального» стресса использовали модель сенсорного контакта с формированием у экспериментальных животных агрессивного и субмиссивного типов поведения [10]. Лабораторные животные с учетом градации по типам поведения были разделены на группы (n=10):
- группа контрольных/интактных животных;
- группа крыс, подвергавшихся воздействию «социального» стресса в течение 20 дней (стресс);
- группа особей, получавших Семакс (АКТГ(4-7)-Pro-Gly-Pro) в дозе 100 мкг/кг/сут внутрибрюшинно с 1-го дня стрессорного воздействия курсом 20 дней;
- группа животных, получавших АКТГ(6-9)-Pro-Gly-Pro в дозе 100 мкг/кг/сут внутрибрюшинно с 1-го дня стрессорного воздействия курсом 20 дней;
Уровень BDNF в сыворотке крови белых крыс оценивали методом иммуноферментного анализа с использованием наборов ELISA Kit for Brain Derived Neurotrophic Factor (BDNF) (США).
Статистическую обработку результатов исследования осуществляли с помощью статистического пакета Exсel и программного обеспечения BIOSTAT, с использованием критерия Манна-Уитни. Статистически значимыми различия считали при p ≤ 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
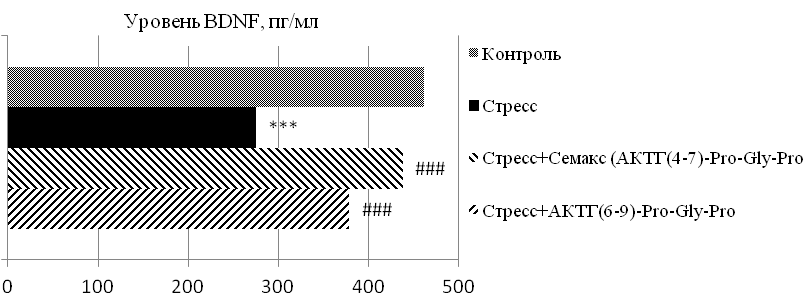
Результаты, отражающие влияние меланокортинов на экспрессию нейротрофического фактора BDNF в сыворотке крови белых крыс в условиях «социального» стресса, представлены на рисунках 1 и 2. По полученным данным у животных с агрессивным типом поведения в условиях «социального» стресса отмечается снижение уровня ВDNF на 40 % (p≤0,01) относительно контрольной группы. Введение меланокортиновых соединений способствует статистически значимой экспрессии изучаемого нейротрофического фактора и его уровень увеличивается: на фоне действия АКТГ(4-7)-Pro-Gly-Pro – практически на 60 % (p≤0,01), АКТГ(6-9)-Pro-Gly-Pro – практически на 40 % (p≤0,01) в сравнении с группой стрессированных животных (рис. 1).
Рис. 1. Уровень BDNF в сыворотке крови белых крыс с агрессивным типом поведения в условиях «социального» стресса под влиянием меланокортинов.
Примечание: *** – p≤0,01 – относительно контроля; ### – p≤0,01 – относительно группы «стресс».
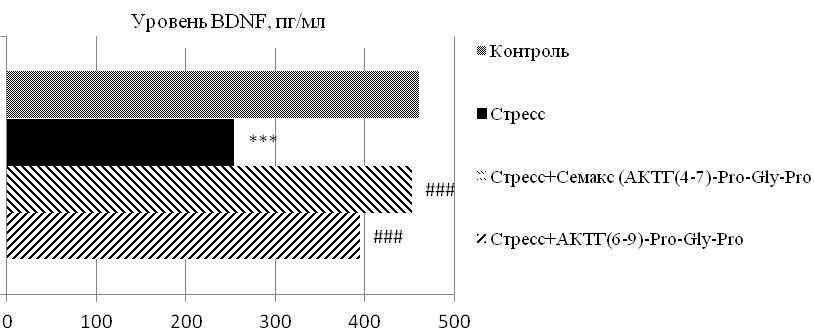
В группах животных с субмиссивным типом поведения при определении уровня BDNF отмечались следующие изменения: у крыс группы «социальный стресс» данный показатель снизился практически на 45 % (p≤0,01) по отношению к контрольной группе; тогда как под влиянием нейропептидных субстанций происходило увеличение данного маркера на 78 % (p≤0,01) – на фоне применения АКТГ(4-7)-Pro-Gly-Pro, на 55 % (p≤0,01) – при АКТГ(6-9)-Pro-Gly-Pro, по сравнению со стрессированными особями (рис. 2).
Рис. 2. Уровень BDNF в сыворотке крови белых крыс с субмиссивным типом поведения в условиях «социального» стресса под влиянием меланокортинов.
Примечание: *** – p≤0,01 – относительно контроля; ### – p≤0,01 – относительно группы «стресс».
По результатам проведенного исследования было установлено, что в условиях «социального» стресса наблюдалось снижение экспрессии BDNF, что подтверждается работами других исследователей. Так, в работе Н. М. Вяловой и Л. А. Левчук, посвященной изучению механизмов нарушений, индуцированных экспериментальным стрессом на различных моделях, установлено, что стресс провоцирует у грызунов развитие депрессивноподобного состояния, которое сопровождается нейропластическими изменениями, включающими угнетение нейрогенеза в гиппокампе, что связано с дефицитом нейротрофических факторов [17]. В настоящее время накоплен значительный объём экспериментальных данных, свидетельствующих о том, что патологическая стресс-реакция способствует снижению содержания BDNF, дефицит которого, в свою очередь, играет важную роль в патофизиологии стресса, индуцируя нарушения нейрогенеза, ассоциированные с изменением нейропластичности, а также дисфункцией гипоталамо-гипофизарно-надпочечниковой и нейротрансмиттерной систем [5, 15, 18]. Установленное в исследованиях снижение экспрессии BDNF в результате воздействия стрессогенных факторов различной природы и восстановление его уровня продолжительным введением стресс-протекторов и антидепрессантов привели к созданию нейротрофической гипотезы развития стресс-индуцированной депрессии [20], согласно которой изменение уровня мозгового нейротрофического фактора BDNF является ключевым механизмом формирования и разработки подходов к лечению подобных нарушений. Данный факт подтверждается установленным снижением содержания мозгового нейротрофического фактора при формировании депрессии и повышение его концентрации в процессе фармакотерапии, а также положительная корреляция уровня BDNF со степенью улучшения состояния пациента. Доказано, что эффективность терапии стресс-протекторами и антидепрессантами осуществляется за счет их воздействия на нейрогенез и нейрональную пластичность [11, 21, 22]. Установленная в данном исследовании корригирующая активность меланокортинов в отношении уровня BDNF при «социальном» стрессе свидетельствует о проявлении АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro выраженных антистрессорных эффектов.
ЗАКЛЮЧЕНИЕ
Таким образом, установленный в работе факт снижения экспрессии BDNF в условиях «социального» стресса и положительное влияние меланокортинов (АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro), способствующее восстановлению данных показателей, свидетельствует о влиянии нейропептидов на экспрессию нейротрофинов класса BDNF и позволяет предложить возможный механизм антистрессорного эффекта.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований, грант РФФИ № 19-04-00461.
REFERENCES
- Magariños A. M., Schaafsma S. M. and Pfaff D. W. Impacts of stress on reproductive and social behaviors. Front Neuroendocrinology, 49, 86 (2018).
- O’Connor D. B., Thayer J. F. and Vedhara K. Stress and Health: A Review of Psychobiological Processes. Annual Review of Psychology, 72, 663 (2021).
- Park C., Rosenblat D., Brietzke E., Pan Z., Lee Y., Cao B., Zuckerman H., Kalantarova A. and McIntyre S. R. Stress, epigenetics and depression: A systematic review. Neuroscience & Biobehavioral Reviews, 102, 139 (2019).
- Cohen S., Gianaros P. J. and Manuck S. B. A Stage Model of Stress and Disease. Perspectives on Psychological Science, 11, 456 (2016).
- Benham G. and Charak R. Stress and sleep remain significant predictors of health after controlling for negative affect. Stress Health, 35, 59 (2019).
- Zhuikova S. E. Gliprolines – regulatory peptides with integrative action. Integrative physiology, 1, 303 (2020).
- Carr R. and Frings S. Neuropeptides in sensory signal processing. Cell and Tissue Research, 375, 217 (2019).
- Fricker L. D. Carboxypeptidase E and the Identification of Novel Neuropeptides as Potential Therapeutic Targets. Advances in pharmacology, 82, 85 (2018).
- Kanunnikova N. P. Neuroprotective properties of neuropeptides. Journal of the Grodno State Medical University, 15, 492 (2017).
- Samotrueva M. A., Yasenyavskaya A. L., Murtalieva V. K., Bashkina O. A., Myasoedov N. F., Andreeva L. A. and Karaulov A. V. Experimental Substantiation of Application of Semax as a Modulator of Immune Reaction on the Model of «Social» Stress. Bulletin of Experimental Biology and Medicine, 166, 754 (2019).
- Tajti J., Szok D., Majláth Z., Tuka B., Csáti A. and Vécsei L. Migraine and neuropeptides. Neuropeptides, 52, 19 (2015)..
- Yasenyavskaya A. L., Samotrueva M. A., Myasoedov N. F. and Andreeva L. A. The effect of semax on the level of interleukin-1β in conditions of «social» stress. Medical Academic Journal., 19, 192 (2019).
- Yasenyavskaya A. L., Samotrueva M. A., Tsibizova A. A., Myasoedov N. F. and Andreeva L. A. The effect of glyprolins on lipid peroxidation in the hypothalamic and prefrontal regions of the brain under conditions of «social» stress. Astrakhanskiy meditsinskiy zhurnal, 15, 79 (2020).
- Gudasheva T. A., Tarasyuk A. V., Povarnina P. Yu. and Seredenin S. B. Brain neurotrophic factor and its low molecular weight mimetics. Pharmacokinetics and pharmacodynamics, 3, 3 (2017).
- Kryzhanovskaya S. Yu., Zapara M. A. and Glazachev O. S. Neurotrophins and adaptation to environmental stimuli: possibilities of expanding the «therapeutic potential». Bulletin of the International Academy of Sciences, 1, 36 (2020).
- Levy M. J. F., Boulle F., Steinbusch H. W., Hove D. L., Kenis G., Lanfumey L. Neurotrophic factors and neuroplasticity pathways in the pathophysiology and treatment of depression. Psychopharmacology, 235, 2195 (2018).
- Vyalova N. M. and Levchuk L. A. The role of BDNF in the formation of depressive disorders. Fundamental research, 10-4, 771 (2014).
- Ostrova I. V., Golubeva N. V., Kuzovlev A. N. and Golubev A. M. Prognostic significance and therapeutic potential of the cerebral neurotrophic factor BDNF in brain damage. General Reanimatology, 15, 70 (2019).
- Naghibzadeh M., Ranjbar R., Tabandeh M. R., Habibi A. Effects of Two Training Programs on Transcriptional Levels of Neurotrophins and Glial Cells Population in Hippocampus of Experimental Multiple Sclerosis. International Journal of Sports Medicine, 39, 604 (2018).
- Yang L., Zhao Y., Wang Y., Liu L., Zhang X., Li B. and Cui R. The Effects of Psychological Stress on Depression. Current Neuropharmacology, 13, 494 (2015).
- Thiele T. E. Neuropeptides and Addiction: An Introduction. International Review of Neurobiology, 136, 1 (2017).
- Vyunova T. V., Andreeva L. A., Shevchenko K. V. and Myasoedov N. F. An integrated approach to study the molecular aspects of regulatory peptides biological mechanism. Journal of Labelled Compounds and Radiopharmaceuticals, 62, 812 (2019).