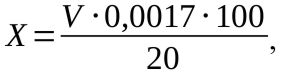ANTIBACTERIAL ACTIVITY OF BEE HONEY AND ITS PEPTIDE FRACTIONS
JOURNAL: «SCIENTIFIC NOTES OF V.I. VERNADSKY CRIMEAN FEDERAL UNIVERSITY. Biology. Chemistry» Volume 7 (73), №3, 2021
Publication text (PDF):Download
UDK: 577.11
AUTHOR AND PUBLICATION INFORMATION
AUTHORS:
Klychenkov S. V., Penza State University, Penza, Russia
Kruchinina A. D., Penza State University, Penza, Russia
Bichurina L. A., Kuznetsk Interdistrict Children’s Hospital, Kuznetsk, Russia
TYPE:Article
DOI:https://doi.org/10.37279/2413-1725-2021-7-3-101-111
PAGES:from 101 to 111
STATUS:Published
LANGUAGE:Russian
KEYWORDS: honey, honey peptides, antimicrobial peptides, antimicrobial activity.
ABSTRACT (ENGLISH):
Recently, the problem of bacteriological resistance has become more and more urgent. The antibiotics used in medical practice are constantly becoming obsolete due to the acquisition of resistance by pathogenic microorganisms, therefore there is an ever-increasing need to search for new antimicrobial drugs of various nature. A promising line of research in this area is the study of the antibacterial activity of protein molecules. Over the past two decades, a lot of data has accumulated showing the wide distribution of antimicrobial peptides among almost all living organisms.
This article studied the antibacterial activity of peptide fractions weighing less than 5 kDa obtained from honey of two varieties — buckwheat and mixed origin, as well as the similar activity of various solutions of the same honey samples. The following methods were sequentially applied for isolation and purification of peptide fractions: ultrafiltration — to obtain a solution containing molecules with a mass of less than 5 kDa; ion exchange chromatography on DEAE-cellulose for purification of the peptide fraction from low molecular weight impurities (carbohydrates, pigments, phenols, etc.) and gel filtration on Sephadex G-25 to desalt the obtained peptide fraction from the buffer solution. Determination of antibacterial activity was carried out using the disk diffusion method with antibiotic-resistant strains of Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa and Salmonella enteritis obtained from patients with various bacterial infections in chronic and acute forms. In the studied samples, the concentration of peptides, carbohydrates in ketosis and hydrogen peroxide was measured.
The results obtained indicate that among the studied solutions of honey, buckwheat has the highest antibacterial activity, which is associated with an increased content of hydrogen peroxide. The study of the antagonistic activity of peptide fractions against test cultures showed that low molecular weight peptides obtained from the studied honey samples do not have an antibacterial effect against the used strains of microorganisms. Apparently, this is due to the absence of low molecular weight antimicrobial peptides in the obtained fractions. Probably, antimicrobial peptides weighing less than 5 kDa are completely absent in bee honey.
ВВЕДЕНИЕ
Пчелиный мёд является сложной биологической многокомпонентной смесью, имеющей в своём составе вещества как растительного происхождения, так и животного. Большое количество идентифицированных к настоящему времени в составе мёда биологически активных веществ позволяет сказать, что мёд обладает антиоксидантной, антимикробной, противовирусной, антидиабетической активностью, позитивно действует на сердечно-сосудистую, нервную, дыхательную системы, органы пищеварения [1]. Не смотря на переменный состав мёда, зависящий от времени сбора нектара пчёлами, сезона, ботанического происхождения мёда и породы пчелы, основной набор компонентов остаётся неизменным: 15–20 % воды, 65–75 % углеводов, из которых наибольшее количество приходится на фруктозу, глюкозу, мальтозу и сахарозу, а также около 1 % других веществ, к которым относятся витамины, минералы, органические кислоты, различные фенольные соединения, белки и пептиды [2].
Антибактериальные свойства мёда привлекают внимание исследователей уже довольно давно. В ряде экспериментальных статей показано, что водные растворы мёда в различной концентрации показывают активность против Escherichia coli, Enterobacter aerogenes, Salmonella typhimurium, Beta-haemolytic streptococci, метициллинрезистентного Staphylococcus aureus, ванкомицинрезистентных энтерококков [3]. Использование мёда в альтернативной медицине как средства, способствующего заживлению ран путём устранения или предотвращения инфицирования и воспаления, эволюционировало в применение различных патчей и повязок, пропитанных очищенным и специальным образом подготовленным для медицинского использования («medical grade») мёдом тонкосемянника Leptospermum scoparium, имеющего в силу своего ботанического происхождения высокое содержание пероксида водорода. Однако антибактериальные свойства мёда зависят не только от присутствия в его составе пероксида водорода, но также проявляются за счёт низкого pH, высокой концентрации углеводов, содержания фенольных соединений.
Большую роль в проявлении антибактериального эффекта мёда играют и антимикробные пептиды — малые белковые молекулы, встречающиеся практически у всех живых организмов. У медоносной пчелы Apis mellifera к настоящему времени идентифицировано около 10 различных видов антимикробных пептидов, участвующих в функционировании иммунной системы этих насекомых [4]. Как известно, при переработке нектара в мёд пчёлы обрабатывают его секретом слюнных желёз, в составе которого могут присутствовать антимикробные пептиды. Действительно, исследования последних лет показали наличие как минимум одного антимикробного пептида пчёл в составе мёда — дефензина-1 (молекулярная масса 5532 Да) [5]. Учитывая, что организмом пчелы вырабатывается гораздо большее количество антимикробных пептидов, перспективным является поиск других пептидов в составе мёда, обладающих антибактериальным действием. Открытие и изучение таких пептидов является актуальной задачей с учётом роста антибиотикорезистентности среди штаммов патогенных микроорганизмов. Целью данной работы является выделение и очистка пептидных фракций мёда с молекулами массой менее 5 кДа, т. е. содержащих низкомолекулярные пептиды, и определение их антибактериальной активности с использованием ряда тестовых культур.
МАТЕРИАЛЫ И МЕТОДЫ
Для определения биологической активности фракций пептидов или отдельных пептидных компонентов раствора пчелиного мёда необходимо добиться приемлемой степени очистки, что при высокой концентрации углеводов является сложной задачей. Комбинация использованных методов ультрафильтрации и ионообменной хроматографии позволяет провести очистку пептидной фракции мёда, однако в силу малого объёма получаемых фракций и необходимости дополнительной очистки нельзя сказать, что этот способ является оптимальным. Тем не менее, для очистки небольших объёмов исследуемых растворов мёда данный метод является пригодным, хотя и трудозатратным.
Пчелиный мёд
В качестве источника исследуемых пептидных фракций использовалось два сорта мёда: гречишный (Пензенская область, р-н д. Пенделка Кузнецкого района, сбор 2020 г.) — образец 1, и светлый смешанного ботанического происхождения (Пензенская область, р-н с. Болтино Камешкирского района, сбор 2020 г.) — образец 2. Собранный мёд хранился в герметично закрытой пластиковой таре в тёмном месте при комнатной температуре. Для выделения пептидной фракции был приготовлен 50 %-й водный раствор мёда общим объёмом 0,5 л, который затем был профильтрован под вакуумом через бумажный фильтр «красная лента» для очистки от грубых примесей. В полученном растворе был определён ряд параметров, характеризующих его состав: концентрация пептидов, углеводов по кетозам и пероксида водорода. Работы по выделению и очистке пептидной фракции пчелиного мёда, а также по оценке количественных параметров, были проведены на базе кафедры «Общая биология и биохимия» ФГБОУ ВО «Пензенский государственный университет».
Определение концентрации пептидов, пероксида водорода и углеводов по кетозам
Для определения концентрации пептидов использовалась модификация метода Лоури: к образцу мёда объёмом 0,7 мл добавляли равный объём 10 %-го раствора ТХУ, инкубировали при комнатной температуре в течение 10 минут и затем центрифугировали 20 минут при 4000 об/мин. В полученной надосадочной жидкости в трёх повторностях определяли концентрацию белковых продуктов методом Лоури по величине поглощения излучения на длине волны 750 нм с длиной оптического пути 10 мм [6]. В качестве контроля использовалась проба, в которой исследуемый раствор был заменён на дистиллированную воду; расчёт концентрации проводился по уравнению калибровочной прямой, построенной с использованием разведений БСА с известными концентрациями.
Для определения содержания в пробах углеводов по кетозам использовали количественный вариант пробы Селиванова [7]: к аликвоте исследуемого раствора объёмом 0,5 мл добавляли 0,5 мл 0,1 %-го спиртового раствора резорцина и 1,5 мл 30 %-го раствора HCl. Смесь перемешивали и ставили на кипящую водяную баню на 8 минут, после чего измеряли оптическую плотность на длине волны 490 нм с длиной оптического пути 10 мм. Контролем служила проба, в которой исследуемый раствор был заменён дистиллированной водой, количественно концентрация определялась по уравнению калибровочной прямой, построенной с использованием серии разведений раствора фруктозы с известными концентрациями. Измерения проводились в трёх повторностях.
В качестве метода определения концентрации пероксида водорода в исследуемых образцах использовали титрование, основанное на окислении в кислой среде йодида калия пероксидом до йода, который затем оттитровывали тиосульфатом натрия. Для этого к 20 мл исследуемого раствора в трёх повторностях приливают 5 мл 10 %-го раствора иодида калия, такой же объём 10 %-го раствора серной кислоты и выдерживают в закрытой посуде без доступа света в течение 10 минут. После инкубации раствор титровали 0,1 М раствором тиосульфата натрия до обесцвечивания. Массовую долю рассчитывали по формуле:
где X – массовая доля пероксида водорода в пробе, V – объём пошедшего на титрование тиосульфата натрия. Полученную массовую долю пересчитывали на абсолютное содержание в мкг/мл.
Ультрафильтрация
Для разделения водного раствора мёда на фракции с молекулами различной массы был применён метод ультрафильтрации с использованием мембраны марки Vivaflow 200, пропускающей молекулы с массой до 5 кДа. Полученный фильтрат содержал большое количество низкомолекулярных соединений, в т. ч. фенолы, углеводы, витамины и пептиды. В растворе определяли концентрацию пептидов, содержание углеводов по кетозам и перекиси водорода теми же методами, что обозначены выше.
Ионообменная хроматография и гель-фильтрация
Для выделения пептидной фракции и очистки её от углеводов и других низкомолекулярных примесей применялся метод ионообменной хроматографии на микрокристаллической ДЭАЭ-целлюлозе. Элюцию осуществляли ступенчатым градиентом с использованием 0,2 М ТРИС-HCl (pH = 10) в качестве начального буферного раствора и 0,2 М Na-цитратный (pH = 6) в качестве конечного. Размеры колонки составили 6×1,5 см, объём наносимой пробы – 500 мкл, объём собираемых фракций – 1,5 мл, скорость элюции – 30 мл/час. Смену буферного раствора производили после сбора седьмой фракции. Контроль концентрации белковых веществ во фракциях осуществлялся методом Лоури, за концентрацией углеводов наблюдали по содержанию кетоз фотоколориметрически с резорцином в кислой среде.
Полученные фракции, содержащие очищенные от углеводов и других примесей пептиды, были соединены и очищены от солей буферного раствора с помощью гель-фильтрации на сефадексе G-25 (элюция велась дистиллированной водой, контроль содержания белка во фракциях спектроскопически по оптической плотности на длине волны 280 нм, объём наносимой пробы – 1 мл, скорость элюции – 40 мл/час, объём собираемых фракций – 2 мл, размер колонки – 15×2 см). Очищенная смесь пептидов пчелиного мёда с молекулами массой до 5 кДа в конечной концентрации 200 и 100 мкг/мл использовалась для определения антибактериальной активности с использованием тестовых культур микроорганизмов.
Микроорганизмы и определение антибактериальной активности
В качестве тестовых микроорганизмов для определения антибактериальной активности диско-диффузионным методом использовались Staphylococcus aureus (культура высеяна из брюшной полости больного перитонитом), Escherichia coli (культура высеяна у больного хроническим пиелонефритом), Pseudomonas aeruginosa (высеяна с раневой поверхности) и Salmonella enteritis (культура высеяна у больного энтеритом), культивируемые на агаре Мюллера-Хилтона. Больные, от которых были получены бактериальные культуры, длительное время принимали антибиотики без выраженного клинического улучшения, поэтому высеянные штаммы сформировали устойчивость к антибиотикам.
После нанесения на питательную среду инокулята тестовой культуры на поверхность среды помещали по 5 стерильных бумажных дисков (d = 9 мм) на одну чашку Петри, пропитанных либо водным раствором пептидной фракции пчелиного мёда с концентрацией 200 или 100 мкг/мл в объёме 10 мкл на каждый диск, либо 10 мкл раствора мёда обоих типов, содержащих молекулы массой до 5 кДа, а также 50 %-й раствор мёда обоих образцов в качестве позитивного контроля, после чего прижимали стерильным пинцетом, а затем помещали в термостат для инкубации при температуре 35–37 °С на 24 часа. По прошествии срока оценивали диаметр зоны задержки роста вокруг диска за вычетом его собственного диаметра. Работа по определению антибактериальной активности была проведена на базе бактериологической лаборатории ГБУЗ «Кузнецкая межрайонная детская больница».
Статистическая обработка полученных данных проводилась путём расчёта ошибки среднего арифметического в ПО LibreOffice Calc.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
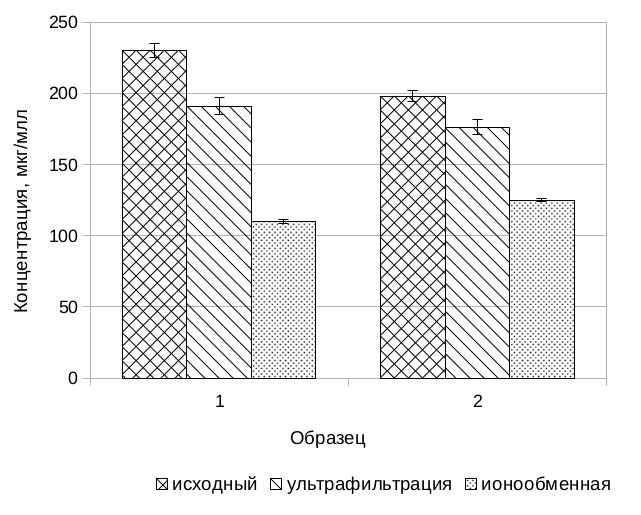
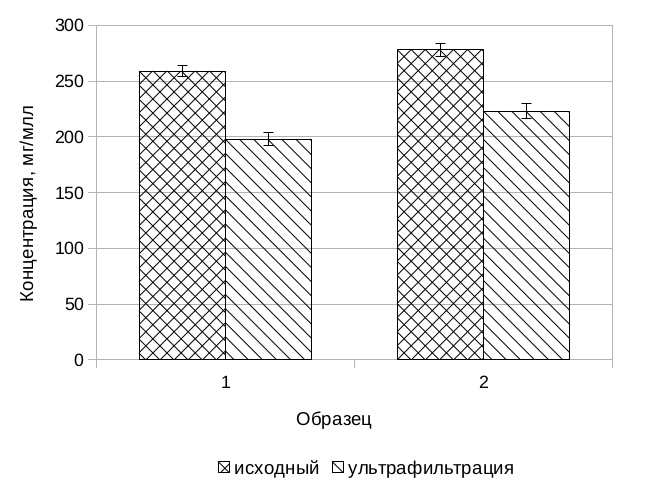
На рис. 1 и в табл. 1 представлены результаты определения концентрации пептидов, углеводов по кетозам и пероксида водорода в исследуемых образцах. Контроль определяемых параметр важен с точки зрения оценки эффективности используемой комбинации методов. Анализ полученных данных позволяет заключить, что достигаемая степень очистки является приемлемой для целей проведённого эксперимента.
 |
 |
|
А |
Б |
Рис. 1. Сравнение концентрации пептидов и кетоз в исследуемых пробах.
А — сравнение концентрации пептидов в исходном растворе, растворе после ультрафильтрации и пиковой концентрации в десорбировавшейся фракции после ионообменной хроматографии. Б – сравнение концентрации углеводов по кетозам в исходном растворе и после ультрафильтрации (в пиковой фракции ионообменной хроматографии углеводов не обнаружено).
Таблица 1.
Концентрация пероксида водорода в исследуемых растворах
| Образец | Тип раствора | |
| Исходный 50 %-й | После ультрафильтрации | |
| Образец 1 | 6,65±0,07 | 1,57±0,03 |
| Образец 2 | 2,44±0,02 | — |
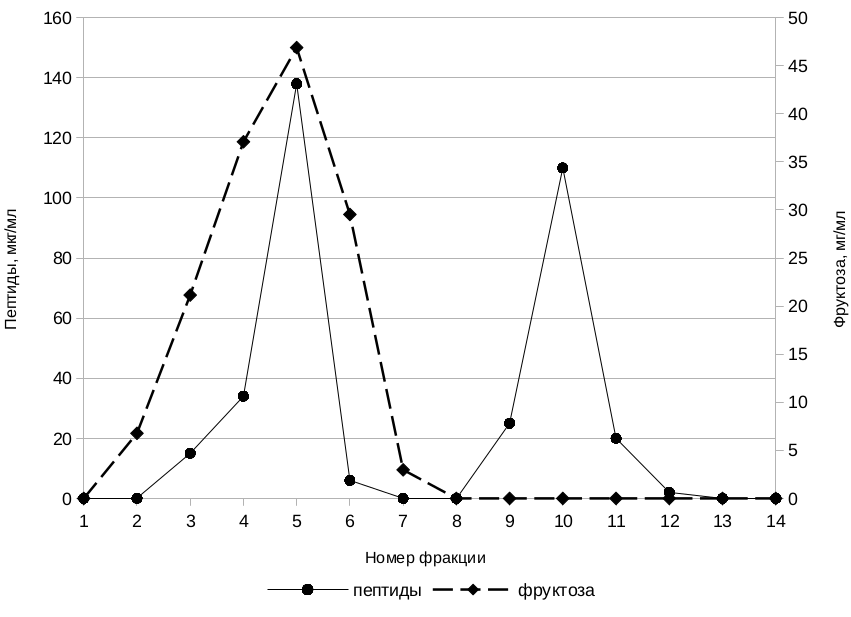
На рис. 2 изображена типичная хроматограмма разделения и очистки пептидов раствора мёда с массой молекул до 5 кДа на ДЭАЭ-целлюлозе.
Рис. 2. Хроматограмма разделения пептидов от низкомолекулярных примесей на ДЭАЭ-целлюлозе.
Отчётливо видны два пика, соответствующие профилю элюции пептидных веществ. Первый пик характеризует несорбировавшиеся на ионообменнике пептиды, вышедшие в свободном объёме колонки вместе с углеводами и другими низкомолекулярными примесями, второй пик соответствует очищенным пептидам, десорбировавшихся после смены буферного раствора. Как видно из хроматограммы, количество сорбировавшихся на носителе пептидов примерно равно количеству несвязавшихся пептидов, вышедших в свободном объёме колонки. Объяснить наблюдаемое явление можно, предположив, что исследуемый раствор мёда с молекулами массой меньшей 5 кДа содержит в своём составе смесь пептидных молекул разнообразного строения, что объясняет их разное сродство к носителю. При уменьшении объёма наносимого на хроматографическую колонку исследуемого раствора не наблюдалось существенных изменений в соотношении высоты двух пиков, что исключает влияние ёмкости ионообменника на разделение, т. е. при существующих условиях хроматографирования соотношение высот двух пиков на хроматограмме определяется составом разделяемой смеси веществ, а не переполнением носителя. Различий в характере разделения пептидов между исследуемыми образцами мёда обнаружено не было.
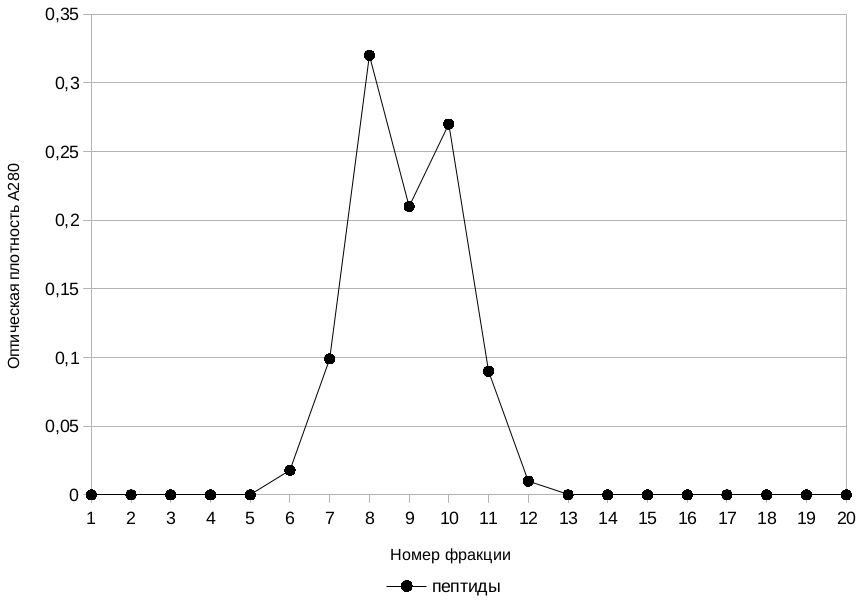
После проведения ионообменной хроматографии фракции 9, 10 и 11 были объединены и очищены от солей буферного раствора с помощью гель-фильтрации на сефадексе G-25. Хроматограмма этого процесса представлена на рис. 3, где видно некоторое разделение общего пика, характеризующего смесь очищенных пептидов мёда (контроль наличия цитрат-иона во фракциях осуществлялся качественной реакцией на помутнение с Ca(OH)2). Полученные данные свидетельствуют о том, что очищенная фракция является смесью пептидов различной природы, однако при данных условиях хроматографирования разделить их не представляется возможным. Фракции с 6 по 12, содержащие максимальную концентрацию пептидных продуктов, объединили в одну и приготовили образцы для определения антибактериальной активности с концентрацией 200 и 100 мкг/мл.
Рис. 2. Профиль элюции смеси пептидов на сефадексе G-25
Результаты оценки антагонистической активности исследованных растворов мёда и пептидных фракций против использованных штаммов тестовых культур представлены в таблице 2. Из полученных данных следует, что антибактериальный эффект понижается с разбавлением раствора мёда, т. е. исходный 50 %-й раствор обоих образцов обладает максимальной антимикробной активностью, причём образец 1 обладает наибольшей активностью против микроорганизмов за счёт повышенного содержания пероксида водорода. Меньшая активность проявляется в случае образцов после ультрафильтрации, что объясняется разбавлением раствора, при котором происходит понижение концентрации углеводов, которая является определяющим факторов антибактериальной активности мёда при относительно больших концентрациях за счёт оказания высокого осмотического давления [8], а также наличия пероксида водорода в сравнительно высоких концентрациях. Наличие антибактериальной активности даже в разбавленном после ультрафильтрации растворе мёда можно объяснить присутствием в составе пероксида водорода, который является доминирующим антибактериальным фактором, повышение активности которого наблюдается при понижении концентрации углеводов и повышении доли растворителя в растворе за счёт активации ферментных систем [9], даже не смотря на понижение концентрированности раствора и инактивации ферментных систем, производящих пероксид, за счёт изменения его коллоидной структуры [10].
Таблица 2.
Результаты определения антибактериальной активности исследуемых образцов пептидов и растворов пчелиного мёда
| Испытуемый образец | Бактериальная культура | |||
| Staphylococcus aureus | Escherichia coli | Pseudomonas aeruginosa | Salmonella enteritis | |
| Величина зоны задержки роста, мм | ||||
| Пептидная фракция, образец 1, 200 мкг/мл | 1±1 | 0 | 0 | 0 |
| Пептидная фракция, образец 1, 100 мкг/мл | 0 | 0 | 0 | 0 |
| Образец 1 после ультрафильтрации | 3±1 | 2±0,75 | 3±1 | 1±0,5 |
| Образец 1, 50%-й раствор | 10±2 | 3±1 | 10±2 | 2±1 |
| Пептидная фракция, образец 2, 200 мкг/мл | 0 | 0 | 2±1 | 0 |
| Пептидная фракция, образец 2, 100 мкг/мл | 0 | 0 | 0 | 0 |
| Образец 2 после ультрафильтрации | 2±1 | 1±1 | 1±1 | 2±1 |
| Образец 2, 50%-й раствор | 5±1 | 4±0,75 | 3±1 | 2±1 |
Как следует из полученных данных, исследованные пептидные фракции обоих образцов пчелиного мёда, содержащие в своём составе молекулы массой менее
5 кДа, не показали антибактериальной активности против использованных штаммов тестовых культур. Вероятность потери пептидами антибактериальной активности во время процесса их выделения и очистки можно исключить, т. к. использованные методы не предполагают применение каких-либо агрессивных воздействий на исследуемые растворы, а значит, отсутствие антагонистической активности можно объяснить тем, что в составе полученных фракций не содержится низкомолекулярных антимикробных пептидов.
На сегодняшний день в исследованиях in vitro продемонстрированы антибактериальные свойства нескольких белковых молекул мёда, однако их масса выше 5 кДа. На основании как полученных нами, так и литературных данных, можно сказать, что в мёде не содержится низкомолекулярных пептидов, проявляющих антимикробную активность [11, 12].
ЗАКЛЮЧЕНИЕ
На основании полученных данных можно сделать следующие выводы.
Во-первых, из двух исследованных образцов мёда наибольшей антибактериальной активностью обладает раствор тёмного сорта – гречишный. Наши экспериментальные данные подтверждают ту связь, которая существует между повышенной концентрацией пероксида водорода в составе мёда и величиной его антибактериальной активности. Более низкая активность светлого сорта мёда – смешанного происхождения – объясняется пониженным по сравнению с гречишным мёдом содержанием пероксида водорода. В обоих случаях 50 %-х растворов в основном антибактериальный эффект оказывается за счёт высокой концентрации углеводов, т. е. их высокого осмотического давления.
Во-вторых, при разбавлении, которое происходит при ультрафильтрации исходного раствора мёда, в обоих случаях наблюдается понижение антибактериальной активности в отношении тестовых культур за счёт понижения концентрации углеводов, однако некоторый уровень активности остаётся вследствие наличия в образцах пероксида водорода и всё ещё большого содержания углеводов.
В-третьих, исследованные пептидные фракции пчелиного мёда не продемонстрировали ожидаемый антибактериальный эффект в следствие отсутствия в их составе антимикробных пептидов массой менее 5 кДа.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-34-90050
REFERENCES
- Cianciosi, D., Yuliett Forbes-Hernández T., Afrin S., Gasparrini M., Reboredo-Rodriguez P., Pia Manna P., Zhang J., Bravo Lamas L., Martínez Flórez S., Agudo Toyos P., Quiles J. L., Giampieri F., Battino M., Phenolic Compounds in Honey and Their Associated Health Benefits: A Review, Molecules, 23(9), 20 (2018).
- Gengin M. T. Klychenkov S. V., Solovev V. B., Karpova G. A., A promising method for assessing the quality of honey, Pchelovodstvo, 2, 51 (2017).
- Mandal M. D., Mandal S. Honey: its medicinal property and antibacterial activity, Asian Pacific Journal of Tropical Biomedicine, 1(2), 154 (2011).
- APD3 Search, Antimicrobial Peptide Database. URL: https://aps.unmc.edu (Visiting date: 16.09.2021).
- Kwakman P. H. S., te Velde A. A., de Boer L., Speijer D., Vandenbroucke-Grauls C. M. J. E., Zaat S. A. J., How honey kills bacteria, The FASEB Journal, 24, 2576 (2010).
- Lowry O. H., Rosebrought N. J., Farr A. G., Randall R. J. Protein measurement with the Folin phenol reagent, Biol. Chem., 193, 1, 265 (1951).
- Filippovich Yu. B. Workshop on General Biochemistry, 311 (Moscow: Prosveshie, 1982).
- Molan P., Thodes T. Honey: A Biologic Wound Dressing, Wound, 6, 27, 141 (2015).
- Brudzynski K., Miotto D., Kim L., Sjaarda C., Maldonado-Alvarez L., Fukś H. Active macromolecules of honey form colloidal particles essential for honey antibacterial activity and hydrogen peroxide production, Scientific Reports., 7, 7637 (2017).
- Brudzynski K. A current perspective on hydrogen peroxide production in honey. A review, Food Chemistry, 332, 127229 (2020).
- Brudzynski K., Sjaarda C. Honey Glycoproteins Containing Antimicrobial Peptides, Jelleins of the Major Royal Jelly Protein 1, Are Responsible for the Cell Wall Lytic and Bactericidal Activities of Honey, PLOS One, 10(4), 230 (2015).
- Bilikova K., Kristof Krakova T., Yamaguchi K., Yamaguchi Y. Major royal jelly proteins as markers of authenticity and quality of honey, Arh Hig Rada Toksikol., 66, 259 (2015).